
лабораторные работы по химии
.pdf№ |
tº C |
Время, сек. |
п/п |
|
|
1 |
|
|
2 |
|
|
3 |
|
|
На основании полученных результатов выразить графически зависимость реакции от температуры, отложив на оси абсцисс температуры, а на оси ординат
– время в секундах.
7. РЕКОМЕНДАЦИИ ПО ПЛАНИРОВАНИЮ И ПРОВЕДЕНИЮ ЭКСПЕРИМЕНТА.
При проведении лабораторного опыта необходимо каждый раствор отмерять своим цилиндром. Каждый опыт проводить в новой пробирке. При попадании на лицо, в глаза, на руки химических реактивов следует смыть немедленно водой и хорошо промыть пораженный участок большим количеством воды.
8. СОСТАВЛЕНИЕ ОТЧЕТА.
1.Цель работы, рабочее задание.
2.Химическая реакция, таблица, график.
3.Вывод о влиянии концентрации на скорость химической реакции.
4.Ответы на контрольные вопросы.
9. СПИСОК ЛИТЕРАТУРЫ.
1.Глинка Н.Л. Задачи и упражнения по общей химии . Москва: Интеграл – пресс, 2001 – 2006,79-93 с.
2.Коровин Н. В. Общая химия. – М.: Высшая школа, 2004, 142-158 с.
3.Белозерова Т.И. Химия. Конспект лекций. в двух частях для. инженернотехнических ( нехимических) специальностей.- Северодвинск: Севмашвтуз., 2009г.,часть1.
4. Белозерова Т.И. Термохимические расчеты. Химическое равновесие. Правило Ле Шателье. Методические указания к практическим работам. Севмашвтуз, 2006, 14с.
10.РЕКОМЕНДАЦИИ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ.
1.Соблюдайте осторожность при работе с термометром и с раствором щелочи. 2 В случае попадания щелочи на одежду следует смыть её водой, а затем нейтрализовать раствором уксусной кислоты с массовой долей 5%.
3.При попадании на лицо, глаза и на руки химических реактивов следует промыть пораженный участок большим количеством воды.
4.Не оставляйте на рабочих местах грязную посуду.
Лабораторная работа № 3.
14

Приготовление растворов различных концентраций.
1.ЦЕЛЬ РАБОТЫ: научиться готовить растворы с определенной концентрацией и определять плотность раствора.
2.РАБОЧЕЕ ЗАДАНИЕ:
1.Приготовить раствор с заданной массовой долей.
2.Измерить плотность полученного раствора.
3.Ответить на контрольные вопросы.
3. ОБЩИЕ СВЕДЕНИЯ 3.1. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ.
Растворы - гомогенные системы переменного состава, состоящие из двух или более компонентов.
3.1.1. Массовая доля растворенного вещества ( )
Массовая доля растворенного вещества – это отношение массы растворенного
вещества (А) к массе раствора, выраженное в процентах:
ω= m A 100 |
(1) |
mр− ра |
|
mр-ра =m(A)+m(H2O) |
(2) |
Масса раствора равна сумме масс растворенного вещества и растворителя
(воды).
Масса раствора (г), его объем (мл) и плотность (г/мл) связаны между собой
соотношением:
mр-ра=ρ*Vр-ра |
(3) |
Пример 1: В 135 г воды растворено 15 г соли. Какова массовая доля соли в полученном растворе?
соли=15*100/135+15=10%
Пример 2: Сколько граммов соли и воды потребуется для приготовления 500г раствора с массовой долей 18%
ω= m A 100
mр− ра
m(A)= * mр-ра/100=18*500/100=90 г m(H2O)= mр-ра-m(A)=500-90=410 г
15
Пример 3: 1200 г раствора соли с массовой долей 20% упарили до массы 800 г. Какова концентрация получившегося раствора?
1) Упаривание приводит к потере воды, содержание же растворенного вещества остается неизменным. Определим массу соли в растворе:
m(A)= * mр-ра/100=20*1200/100=240 г
2) Определим массовую долю соли в новом растворе:
соли=240*100/800=30%
Пример 4: Приготовить 500 г раствора KJ с массовой долей KJ 19%. Сколько соли необходимо добавить, чтобы получить 20 % раствор?
1) Определяем массу KJ в исходном растворе: m(A)= * mр-ра/100=19*500/100=95 г
2)Обозначим массу прибавленного KJ за х, то масса раствора будет равна (500+х). Поставим эти величины в формулу (1):
20=95+х/500+х=240 х=6,25 г
3.1.2 Молярная концентрация.
Молярная концентрация – это отношение количества вещества v(A) к объему
раствора V(р-ра). |
|
С(А)= v (A)/ V(р-ра) (моль/л) |
(4) |
Раствор с молярной концентрацией K2SO4 |
C(K2SO4)=1моль/л может быть |
обозначен как 1 М K2SO4 – одно молярный раствор сульфата калия. |
|
v (A)=m(A)/M(A) |
(5) |
объединяя (6) и (7) получаем: |
|
С(А)=m(A)/M(A)*V |
(6) |
Где m(A) – масса вещества (г), М(А) – молярная масса вещества (г/моль), V – объем раствора (л).
Пример 5. Определить молярную концентрацию раствора KOH, в 50 мл которого содержится 5,6 г вещества.
CKOH=m(KOH)/M(KOH)=5,6*1000/56*50=2 моль/л или 2 М KOH
4. ОБЪЕКТ ИССЛЕДОВАНИЯ.
При проведении лабораторной работы необходимо определить плотность приготовленного раствора.
5. КОНТРОЛЬНЫЕ ВОПРОСЫ.
1.В 110г водного раствора содержится 56г КОН. Какова массовая доля КОН в растворе?
2.В 910г Н2О растворено 309г NaOH, плотность раствора ρ=1,3 г/мл. Найдите:
а) массовую долю NaOH б) молярную концентрацию
3.Сколько кг растворителя нужно добавить к 1л раствора с молярной концентрацией См=4 моль/л, чтобы получить раствор См=0,2 моль/л.
6. ОПИСАНИЕ ЛАБОРАТОРНОЙ УСТАНОВКИ И ПОРЯДОК ВЫПОЛНЕНИЯ ОПЫТА.
16
ОПЫТ. Приготовление раствора заданной концентрации из навески твердого вещества и определение плотности раствора.
Работу следует выполнять в следующей последовательности:
1.Получить задание для приготовления раствора соли определенной концентрации (масса раствора m=100 г).
2.Рассчитать необходимое количество твердого вещества и воды.
3.Взвесить с точностью до 0,01 г навеску соли.
4.Отмерить с помощью цилиндра необходимое количество воды.
5.Навеску соли перенести в стакан и, постепенно прибавляя отмеренную воду, перемешивать содержимое до полного растворения.
6.Замерить объем (V) полученного раствора по цилиндру.
7.Рассчитать плотность раствора
ρтеор=m/V [г/см3]
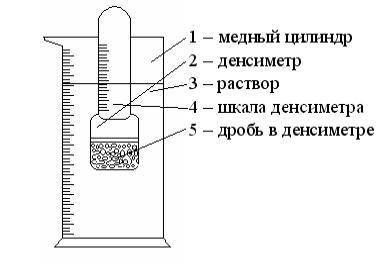
8. Подобрать ареометр и замерить плотность приготовленного раствора. Если при приготовлении раствора соли произошло защитное разогревание или охлаждение раствора, следует выждать пока раствор вновь не обретет комнатную температуру, и только после этого производить измерения плотности.
Ареометр (денсиметр) – стеклянный поплавок, имеющий сверху шкалу, градуированную в единицах плотности. Действие ареометра основано на законе Архимеда. Для измерения плотности ареометр опускают в раствор и по нижнему краю мениска жидкости отчитывают показания.
|
Рис. 1 Ареометр (денсиметр) |
7. |
РЕКОМЕНДАЦИИ ПО ПЛАНИРОВАНИЮ И ПРОВЕДЕНИЮ |
ЭКСПЕРИМЕНТА. |
|
1. |
При проведении опыта ареометр подбирать с учетом теоретически |
рассчитанной плотности. |
|
2. |
После измерения плотности, ареометр промыть, протереть |
8. |
СОСТАВЛЕНИЕ ОТЧЕТА. |
1.Порядок проведения опыта.
2.Расчеты.
3.Ответы на контрольные вопросы.
17
4. Вывод
5.Решить предложенный вариант
9. СПИСОК ЛИТЕРАТУРЫ.
1.Глинка Н.Л. Задачи и упражнения по общей химии . Москва: Интеграл – пресс, 2001 – 2006,95 -102 с.
2.Коровин Н. В. Общая химия. – М.: Высшая школа, 2004, 204 -212 с.
3.Белозерова Т.И. Химия. Конспект лекций. в двух частях для. инженернотехнических ( нехимических) специальностей.- Северодвинск: Севмашвтуз., 2009г.,часть1.
10.РЕКОМЕНДАЦИИ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ.
1.Соблюдайте осторожность при работе с ареометром.
2Не оставляйте на рабочих местах грязную посуду.
Лабораторная работа № 4.
Электролиз растворов
1.ЦЕЛЬ РАБОТЫ: Изучить электродные процессы при электролизе растворов.
2. РАБОЧЕЕ ЗАДАНИЕ:
18
1. Взвесить массу катода до электролиза.
2.Провести процесс электролиза.
3.Взвесить массу катода после электролиза.
4.Рассчитать выход по току.
5.Ответить на контрольные вопросы.
3. ОБЩИЕ СВЕДЕНИЯ.
Окислительно-восстановительная реакция, протекающая в растворе или расплаве электролита у электродов при пропускании постоянного электрического тока, называется электролизом.
Электролиз осуществляется в электролизерах. Основным конструкционным элементом являются электроды, соединенные с полюсами источника постоянного тока.
Электрод, присоединенный к отрицательному полюсу источника тока, называется катодом, положительный электрод - анодом.
На катоде в процессе электролиза всегда происходит восстановление катионов из объема электролита. На аноде происходит отдача электронов, т.е. реакция окисления.
В растворах и расплавах различных электролитов имеются разноименные по знаку ионы, т.е. катионы и анионы, которые находятся в хаотическом движении. Но если в такой расплав электролита, например, расплав хлорида натрия NaCl, опустить электроды и пропустить постоянный электрический ток,
то катионы Na+ |
будут двигаться к катоду, а анионы Сl- |
к аноду. На катоде |
||
электролизера |
происходит процесс |
восстановления катионов электронами |
||
внешнего источника тока: |
|
|
|
|
|
Na+ + e= Na° |
|
|
|
|
Катион натрия Металлический натрий |
|
|
|
На аноде идет процесс окисления аниона хлора, причем, отрыв |
||||
избыточных электронов от С1- осуществляется за счет |
энергии |
внешнего |
||
источника тока: |
2С1- - 2е = С12° |
|
|
|
|
|
|
||
|
Анион хлора |
Молекулярный хлор |
|
|
Суммарное уравнение электролиза расплава хлорида натрия: |
|
|||
|
2NaCl → 2Na + + 2С1-→ 2Na ° + С12° |
|
|
|
Если электролизу подвергается |
расплав, который |
содержит |
несколько |
|
различных катионов металлов, то в этом случае последовательность восстановления определяется электродными потенциалами. В первую очередь восстанавливаются катионы металлов, обладающих большим значением электродного потенциала.
Более сложные процессы электролиза протекают в водных растворах
электролитов. |
|
|
|
|
|
|
С |
учетом ряда |
стандартных потенциалов |
металлов возможны три |
|||
случая |
протекания |
восстановительного |
процесса |
на |
катоде |
в водных |
растворах (процессы на катоде не зависят от материала катода): |
|
|||||
1. |
Катионы металлов, стандартный |
электродный |
потенциал |
которых |
||
|
|
19 |
|
|
|
|

больше, чем -0,413В (от Ni2+ до Pt4+), при электролизе практически полностью восстанавливаются на катоде.
Меn+ +n*е→Меo
2.Катионы металлов, с малой величиной стандартного электродного
потенциала (от Li+ до А13+ включительно) не восстанавливаются на катоде, вместо них восстанавливаются молекулы воды:
2Н2О + 2е → Н2 + 2ОН-
3.Катионы металлов, стандартный ионный потенциал которых
меньше, чем у водорода, но больше, чем у алюминия (от Мn+ до Н2+), при электролизе на катоде восстанавливаются одновременно с молекулами воды.
Для определения порядка протекания окислительно-восстановительных процессов на электродах при электролизе водных растворов можно руководствоваться правилами таблицы 1.
Таблица 1
Катодные процессы в водных растворах
Электрический ряд напряжений металлов
Li, K, Ca, Na, Mg, Al |
Mn, Zn, Fe |
Ni, Sn, Pb |
Н2 |
Cu, Ag, Pt, Au |
2Н2O+ 2e→ Н2+2OHֿ◌ |
|
|
|
|
Меn++nОН-= |
Выделяется Н2 |
|
Men++ne-=Me0 |
|
=Ме(ОН)n-католит |
или Ме |
|
|
|
|
|
|
|
|
|
|
|
|
|
Характер реакций, протекающих на аноде, зависит от природы аниона и материала анода. Аноды подразделяются на нерастворимые и растворимые. Нерастворимые аноды изготавливаются из угля, графита, платины, иридия, при электролизе они служат лишь передатчиками электронов. Анионы бескислородных кислот (S2-, I-, Вг-, Сl-) при их достаточной концентрации окисляются довольно долго:
2 Сl--2е→С12
2Вг--2е→Вг2
Если же раствор содержит анионы кислородных кислот (например, SO42-,NO3-, СО22-, РО43-), то на аноде окисляются не эти ионы, а молекулы воды:
2Н2О-4е→О2 + 4Н+
Если растворимые аноды изготавливаются из меди, серебра, цинка, кадмия, никеля, железа (в определенных условиях нерастворимыми становятся и аноды из железа, никеля, свинца), при электролизе они окисляются сами.
Me - ne→ Me n+
Рассмотренные правила сведены в таблицу 2:
Таблица 2.
|
Анодные процессы в водных растворах |
Анод |
Кислотный остаток Асm- |
|
20 |

|
Бескислородный |
|
Кислородосодержащий |
|
Растворимый |
окисление металла анода |
|||
|
|
Me0 - ne→Men+ |
||
|
анод |
раствор |
||
|
|
|
|
|
Нерастворимый |
Окисление анионов |
|
|
В щелочной среде: |
|
кроме фторидов |
|
|
4ОН--4е→О2+2Н2О |
|
Асm-- me →Ас0 |
|
|
В кислой и нейтральной: |
|
|
|
|
2Н2О-4е→О2 + 4Н + |
|
|
|
|
|
Анионы по их способности окисляться располагаются в следующем порядке
J-, Br-, S2- , Сl- , ОН- , SO42- , NO3- , F-
Решение типовых задач
Задача 1. Написать |
уравнение электролиза раствора KCl, если анод |
||
нерастворимый. |
|
|
KCl↔K+ +Cl- |
Решение: |
|
|
|
Катод (-) |
|
|
Анод (+) |
2H2O+2e↔ H2↑+2OH |
|
|
2Cl-2e↔Cl2 |
Суммарное ионное уравнение: |
|
|
|
|
|||
|
2Н2О + 2С1 → Н2↑ + С12↑ + 2ОН- |
||
Суммарное молекулярное уравнение: |
|||
|
2КС1 + 2Н2О→ 2Н2↑ + С2↑+ 2КОН |
||
|
|
|
Вторичный продукт электролиза |
Задача 2. Написать уравнение реакции электролиза водного раствора AgNO3, если а) анод нерастворимый;
б) анод растворимый, серебряный.
Решение:
а) анод нерастворимый |
|
AgNO3↔ Ag + + NO3- |
катод(-) |
|
анод(+) |
|
||
Ag++1e→Ag0 |
|
2H2O-4e→O2+4H+ |
Суммарное уравнение процессов: |
||
4AgNO3 + 2H2O→4Ag + О2+4HNO3 |
||
|
|
Вторичный продукт электролиза |
б) анод растворимый, серебряный |
||
катод(-) |
|
анод(+) |
Ag++1e→Ag |
|
Ag0-1e→Ag+ |
Суммарное уравнение электролиза с растворимым анодом написать нельзя. |
||
Расчет количества веществ, разложенных или образовавшихся в процессе электролиза, производится по закону Фарадея. Теоретически массы веществ, испытавших изменение при электролизе, определяются
21

m= M э Q F
Q= J τ
Q – количество прошедшего электричества m – масса вещества, г.
Mэ - химический эквивалент вещества, г. J – сила тока, А
τ - время электролиза, сек.
Пример: Сколько меди выделяется при пропускании через раствор ее соли тока силой 6А, в течение 1 часа, если выход по току составляет 98%?
m(Си)факт = m(Си)теор*0,98 = Mэ (Cu)*J*τ*0,98 /96500= 32*6*3600*0,98/96500 =7г..
Следовательно, на катоде выделится 7 грамм меди.
4. ОБЪЕКТ ИССЛЕДОВАНИЯ.
Лабораторная установка для проведения процесса электролиза с растворимым медным анодом.
5. КОНТРОЛЬНЫЕ ВОПРОСЫ.
1.В каких случаях образуются вторичные продукты при электролизе?
2.В какой последовательности и выделяются на катоде металлы при электролизе раствора, содержащего ионы Ni2+, Cr2+,Fe3+?
3.Какой силы должен быть ток, чтобы при пропускании его через расплав MgSO4 выделить на катоде 6 г. магния за 10 часов? Написать уравнения электродных процессов.
4.Через последовательно соединенные электролитические ванны с платиновыми
электродами пропустили ток. В первой ванне раствор сульфата натрия, во второй-раствор нитрата серебра, а в третьей - раствор соляной кислоты. Какие продукты выделились на электродах во всех трех ваннах и сколько их получилось по массе, если в первой ванне выделится на катоде 1 мг. водорода?
5.Через водный раствор NaCl (электроды угольные) пропускали ток сначала при перемешивании раствора, а затем без перемешивания, отделив в последнем вторичные продукты. Написать уравнения электродных процессов для двух случаев.
6.ОПИСАНИЕ ЛАБОРАТОРНОЙ УСТАНОВКИ И ПОРЯДОК ВЫПОЛНЕНИЯ ОПЫТА.
. Электролиз водного раствора сульфата меди с медным анодом.
Опыт проводите в стакане, который закрывается эбонитовой крышкой, снабженной двумя клеммами для закрепления электродов (см. рис. 1).
2 |
3 |
1
22

Рис. 1. Электролизный стакан.
1.Раствор электролита
2.Анод
3.Катод
Тонкий медный электрод тщательно зачистите абразивным порошком, промойте проточной водой, высушите фильтрованной бумагой и взвесьте на технических весах с точность до 00,1 гр.
Закрепите с помощью зажимов оба медных электрода в крышке стакана. В стакан налейте ¾ его объема раствор состава:
CuSO4*5H2O-150 г/л. H2SO4-50г/л. С2H5OH-50г/л.
Опустите электроды в раствор. Электроды соедините с полюсами источника тока. Включите, отметив по секундной стрелке часов время и ток в цепи электролизера. Быстро при помощи реостата установите силу тока 0,5-1,5 А, поддерживайте её постоянной.
Составьте схему электролиза (см. рис. 2) и уравнения реакций, протекающих на катоде и аноде. По истечении 20 минут (в случае резкого падения тока электролиз прекратить) освободите из зажимов катод, вымойте его в проточной воде, осторожно просушите фильтрованной бумагой и снова взвесьте на технических весах. Все количественные параметры электролиза внесите в таблицу 3.
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
J(A) |
τ (c) |
Масса катода (Cu) |
mт |
mτ- mo |
|
η(Сu)% |
||||||||
|
|
|
|
|
|
|
|
|
|
(теор.) |
(факт.) |
|
|
|
|
|
|
|
|
|
|
|
mo |
mт |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А
V |
катод |
Анод |
Рис. 5. Схема процесса электролиза.
23
