
ткм
.pdf
определѐнного состава и одинакового кристаллического строения является одной фазой, несмотря на наличие между кристаллами поверхности раздела. Компонентами называются вещества, образующие сплавы.
Одно из последних определений понятий «фаза» и «компоненты» сформулировано так: «Фазой называют гомогенную часть гетерогенной системы или совокупность нескольких частей, разобщѐнных поверхностями раздела, одинаковых по химическому составу, строению и свойствам, которые не зависят от массы фазы. Компонентами фазы называют индивидуальные вещества, способные существовать в изолированном виде, наименьшее число которых достаточно для образования всех фаз системы». Таким образом,
компонентами называют не общее число составляющих систему веществ, а такое их число, которое достаточно для выражения состава любой фазы системы.
Диаграммы состояния конденсированных систем, к которым относится большинство металлических, представляют собой, как правило, изобарические сечения диаграмм «температура – состав – давление» при нормальном давлении P = 98,1 кПа. Небольшое отклонение от этого давления не оказывает существенного влияния на фазовый состав конденсированной системы, поскольку из-за малой упругости паров наличием парообразной фазы с достаточным основанием можно пренебречь. Поэтому при фиксированном давлении во внимание принимается только один внешний фактор – температура, и правило фаз принимает упрощѐнную формулу:
C = K + 1 − Ф.
Следовательно, для системы из двух компонентов вариантность будет:
С = 3 − Ф.
В настоящей главе рассматриваются простейшие диаграммы состояния, каждая из которых характеризуется своим видом взаимоотношения компонентов:
 диаграмма состояния системы, в которой компоненты образуют непрерывный ряд твѐрдых растворов;
диаграмма состояния системы, в которой компоненты образуют непрерывный ряд твѐрдых растворов;
диаграмма состояния эвтектического типа; диаграмма состояния перитектического типа;
диаграммы состояния систем, в которых компоненты образуют химические соединения.
Хотя указанные разновидности диаграмм состояния относятся к простейшим, более сложные диаграммы состояния, однако, не представляют чего-либо принципиально нового по сравнению с простейшими.
Применение правила фаз к анализу диаграмм состояния рассмотрено на некоторых примерах ниже.
5.1.Диаграмма состояния системы, в которой компоненты образуют непрерывный ряд твѐрдых растворов
Диаграмма состояния указанного типа приведена на рис. 22, на котором стрелками показано изменение составов твѐрдой и жидкой фаз с понижением температуры.

На оси ординат отложена температура, а на оси абсцисс – концентрация компонентов А и В. Концентрация компонента В отсчитывается слева направо, а концентрация компонента А – справа налево. Сумма концентраций компонентов А и В в любой точке диаграммы равна 100 %. Верхняя линия, соответствующая началу кристаллизации сплавов, называется линией ликвидуса (от лат. liqvidus – жидкий). Выше этой линии сплавы находятся в жидком состоянии (область ж). Нижняя линия, соответствующая концу кристаллизации, называется линией солидуса (от лат. solidus – твѐрдый). Ниже этой линии все сплавы находятся в твѐрдом состоянии (α-твѐрдый раствор – область α).
а) |
б) |
Рис. 22. Диаграмма состояния сплавов для случая неограниченной растворимости компонентов в твѐрдом состоянии: а) кривые охлаждения чистого металла A и сплава 1;
б) структура сплава состава C в зависимости от температуры (схема)
Между линиями ликвидуса и солидуса лежит область совместного существования двух фаз (ж + α).
На линии ликвидуса жидкость насыщена относительно твѐрдой фазы, кристаллы которой начинают выделяться из неѐ при малейшем понижении температуры. Сказанное относится и к линии солидуса. Ниже этой линии твѐрдые растворы устойчивы достаточно долгое время. При малейшем повышении температуры появляется жидкость.
В рассматриваемой системе возможно только одно равновесие между ее фазами – двухфазное равновесие между жидким и твѐрдым растворами
(ж ↔ α).
Проследим за кристаллизацией сплава, ордината которого на рис. 22 обозначена цифрой 1. Пока не достигнута точка l1, т. е. выше линии ликвидуса, жидкость остается однородной, а состав ее одинаков с составом рассматриваемого сплава (C). В точке l1, отвечающей температуре Т1, жидкость оказывается насыщенной относительно α-твѐрдого раствора. При малейшем понижении температуры из нее начнут выделяться кристаллы твѐрдого раствора. Их состав определится точкой s1 – пересечением изотермической прямой, проведѐнной через точку l1, с кривой солидуса.

При дальнейшем охлаждении составы твѐрдой фазы и жидкости будут непрерывно изменяться, перемещаясь по линии солидуса и ликвидуса. При этом по мере выделения кристаллов, точка состава жидкой фазы будет удаляться от точки состава исходного сплава, а точка состава твѐрдого раствора всѐ более приближаться к ней.
На первый взгляд может показаться, что состав выпадающих кристаллов не должен отличаться от состава жидкости. Однако это не так. При температуре начала кристаллизации в равновесии с жидкостью будут находиться такие кристаллы, которые, взятые сами по себе, начали бы плавиться при переходе через эту температуру. Выделение кристаллов, обогащѐнных в рассматриваемом случае компонентом В, приводит к тому, что остающаяся жидкость беднеет этим компонентом, т. е. еѐ состав сдвигается влево от состава исходного сплава. Так, при температуре Т2 состав жидкости отвечает точке С2ж .
В равновесии с этой жидкостью будут уже не кристаллы состава С1 , а кристаллы С2 , более богатые компонентом А. Таким образом, состав прежде выпавших кристаллов С1 посредством диффузии переместится влево, как это
показывает кривая солидуса. Средний состав сплава при этом, конечно, не меняется.
Отрезки l1s1, l2s2, ..., соединяющие составы находящихся в равновесии фаз, называют конодами. В точках плавления компонентов А и В коноды вырождаются в точку.
По мере охлаждения масса жидкости непрерывно уменьшается, а количество кристаллов растет. Соотношение жидкой и твѐрдой фаз при любой температуре можно вычислить по правилу отрезков (рычага).
Согласно этому правилу, например, массовое или объѐмное количество твѐрдой фазы определяется как отношение длины отрезка, примыкающего к составу жидкой фазы, к длине всей коноды. Аналогично количество жидкой фазы определится как отношение длины отрезка, примыкающего к составу твѐрдой фазы, к длине коноды. При температуре Т2, следовательно, количество
-твѐрдых кристаллов в процентах составит nl2 / l2 s2·100, а количество жидкой фазы – ns2 / l2s2·100.
При температуре Т3 последние остатки жидкости, отвечающей составу С3ж ,
исчезнут, а состав твѐрдой фазы определится точкой С, т. е. будет отвечать составу исходного сплава.
При нагреве сплава пpoцeссы в нем будут происходить в обратной последовательности. Важно, чтобы скорость охлаждения сплава или скорость его нагрева были такими, чтобы обеспечить завершение протекающих в нѐм изменений.
Анализируя равновесие между жидким и твѐрдым растворами (ж↔α) в системе, представленной на рис. 22, можно отметить следующие особенности. Так как выше линии ликвидуса система представлена только одной фазой – жидкой, вариантность системы будет равна двум (C = 3 − 1 = 2). Это означает, что обе переменные – и температура, и концентрация, которыми определяется
подобное состояние системы, независимы. На диаграмме состояния в соответствии с этим жидкости отвечает двумерная область существования (по числу независимых переменных). Другими словами, согласно правилу фаз, когда система имеет две степени свободы, можно изменять и температуру, и концентрацию. При этом система не выходит из области существования жидкой фазы.
Совершенно аналогичные рассуждения правомерны для однофазной области твѐрдого раствора.
При кристаллизации или плавлении твѐрдого раствора система состоит из двух фаз и имеет одну степень свободы (C = 3 − 2 = 1). В этом случае мы можем, не уничтожая состояния равновесия двух фаз, а только смещая его, изменять температуру. Понятно, что каждой температуре будет отвечать уже вполне определѐнное состояние системы. В данном случае только температура является независимой переменной, а две другие – составы твѐрдой и жидкой фаз – еѐ функциями.
Кристаллизация (плавление) твѐрдого раствора происходит в интервале температур, о величине которого в сплавах разных концентраций правило фаз ничего «сказать не может». Только на ординатах, соответствующих чистым компонентам, в точках пересечения ликвидуса и солидуса, этот интервал вырождается в точку. Система становится однокомпонентной, и степень свободы еѐ при переходе из жидкого состояния в твѐрдое (или наоборот) становится равной нулю. Это означает, что превращение в сплаве начинается и заканчивается при постоянной и строго определѐнной температуре.
Сказанное иллюстрируется кривыми охлаждения, приведѐнными на рис. 22. Видно, что чистый металл A (как и B) затвердевает при постоянной температуре. Все сплавы промежуточного состава дают качественно одинаковые кривые охлаждения. На них, как это показано на кривой охлаждения сплава 1, будут видны два перелома: верхний перелом соответствует началу кристаллизации, а нижний – концу кристаллизации.
По кривым охлаждения для серии сплавов от состава A до состава B можно построить диаграмму состояния. Для этого отложим на ординатах каждого сплава температуры начала и конца кристаллизации. Соединив одной кривой температуры начала кристаллизации, а другой – температуры конца еѐ, получим линии ликвидуса и солидуса.
Метод построения диаграмм состояния по кривым охлаждения называется термическим анализом.
5.2. Диаграмма состояния эвтектического типа
На рис. 23 приведен общий случай диаграммы состояния эвтектического типа, когда компоненты способны растворять друг друга в твѐрдом состоянии до некоторого предела. Здесь линия А'еВ' – линия ликвидуса, линия А'abВ' – линия солидуса. Линия аа0 показывает изменение растворимости компонента В в А с изменением температуры, а линия bb0 – компонента А в В. Эти линии получили название линий предельной растворимости. Точки а и b
характеризуют максимальную растворимость компонентов друг в друге в
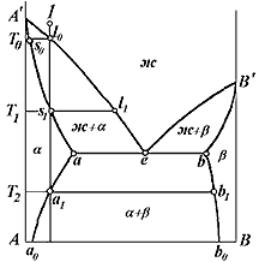
твѐрдом состоянии, а точки а0 и b0 – предельную растворимость при комнатной температуре.
Точка e пересечения двух ветвей |
|
|||||
ликвидуса |
А'е |
и |
B'e |
называется |
|
|
эвтектической точкой, а горизонталь, на |
|
|||||
которой лежит эвтектическая точка, – |
|
|||||
эвтектической горизонталью. Сплав, |
|
|||||
состав которого соответствует точке е, |
|
|||||
называют эвтектическим (т. е. легко |
|
|||||
расплавляющимся). Он кристаллизуется |
|
|||||
при самой низкой температуре. Сплавы, |
|
|||||
лежащие слева от эвтектической точки, |
|
|||||
находящиеся |
в |
пределах |
концентрации |
|
||
точек a и e, называют доэвтектическими, |
|
|||||
а сплавы, лежащие по другую сторону от |
|
|||||
неѐ, в пределах концентрации точек b и e, – |
|
|||||
заэвтектическими. |
|
|
|
|
Рис. 23. Диаграмма состояния |
|
Поле |
диаграммы |
|
состоит |
из |
системы, компоненты которой |
|
|
образуют ограниченные твѐрдые |
|||||
нескольких областей. В области ж сплавы |
растворы и эвтектику |
|
находятся в жидком состоянии, в области α |
||
|
–в состоянии твѐрдого раствора
компонента В в компоненте А, в области β – в состоянии твѐрдого раствора компонента А в В. В области ж +  имеем смесь жидкости с кристаллами α- твѐрдого раствора, в области ж + β – смесь жидкости с кристаллами β-твѐрдого раствора, а в области α + β – смесь кристаллов двух твѐрдых растворов α и β. Кроме указанных трѐх однофазных и трѐх двухфазных областей, на диаграмме имеется трѐхфазная область. Это эвтектическая горизонталь аb, где одновременно сосуществуют: жидкость состава точки е и твѐрдые растворы α и β, составы которых определяются точками а и b соответственно.
имеем смесь жидкости с кристаллами α- твѐрдого раствора, в области ж + β – смесь жидкости с кристаллами β-твѐрдого раствора, а в области α + β – смесь кристаллов двух твѐрдых растворов α и β. Кроме указанных трѐх однофазных и трѐх двухфазных областей, на диаграмме имеется трѐхфазная область. Это эвтектическая горизонталь аb, где одновременно сосуществуют: жидкость состава точки е и твѐрдые растворы α и β, составы которых определяются точками а и b соответственно.
Видно, что фрагменты представленной на рисунке диаграммы в области составов, левее точки a0 и правее точки b0 аналогичны рассмотренной выше диаграмме с неограниченной растворимостью компонентов в твѐрдом и жидком состояниях. Поэтому кристаллизация сплавов в указанных областях составов будет протекать точно так же, как и кристаллизация сплавов с полной взаимной растворимостью компонентов. После затвердевания сплавы, лежащие левее точки а0, будут состоять только из кристаллов твѐрдого раствора α, а сплавы, лежащие правее точки b0, – из кристаллов β.
На примере сплава 1 проследим за кристаллизацией сплавов, ординаты которых проходят левее точки а, но правее точки а0. Выше кривой ликвидуса сплав представляет однородную жидкость. В точке l0 на кривой ликвидуса сплав оказывается насыщенным относительно кристаллов α-твѐрдого раствора. При дальнейшем охлаждении из расплава начинают выделяться α-кристаллы, состав которых определяется точкой s0 пересечения горизонтали, проходящей через точку l0, с кривой солидуса. С понижением температуры, вплоть до Т1, составы жидкой и твѐрдой фаз будут непрерывно изменяться в соответствии с

линиями ликвидуса (участок l0l1) и солидуса (участок s0s1). Количественное соотношение фаз при той или иной температуре может быть вычислено по упомянутому выше правилу отрезков. При температуре Т1 жидкость полностью затвердевает, а состав α-кристаллов определится точкой s1. При последующем охлаждении до Т2 сплав остается однородным твѐрдым раствором. В точке а1 α- твѐрдый раствор становится насыщенным компонентом В. При дальнейшем охлаждении из α-твѐрдого раствора начнут выделяться β-кристаллы. Их состав в этот момент будет соответствовать точке b1 на кривой растворимости bb0. Процесс выделения β-кристаллов будет продолжаться с понижением температуры, причѐм составы α и β фаз будут изменяться: α-кристаллов – по кривой а1а0, β-кристаллов – по кривой b1b0.
Аналогично рассмотренному будет протекать кристаллизация сплавов, ордината которых проходит правее точки b, но левее точки b0. При этом с понижением температуры из β-твѐрдого раствора начнут выделяться α- кристаллы. Составы α и β фаз будут изменяться согласно линиям предельной растворимости аа0 и bb0.
На примере сплава 2 (рис. 24) рассмотрим кристаллизацию доэвтектических сплавов, ордината которых проходит между точками a и e, т. е. пересекает эвтектическую горизонталь. При охлаждении до кривой ликвидуса
|
(точка l0) в сплаве не происходит фазовых |
|||||
|
изменений. В интервале от Т0 |
до эвтектической |
||||
|
температуры Те будет протекать двухфазное |
|||||
|
превращение ж↔α-твѐрдый раствор. В |
|||||
|
момент достижения температуры Те |
состав |
||||
|
твѐрдого раствора определится точкой a, а |
|||||
|
жидкости – точкой е. В точке е, являющейся |
|||||
|
точкой пересечения двух ветвей ликвидуса, |
|||||
|
сплав |
становится |
насыщенным |
как |
||
|
компонентом А, так и компонентом В. |
|||||
|
Следствием |
этого является |
одновременное |
|||
|
выделение твѐрдых растворов α и |
β. Так |
||||
Рис. 24. К кристаллизации |
начинается |
трѐхфазное |
эвтектическое |
|||
сплавов, ордината которых |
превращение ж↔α + β. Составы участвующих |
|||||
проходит через эвтектическую |
в превращении фаз неизменны и, как уже было |
|||||
горизонталь |
отмечено, |
определяются точками: а – |
для α- |
|||
|
||||||
твѐрдого раствора, е – для жидкости, b – для β-твѐрдого раствора. Трѐхфазное превращение протекает при постоянной температуре и заканчивается в тот момент, когда затвердеет вся жидкость. Теперь сплав будет состоять из двух твѐрдых фаз – α и β, между которыми устанавливается двухфазное равновесие
α↔β.
При дальнейшем понижении температуры составы α и β-твѐрдых растворов будут непрерывно изменяться вдоль кривых аа0 и bb0 соответственно. Из α-твѐрдого раствора начнут выделяться β кристаллы, а из β-твѐрдого раствора
– α-кристаллы. Как видно, процесс будет аналогичен рассмотренному выше при охлаждении сплава 1 ниже точки а1 (см. рис. 23).

Кристаллизация заэвтектических сплавов, ордината которых проходит между точками е и b, протекает аналогично кристаллизации доэвтектических сплавов, рассмотренных на примере сплава 2. Только ниже линии ликвидуса вместо α-кристаллов выделяются β-кристаллы, из которых при дальнейшем охлаждении согласно кривой bb0 будут выделяться α-кристаллы.
В отличие от кристаллов, выпадающих непосредственно из жидкого расплава до достижения эвтектической температуры и получивших название первичных, кристаллы, выделившиеся из твѐрдого раствора, называют вторичными. В рассматриваемом случае их обозначают символами αII и βII.
Из изложенного ясно, что в эвтектическом сплаве, т. е. сплаве 3 (рис. 24), ордината которого проходит через эвтектическую точку е, затвердевание жидкости начинается непосредственно одновременным выделением из нее α и β-твѐрдых растворов. Таким образом, сразу начинается трѐхфазное превращение ж↔α + β, за которым следует двухфазное равновесие α↔β. Смесь одновременно закристаллизованных двух твѐрдых растворов α и β называют
эвтектической смесью или эвтектикой.
Согласно определению эвтектика – жидкая система, находящаяся в равновесии с твѐрдыми фазами, число которых равно числу компонентов системы [17]. При кристаллизации такой системы образуется механическая смесь твѐрдых фаз того же состава (твѐрдая эвтектика).
Для уяснения особенностей распада фаз α и β, обусловленного понижением температуры и сопровождающегося выделением фаз βII и αII, подчеркнѐм следующее. При охлаждении доэвтектических сплавов в результате неизбежного распада имеющейся в них β-фазы (заметим: присутствующей в эвтектике и в виде вторичной фазы βII) также образуется и вторичная α-фаза (αII). Эта фаза сливается с окружающими еѐ зѐрнами первичной фазы α и в виде самостоятельной структурной составляющей в сплавах не наблюдается. Поэтому на диаграмме состояния отмеченная особенность выделения αII не указывается. То же самое можно сказать и о фазе βII при кристаллизации заэвтектических сплавов.
Вторичные кристаллы αII и βII, выделяющиеся из эвтектических составляющих, объединяются с соответствующими фазами эвтектики и поэтому структурно не обнаруживаются.
Структуры некоторых сплавов приведены на рис. 25.
Рис. 25. Схема структур сплавов 1, 2 и 3 (см. рис. 23, 24) при комнатной температуре

Рассматривая представленную на рис. 23 диаграмму состояния с точки зрения правила фаз, отметим следующие характерные особенности. Очевидно, что трѐхфазному превращению ж↔α + β, т. е. одновременному выделению твѐрдых фаз α и β из раствора ж, насыщенного обоими компонентами, должны предшествовать двухфазные равновесия ж↔α и ж↔β.
Первое из равновесий описывается кривыми А'e и А'а и отвечает выделению из жидкости кристаллов α-твѐрдого раствора. Второе описывается кривыми B'e и B'b и отвечает выделению кристаллов β-твѐрдого раствора. Вариантность превращений ж↔α и ж↔β определяется из правила фаз согласно уравнению Габба C = 3 − 2 = 1. Одна степень свободы указывает на то, что процесс кристаллизации как α-твѐрдого раствора, так и β-твѐрдого раствора будет протекать в интервале температур. До тех пор пока жидкость насыщена кристаллами только одного вида – α или β, протекает соответственно один из двухфазных процессов.
Как только для составов, расположенных между точками a и b, температура понизится до эвтектической, достигается некоторое новое предельное состояние жидкости: она становится насыщенной одновременно обоими видами кристаллов. Таким образом, в равновесии оказываются три фазы постоянного состава: α- и β-кристаллы, составы которых соответствуют точкам a и b, и жидкость эвтектического состава. Вариантность двухкомпонентной системы, находящейся в трѐх фазах, равна нулю: C = 3 − 3 = 0. Поэтому эвтектическое превращение протекает при постоянной температуре.
5.3. Диаграмма состояния перитектического типа
Кроме рассмотренного эвтектического равновесия между жидкостью и двумя твѐрдыми фазами ж↔α + β, в двойной системе возможно другое трехфазное равновесие вида ж + α↔β, называемое перитектическим.
Перитектика (от греч. – плавлю,
расплавляю) – «жидкий раствор, который может находиться при данном давлении в равновесии с двумя или более твѐрдыми фазами, одни из которых при отнятии от системы теплоты растворяются, другие – выделяются. Число твѐрдых фаз равно числу компонентов системы, в соответствии с чем различают двойную перитектику, тройную и т. д.». «Перитектикой также нередко называют точку, в которой пересекаются линии температур начала кристаллизации двух твѐрдых фаз в равновесии с жидкостью перитектического состава».
Диаграмма состояния перитектического типа приведена на рис. 26. Линия А'рВ' соответствует линии ликвидуса, а линия А'аbВ' – линии солидуса. В результате перитектического превращения при взаимодействии жидкости и одного из ранее выделившегося твѐрдого раствора образуются кристаллы другого твѐрдого раствора. Этим перитектическое превращение отличается от эвтектического, где из жидкой фазы одновременно кристаллизуются две твѐрдые.
Перитектическому превращению, как и эвтектическому, на диаграмме состояния отвечают три точки: а, b и р. Точку р называют перитектической, а температуру, при которой протекает трѐхфазное превращение, – перитектической. Нетрудно увидеть, что на перитектической диаграмме состояния, так же как и на эвтектической, имеются семь областей: ж, α, β, ж + α, ж + β, α + β и горизонталь при температуре перитектики, на которой в равновесии находятся фазы: α, β и жидкость.
Проследим механизм перитектического превращения на примере кристаллизации трѐх сплавов, ординаты которых на рис. 26 обозначены цифрами 1, 2 и 3. Кристаллизация сплава 1 начинается при температуре Т1 выделением кристаллов α-твѐрдого раствора. Этот процесс продолжается до перитектической температуры Тр. Заметим, что точка р является точкой пересечения кривых ликвидуса α и β-твѐрдых растворов. Следовательно, жидкость оказывается насыщенной β-кристаллами. Поэтому из жидкости начинают выделяться β-кристаллы. Процесс выделения α-кристаллов прекращается. В противном случае это привело бы в результате вызываемого им обеднения жидкости компонентом А к смещению точки р вправо, т. е. в область ее ненасыщенного состояния. Таким образом, выделение из жидкости β-кристаллов может происходить только при одновременном превращении ранее выделившихся α-кристаллов, т. е. в результате перитектической реакции ж + α↔β. Когда израсходуется вся жидкость, реакция закончится, и сплав будет состоять их двух фаз: β-твѐрдого раствора и оставшихся непревращѐнными α- кристаллов. Дальнейшие превращения в сплаве произойдут, как рассмотрено ранее для сплава 2 на рис. 24.
При кристаллизации сплава 2, как и в предыдущем случае, сначала также выделяются α-кристаллы, а при перитектической температуре протекает трѐхфазное превращение ж + α↔β. К его концу вся жидкость и все α-кристаллы оказываются одновременно превращѐнными, а сплав представляет однородный β-твѐрдый раствор. При дальнейшем охлаждении из него выделяются α- кристаллы. Состав α и β-твѐрдых растворов изменяется вдоль кривых предельной растворимости aa0 и bb0.
Кристаллизация сплава 3 начинается также с выделения α-кристаллов. При перитектической температуре трѐхфазное превращение ж + α↔β заканчивается их исчезновением. Из оставшейся непрореагировавшей жидкости, уже в отсутствие α-твердого раствора, до температуры Т2 будут выделяться β- кристаллы. При этой температуре вся жидкость затвердевает, а сплав представляет собою однородный β-твѐрдый раствор. При дальнейшем
охлаждении по достижении точки b1, начнѐтся распад β-твѐрдого раствора с выделением α-кристаллов.
Можно объяснить и по-другому, почему уже выпавшие α-кристаллы растворяются в той самой жидкости, из которой они только что выделились. Дело заключается в том, что если до перитектической температуры в равновесии друг с другом были только жидкость и α-кристаллы, то, начиная с температуры перитектики, жидкость оказывается также в равновесии с β- кристаллами предельной концентрации. Поскольку разность концентраций жидкости и β-кристаллов меньше, чем той же жидкости и α-кристаллов, пройти диффузионному процессу выделения из жидкости β-кристаллов легче, чем α- кристаллов. Но как только β-кристаллы начинают выделяться, жидкость, изменяя свой состав по ликвидусу, в отношении α-кристаллов становится ненасыщенной, α-кристаллы начнут растворяться, возвращая тем самым концентрацию жидкости к прежнему равновесному состоянию. Этот процесс будет продолжаться до тех пор, пока не растворятся все α-кристаллы или не израсходуется вся жидкость.
Таким образом, при перитектическом превращении, в отличие от эвтектического, только часть сплавов, испытывающих трѐхфазное превращение, затвердеет при перитектической температуре. Состав этих сплавов лежит в интервале концентрации между точками а и b. Другая часть сплавов, испытывающих трѐхфазное превращение и расположенных в интервале концентраций между точками b и р, затвердевает ниже перитектической температуры.
Перитектическими сплавами называют сплавы, кристаллизующиеся из жидкости путем выделения твѐрдой фазы с последующим образованием из неѐ и оставшейся жидкости второй твѐрдой фазы.
Степень свободы при перитектическом превращении равна нулю. Поэтому перитектическая реакция, как и эвтектическая, протекает при постоянной температуре. Разумеется, что, пока из расплава выделяется только один вид кристалла, по отношению к которому насыщение достигается раньше, степень свободы будет равна единице. Поэтому процесс кристаллизации будет протекать в интервале температур. На кривых охлаждения сплавов, испытывающих перитектическое превращение, будет наблюдаться перелом, соответствующий началу кристаллизации одной твѐрдой фазы, и горизонтальная площадка, соответствующая собственно перитектическому процессу.
5.4.Диаграммы состояния систем, в которых компоненты образуют химические соединения
Компоненты системы могут образовывать между собою химические соединения, характеризующиеся различной прочностью. Одни из них сохраняются при переходе в жидкое состояние, другие разлагаются, не достигая точки плавления. В первом случае идѐт речь о так называемом конгруэнтном плавлении, а во втором – инконгруэнтном (от лат. congruent – совпадающий, incongruent – несовпадающий). Эти наименования указывают на совпадение
