
ткм
.pdf
ЧАСТЬ I МАТЕРИАЛОВЕДЕНИЕ ГЛАВА 1. СТРОЕНИЕ МЕТАЛЛОВ 1.1. Атомно-кристаллическое строение металлов
Все металлы и металлические сплавы, полученные обычными способами, представляют собой поликристаллические тела, состоящие из различно ориентированных по отношению друг к другу кристаллов. Эти кристаллы, вследствие взаимного столкновения в процессе кристаллизации, имеют неправильную форму и называются кристаллитами, или зѐрнами. На кристалличность металлов – самородных меди и золота – и сходство их кристаллов с кристаллами солей обратил внимание в шестидесятых годах 18-го столетия гениальный русский учѐный М.В. Ломоносов. Понятие о кристалличности металлов и сплавов легло в основу современного научного объяснения их прочностных и пластических свойств. Атомы (ионы) в кристаллах расположены закономерно.
При особых условиях металлы и сплавы могут быть получены в аморфном состоянии. Атомы в аморфных телах расположены хаотично.
В дальнейшем, вместо выражения «металлы и сплавы», в тексте возможно использование термина «металлы», что соответствует принятой терминологии. Попутно отметим, что все металлы и сплавы условно подразделяют на две группы. Железо и сплавы на его основе, т. е. сталь и чугун, называют чѐрными металлами, а остальные металлы и их сплавы – цветными.
Атомы в кристалле, располагаясь в определѐнном порядке, образуют кристаллическую решѐтку. Эта решѐтка представляет собою воображаемую пространственную сетку, в узлах которой находятся положительно заряженные ионы, а между ними – свободные электроны, получившие название электронного газа.
Расположение атомов в кристалле обычно изображают в виде пространственных так называемых элементарных кристаллических ячеек, перемещением которых можно воспроизвести пространственную кристаллическую решѐтку. Для металлов наиболее распространены три типа кристаллических решѐток:
 объѐмно-центрированная кубическая (ОЦК) – атомы расположены в вершинах и центре куба. Эта решѐтка характерна для альфа-железа, альфахрома, молибдена, вольфрама, ванадия и других металлов;
объѐмно-центрированная кубическая (ОЦК) – атомы расположены в вершинах и центре куба. Эта решѐтка характерна для альфа-железа, альфахрома, молибдена, вольфрама, ванадия и других металлов;
 гранецентрированная кубическая (ГЦК) – атомы расположены в вершинах куба и в центре каждой грани. Эту упаковку имеют металлы: гаммажелезо, альфа-никель, медь, алюминий, свинец и др.;
гранецентрированная кубическая (ГЦК) – атомы расположены в вершинах куба и в центре каждой грани. Эту упаковку имеют металлы: гаммажелезо, альфа-никель, медь, алюминий, свинец и др.;
гексагональная плотноупакованная (ГПУ) – атомы расположены в углах
ицентре шестигранных оснований призмы, и три атома расположены в средней плоскости призмы. Эту решѐтку имеют магний, цинк, кадмий, альфа-цирконий
идругие металлы.
Расстояния между центрами ближайших атомов в элементарной ячейке называются периодами решѐтки.

В ОЦК-рѐшетке каждый атом в вершине куба одновременно принадлежит восьми элементарным ячейкам. Следовательно, на одну элементарную ячейку ОЦК-решѐтки приходится два атома: из них один атом находится в центре куба, а один вносят атомы, расположенные в вершинах куба. Аналогичным образом можно показать, что на одну элементарную ячейку ГЦК-решѐтки приходится четыре атома, а на одну ячейку ГПУ-решѐтки – шесть атомов.
Важной характеристикой кристаллической решѐтки является еѐ плотность, т. е. объѐм, занятый атомами. Атомы при этом рассматриваются как жѐсткие
шары. |
Плотность |
характеризуется |
|
|
|
||||||||
координационным числом |
– |
числом |
|
|
|
||||||||
атомов, находящихся на равном и |
|
|
|
||||||||||
наименьшем расстоянии от одного, так |
|
|
|
||||||||||
называемого базисного атома. |
|
|
|
|
|
|
|||||||
На рис. 1 приведена схема |
|
|
|
||||||||||
кубической |
объѐмно-центрированной |
|
|
|
|||||||||
решѐтки, где за базисный атом ○ взят |
|
|
|
||||||||||
атом, расположенный в центре куба. |
|
|
|
||||||||||
Наименьшее |
|
расстояние |
|
между |
|
|
|
||||||
атомами |
составляет |
|
|
|
, |
где а |
– |
|
|
|
|||
a |
3 / 2 |
|
|
|
|||||||||
период решѐтки. |
|
|
|
|
|
|
|
|
|
|
|||
Видно, что на равном и |
|
|
|
|
|
||||||||
ближайшем |
расстоянии |
|
от |
него |
|
|
|
|
|
||||
находится |
|
8 |
|
|
атомов, |
|
|
|
|
|
|||
расположенных в вершинах куба. |
Рис. 1. Схема, демонстрирующая число |
||||||||||||
Таким образом, координационное |
атомов, находящихся на равном и наименьшем |
||||||||||||
число |
для |
|
этой |
решѐтки |
8 |
расстоянии d в объѐмно-центрированной |
|||||||
(обозначается К8), а коэффициент |
|
|
кубической решѐтке |
||||||||||
заполнения, |
|
т. е. |
отношение |
|
|
|
|
|
|||||
объѐма, занятого атомами, к |
|
|
|
|
|
||||||||
объѐму ячейки, составит 68 %. |
|
|
|
|
|
|
|||||||
Чем |
|
|
|
больше |
|
|
|
|
|
||||
координационное |
|
|
число |
|
|
|
|
|
|||||
решѐтки, тем выше плотность |
|
|
|
|
|
||||||||
упаковки |
|
атомов. |
|
Для |
|
|
|
|
|
||||
гранецентрированной |
|
|
|
|
|
|
|
|
|
||||
кубической |
и |
гексагональной |
|
|
|
|
|
||||||
плотноупакованной |
решѐток |
|
а) |
|
б) |
|
|||||||
координационное |
число |
12 |
Рис. 2. Схема, поясняющая различную плотность |
||||||||||
(принятое |
|
обозначение |
атомов в двух плоскостях ОЦК решѐтки: |
||||||||||
соответственно К12 и Г12). Эти |
а) в плоскости куба; б) в плоскости, |
||||||||||||
решѐтки |
являются |
наиболее |
проходящей через элементарную ячейку |
||||||||||
|
|
|
|
|
|||||||||
компактными. |
Коэффициент |
|
|
|
|
|
|||||||
заполнения в них составляет 74 %. |
|
|
|
|
|
||||||||
В специальной литературе рассматриваются такие вопросы, как кристаллографические обозначения атомных плоскостей кристаллов и индексы

направлений, что необходимо, например, при объяснении такого характерного для металлических кристаллов свойства, как анизотропия – неодинаковость многих свойств – физических, химических, механических – по разным кристаллографическим направлениям. Связано это с тем, что различные плоскости заполнены атомами с различной плотностью. В качестве примера рассмотрим две плоскости в объѐмно-центрированной кубической решѐтке: плоскость куба и плоскость, проходящую через элементарную ячейку (рис. 2).
Четыре атома, расположенные в вершинах квадрата, вносят в плоскость куба один атом, поскольку каждый из этих атомов в совокупности с соседними ячейками принадлежит четырѐм плоскостям. Следовательно, плотность атомов в плоскости куба составит 1/a2 (а – период решѐтки). Плотность атомов в плоскости, проходящей через элементарную ячейку, как нетрудно показать, составит 
 2
2 a2 , т. е. в
a2 , т. е. в 
 2 раз будет больше.
2 раз будет больше.
Анизотропия особенно важна в технике, где используются монокристаллы. Металлы, затвердевшие в обычных условиях, состоят из множества различно ориентированных по отношению друг к другу кристаллитов. Поэтому свойства литого металла во всех направлениях более или менее одинаковы. Это явление получило название квазиизотропности, т. е. кажущейся одинаковости.
1.2. Дефекты в реальных кристаллах
Дефекты в кристаллах, или структурные дефекты, – это нарушения периодичности пространственного расположения атомов (ионов) в кристаллическом теле. Различают четыре типа дефектов:
 точечные, имеющие малые, не превышающие нескольких атомных диаметров размеры в трѐх измерениях;
точечные, имеющие малые, не превышающие нескольких атомных диаметров размеры в трѐх измерениях;
 линейные, имеющие малые размеры в двух измерениях и значительную протяжѐнность в третьем;
линейные, имеющие малые размеры в двух измерениях и значительную протяжѐнность в третьем;
поверхностные, протяжѐнные в двух направлениях и малые в третьем; объѐмные, имеющие значительные размеры во всех трех направлениях.
К точечным дефектам относят:
вакансии – узлы в кристаллической решѐтке, свободные от атомов; межузельные атомы – атомы, находящиеся вне узлов кристаллической
решѐтки;
 примесные атомы, которые могут находиться как в междоузлиях (атом внедрения), так и в узлах кристаллической решѐтки (атом замещения).
примесные атомы, которые могут находиться как в междоузлиях (атом внедрения), так и в узлах кристаллической решѐтки (атом замещения).
К точечным дефектам относятся также некоторые комбинации: бивакансии, комплексы и т. п. Появление вакансий связано с присутствием в кристалле атомов с кинетической энергией, значительно превышающей среднюю, свойственную данной температуре. При перемещении атома кристалла из нормального положения в узле в какое-либо из междоузлий возникает пара «вакансия – межузельный атом», которая называется дефектом Френкеля. Если же под действием тепловых флуктуаций атом из своего узла выходит на поверхность (он может даже испариться), образующийся дефектвакансия называется дефектом Шотки (W. Schottky).

Место образовавшихся вакансий займут атомы, удалѐнные от поверхности, а вакансия будет перемещаться в глубь кристалла. Таким образом, источниками вакансий, получивших название тепловых, являются границы зѐрен, трещины и другие пустоты. Схема образования вакансий представлена на рис. 3.
Заштрихованные квадратики – атомы.
Точечные дефекты, в отличие от других дефектов, являются термодинамически
равновесными, т. е. каждой температуре кристалла соответствует определенная концентрация тепловых вакансий и межузельных атомов. Энергия образования межузельного атома значительно превышает энергию образования вакансии, так как межузельный атом вызывает большие искажения, чем вакансия.
Поэтому концентрация межузельных атомов по сравнению с концентрацией вакансий невелика. За счѐт облучения высокоэнергетическими элементарными частицами, быстрого охлаждения с высокой температуры, пластической деформации можно достичь концентрации точечных дефектов гораздо выше равновесной. Точечные дефекты оказывают влияние на электрические, магнитные и другие свойства металлов и сплавов.
К наиболее важным видам линейных дефектов относятся дислокации (от лат. dis – раз + location – смещение, перемещение). Их простейшими видами являются краевая и винтовая дислокации.
Краевую дислокацию удобно представить следующим образом. Рассмотрим кристалл как толстую книгу, в которой атомные плоскости моделируются листами бумаги. Затем вложим еще один лист размером в половину страницы. Идеальный порядок – параллельность атомных плоскостей-листов на всѐм протяжении – нарушится, поскольку вложенная плоскость обрывается внутри книги – кристалла (в реальных кристаллах атомные плоскости часто обрываются). Так возникает краевая дислокация, осью или линией которой является край «лишней» полуплоскости, получившей название экстраплоскости. Далее представим себе плоскость, перпендикулярную листам бумаги и проходящую через край экстраплоскости. По обе стороны от этой плоскости, называемой плоскостью скольжения, между всеми атомами налажено взаимодействие – они как бы «вцепились» друг в друга, а атом на краю экстраплоскости одинок: у него нет атома напротив. Описанная картина с книгой представлена на рис. 4, где светлыми кружочками обозначены атомы, Р – вектор сдвига.

Одновременно на этом рисунке |
|
|||||
показано, что краевая дислокация |
|
|||||
может быть получена в результате |
|
|||||
неполного |
сдвига верхней |
части |
|
|||
кристалла |
относительно |
нижней на |
|
|||
один |
период |
кристаллической |
|
|||
решѐтки. При этом направление |
|
|||||
сдвига |
перпендикулярно |
оси |
|
|||
дислокации. |
|
|
|
|
||
Видны: |
след |
«лишней» |
|
|||
полуплоскости, проходящей через ось |
|
|||||
Y |
перпендикулярно |
плоскости |
|
|||
рисунка, |
и |
след |
плоскости |
|
||
скольжения Х, проходящей также |
|
|||||
перпендикулярно плоскости рисунка. |
Рис. 4. Схема краевой дислокации |
|||||
Видно нарушение расположения |
|
|||||
атомов и нарушение параллельности атомных плоскостей. Затушѐванная область, вытянутая вдоль оси дислокации, называется ядром дислокации.
На рис. 4 атомы ядра дислокации расположены по контуру затушѐванного пятиугольника. В реальных кристаллах поперечные размеры области нерегулярного расположения атомов на линии дислокации составляют несколько межатомных расстояний. Понятно, что выше линии дислокации решѐтка сжата, а ниже – растянута. Если экстраплоскость расположена в верхней части кристалла, как показано на рис. 4, дислокацию называют положительной и обозначают знаком  ; если в нижней (для чего достаточно перевернуть кристалл) – отрицательной и обозначают знаком
; если в нижней (для чего достаточно перевернуть кристалл) – отрицательной и обозначают знаком  . Указанное различие чисто условное и используется при анализе взаимодействия дислокаций. Дислокации противоположных знаков притягиваются, а одного –
. Указанное различие чисто условное и используется при анализе взаимодействия дислокаций. Дислокации противоположных знаков притягиваются, а одного –
отталкиваются. |
|
|
|
|
|
|
|
|
Винтовую |
дислокацию представить |
|||||
|
более сложно. Она может быть получена |
||||||
|
при сдвиге на период решѐтки одной части |
||||||
|
кристалла |
относительно |
другой |
вдоль |
|||
|
некоторой |
|
полуплоскости |
|
(эта |
||
|
полуплоскость |
проходит |
|
через |
|||
|
затушѐванную часть кристалла на рис. 5). |
||||||
|
Край этой полуплоскости – прямая EF, |
||||||
|
точнее, та часть этой прямой, которая |
||||||
|
пронизывает кристалл, называется осью, |
||||||
|
или линией дислокации. Она отделяет ту |
||||||
|
часть плоскости скольжения, где сдвиг уже |
||||||
|
произошел, от той части, где сдвиг еще не |
||||||
|
происходил. Следовательно, направление |
||||||
Рис. 5. Схема винтовой дислокации |
сдвига, |
порождающего |
|
винтовую |
|||
дислокацию, |
параллельно |
еѐ |
оси. |
При |
|||
|
|||||||

дальнейшем действии сил ось дислокации продолжит смещение к задней стенке кристалла до линии Е'F' и т. д.
Важно обратить внимание на то обстоятельство, что на рис. 5 атомы представлены в виде деформированных кубов. На этом акцентируется внимание не во всех изданиях, и некоторые читатели полагают, что атомы расположены в местах пересечения линий. Вследствие этого возникает недопонимание. Теперь, если текущее положение линии дислокации будем обходить вокруг, начиная с левой, более «высокой» части кристалла, т. е. двигаться по часовой стрелке, то опустимся по винтовой «лестнице» вниз, переходя с одного «кристаллического этажа» на другой. Получается, что атомные плоскости, закручиваясь вокруг линии дислокации, смыкаются в одну винтовую поверхность. Отсюда и название дислокации. Вокруг неѐ формируются геометрические и энергетические искажения в кристаллической решѐтке. Дислокацию,
образованную вращением по часовой стрелке, называют |
правой, |
а в |
||
|
противоположном направлении – левой. |
|
||
|
На рис. 6 схематически показано |
|||
|
расположение атомов в двух атомных |
|||
|
плоскостях, расположенных по одну и другую |
|||
|
стороны от плоскости скольжения. Плоскость |
|||
|
рисунка совпадает с плоскостью скольжения. |
|||
|
Белыми кружками показаны атомы атомной |
|||
|
плоскости, расположенной непосредственно |
|||
|
выше плоскости скольжения, а чѐрными |
|||
|
кружками – атомы плоскости, расположенной |
|||
|
ниже плоскости скольжения. |
|
|
|
|
Между |
рассмотренными |
предельными |
|
|
случаями – краевой и винтовой дислокациями |
|||
|
– возможны любые промежуточные, где линия |
|||
Рис. 6. Расположение атомов |
дислокации не обязательно прямая, а может |
|||
вокруг винтовой дислокации АБ |
представлять |
произвольную |
плоскую |
или |
пространственную кривую.
Дислокации образуются при срастании зѐрен и блоков в процессе кристаллизации, при фазовых превращениях, а также в процессе пластической деформации.
Внутри кристалла линии дислокации не могут обрываться и должны либо выходить на поверхность кристалла (кристаллита), либо разветвляться, образуя сетку дислокаций, либо быть замкнутыми, образуя так называемые дислокационные петли.
Одной из важнейших характеристик дислокаций является их плотность – суммарная длина всех линий дислокаций в единице объѐма материала (размерность см/см3 или см-2). Плотность дислокаций определяется экспериментально, как среднее число линий дислокаций, пересекающих единичную площадку. В наиболее совершенных монокристаллах плотность дислокаций составляет 102–103 см-2, для отожжѐнных металлов – 106–108 см-2, а для холоднодеформированных она увеличивается до 1011–1012 см-2, что

равносильно суммарной длине дислокаций, заключенных в 1 см3, примерно в один миллион километров. Это больше, чем расстояние от Земли до Луны и обратно!
Прочность металла от плотности дислокаций зависит следующим образом: для наиболее совершенных монокристаллов (бездефектные усы) она близка к теоретической, для отожжѐнных металлов снижается, а при дальнейшем увеличении плотности дефектов – несколько возрастает.
Степень искажения кристаллической решѐтки вокруг дислокации оценивается вектором Бюргерса – основной характеристикой дислокационной линии. Для его определения вокруг линии дислокации строится контур (контур Бюргерса). Такой контур в кристалле с краевой дислокацией представлен на рис. 7. Откладывая из точки 1 отрезки, равные, например, трѐм межатомным
расстояниям |
(протяжѐнность |
сторон |
|
|||
контура выбирается произвольно) и, |
|
|||||
обходя дислокацию, как показано на |
|
|||||
данном рисунке, приходим в точку 1'. |
|
|||||
Контур оказывается разомкнутым. Чтобы |
|
|||||
замкнуть |
контур, |
его |
необходимо |
|
||
дополнить вектором, замыкающим разрыв. |
|
|||||
Этот вектор называют вектором Бюргерса |
|
|||||
и обозначают b. Понятно, что в |
|
|||||
бездефектном кристалле контур был бы |
|
|||||
замкнутым. |
|
|
|
|
|
|
Определение |
вектора |
|
Бюргерса |
|
||
винтовой |
дислокации |
производят |
Рис. 7. Контур Бюргерса 1–2–3–4–1' |
|||
аналогично. |
Вектор Бюргерса однозначно |
|||||
вокруг краевой дислокации, |
||||||
характеризует дислокацию. Он |
позволяет |
|||||
замыкающейся вектором Бюргерса b |
||||||
рассчитать |
ряд параметров, |
|
например, |
|||
|
|
|||||
силы, требуемые для продвижения дислокации.
Увинтовой дислокации вектор Бюргерса параллелен к еѐ линии, у краевой
–перпендикулярен.
Дислокации оказывают влияние не только на прочностные свойства. Они увеличивают электросопротивление, скорость диффузии.
К поверхностным дефектам относятся границы зѐрен, субзѐрен, двойниковые границы, дефекты упаковки (нарушения в чередовании плотноупакованных плоскостей; чаще всего встречаются в плотноупакованных структурах – ГЦК и ГПУ). Границы представляют переходную зону между кристаллитами или субзѐрнами с различной ориентацией кристаллографических плоскостей (рис. 8). Ориентация зѐрен показана стрелками.
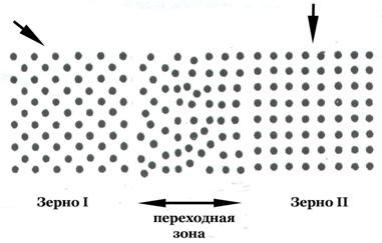
Переходная область между кристаллитами составляет 5–10 межатомных расстояний. Нарушения на границах субзѐрен меньше. Поверхностные дефекты, особенно границы зѐрен, оказывают существенное влияние на свойства материалов. Например, предел текучести ζт зависит от размера зерна d
следующим образом:
ζт = ζo + kd-0,5,
где ζo и k – постоянные для данного материала, т. е. чем мельче зерно, тем выше предел текучести. Увеличивается вязкость и снижается опасность хрупкого разрушения. Размер субзѐрен оказывает аналогичное, но меньшее влияние. По сравнению с диффузией сквозь кристалл, диффузия по границам зѐрен протекает во много раз быстрее, что имеет большое практическое значение.
К объѐмным дефектам относятся скопления точечных дефектов типа пор, включения посторонних фаз, смещения атомов из-за разной ориентации граничащих объѐмов кристалла.
1.3.Диффузионные процессы в металле
Вспециальной литературе приводится несколько отличающихся в деталях определений слова диффузия (от лат. diffusio – распространение, растекание). В общем случае под диффузией условимся понимать перемещение атомов на расстояния не менее средних межатомных для данного вещества. Диффузия – прямое следствие теплового движения атомов. При постоянной температуре и отсутствии разности химических потенциалов в пределах системы диффузионное перемещение происходит неупорядоченно. Разность химических потенциалов может определить направленный диффузионный поток, т. е. направление преимущественного перемещения. При постоянной температуре разность химических потенциалов может быть обусловлена наличием дефектов в кристаллах, градиентом упругих напряжений, а также неоднородностью распределения концентраций компонентов системы.
Втвѐрдых телах принципиально возможно несколько механизмов диффузионного перемещения атома: циклический – одновременное перемещение группы атомов по замкнутому контуру; обменный – взаимный обмен положением двух атомов (частный случай циклического); вакансионный
– переход атома из позиции, в которой он находится, в свободную позицию – вакансию; межузельный – перемещение атомов в междоузлиях (рис. 9).
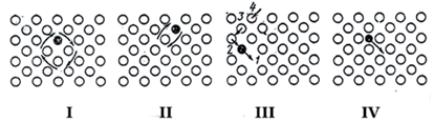
Реализуется тот механизм, при котором оказывается наименьшим энергетический барьер (энергия активации) – величина, которую необходимо преодолеть перемещающемуся атому. Для металлических атомов наиболее вероятен вакансионный механизм, а для элементов с малым атомным радиусом, таких как водород, углерод, азот – межузельный.
Рис. 9. Схема, демонстрирующая механизмы перемещения атомов в кристаллической решѐтке металла:
I – совместное перемещение (циклическое вращение) группы атомов (в данном случае – четырѐх);
II – обмен соседних атомов;
III – 1 – вакансия, в которую может переместиться атом 2, обладающий повышенной энергией; появившуюся на месте атома 2 вакансию может занять атом 3 и т. д.;
IV – диффузия по межузельному механизму (характерна для элементов с малым атомным радиусом – C, N, H)
Для описания диффузионных процессов в металлах и сплавах предложен ряд зависимостей, в основе которых лежат признанные классическими законы Фика. Их два. Они рассматриваются в специальной и учебной литературе, где материаловедение является профилирующей дисциплиной.
Диффузионные процессы играют важную роль в процессах кристаллизации, рекристаллизации, фазовых превращений, лежат в основе многих технологических процессов, таких как получение материалов методами порошковой металлургии, создание диффузионных покрытий (азотирование, цементация, борирование, силицирование, хромирование, нитроцементация и т. п.), плазменных и детонационных покрытий, покрытий, получаемых методом холодного газодинамического напыления, а также в процессах обработки материалов резанием, при эксплуатации машин и механизмов и во многих других случаях.

ГЛАВА 2. ФОРМИРОВАНИЕ СТРУКТУРЫ МЕТАЛЛОВ И СПЛАВОВ ПРИ КРИСТАЛЛИЗАЦИИ
2.1. Кристаллизация металлов
Переход металла из жидкого состояния в твѐрдое кристаллическое называется кристаллизацией. Вместе с тем, в некоторых учебниках кристаллизация определяется как переход металла из жидкого состояния в твѐрдое. Такое определение устарело. Оно не точно, поскольку в настоящее время многие металлические материалы, благодаря высоким скоростям охлаждения их расплавов, получают не в кристаллическом, а в аморфном состоянии. Одно из современных определений понятия «кристаллизация» звучит так: «Кристаллизация – образование кристаллов при переходе вещества из термодинамически неустойчивого состояния (жидкого, твѐрдого,
газообразного) в устойчивое». На рис. 10 представлена так называемая Р–Т диаграмма состояния чистого вещества.
Из показанных на данном рисунке линий – «плавление», «кипение» и « сублимация» – первые две не нуждаются в пояснении, поскольку понятия «плавление» и «кипение» хорошо известны из школьного курса. Дадим определение третьему понятию – «сублимации». Сублимация – переход вещества из твѐрдой фазы в газообразную, минуя жидкую (вещество не
|
плавится). |
Этот |
|
переход |
|
|
сопровождается |
поглощением |
|||
|
тепла. |
|
|
|
|
|
Из рис. 10 следует, что |
||||
|
вещество |
в кристаллическом |
|||
Рис. 10. Диаграмма состояния чистого вещества: |
состоянии |
(область |
|
ниже ВАС |
|
AC' – кривая плавления вещества с |
или ВАС') может быть получено, |
||||
аномальным изменением объѐма при |
|||||
кроме |
обычных |
хорошо |
|||
плавлении (лѐд, Bi, Ga и др.) |
|||||
известных |
путей: «жидкость → |
||||
|
|||||
твѐрдое» (например, замерзание водоѐмов, процессы пайки) или «газ → жидкость → твѐрдое», также путем «газ → твѐрдое» (осаждение из газовой фазы). Первые два процесса, как видно из диаграммы, протекают при давлениях, превышающих давление в тройной точке А, а осаждение из газовой фазы – при меньших давлениях. Данное выше определение кристаллизации предусматривает еще один путь получения кристаллического вещества, а именно «твѐрдое → твѐрдое». Наглядный пример «твѐрдого» пути – переход вещества из аморфного состояния в кристаллическое.
