
- •1. Количественные определения в операциях обогащения
- •Отсадка
- •Решение:
- •2.1. Задания для самостоятельной работы
- •2. Выщелачивание руд благородных металлов
- •2.1. Термодинамика растворения.
- •Решение:
- •2.2. Металлургический расчет выщелачивания
- •Цианирование
- •Решение:
- •1.Расчет расхода цианистого натрия и извести.
- •2. Определим массу и состав растворов, выходящих из аппаратов цианирования.
- •3. Определим остаточное содержание золота в руде после цианирования.
- •4. Составим материальный баланс операции цианирования 1 т руды.
- •2.1. Задания для самостоятельной работы
- •3.Отделение растворов oт осадка. Расчет промывки осадков
- •3.1. Отмывка методом периодической декантации.
- •Решение:
- •Решение:
- •3.2 Расчет отмывки осадка после фильтрации пульпы.
- •3.2. Задания для самостоятельной работы
- •4.Цементация благородных металлов из растворов
- •4.2. Задания для самостоятельной работы
- •5.1. Законы Фарадея и показатели электролиза
- •5.1.1. Законы Фарадея
- •5.1.2. Выход по току:
- •5.1.3. Удельный расход энергии и выход по энергии:
- •5.1.4. Напряжение на электролизёре:
- •5.2. Расчёты при электролитическом рафинировании сплавов благородных металлов.
- •5.3. Расчёт при электрохимическом выделении золота из тиомочевинного элюата
- •6.Расчет схем сорбционного выщелачивания
Решение:
Запишем реакцию растворения в ионной форме:
![]() (2.1.6)
(2.1.6)
Представим ее в виде двух полуреакций (окисления и восстановления):
![]() (2.1.7)
(2.1.7)
![]() (2.1.8)
(2.1.8)
Таблица 2.1
Стандартные потенциалы некоторых окислителей металлов
|
Полуреакция востановления |
рН среды |
о, В |
|
|
|
+ 1,36 |
|
|
7 |
+ 1,23 |
|
|
14 |
+ 0,40 |
|
|
14 |
- 0,15 |
|
|
14 |
+ 0,95 |
|
|
0 |
+ 0,69 |
|
|
0 |
+ 0,69 |
|
|
|
+ 2,87 |
|
|
|
+ 2,91 |
|
|
|
+ 1,02 |
|
|
14 |
+ 1,00 |
|
|
0 |
+ 0,77 |
|
|
0 |
+ 0,86 |
|
|
|
+ 0,54 |
|
|
|
+ 0,54 |
|
|
|
+ 1,09 |
.Окислительный
потенциал кислорода при его восстановлении
по полуреакции (2.7)
![]() (см. табл. 2.1). Потенциал золота в растворе
его соли
(см. табл. 2.1). Потенциал золота в растворе
его соли![]() (см.
табл. 2.2).
(см.
табл. 2.2).
В
случае отсутствия справочных данных
потенциал металла в растворе его соли
может быть определен по известным
значениям константы нестойкости
комплекса
![]() по уравнению Нернста.
по уравнению Нернста.
Таблица 2.2
Стандартные потенциалы благородных металлов в воде и в растворах их солей и константы нестойкости образующихся комплексов
|
Полуреакция окисления |
о, В |
|
|
|
+ 1,88 |
|
|
|
+ 1,50 |
|
|
|
+ 0,799 |
|
|
|
+ 1,2 |
|
|
|
+ 0,987 |
|
|
|
+ 0,8 |
|
|
|
- 0,54 |
41 |
|
|
+ 0,15 |
29,4 |
|
|
- 0,47 |
39,9 |
|
|
+ 0,38 |
25,5 |
|
|
+ 0,58 |
22,1 |
|
|
+ 1,00 |
29,5 |
|
|
+ 0,73 |
16 |
|
|
+ 0,76 |
33 |
|
|
+ 0,59 |
13,2 |
|
|
+ 0,44 |
19,0 |
|
|
+ 0,40 |
29,6 |
|
|
+ 0,19 |
24,9 |
|
|
+ 0,86 |
20 |
. Рассмотрим этот расчет.
Применительно к реации (2.1.6) уравнение Нернста примет вид
![]()
![]() (2.1.9)
(2.1.9)
Подставив
значения постоянных (R,
T,
F),
![]() ,n
и перейдя от натуральных логарифмов к
десятичным, получим для золота при 25
оС:
,n
и перейдя от натуральных логарифмов к
десятичным, получим для золота при 25
оС:
![]()
![]() (2.1.10)
(2.1.10)
Значение![]() найдем
через константу нестойкости комплексного
иона
найдем
через константу нестойкости комплексного
иона![]() ,
равновесие диссоциации которого
,
равновесие диссоциации которого![]()
сильно сдвинуто влево и характеризуется величиной константы нестойкости:
 (2.1.11)
(2.1.11)
Из
уравнения (2.1.11)

Подставим
значение
![]() в
уравнение (2.1.10):
в
уравнение (2.1.10):
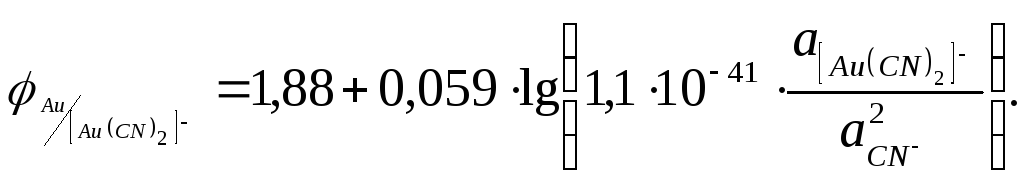
После упрощения получим:

При
![]() =
1 и
=
1 и![]() стандартный потенциал полуреакции
(2.1.8) равен – 0,54 В, т.е.
стандартный потенциал полуреакции
(2.1.8) равен – 0,54 В, т.е.![]() .
.
Так
как
![]() (-
0,15 В) меньше чем
(-
0,15 В) меньше чем![]() (-
0,54 В), то процесс растворения золота в
цианистом растворе в присутствии
кислорода термодинамически возможен.
(-
0,54 В), то процесс растворения золота в
цианистом растворе в присутствии
кислорода термодинамически возможен.
Рассчитаем
по уравнениям (2.1.1) и (2.1.2)
![]() иКр
реакции:
иКр
реакции:
![]()
![]()
![]()
Высокое значение константы равновесия показывает, что реакция (2.1.6) должна протекать с большой полнотой в сторону растворения золота.
