
- •Казахская головная
- •Оглавление
- •Предисловие
- •Лекция № 1 «Общие сведения о предмете»
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 2 «Законы термодинамики» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Глоссарий
- •Литература
- •Лекция № 3 Продолжение темы: «Законы термодинамики» Краткое содержание лекции
- •Сабақтын қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Глоссарий
- •Литература:
- •Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 5 «Коллоидные системы»
- •Сабақтың қысқаша мазмұны
- •Контрольные вопросы
- •Список литературы
- •Лекция № 6 «Получение коллоидно-дисперсных систем» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Контрольные вопросы
- •Лекция № 7 «Строение лиофобных золей» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 8 «Коллоидно-химическая теория схватывания и твердения вяжущих веществ»
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Cабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция №10 «Фазовые равновесия в однокомпонентных системах» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срсп
- •Глоссарий
- •Литература
- •Лекция №11 «Фазовые равновесия в двухкомпонентных системах. Диаграмма состояний двухкомпонентной системы с эвтектикой без твердых растворов и химических соединений» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы:
- •Литература
- •Лекция №12 « Диаграмма состояния двухкомпонентной системы с химическим соединением»
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 13 «Основы аналитической химии» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература:
- •Лекция № 14 «Количественная характеристика растворов» Краткое содержание лекции
- •Лекцияның қысқаша мазмұны
- •Контрольные вопросы
- •Глоссарий
- •Литература:
- •Лекция № 15 «Методы качественного анализа» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Сабақтың қысқаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция №17 «Непредельные углеводороды» Краткое содержание лекции
- •Диеновые углеводороды (алкадиены, или диолефины)
- •Непредельные углеводороды ряда ацетилена (алкины)
- •Cабактың кыскаша мазмұны
- •Задание на срс
- •Задание на срсп
- •Контрольные вопросы
- •Глоссарий
- •Литература
- •Лекция № 18 «Производные ациклических углеводородов. Галогенопроизводные»
- •Лекция № 29 «Полимерные композиции»
- •Лекцияның қысқаша мазмұны
- •Задание наСрс
- •Задание наСрсп
- •Контрольные вопросы
- •Глоссарий
- •Литература:
- •Лекция № 30 «Поверхностно-активные вещества» Краткое содержание лекции
- •Сабақтың қысқаша мазмұны
- •Задание наСрс
- •Контрольные вопросы
- •Глоссарий
- •Литература
Глоссарий
|
№ |
Русс/каз/англ. |
Пояснение |
|
1 |
Номенклатура органических соединений |
Тривиальные, рациональные, международные названия органических соединений
|
|
Органикалык косылыстардын номенклатурасы | ||
|
Nomenclature of organic compounds | ||
|
2 |
Структурные формулы |
Изображения органических соединений с помощью символов для элементов и черточек для обозначения химических связей |
|
Структуралык формулалар | ||
|
Structural formulas | ||
|
3 |
Природные газы |
Дешевое и ценное сырье для получения различных органических веществ |
|
Табиги газдар | ||
|
Natural gases | ||
|
4 |
Крекинг нефти |
Термическое разложение при высокой температуре
|
|
Мунайды крекинглеу | ||
|
Gracing | ||
|
5 |
Этиленовые углеводороды |
В молекулах которых между углеродными атомами имеется одна двойная связь |
|
Этилещцк кемірсутектер | ||
|
Ethylene nydrocarfons | ||
|
6 |
Ацетилен |
Ненасыщенный углеводород, содержащей в молекуле одну тройную связь |
|
Ацетилен | ||
|
Acetylene | ||
|
7 |
Каучук |
Высокомолекулярное соединение
|
|
Каучук | ||
|
Caoutchouc |
Литература
Основная:
1. Артеменко А.И. Органическая химия. – М.: «Высшая школа», 2003. – 605с.
Дополнительная:
3. Артеменко А.И. Органическая химия. – М.: «Высшая школа», 1987. – 430с.
Лекция № 18 «Производные ациклических углеводородов. Галогенопроизводные»
Краткое содержание лекции
Галогенопроизводными называют органические соединения в молекулах, которых один или несколько атомов водорода замещены на галогены. В зависимости от числа водородных атомы углеводорода заменены на галогены, различают моно- и полигалогенопроизводные (ди-, три – и более).
Характер радикала, связанного с галогеном, определяет предельность или непредельность галогенопроизводных.
По систематической номенклатуре название галогенопроизводного складывается из названия углерода и галогена с добавлением цифр, обозначающие его места в главной цепи.
|
Например:
СН3-С2Н5- Br- 1-бром пропан
Сабактың қысқаша мазмұны Молекуласында сутек атомдары бір немесе бірнеше сутек галогенге алмасқан органикалық қосылыстарды галогентуындылар деп атайды. Көмірсутектегі сутек атомдарының галогенге алмасқан санына байланысты моно- және полигологентуындылар (ди-, три және т.б.) болып бөлінеді Галогенмен байланысқан радикалдың сипатына байланысты қаныққан және қанықпаған түрлері анықталады. Қарапайым моногалогентуындыларды атау үшін, галогенмен байланысқан көмірсутектің аты аталып, галогеннің орыны цифрамен көрсетіледі Мысалы:
СН3-С2Н5- Br-1 бром пропан Задание наСРС
изготовления строительных материалов. Примеры.
О 1с.131-133; 140 Д 3с. 89-90; 98 Сроки выполнения – 9 неделя. Вид заданий – контрольная работа.
Задание на СРСП
моногалогенпроизводных.
С2Н5СL+NaOH C2H5J+AgNO2 C2H5CL+NaOC2H5
О 1с.127-130 Д 3с. 91; 96-97 Контрольные вопросы
А) Для письменного контроля
Б) Для компьютерного тестирования 1.Укажите формулу 1-хлорбутана: СН3–(СН2)2-СН2Сℓ СН3–СН2-(СН Сℓ)-СН3 СН3–СН (СН3)- СН2Сℓ СН3–СН2–СН2- СН2Br 2. Какая формула соответствует 2- хлорбутану. СН3–СН(Сℓ) –СН2- СН3 СН3–СН2-(СН Сℓ)-СН3 СН3–СН (СН3)- СН2Сℓ СН3–СН2–СН2- СН2Br 3.Укажите общую формулу предельных моногалогенпроизводных: СnH2n+1Hаℓ СnH2n+2 СnH2nСООН СnH2n 4.Сколько изомеров имеют галогенпроизводное СН3–СН2- СН2 - СН2Сℓ? три два четыре один 5.Укажите способ получения моногалогенопроизводных. R-Сℓ+Na-I+Na
Cℓ С2Н4+Н2 CH3I+2Na CH3Сℓ+NaОН 6.Укажите формулу дихлорметана СН2Cℓ2 СН3Cℓ СН3- СНCℓ2 СН3Cℓ2 7.Укажите формулу растворителя тетрахлорид углерода СCℓ4 СН3Cℓ СНCℓ2- СНCℓ2 СН2Cℓ2 8.Укажите формулу хлористого винила СН2=СНCℓ СН3Cℓ СНCℓ2- СНCℓ2 СНCℓ= СНCℓ 9.На основе какого галогенпроизводного получают политетрафторэтилен? СF2= СF2 СН3F СН2 = СНF СНF= СНF 10.Укажите формулу хлорпрена, из которого получают каучук: СН2 = С(Cℓ)- СН= СН2 СН2 = С(СН3)- СН= СН2 СН2 = С(Cℓ) –СН3 СН2 = С(СН3)- СН3 Глоссарий
Литература: Основная 1. Артеменко А.И. Органическая химия. – М.: «Высшая школа», 2003. – 605 с. Дополнительная 3. Артеменко А.И. Органическая химия. – М.: «Высшая школа», 1987. – 430 с.
Лекция № 19 «Кислородержащие производные: одно- и многоатомные спирты» Краткое содержание лекции От числа гидроксильных групп спирты бывают одно- и многоатомные, в зависимости от характера радикала, связанного с гидроксильной группой спирты бывают предельными и непредельными:
СН3 - СН2 – ОН СН2 - СН2 этанол (предельный) ОН ОН одноатомный этандиол (предельный) двухатомный
СН2 = СН- СН2ОН аллиловый спирт (предельный) одноатомный
По систематической номенклатуре название одноатомных спиртов происходит от алкана с добавлением суффикса – ол; двухатомных спиртов-с добавлением суффикса – диол. Спирты получают гидратацией алкенов, которая имеет важное промышленное значение, существуют и другие способы. Химические свойства спиртов определяются реакционноспособной гидроксильной группой – ОН, входящей в состав молекулы. Характерны следующие реакции: замещение водорода, реакция этерификации, дегидратация, окисление и реакция получения полимеров из двух-, трехатомных спиртов. Спирты применяются в различных областях промышленности.
Сабактың қысқаша мазмұны Спирттер бір және көп атомды болады Гидроксил тобымен байланысқан радикалдың табиғатына байланысты спирттер қаныққан және қанықпаған болады
СН3 - СН2 – ОН СН2 - СН2 этанол (қаныққан) ОН ОН бір атомды этандиол (қаныққан екі атомды)
СН2 = СН- СН2ОН аллил спирті (қанықпаған бір атомды) Систематикалық номенклатура бойынша бір атомды спиртті атау үшін алқанға ол жалғауын екі атомды спирттерге-диол жалғауын жалғайды. Спирттердің химиялық қасиеттері молекула құрамында гидросил тобының –ОН реакцияға түскіштігімен анықталады. Сутектің орын басу, этерификация (эфирлену реакциясы), дегидратация, тотығу және екі-, үш атомды спирттерден полимерлер алу реакциялары спирттерге тән реакциялар. Спирттер өнеркәсіптің көптеген салаларында қолданылады.
Задание на СРС
2. Строение, свойства. 3. Химические свойства многоатомных спиртов. 0 1 с.152,163, 0 1 с. 158-160; 162.
Сроки выполнения - 9 неделя. Вид заданий – контрольная работа.
Задание на СРСП 1. Закончите уравнения химических реакций: а) СН3 OH+Na ОН б) СНз CL + КОН в) С2Н5 ОН+С3Н7+ ОН 2.Предложите пути синтеза полиэфира из многоатомных спиртов. 3.Какие вещества образуются при окислении следующих спиртов: а) пропонола-2 б) 2 метил-бутанола-2 в) этанола 4.Приведите основные области применения спиртов. 0[1] с.150-151; 152; 164; 166. Д[3] с.102-106.
Контрольные вопросы А) Для письменного тестирования
Б) Для компьютерного тестирования 1. Назовите спирты следующего строения CH 3 – СН (ОН) – СН 2 – СН 3? а) бутанол - 2 б) бутанол - 3 в) пентанол - 2 г) гексанол – 3 2.
Укажите реакцию получения этанола: а) СH3-СH2 -СН= СН+ Н2 б) CH3-CH3 +CL2 в) СH2 =СН +H2O г) СH3 CL+НCL 3. Какой алкен образуется при дегидратации изопропилового спирта? а) этилен б) пропилен в) бутен г) пентан 4. Укажите полимер на основе этиленгликоля и дикарбоновой кислоты: а) полиэфир б) полиамид в) полиакрилат г) поликарбонат
а) бутандиол -1,2 б) бутандиол -2,3 в) пропандиол – 1,2 г) этандиол
а) СН2 = СН-СН2 – СН3 + Н2 О б) СН3 = СН2-СН2 – СН2 CL +NaОH в) CН3 –СН = СН2 +НCL г) CН2 = СН2 +Н2 О 7. Какой продукт образуется при окислении спирта пропанола - 2? а) ацетон б) бензол в) пропан г) уксусная кислота 8. Какая реакция соответствует получению глифталевого полимера? а) поликонденсация б) полимеризация в) окисление г) замещение 9. Назовите спирт: СН2 =СН- СН2 –СН2ОН а) бутанол-1 б) бутен – 1 –ол -4 в) бутандиол г) бутан 10. Укажите реакцию получения глицерина: а) омыление жиров б) окисление альдегидов в) замещение
Глоссарий
Литература Основная 1. Артеменко А.И. Органическая химии. – М.: «Высшая школа», 2003. – 605 с. Дополнительная 3. Артеменко А.И. Органическая химии. – М.: «Высшая школа», 1987– 403 с.
Лекция №20 Карбоновые кислоты Краткое содержание лекции Карбоновыми кислотами называют производные углеводородов, которые содержат в молекуле одну или несколько карбоксильных групп-СООН. Общая формула R-COOH. В зависимости от природы радикала, связанного с карбоксильной группой, карбоновые кислоты бывают предельные и непредельные. Число карбоксильных групп определяют основность кислот. По количеству углеродных атомов в радикале различают низшие (низкомолекулярные) и высшие (высокомолекулярные). Одноосновные насыщенные кислоты имеют общую форму: СnН2n+1 СООН. Номенклатура. Карбоновые кислоты чаще всего называют согласно тривиальной номенклатуре, которых они были выделены впервые. По систематической номенклатуре название карбоновых кислот производят от названий соответсвующих предельных углеводородов с добавлением окончание-овая и слово «кислота». Нумерация главной цепи начинается с углерода, входящего в состав карбоксильной группы. Изомерия. Первые три представителя гомологического ряда предельных одноосновных карбоновых кислот (муравьиная,уксусная, пропионовая) изомеров не имеют. Изомеры в этом ряду появляются у масляной кислоты, где в молекуле имеется четыре углеродных атома: СН3 – СН2 – СН2 – СООН –масляная или бутановая кислота
Сабактың қысқаша мазмұны Құрамында бір немесе бірнеше карбоксил тобы – СООН бар көмірсутектердің туындысы карбон қышқылдары деп аталады. Жалпы формуласы: R – СООН Карбоксил тобымен байланысқан радикалдың табиғатына қарай қаныққан және қанықпаған болады. Карбоксил тобының саны қышқылдың негізділігін көрсетеді, 1 – карбоксил тобы болса – бір негізді, 2 – карбоксил болса 2 – негізді т.б. Радикалдағы көміртек атомының санына байланысты төменгі және жоғары молекулалы қышқылдар болып бөлінеді. Бір негізді қаныққан карбон қышқылдарының жалпы формуласы: СnН2n+1 СООН Номенклатура. Карбон қышқылдары көбіне тривиалды номенклатура бойынша шығу табиғатына қарап аталады. Систематикалық номенклатура бойынша сәйкес келетін қаныққан СН-ге “қышқыл” деген сөзді қосып атайды, нумерация – СООН жақын жағынан басталады, рационалды номенклатура бойынша сірке қышқылының туындысы деп қарайды. Н – СООН – құмырсқа қышқылы, метан қышқылы; СН3 – СООН – сірке қышқылы, этан қышқылы; СН3 – СН2 – СООН – пропион, пропан қышқылы; Изомерия. Көміртегінің 4 атомы бар қышқылдың екі изомері, 5 – атомында – 4 т.т. солай тізбек өскен сайын өсе береді.
CH3 3 2 1 б) CH3 – CH – COOH – изомай қышқылы, диметил сірке қышқылы, систематикалық номенклатура бойынша 2 – метилпропан қышқылы.
Задание на СРС
О [1] с. 199-208 Сроки выполнения – девятая неделя. Виды заданий – реферат, контрольные задания
Задание на СРСП
O R – C + PCl5 OH 5. R–COOH+SOCl2
О [1] с. 199-204 с. 198-205, 208 Д [2] с. 136-138, 144, 145,104, 126, 134
Контрольные вопросы А) Для письменного контроля
Б) Для компьютерного тестирования
а) карбоксил б) карбонил в) гидроксил г) нитро
а) НООС - СООН б) СН3- СООН в) СН2= СН - СООН г) НООС – СН2- СООН
а) одноосновной ненасыщенной б) одноосновной насыщенной в) двухосновной г) одноосновной
а) НООС – (СН)2- СООН б) СН3СООН в) СН3– (СН2)2- СООН г) НООС - СООН
а) мыло б) кислота в) основание г) альдегид
а) числом карбоксильных групп б) числом карбонильных групп в) числом гидроксильных групп г) числом нитрогрупп
а) СН3= СН - СООН б) СН3– СН2- СООН в) НООС – СН = СН - СООН г) СН3 - СООН д) НСООН
а) НООС – (СН2)4- СООН б) СН3– (СН2)4- СООН в) НООС – СН2– СООН г) СН3СООН
а) спиртом б) альдегидом в) кетоном г) водой
а) больше 10 б) меньше 10 в) 10 г) 5
Глоссарий
Литература Основная: 1.Артеменко А.И. Органическая химия. – М.: «Высшая школа», 2003. – 605с. Дополнительная: 3. Артеменко А.И. Органическая химия. – М.: «Высшая школа», 1987. – 430с.
Лекция №21 Двухосновные карбоновые кислоты Краткое содержание лекции Двухосновные или дикарбоновые кислоты содержат в молекуле две карбоксильные группы: НООС – R– СООН. В зависимости от характера радикала Rдвухосновные кислоты могут быть предельными и непредельными. По систематической номенклатуре названия двухосновных кислот составляются из названий соответствующих углеводородов и окончания – диовая или слов «дикарбоновая кислота»:
Изомерия предельных двухосновных кислот зависит от строения углеродной цепи, с которой связаны два карбоксила, а непредельных - от положения двойной связи в этой цепи. Кроме этого, непредельные двухосновные кислоты, подобно одноосновным непередельным, могут существовать в виде двух геометрических (цис-транс) изомеров. Например, простейшая двухосновная непредельная кислота НООС – СН = CH-СООН (этилен – 1,2 – дикарбоновая) существует в транс-форме (фумаровая кислота) и цис-форме (малеиновая кислота):
Н ─ C ─ СООН Н — С — СООН ║ ║ НООС ─ С ─ Н Н ─ С ─ СООН Фумаровая кислота малеиновая (транс-изомер) кислота (цис-изомер)
Сабақтың қысқаша мазмұны Екі негізді немесе дикарбон қышқылдары молекуласында екі карбоксил тобы НООС -R– СООН бар. РадикалдыңRтабиғатына қарай қаныққан және қанықпаған болып бөлінеді. Систематикалық номенклатура бойынша екі негізді карбон қышқылын атау үшін, сәйкес келетін көмірсутекке “дикарбон қышқылы” сөздері жалғанады.
Қаныққан екі негізді қышқылдардың изомериясы екі карбоксил тобымен байланысқан көміртек тізбегінің құрылысына, ал қанықпаған қышқылдарда тізбектегі қос байланыстың орнына байланысты. Сонымен қатар қанықпаған екі негізді карбон қышқылдары екі геометриялық (цис-транс -) изомерлері түрінде болады. Мысалы, екі негізді қанықпаған НООС – СН= СН – СООН этилен-1,2-дикарбон қышқылы, транс-(фумар қышқылы) және цис – (малеин қышқылы) түрлерінде болады:
Н ─ C ─ СООН Н — С — СООН ║ ║ НООС ─ С ─ Н Н ─ С ─ СООН фумар қышқылы малеин қышқылы (транс-изомер) (цис-изомер)
Задание на СРС
О [1] с. 219 – 221 - 224 Д [2] с. 149 – 155 Сроки выпонения – десятая неделя. Виды заданий – реферат, контрольные задания
Задание на СРСП
НООС – СН – СН – СООН → │ │ - Н2O ОН Н
О [1] с. 220, 212, 215 - 217 Д [3] с. 148 - 152, 154 Контрольные вопросы А) Для письменного контроля 1. Какие кислоты называются непредельными двухосновными кислотами? 2. Применяемые в строительстве полимеры получают на основе какой кислоты?
Б) Для компьютерного тестирования 1.Сколько изомеров имеет эта кислота СН3(СН2)3СООН? а) четыре б) три в) пять г) два
а) восстановление б) окисление в) замещение г) обмена
а) адипиновая б) малоновая в) фтальевая г) янтарьная
а) двухосновные б) ненасыщенные в) насыщенные г) высшее
а) С17Н35СООН б) С11Н23СООН в) С17Н33СООН г) С4Н9СООН
а) НСООН б) СН3СООН в) СН3 – СН2 - СООН г) СН2= СН - СООН
а) насыщенный, ненасыщенный б) одноосновная в) двухосновная г) многоосновная
а) фумаровая б) малеиновая в) малоновая г) щавелевая
а) метакриловой б) акриловой в) адипиновой г) бутеновой 9. Составу С4Н6О2соответствует сколько изомера карбоновой кислоты: а) три б) четыре в) два г) шесть
Глоссарий
Литература Основная:
Дополнительная:
Лекция № 22 «Ароматические углеводороды» Краткое содержание лекции Ароматические соединения имеют широкое практическое применение. Они используются в производстве полимеров, таких как фенолформальдегидных, глифталевых полиэфиров, эпоксидных и т. д. Они являются основой многих лакокрасочных материалов и клеев. Главным представителем ароматических соединений является бензол.
Рассматриваются
вопросы строения ароматических
соединений на примере молекулы бензола,
приведены схемы образования единой
Приведены способы получения ароматических углеводородов, основными природными источниками являются каменный уголь и нефть, гомологи бензола можно получить синтетическим путем.
Ароматические
соединения (арены) —
органические,
соединения с плоской циклической
структурой, в которой все углеродные
атомы создают
единую делокализованиую
К ароматическим соединениям относятся прежде всего бензол С6Н6 и его многочисленные гомологи и производные. Ароматические соединения могут содержать в молекуле одно или несколько бензольных ядер (многоядерные ароматические соединения).
Ароматические соединения с одним бензольным ядром Строение молекулы бензола Главным представителем ароматических углеводородов является бензол С6Н6. Он обнаружен М. Фарадеем в 1825 г. в светильном (коксовом) газе, а в 1833 г. получен Э. Митчерлихом сухой перегонкой бензойной кислоты с избытком извести. Строение молекулы бензола чаще всего выражают формулой, предложенной немецким химиком А. Кекуле (1865)
Этой формулой пользуются и сейчас, но вкладывают в нее новый смысл. Согласно Кекуле, бензол — замкнутая система с тремя сопряженными двойными связями — циклогексатриен-1,3,5. Но эта формула, соответствуя элементному составу молекулы бензола, не отвечает многим его свойствам. Например, согласно формуле Кекуле бензол формально является непредельной системой. В то же время он вступает преимущественно в реакции замещения, а не присоединения. Формула Кекуле также не в состоянии объяснить равенства расстояний между углеродными атомами, что имеет место в реальной молекуле бензола. Кроме того, она не может объяснить и высокой устойчивости бензольного кольца. Если исходить из классической формулы Кекуле, у бензола должно быть два орто- изомера:
Однако известен только один- орто- изомер. Чтобы выйти из этого затруднения. Кекуле был вынужден допустить возможность постоянного изменения положения двойных связей в молекуле, т.е. выдвинул теорию «осцилляции», согласно которой двойные связи не фиксированы на одном месте.
С
Все углеродные
атомы в молекуле бензола находятся и
состоянии sp2-
гибридизации.
Каждый из них связан тремя своими
гибридными орбиталями
с двумя такими же орбиталями двух
соседних углеродных атомов
и одной орбиталью атома водорода,
образуя три
Ароматичность — общий признак некоторых циклических органических соединений, обладающих совокупностью особых свойств.
Главной
особенностью таких соединений является
равномерное распределение
Эти особенности обусловливают все важнейшие физические и химические свойства ароматических соединений. Например, они вступают преимущественно в реакции замещения (в основном электрофильного), а не присоединения (несмотря на формальную ненасыщенность). Ароматические соединения обладают высокой устойчивостью, например к окислителям.
В
незамещенной молекуле бензола
На
основании большого экспериментального
материала выведены правила
ориентации, в
основу которых, положены теоретические
представления о перераспределении
Заместители, связанные с бензольным кольцом, по своему ориентирующему влиянию на вновь входящие заместители (атакующие реагенты) делят на две группы. Заместители (ориентанты) первого р о д а: -ОН, -OR, -OCOR, -SH,-SR, CH2R, -CR3, -NH2, -NHCOR, -NHR, (Hal)*. Эти заместители, обладают электронодонорными свойствами, смещают электронную плотность в сторону бензольного кольца. Активируя кольцо, они облегчают вхождение электрофильных реагентов, ориентируя их в орто- и пара- положения. Поэтому такие заместители называют орто- и пара- ориентантами. При действии нуклеофильных реагентов реакция замещения протекает с большим трудом ( при этом реагентов направляется в мета- положение.)
2. 1. Заместители (ориентанты)второго р о д а: - СN, - COOН, -SO3H, -СНО, -COR, -COOR, -NО2 -N+H3, ,ССl3. Они смещают электронную плотность от бензольного кольца, т.е. обладают электроноакцепторными свойствами. Эти заместители дезактивируют бензольное кольцо, затрудняя вхождение электрофильных реагентов. При этом вновь входящий заместитель будет ориентирован в мета- положение. Такие заместители называют мета-ориентантами. В то же время заместители второго рода облегчают реакции с нуклеофильны-ми реагентами, способствуя орто- и пара-ориентации. Таким образом, замещение атомов водорода вмолекуле бензола происходит с учетом природы заместителя, связанного с ядром (если заместителей несколько, то существенную роль играет их взаимное расположение), и характера, атакующего реагента. Химические свойства ароматических соединений: реакции электрофильного замещения, некоторые реакции присоединения и окисления. Следует обратить особое внимание на правило ориентации заместителей в бензольном ядре, так как при изучении химических свойств производных ароматических углеводородов возникает необходимость опираться на это правило. Закончите химические реакции, исходя из правила ориентации заместителей: 1 СН3 С // \
/ // НС СН \\ / СН
2. NO2 С // \
/ // НС СН \\ / СН
Сабактың қысқаша мазмұны Ароматты қосылыстар іс жүзінде кеңінен қолданылады. Полимерлер өндірісінде әсіресе фенолформальдегидті, гліфталь, эпоксидті поли эфирлерін алуда көп пайдаланылады. Олар көптеген лак-бояу және желімдегіш материалдардың негізі болып табылады. Ароматты қосылыстардың басты өкілі бензол. Ароматты қосылыстардың құрылысы бензол молекуласының мысалында қарастырылады. Бензол молекуласында біртұтас тұйық П-электрондық жүйесінің пайда болу схемасы, Э Хюккель ережесіне циклді көмірсутектердің “ароматтық” мағынасы ашылып көрсетіледі; бензол гомологтарының изомерия мен номенклатурасы беріледі. Ароматты көмірсутектерді алу жолдары келтіріледі; негізгі табиғи шикізаттар: таскөмір мен мұнайдан алу және бензол гомологтарын синтетикалық жолмен алу жолдары беріледі. Химиялық қасиеттері: электрофильдік орын басу реакциясы, кейбір қосып алу және тотығу реакциялары мысал ретінде көрсетіледі. Ароматты қосылыстар туындыларының химиялық қасиеттерін оқығанда, әсіресе бензол сақинасындағы орынбасарлардың бағытталу ережесіне баса назар аудару қажет. Орынбасарлардың бағыттау ережесіне сүйеніп химиялық реакцияларды аяқтаңыздар.
С // \
/ // НС СН \\ / СН
2. NO2 С // \
/ // НС СН \\ / СН Задание на СРС 1. Физические свойства ароматических углеводородов.
О[1] с. 379, 384 Д[3] с. 272, 273 Срки выполнения – 10 неделя. Вид заданий – контрольная работа. Задание на СРСП
а) C6H6+C2H5Cl б) C6H5 -CH3 +Cl2 в) C6H5-C2H5+ HNO3
а) бензола с серной кислотой; б) окисление толуола; в) получение стирола из этилбензола
а) толуола б) стирола в) изопропилбензола
Контрольные вопросы А) Для письменного контроля
Б) Для компьютерного тестирования
а) CnH2n- 6 б) CnH2n+ 2 в) CnH2 г) CnH2nOn – 2
а) пропан б) циклогексан в) метан г) бутанол
а) CH3-CH3+CL2 → CH3-CH2CL+HCL б) C6H5- CH3+CL2 → C6H5-CHCL+HCL в) C6H6+CL2 → C6H5CL+HCL г) С2H5OH+NaOH → C2 H5-ONa+H2O
а) метан б) ацетон в) бензойная кислота г) диоксан
а) C6H5 – NO2 б) CH3COOH в) C6H5 – SO3H г) C6H5 – CH= CH2
а) SP2– гибридизованном б) SP1– гибридизованном в) SP3– гибридизованном г) S-S– состоянии 7. Какое из приведенных соединений относится к гомологам бензола? а) C2H5OH б) CH3COOH в) C6H5- CH3 г) C3H7 CL
а) пропилен б) пропадиен в) ацетон г) стирол
а) полимеризация б) электрофильное замещение в) обмена г) деструкция 10. Какое ароматическое соединение применяется в качестве растворителей лаков, красок? а) этилацетат б) бензойная кислота в) хлороформ д) толуол Глоссарий
Литература Основная
Дополнительная 1.Егембердиева Г.А. Полимеры в деревообработке: Учебное пособие. – Алматы: КазГАСА, 2004. – 108 с. 9.Травень В.Ф. Органическая химия.–М.: ИКУ «Академкнига», 2004.–727 с.
Лекция № 23 «Функциональные производные ароматических угдеводородов» Краткое содержание лекции Рассмотрены основные производные ароматических углеводородов: галоген-, сульфо-, кислородсодержащие. Наибольший интерес представляют одно-, многоатомные фенолы, их строение и свойства. Фенолы применяются в качестве исходного сырья для получения фенолоальдегидных полимеров, которые широко применяются в производстве строительных материалов. Необходимо привести строение и свойства производных ароматических углеводородов, уметь написать реакции электрофильного замещения.
ГАЛОГЕНОПРОИЗВОДНЫЕ АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ В результате реакции галогенирования образуются ароматические галогенопроизводные — вещества, содержащие-в молекуле один или несколько атомов галогена, связанных непосредственно с ароматическим ядром или с углеродом боковой цепи
Различают моно-, ди-, три- и полигалогенопроизводные. Номенклатура и изомерия. По систематической номенклатуре названия ароматических галогенопроизводных образуют, добавляя название галогена к названию ароматического углеводорода. Если атомов галогена в ядре два и более, то их положение указывают цифрами. При этом сумма номеров должна быть наименьшей, а перечисление Галогенов идет в алфавитном порядке. Изомерия галогенопроизводных зависит от положения галогена в ядре Галогенопроизводные вступают в реакцию нуклеофильного и электорофильного замещения. Фенолы
Строение. Фенолы — органические соединения, содержащие в молекуле гидроксіілъную группу, которая непосредственно связана с бензольным ядром
В зависимости от числа гидроксильньгх групп в бензольном кольце различают одно-, двух- и трехатомные фенолы. Номенклатура и изомерия. Фенолы и их гомологи называют или
бензентриол-1,2,4
тривиальными названиями (например, фенол, крезол и т.д.), ш и по систематической номенклатуре, добавляя суффикс -ол к названию ароматического углеводорода За фенолом сохранилось и старое название—карболовая кислота («карболка»). Метильному гомологу фенола — крезолу соответствуют три изомера
Двухатомные фенолы (дигидрокеибензолы) также существуют в виде трех изомеров*:
Существуют три изомерных трехатомных фенола (тригидроксибензола):
пирогаллол гидроксигидрохинон флороглюцин (бензентриол-1,2,3) (бензентриол-1,2,4) (бензентриол-1,3,5)
Получение. Фенол (моногидроксибензол) и его метальные го- мологи (крезолы) в значительных количествах содержатся в камен- ноугольной смоле. Однако сам фенол чаще получают синтетически ми способами. Сабақтың қысқаша мазмұны Ароматты көмірсутектердің негізгі туындылары: галоген-, сульфо-, оттекті. Осылардың арасында кеңінен қолданыс тапқаны бір-, көп атомды фенолдар. Фенолдар құрылыс материалдар өндірісінде кеңінен қолданылатын фенолальдегидті полимерлерді алатын негізгі шикізат. Ароматты көмірсутектердің туындыларының құрылысы мен қасиеттерін, электрофильдік орынбасу реакцияларын жаза білу керек.
Задание наСРС 1. Заместители первого и второго рода, влияние их на электронную плотность бензольного ядра. 2. Отдельные представители производных ароматических углеводородов, их применение. 3. Алькильные и ацильные производные ароматических углеводородов. O[1].с. 394, 397, 399-403
Сроки выполнения – 11 неделя. Виды заданий – конспект. Задание на СРСП
С6Н5ОН
+ NaOH С6Н5SO3H
+ NaOH С6Н5ОН
+ CH3Cl Контрольные вопросы А) Для письменного контроля
Б) Для компьютерного тестирования 1. Какое из перечисленных соединений входит в состав красителей: а) антрацен б) метан в) этанол г) уксусная кислота 2. Какое уравнение реакции показывает получение ароматического соединения – фенола? а) C6H5CI+NaOH→C6H5OH+NaCl б) СН3Cl + NaOH → СН3ОН+ NaСl в) СН3CООН + NH3 → СН3СООNН4 г) СН4 + НОNO2 → СН3NО2 + Н2О 3. Какое органическое соединение входит в состав красителей? а) гидрохинон б) пентан в) изопрен г) ацетон 4. Какое соединение входит в состав красителей? а) антрацен б) ксилол в) изопрен г) дивинил 5. Назовите правильно ароматический углеводород: C6H5- SO3H: а) бензол сульфокислота б) метилбензол в) хлорбензол г) сульфид бензола 6. На основе какого производного бензола получают в промышленности красители? а) пропилбензол б) бромбензол в) винилбензол г) аминобензол (анилин) Глоссарий
Литература: Основная 1.Артеменко А.И. Органическая химия.–М.: «Высшая школа», 2003.- 605 с. Дополнительная 9. Травень В.Ф. Органическая химия – М.: ИКУ «Академкнига», 2000.-727 с.
Лекция № 24 «Высокомолекулярные соединения» Краткое содержание лекции Рассмотрены общие свойства молекулярных соединений, их строение, классификация, особенности, понятие о молекулярной массе полимеров. Основными источниками получения полимеров являются природные и синтетические материалы. Рассмотрены агрегатные и фазовые состояния полимеров. Высокомолекулярные соединения (ВМС) – это химические вещества, которые состоят из большого числа повторяющихся группировок (мономерных звеньев), соединенных между собой химическими связями.. Несмотря на многие сотни атомов, входящих в состав одной макромолекулы, ее химическое строение часто бывает не таким уж и сложным. Дело в том, что макромолекулы большинства высокомолекулярных соединений построены из одинаковых, многократно повторяющихся групп атомов – элементарных (мономерных) звеньев, связанных друг с другом. Например, молекулы полиэтилена и поливинилхлорида
… - СН2 - СН2 - СН2 - СН2 - … … - СН2 – СН - СН2 – СН - … | | Cl Cl полиэтилен поливинилхлорид
построены из элементарных звеньев – остатков мономеров
- СН2 - СН2 - и - СН2 - СН – | Cl
Для натурального каучука элементарным звеном служит остаток молекулы изопрена - СН2 – С = СН - СН2 - | CН3
Это позволяет использовать для изображения полимеров суммарные формулы, например:
[- CH2–CH2 -]nили [-C2 Н4] n[- СН2–СНСl -] nили [С2Н3Сl] n полиэтилен поливинилхлорид
- СН2– С = СН – СН2– | или [С5Н8] n СН3
полиизопрен
Высокомолекулярные соединения часто называют просто полимерами. Число элементарных звеньев в макромолекуле (n) является одной из главных характеристик полимера и называется степенью полимеризации(Р) полимера. Между этой величиной и молекулярной массой полимера имеется соотношение:P=M/m, гдеm– молекулярная масса элементарного звена. Следовательно, молекулярная масса полимера равнаM= Рm. Полимеры с высокой степенью полимеризации называютсявысокополимерами, а с небольшой - олигомерами. Согласно способам получения все органические полимеры делят на три группы: природные, или биополимеры (белки, нуклеиновые кислоты, целлюлоза, натуральный каучук и др.) синтетические (полиэтилен, поливинилхлорид, полистирол и др.) и искусственные,которые получают путем химической модификации природных полимеров (эфиры целлюлозы, хлорированный натуральный каучук и др.). По химическому составу основной макромолекулярной цепи ВМС делят на два больших класса: гомоцепные, цепи которых построены из одинаковых атомов, и гетероцепные, макромолекулярная цепь которых содержит атомы различных элементов. Среди гомоцепных полимеров наиболее распространены карбоцепные, их макромолекулярные цепи содержат только углеродные атомы.
Сабақтың қысқаша мазмұны Жоғары молекулалық қосылыстардың жалпы қасиеттері, құрылысы, жіктелуі (классификациясы), ерекшеліктері полимерлердің молекулалық массасы туралы ұғым қарастырылады. Полимерлерді алатын негізгі шикізат көздері: табиғи және синтетикалық материалдар. Полимерлердің агрегаттық және фазалық күйлері жөнінде мәліметтер беріледі.
Задание наСРС
О Сроки выполнения – 12 неделя. Вид заданий – конспект. Задание на СРСП
Контрольные вопросы А) Для письменного тестирования
Б) Для компьютерного тестирования: 1. Укажите полимер, на основе которого получают резину: а) каучук б) полистирол г) поливинлацетат д) полиакрилат 2. К какому классу органических соединений относится полиэтилен? а) полимерам б) красителям в) углеводам г) гетероциклическим 3. Какое из приведенных соединений относится к высокомолекулярным? а) [- СН2 – СН2-]n б) СН3СООН в) С6 Н5NН2 г) СН3Сl 4. Какова структурная формула изопрена, который составляет основу натурального каучука? а) СН2= С(СН3) – СH=СН2 б) СН3- СООН в) СН4 г) С2 Н3 5. Какое из приведенных соединений относится к высокомолекулярным? а) [-СН,2 -СН(CL)-]n б) С6Hl4 в) СН3 – О – СН3 г) С6 Н12О6
Глоссарий
Литература Основная 1. Артеменко А.И. Органическая химия.–М.: «Высшая школа», 2003.-605 с. Дополнительная 9.Травень В.Ф. Органическая химия. – М.: ИКУ «Академкнига», 2004.-727 с.
Лекция № 25
«Способы получения полимеров»
Краткое содержание лекции Существуют два основных способов получения полимеров: цепная полимеризация и поликонденсация. Реакция соединения нескольких молекул мономера, при которой не происходит выделения побочных низкомолекулярных продуктов, т.е. она не сопровождается изменением элементного состава мономера, называется полимеризацией. В полимеризацию вступают в основном непредельные мономеры, у которых двойная связь находится между углеродными атомами
nCH2 = CH – Cl → СН2 – СН – | Cl n винилхлорид поливинилхлорид
или между атомом углерода и другим атомом
О // nН – С → [СН2– О -]n \ Н формальдегид полиформальдегид В первом случае образуются карбоцепные полимеры, во втором – гетероцепные. Возможна полимеризация и предельных соединений циклического строения с гетероатомом в цикле. Полимеризация этих соединений происходит с размыканием цикла, в результате чего образуется гетероцепной линейный полимер.
nH2C–CH2 → [- СН2– СН2– О -]n \ / О оксид этилена полиэтиленоксид
Как и любая химическая реакция, полимеризация начинается с разрыва одних химических связей и возникновения других. Такой разрыв, как известно, может происходить или по гетеролитическому, или по гомолитическому механизму. В первом случае образуются ионы, а во втором – свободные радикалы. Полимеризация, протекающая через образование ионов, называется ионной полимеризацией, а идущая с участием свободных радикалов, -радикальной.Таким образом, радикальная и ионная полимеризации различаются природой а к т и в н о г о ц е н т р а , начинающего и ведущего макромолекулярную цепь.
Сабақтың қысқаша мазмұны Полимерлерді алудың негізгі екі тәсілі бар: тізбекті полимерлеу және поликонденсация. Тізбекті полимерлеу реакциясының механизмі, оның түрлері: радикалдық және иондық қарастырылды (мысал келтіру). Полимеризацияны жүргізу жолдары, полимерлеу тәсілімен алынған өндірістік полимерлер: полиэтилен, полистирол, поливинилхлорид, поливинилацетат, каучуктер, полиакрилаттар т.б. Задание наСРС 1. Способы проведения цепной полимеризации. 2. Отдельные представители полимеров, получаемых реакцией полимеризации и сополимеризации. О[1] с. 519-530 Сроки выполнения – 12 неделя. Виды заданий – конспект.
Задание на СРСП 1. Назовите вещества, используемые в качестве инициаторов, укажите их строение. 2. Напишите механизм радикальной полимеризации стирола, применение в производстве строительных материалов. 3. Приведите механизм реакции катионной полимеризации винилацетата, применение ПВА. Д[3] с. 309,369 Контрольные вопросы А) Для письменного контроля 1. Какие инициаторы применяются в радикальной полимеризации? Привести примеры. 2. Какие катализаторы используются в анионной и катионной полимеризации? Примеры. 3. Каково строение мономеров, вступающих в реакцию полимеризации? Примеры. Б) Для компьютерного тестирования 1. Какая реакция соответствует получению полимера поливинилхлорида (ПВХ): а) n С6Н5 –CH= СН2 → [ - С6Н5 –CH -СН2- ] n б) СН2 = СН2 + Н2О →СН3СН2ОН в) СН3Вr + NаОН →СН3ОН + NаВr г) СН4 + Сl →СН3С1+ НС1 2. Какой полимер применяется для изготовления деталей мебели: а) полиэтилен б) каучук в) крахмал г) полиэфир 3. Какое строение имеет полимер – полистирол: а) [ -СН2-СН(С6Н5)- ] n б) [ -СН2 - СН2- ] n в) СН3 = СН3 СН3 ОН 4. Какое уравнение реакции соответствует реакции полимеризации стирола? а) nC6H5-CH=СН2→[-CH2-CH-( C6H5)]n б) nCH2=CH2→[-CH2-CH2-]n в) С6Н6+ Cl2→ С6Н5Cl + НCl г) СН2 = СН – СН3 + Н2 →СН3 – СН3 – СН3 5. Какое уравнение реакции показывает радикальную полимеризацию винилхлорида? а)
n СН2
= СН (Сl) +R б) СН2 = СН2 + Н2 → СН3 – СН3 в)СН3 ОН + NаOН → СН3 ОNа г) СН2Сl - СН2Сl → СН3 –СН3 6. Какой продукт образуется при восстановлении D – глюкозы? а) D-сорбит б) глицерин в) этиленгликоль г) гексанол 7. Какое строение имеет полимер акриловой кислоты? а) [- СН2 –СН (СООН)-]n б) [- СН2 – СН (Сl) -]n в)С2 Н5 – О – С2Н5 г) [- СН2 – СН2 -]n 8. Какова структурная формула стирола, применяющего для получения полистирола? а) C6H5 – CH= CH2 б) C6H5 – NO2 в)CH3COOH г) C6H5 – SO3H 9. Какая реакция соответствует получению бензола? а) реакция Н.Д. Зелинского б) реакция Н.Н. Семенова в) реакция М.В. Коновалова г) реакция окисления Глоссарий
Литература: Основная 1.Артеменко А.И. Органическая химия. – М.: «Высшая школа», 2003.-605 с. Дополнительная 3.Артеменко А.И. Органическая химия.–М.: «Высшая школа», 1987.-430с.
Лекция №26 «Способ получения полимеров реакцией поликонденсации»
Краткое содержание лекции
Поликонденсация – процесс образования полимеров путем химического взаимодействия молекул мономеров, сопровождающийся выделением низкомолекулярных веществ (воды, хлорводорода, аммиака, спирта и др.). При поликонденсации происходит взаимодействие между функциональными группами, входящими в состав мономеров (-ОН, -СООН, -NH2, -СНО и др.). Мономеры, вступающие в реакцию поликонденсации, должны быть не менее чем бифункциональными. Приведем примеры некоторых реакций поликонденсации. При взаимодействии адипиновой кислоты с гексаметилендиамином на первой стадии образуется устойчивое соединение с функциональностью, равной исходному мономеру
ОН
+ Н НООС – (СН2)4– СОNH– (CH2)6–NH2→
→ HOOC – (CH2)4 – CO –NH – (CH2)6 – NH2 + H2O
В дальнейшем процесс наращивания полимерной цепи может идти различными путями: либо взаимодействием образовавшегося димера с одним или двумя различными мономерами, либо реакцией между отдельными фрагментами будущего полимера:
НООС – (СН2)4– СОNH- (CH2)6–NH2→
→ HOOC–(CH2)4–CONH–(CH2)6–CONH-(CH2)4–CONH–(CH2)6–NH2 В результате реакции образуется полимер, из которого получают полиамидное волокно – нейлон. Как и всякий процесс образования полимеров, поликонденсация также состоит из трех элементарных актов:
OHОН | | + Н – С → Н
Затем эти группы вступают в реакцию поликонденсации между собой.
Особенностью стадии роста цепи при поликонденсации является независимость отдельных актов роста друг от друга. Поэтому процесс поликонденсации можно представить как сумму однотипных реакций, проходящих между молекулами мономера, димера, тримера и т.д.
Процесс поликонденсации может прекратиться по многим причинам: вследствие установившегося равновесного состояния, изменения структуры и нарушения эквивалентности функциональных групп, увеличения вязкости реакционной среды и связанного с этим уменьшение подвижности макромолекул. Продукты поликонденсации представляют собой сложную смесь. В ее состав могут входить фракции полимергомологов, низкомолекулярные соединения, некоторое количество не вступивших поликонденсацию мономеров и даже побочные продукты. Процесс поликонденсации проводят в основном двумя способами: в расплавеили в растворе.В первом случае обходятся без растворителя (в токе инертного газа), нагревая мономеры или олигомеры до температуры на 10-20°C выше плавления образующегося полимера. Во втором – мономеры и полимер находятся в одной жидкой фазе в растворенном состоянии.
Сабақтың қысқаша мазмұны Поликонденсациялау реакциясының анықтамасы және мономердің құрылысының поликонденсациялануға қабілеттілігі түсіндіріледі. Поликонденсациялау түрлері: гомо-, гетерополиконденсация (мысал келтіру). Реакцияны жүргізу жолдары. Поликонденсациялау реакциясымен алынған негізгі полимерлер: полиэфирлер, полиамидтер, эпоксидті смолалар, фенолальдегидті, карбамидті және т.б. Осы полимерлердің қолданылуы. Задание на СРС 1.Строение мономеров, имеющих несколько функциональных групп. 2.Схему реакции поликонденсации фталевой кислоты и глицерина. Определить, какие структуры полимеров возможны в этой реакции. 3.Процесс сополиконденсации, примеры. 4.Применение поликонденсационных полимеров в деревообработке О[1] с. 531-534 Форма контроля – конспект. Срок – 13 неделя. Задание на СРСП
Контрольные вопросы
Глоссарий
Литература Основная
Дополнительная 9.Травень В.Ф. Органическая химия – М.: ИКУ «Академкнига», 2004.
Лекция №27 «Физико-химические и механические свойства полимеров»
Краткое содержание лекции Особенности физических свойств высокомолекулярных соединений. Природа гибкости молекулярных цепей. Межмолекулярные взаимодействия. Адгезия и когезия в полимерах. Понятие об агрегатном, фазовом и физическом состоянии полимера. Деформация полимеров. Термомеханические кривые аморфных полимеров. Характеристика высокоэластичного, стеклообразного и вязкотекучего состояния аморфного полимера. Области применения полимеров во многом определяются их физическими свойствами. Высокомолекулярные соединения, в отличие от низкомолекулярных, могут находиться только в двух агрегатных состояниях: в твердомижидком. Что же касается фазовых состояний, то полимеры бываютаморфными иликристаллическими. Аморфное строение имеют полимеры, макромолекулы которых расположены неупорядоченно, хаотично. Такое состояние характерно для макромолекул нерегулярного строения. Например, аморфными являются атактический полипропилен, многие каучуки. Аморфные полимеры – мягкие, эластичные материалы. Они могут существовать в трех физических состояниях – вязкотекучем, высокоэластическом и стеклообразном. Вязкотекучие полимеры, имеющие аморфное строение (например, низкомолекулярный полиизобутилен, фенолформальдегидные полимеры - резолы), необратимо изменяют свою форму под воздействием даже незначительных механических нагрузок. Высокоэластические полимеры (эластомеры), имеющие в ненапряженном состоянии аморфное строение (например, каучуки и резины), подвергаются обратимой деформации под воздействием небольших нагрузок. Такие полимеры не имеют вязкого течения ни в растянутом состоянии, ни после снятия напряжения. Высокоэластическими становятся многие твердые полимеры (полистирол, поливинилхлорид и др.) при нагревании. Высокоэластические полимеры занимают промежуточное положение между аморфными и кристаллическими полимерами. Дело в том, что эластические свойства полимеров обусловлены или очень слабыми межмолекулярными силами, или нерегулярностью структуры, что придает таким полимерам высокую степень аморфности. Однако при приложении напряжения и происходящей при этом деформации (удлинении) материала макромолекулярные цепи в аморфных областях выпрямляются и располагаются почти параллельно. Это приводит к состоянию с высокой степенью кристалличности, которое, однако, устойчиво лишь при приложенной внешней нагрузке (напряжении), так как межмолекулярные силы слишком слабы для того, чтобы в отсутствие этого напряжения сохранилось кристаллическое состояние. Стеклообразные полимеры – твердые высокомолекулярные соединения, не успевшие при охлаждении закристаллизоваться, но потерявшие текучесть. Они имеют аморфное или кристаллическое строение и мало изменяет свою форму даже при больших нагрузках. После устранения напряжения эти полимеры способны восстанавливать свою первоначальную форму. Полимеры, которые переходят из высокоэластического состояния в стеклообразное при температурах ниже комнатной, относят к эластомерам, а при более высоких температурах – кпластикам(например, поливилхлорид или фенопласты).
Сабақтың қысқаша мазмұны Жоғары молекулалық қосылыстардың физикалық қасиеттерінің ерекшеліктері, молекулалық тізбектің иілгіштігі. Молекулааралық әрекеттесу. Полимерлердегі адгезия мен когезия. Полимерлердің деформациясы. Аморфты полимерлердің термомеханикалық қисығы. Аморфты полимерлердің жоғарғыэластикалық, шынытәрізді және тұтқыраққыш күйдегі сипаттамасы. Задание наСРС
О[1] с. 512, 513 Сроки выполнения –13 неделя. Вид занятий – конспект.
Задание на СРСП
Контрольные вопросы < А) Для письменного контроля 1. Каков физический смысл процессов адгезии и когезии полимеров? 2.Какие виды межмолекулярных взаимодействий характерны для высокомолекулярных соединений? 3.В каких агрегатных и физических состояниях могут находиться полимеры? Б) Для компьютерного тестирования 1. Какой процесс улучшает физико-механические свойства полимеров: а) пластификация б) нагревание в) деформация г) деструкция 2. Какое физическое состояние характерно только для полимеров при нагревании? а) высокоэластическое б) газообразное в) кристаллическое г) жидкое 3. Какой процесс вызывает старение полимеров: а) деструкция б) измельчение в) набухание г) пластификация 4. В каких физических состояниях могут находиться полимеры при нагревании? а) вязкотекучем б) газообразном в) твердом г) аморфном. 5. Какой процесс предшествует растворению полимеров? а) набухание б) флокуляция в) гидротация г) окислени. 6. Каково влияние пластификатора при введении его в полимер? а) улучшает физико-механические свойства полимера б) не влияет в) ухудшает свойства полимера г) влияет незначительно 7. Какие факторы ускоряют процесс старения полимеров? а) нагревание и окисление б) измельчение в) набухание г) растворение 8. В каком физическом состоянии полимеры подвергаются необратимой деформации? а) твердом б) коллоидном в) газообразном г) аморфном 9. Какие вещества вводятся в полимеры для улучшения физико-механических свойств полимеров? а) пластификаторы б) катализаторы в) стабилизаторы г) ингибиторы Глоссарий
Литература Основная 1.Артеменко А.И. Органическая химия. – М.: «Высшая школа», 2003.-605 с. Дополнительная 9.Травень В.Ф. Органическая химия. – М.: ИКУ «Академкнига», 2004.-727 с. 1. Егембердиева Г.А. Полимеры в деревообработке. Учебное пособие. – Алматы: КазГАСА, 2004. – 108 с.
Лекция № 28 «Кремний органические соединения»
Краткое содержание лекции
. Среди элементоорганических соединений IV группы особое место занимают кремнийорганические соединения (КОС). В лекции рассматриваются классификация, строение, номенклатура, свойства КОС, применение в строительстве и других отраслях хозяйства – в машиностроении, стройтельстве, сельском хозяйстве, медицине. Кремнийорганические соединения используют в качестве гидрофобных веществ, гидравлических жидкостей, высокотемпературных смазок, теплоносителей, герметиков, диэлектриков и эластомеров. Все кремнийорганические соединения делят на две большие группы: низкомолекулярные и высокомолекулярные. В основу классификации этих соеденений положены кремнийводороды, или силаны, общая формула которых SinH2n+2. Все остальные классы кремнийорганических соедений можно рассматривать как производные силанов. Например, к низкомолекулярным кремнийорганическим соединениям относят: алкилсиланы RnSiH4-n, алкоксисиланы Si(OR)4, алкокси(арилокси)галогенсиланы (RO)nSiH4-n,n4-n 2-n алкил(арил)галогенсиланы RnSiX4-n, алкил(арил)галогенсидридсиланы RnHSiX3-n, алкил(арил)гидроксисиланы RnSi(OH)4-n, силазаны RnSi(NH2) 4-n, алкилсиланоляты RSi(OH2)OMeи др. Высокомолекулярные кремнийорганические соединения в зависимости от характера связей в макроцепи делят на: полиорганосиланы –Si–Si–, полиорганокарбосиланы –Si–C–Si–, полиорганосилоксаны –Si–O–Si–, полиорганокарбосилоксаны –Si–C–Si–O–, полиметаллорганосилоксаны –Si–O–Me–O–Si– 2СH3Cl+Si(CH3)2SiCl2 диметилдихлорсилан
Полимерные кремнийорганические соедения (полиорганосилоксаны) получают поликонденсацией диалкил (диарил) силандилов, которые образуются, в свою очередь, гидролизм, алкил (арил) хлорсиланов или алкил (арил) гидроксисиланов:
сислан R R R | | |
| | | RRn-2R
Строение полиорганосилоксанов зависит от функциональности исходных кремнийорганических мономеров. При гидролизе диалкил (диарил) дихлорсиланов образуются линейные полимеры, а при гидролизе алкил (арил) тихлорсиланов – разветвленные ил пространственные полимеры. Органгосиланы проявляют большую химическую активность, чем алканы. Особенно реакционноспособные те кремнийорганические соединения, в молекулах которых атом кремния связаны с водородогалогеном (кроме фтора), амино- или гидроксильной группой.
Сабақтың қысқаша мазмұны IV топтың элементорганикалық қосылыстарының ішінде ең маңыздысы кремний органикалық қосылыстар (КОҚ). КОҚ класификациясы, құрылысы, номенклатурасы, қасиеттері қарастырылады. Олардың құрылыста және шаруашылықтың басқада салаларында қолданылуы беріледі.
Задание на СРС 1. Химия кремнийорганических соединений. 2. Синтез кремнийорганических соединений. 3. Применение кремнийорганических соединений. О[2]с. 26-40; О[1] с. 277,278. Сроки выполнения – 13 неделя. Вид заданий – конспект.
Задание на СРСП 1. Номенклатура КОС. Примеры. 2. Получение кремний органических полимеров. 3. Гидрофобизаторы на основе кремнийорганических соединений.
Контрольные вопросы А) Для письменного контроля 1. Какие соединения кремния называются силанами? 2.По какому характеру макроцепи высокомолекулярные кремнийорганические соединения делятся? 3. В каких случаях образуются линейные полимеры? 4. Гидрофобизация строительных материалов. 5.Применение кремнийорганических соединений в производстве стройматериалов. 6.С чем связано гидрофобизирующее действие кремнийорганических соединений? 7. Что представляют собой кремнийорганические жидкости? Б) Для компьютерного тестирования
а) СН2SiН3 б) СН3 SiCL3 в) С2Н5 SiН3 г) С2Н5 SiCL3 2.Укажите кремнийорганические жидкости, которые применяются для строительных материалов как гидрофобизирующие препараты а) ГЖК-10, ГЖК-11 б) БПК-20 в) Б-123 г) БФ-21 3.Укажите область применения алкилсиланолята натрия. а) гидрофобизация строительных материалов б) гидротехника в) вулканизация полимерных материалов г) гидрофобизация полимерных материалов 4.Укажите молекулярную массу кремнийорганических жидкостей: а) от 500 до 25.000 б) от 50 до 500 в) выше 25.000 г) ниже 500 5.Где применяется кремнийорганическая резина? а) авиационная промышленность б) пищевая промышленность в) текстильная промышленность г) деревообрабатывающая промышленность
Глоссарий
Литература: Основная 1. Артеменко А.И. Органическая химия. – М.: «Высшая школа», 2003.-605 с
|
|




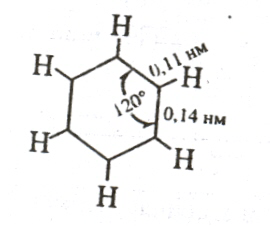 огласносовременном
представлениям молекула бензола имеет
строение
плоского шестиугольника, стороны
которого равны между собой
и составляют 0,14 нм. Это расстояние
является средним значением между
величинами 0,154 нм (длина одинарной
связи) и 0,134 нм (длина
двойной связи). Не только углеродные
атомы, но и связанные с ними шесть
атомов водорода лежат в одной плоскости.
Углы, образованные
связями Н-С -С и С-С-С, равны 120° :
огласносовременном
представлениям молекула бензола имеет
строение
плоского шестиугольника, стороны
которого равны между собой
и составляют 0,14 нм. Это расстояние
является средним значением между
величинами 0,154 нм (длина одинарной
связи) и 0,134 нм (длина
двойной связи). Не только углеродные
атомы, но и связанные с ними шесть
атомов водорода лежат в одной плоскости.
Углы, образованные
связями Н-С -С и С-С-С, равны 120° :







 -H2O
-H2O


 О
О






 //
СН2ОН
//
СН2ОН





 \
\

 R2SiCl
R2SiCl R2Si(OH)2
R2Si(OH)2 R2Si(OR’)2
диалкилдигидрок-
R2Si(OR’)2
диалкилдигидрок- nR2Si(OH)2
HO–Si–O– –Si–O– –––Si–OH
nR2Si(OH)2
HO–Si–O– –Si–O– –––Si–OH