
- •Передмова
- •Робоча програма
- •Приклади виконання завдань
- •Контрольні завдання
- •Основні класи неорганічних сполук основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Ентропія, енергія гіббса та напрямленість процесів основні поняття та визначення
- •Приклади виконання завдань
- •Визначити можливість перебігу реакції
- •Визначити, за якої температури настане рівновага в системі
- •Контрольні завдання
- •Хімічна кінетика основні поняття та визначення
- •Приклади виконання завдань
- •Визначити швидкість реакції ,
- •Контрольні завдання
- •Хімічна рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •241-260.Як треба змінити а) температуру, б) тиск, в) концентрації реагуючих речовин в системі для зміщення рівноваги в напрямку прямої реакції?
- •II модуль розчини. Концентрації розчинів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електролітична дисоціація ступінь та константа дисоціації основні поняття та визначення
Приклади виконання завдань
Приклад 1. Визначення маси одного з елементів складної речовини за відомою формулою сполуки.
Визначити
масу Al, яку можна отримати з 1 кг каоліну
![]() .
Яка доля від загальної маси припадає
на вміст алюмінію?
.
Яка доля від загальної маси припадає
на вміст алюмінію?
Розв’язання.
З формули каоліну
видно, що до складу 1 моль
![]() входять 2 моль атомів
Al. Оскільки
кількість речовини
входять 2 моль атомів
Al. Оскільки
кількість речовини
![]() і маса
і маса![]() пов’язані формулою
пов’язані формулою![]() ,
деМ –
молярна маса речовини, то знаходимо:
,
деМ –
молярна маса речовини, то знаходимо:
![]() (г/моль);
(г/моль);
![]() ·
г/моль·1 моль=258 г;
·
г/моль·1 моль=258 г;
![]() г/моль;
г/моль;
![]()
Для визначення маси Al, яку можна отримати з 1 кг каоліну, складаємо пропорцію:
258
г
![]() містять 54 г Al
містять 54 г Al
1000 г -“- -“- х г Al
Отже
![]()
Для визначення долі Al в каоліні складаємо пропорцію за формулою каоліну:
маса
моль
![]() 258 г становить 100%
258 г становить 100%
маса Al в моль каоліну 54 г становить y %.
Звідси
![]() .
.
Приклад 2. Визначення маси та об’єму реагуючих речовин і продуктів реакції за рівнянням реакції.
Ефективним методом видалення з води кисню є обробка її гідразином N2H4. Реакція відбувається за рівнянням:
![]() .
.
Скільки грамів N2H4 треба взяти, щоб утворилося 50 г Н2О? Який об’єм (н.у.) азоту при цьому виділиться?
Розв’язання. Як видно з рівняння реакції з 1 моль N2H4 утворюється 1 моль N2 і 2 моль Н2О.
Кількість
речовини
![]() і масаm
пов’язані між собою формулою:
і масаm
пов’язані між собою формулою:
![]() ,
,
де
М -
молярна маса речовини,
![]() .
.
Далі знаходимо:
![]() ;
;
![]() ;
;
![]() ;
;
![]() .
.
Для визначення маси N2H4, потрібної для утворення 50 г води, складаємо пропорцію за рівнянням реакції:
32 г N2H4 утворюють 36 г Н2О
х г N2H4 -“- 50 г Н2О
Звідси
![]() N2H4.
N2H4.
Для визначення об’єму азоту, який утворюється разом з 50 г Н2О виходимо з молярного об’єму газу за нормальних умов (н.у.):
![]() ;
;
![]()
Далі складаємо пропорцію за рівнянням реакції:
22,4л N2 утворюються разом з 36 г Н2О
y л N2 -“- 50 г Н2О
Отже
y =
![]() .
.
Приклад 3. Розрахунки за рівнянням Менделєєва-Клапейрона.
Визначити об’єм , який займає водень масою 0.357 г при температурі 270С та тиску 1,5·105 Па?
Розв’язання. Об’єм водню можна визначити користуючись рівнянням Менделєєва-Клапейрона:
![]() ,
,
де:
Р – тиск, Па; V – об’єм газу, м3;
m – маса газу, г; Т – температура, К; R –
універсальна газова стала,
![]() ;
М – молярна маса газу, г/ моль.
;
М – молярна маса газу, г/ моль.
![]() =2
г/моль, Т=27+273=300К.
=2
г/моль, Т=27+273=300К.
Об’єм газу дорівнює:
![]()
Приклад 4. Обчислити молярну масу газу, якщо за нормальних умов маса 0,112 л цього газу дорівнює 0.22 г.
Розв’язання. Нормальні умови: 00С, або 273К; тиск 1,013·105 Па.
Молярну масу газу можна визначити, користуючись рівнянням Менделєєва-Клапейрона:
![]() ,
,
де Р – тиск, Па; V – об’єм газу, м3;
m – маса газу, г;
Т – температура, К;
R
– універсальна газова стала,
![]() ;
;
М – молярна маса газу, г/ моль. Т=273К.
Молярна маса газу дорівнює:
![]()
Приклад 5. Визначення молярної маси еквівалента реагуючої речовини.
Визначити молярну масу еквівалента Феруму, якщо при взаємодії 5,6 г заліза з сіркою утворюється 8,8 г ферум сульфіду. Молярна маса еквівалента Сульфуру дорівнює 16 г/моль.
Розв’язання. З умов задачі виходить, що з 8,8 г ферум сульфіду 5,6 г - маса Феруму, а 8,8 г – 5,6 г = 3,2 г – маса Сульфуру.
На
основі закону еквівалентів маси реагуючих
речовин пропорційні молярним масам
їхніх еквівалентів, тобто
![]()
Звідси
![]() .
.
Відповідь. Молярна маса еквівалента Феруму дорівнює 28 г/моль.
Приклад 6. Визначення маси реагуючої речовини.
Визначити масу натрій гідрогенсульфату , що утворюється при нейтралізації сульфатною кислотою розчину, який містить 8 г NaOH.
Розв’язання. Знаходимо молярну масу еквівалента натрій гідроксиду:
![]() .
.
Знаходимо молярну масу еквівалента утвореної солі:
![]()
Згідно
закону еквівалентів
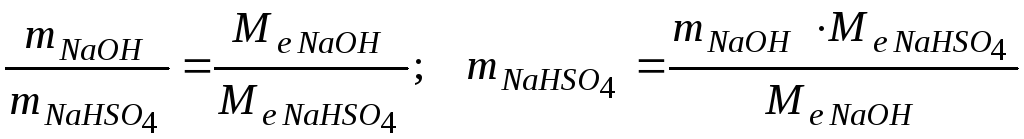
![]() .
.
Відповідь. Маса натрій гідрогенсульфату дорівнює 24 г.
Приклад 7. Визначення об’єму реагуючої речовини.
Визначити об’єм водню (н.у.), який виділяється при взаємодії 1,75 г металу з кислотою, якщо молярна маса еквівалента металу дорівнює 28 г/моль.
Розв’язання. Згідно із законом еквівалентів речовини реагують і утворюються в еквівалентних кількостях, тобто
![]() ,
,
де
![]() -
кількість молів еквівалентів металу
та водню відповідно.
-
кількість молів еквівалентів металу
та водню відповідно.
Оскільки кількість речовини v пов’язана з масою речовини m та об’ємом газу V співвідношеннями
![]() то закон еквівалентів для
даної реакції набуває вигляду
то закон еквівалентів для
даної реакції набуває вигляду

Звідси виражаємо об’єм Н2

Знаходимо молярний об’єм еквіваленту водню, враховуючи, що 1 моль Н2 містить 2 моль еквівалентів Н2 (ЕН = Н) і, як наслідок,
![]() .
.
Отже
![]() .
.
Відповідь. Об’єм водню, що виділяється, дорівнює 0,7 л.
