
Соотношение Майера
Сначала рассмотрим закон, описывающий этот процесс и его график в координатах (P,V).
Рис.
3

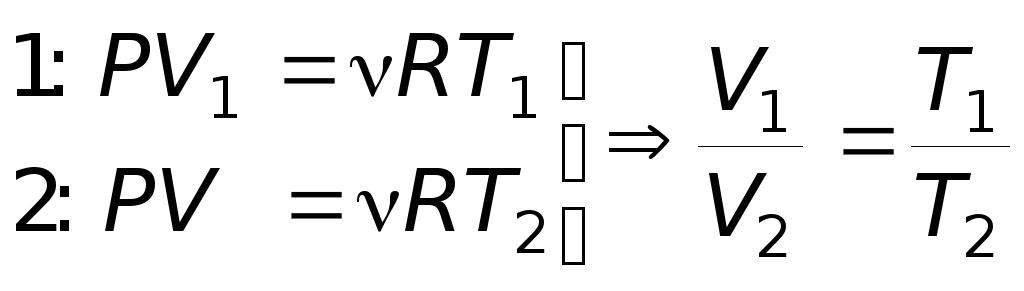 - закон Гей-Люссака.
- закон Гей-Люссака.
Теперь работа, совершаемая газом,
![]()
первое
начало термодинамики для изобарического
процесса.
![]() ,
и первое начало термодинамики не
меняет своего вида:
,
и первое начало термодинамики не
меняет своего вида:
![]()
Формула для подсчёта теплоты теперь примет вид
![]()
где
![]() -
молярная теплоёмкость газа при постоянном
давлении.
-
молярная теплоёмкость газа при постоянном
давлении.
Приращение внутренней энергии запишем в виде
![]()
Работу, совершаемую газом, также представим в аналогичном виде
![]() .
.
Здесь мы
воспользовались уравнением
Менделеева-Клапейрона
![]()
дифференциальное
уравнение которого при
![]() дает
дает
![]() .
.
Из выражения для работы следует размерность и физический смысл универсальной газовой постоянной R:
![]() ,
, ![]() .
.
Универсальная газовая постоянная R численно равно работе, совершённой одним молем газа при изобарическом процессе при увеличении его температуры на один градус.
Продолжим рассмотрение изобарического процесса. Подставляя полученные выражения для dQ, dU, dA в первое начало термодинамики, получим:
![]()
Сокращая на
dT,
получим соотношение между молярными
теплоёмкостями газа при постоянном
объёме
![]() и постоянном давлении
и постоянном давлении
![]() :
:
![]() - соотношение Майера.
- соотношение Майера.
Учитывая
выражение для
![]() ,
получим аналогичное выражение для
,
получим аналогичное выражение для
![]()
![]() =
=![]() .
.
Приведем
также выражение для отношения молярных
теплоёмкостей
![]() и
и
![]()
![]() .
.
Для двухатомных
молекул при невысоких температурах
i =
5, тогда
![]() 1,4.
1,4.
Выпишем работу, совершаемую газом при изобарическом процессе (P=const):

Рис.
4
работа, совершаемая
газом при изобарическом процессе.

![]() -
-
На графике (P,V) работа, совершаемая газом, численно равна площади прямоугольника, построенного под изобарой.
3. Термодинамика изотермического процесса: T=const.
Приведем закон, описывающий этот процесс, и его график в координатах (P,V).
Рис.
5
закон
Бойля-Мариотта

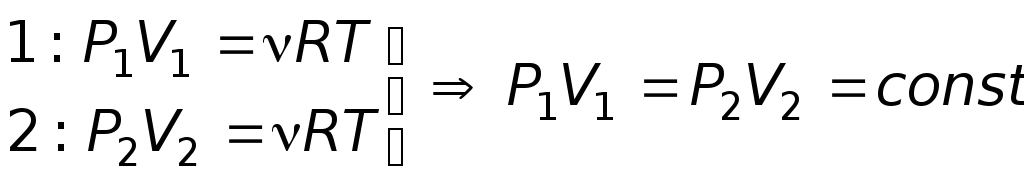 Так как T
=
const,
то
Так как T
=
const,
то
![]()
т. е. dU = 0 - изменение внутренней энергии газа при изотермическом процессе равно нулю.
Первое
начало термодинамики при изотермическом
процессе
dQ = dA -
При изотермическом процессе вся теплота, сообщенная газу, идет на работу, совершаемую газом: Q = A.
Выпишем работу, совершаемую
газом при изотермическом процессе.
Используя уравнение Менделеева-Клапейрона
![]() представим
элементарную работу в виде:
представим
элементарную работу в виде:
![]()
Тогда
 .
.
работа,
совершаемая газом при изотермическом
процессе
Рис.
6

![]()
Учитывая
то, что при изотермическом процессе
![]() работу можно вычислить
также по формуле:
работу можно вычислить
также по формуле:
![]() ;
;
На графике (P,V) работа, совершаемая газом, численно равна площади под кривой, описывающий изотермический процесс.
4. Термодинамика адиабатического процесса: dQ=0
Несмотря на то, что мы поочерёдно рассмотрели процессы с V=const, P=const, T=const, список характерных газовых процессов этим не исчерпывается. Обратим внимание, что при изохорическом процессе dA=0, при изотермическом процессе dU=0, и поэтому естественно рассмотреть процесс в котором dQ=0, т.е. адиабатический процесс.
Адиабатический процесс - это процесс, протекающий без теплообмена с окружающей средой.
Поскольку dQ = 0, то первое начало термодинамики примет вид:
первое
начало термодинамики при адиабатическом
процессе
![]() -
-
Такой вид первого начала термодинамики позволяет легко вычислить работу, совершаемую газом:
![]()
или для конечного адиабатического процесса:
![]() -
-
- работа, совершаемая газом при адиабатическом процессе.
Исходя из dU + dA = 0, выведем закон, которому удовлетворяют параметры газа при адиабатическом процессе. Для этого dU и dA представим в виде

Подставив это выражение в dU + dA = 0, получим дифференциальное уравнение:
![]()
которое, разделив на СV T и используя соотношения
![]()
![]()
![]() ,
,
можно записать в виде
![]() .
.
Это дифференциальное уравнение приводится к полному дифференциалу:
![]()
Решение этого дифференциального уравнения имеет вид
![]()
уравнение
адиабатического процесса в переменных(T,V)
![]()
![]() -
-
Воспользовавшись уравнением Менделеева-Клапейрона PV = RT, можно перейти к переменным (P,V) и (T,P).
Например,
из
![]() Подставляя это в
уравнение
Подставляя это в
уравнение
![]() ,
получим
,
получим
![]()

или
![]() -
уравнение Пуассона,
-
уравнение Пуассона,
где
![]() -коэффициент
Пуассона.
-коэффициент
Пуассона.
Рис.
7

![]()
![]()
 -
уравнения адиабаты.
-
уравнения адиабаты.
