
Лекция № 9,10
Углеводы. Углеводы – это вещества растительного происхождения, образуются в процессе фотосинтеза.
В природе:
а) фотосинтез (растения):
 хСО2
+ уН2О
+ h
Сх(Н2О)у
+ хО2
хСО2
+ уН2О
+ h
Сх(Н2О)у
+ хО2
(солнце)
б) метаболизм (животные и человек):
 Сх(Н2О)у
+ хО2
хСО2
+ уН2О
+ h
Сх(Н2О)у
+ хО2
хСО2
+ уН2О
+ h
Функции углеводов.
-
Питательная
-
Энергетическая (крахмал, гликоген)
-
Структурная (целлюлоза)
Моносахариды.
Классификация моносахаридов.
-
В

 зависимости от расположения карбонильной
группы в цепи моносахариды делят на
альдозы и кетозы.
зависимости от расположения карбонильной
группы в цепи моносахариды делят на
альдозы и кетозы.
альдозы кетозы
-
По числу атомов углерода в цепи различают триозы (С3), тетраозы (С4), пентозы (С5), гексозы (С6).
Альдопентозы:



рибоза 2-дезоксирибоза ксилоза
А льдогексозы: Кетогексозы:
льдогексозы: Кетогексозы:


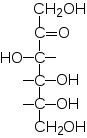
глюкоза манноза галактоза фруктоза
Физические свойства.
Твердые вещества, хорошо растворимые в Н2О и С2Н5ОН. Большинство сладкие на вкус.
Изомерия.
1.Структурная изомерия, обусловленная различным расположением карбонильной группы в цепи.

 С6Н12О6
С6Н12О6
глюкоза фруктоза
альдоза кетоза
2. Цикло-оксотаутомерия. Это подвижная равновесная изомерия, когда открытая (цепная-, оксо-) форма переходит в циклические самопроизвольно и наоборот.







-D-глюкофураноза -D-глюкопираноза






D-глюкоза
оксоформа
равновесие
-D-глюкофураноза -D-глюкопираноза
-
Стереоизомерия. Оптическая (зеркальная) изомерия.
У альдогексоз четыре центра хиральности (С*), поэтому много стереоизомеров. Число стереоизомеров можно вычислить по формуле: N = 2n, где N – число изомеров, n – число хиральных центров. N = 24 = 16. Итак у альдогексоз 16 стереоизомеров, которые отличаются расположением в пространстве заместителей хиральных центров.
 Глюкоза
Глюкоза
а)




D–глюкоза L–глюкоза
энантиомеры
Изомеры, которые относятся друг к другу как предмет и несовместимое с ним зеркальное изображение называются энантиомерами. Энантиомеры – это зеркальные изомеры, оптические антиподы. Еще их обозначают как D– и L– изомеры. Принадлежность углеводов к D-, L- ряду определяют по конфигурации последнего хирального центра, (у гексоз пятого атома С*, у пентоз четвертого С*), сравнивая с D-глицериновым альдегидом (конфигурационным стандартом).


D–глицериновый альдегид L–глицериновый альдегид
б) кроме энантиомера у D-глюкозы есть еще 14 стереомеров, они называются –диастереомеры. –Диастереомеры, которые отличаются конфигурацией у одного С* называются эпимеры.








глюкоза галактоза глюкоза манноза
эпимеры эпимеры
(–диастереомеры) (–диастереомеры)
в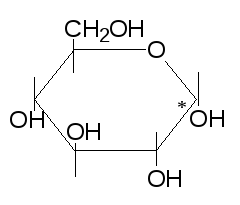
 )
В циклической форме у моносахаридов
появляется еще один хиральный центр –
атом углерода карбонильной группы –
аномерный центр и еще гидроксил –
полуацетальный (гликозидный). Изомеры,
которые отличаются расположением
полуацетального гидроксила называются
-,
-
аномеры.
)
В циклической форме у моносахаридов
появляется еще один хиральный центр –
атом углерода карбонильной группы –
аномерный центр и еще гидроксил –
полуацетальный (гликозидный). Изомеры,
которые отличаются расположением
полуацетального гидроксила называются
-,
-
аномеры.


–D–глюкоза –D–глюкоза
аномеры
(–диастереомеры)
Мутаротация.
Изменение угла вращения плоскости поляризованного луча свежеприготовленным раствором моносахарида до установления равновесия между всеми формами называется мутаротацией.
Химические свойства.
Моносахаридам характерны свойства многоатомных спиртов и альдегидов, т.к.они содержат карбонильную и гидроксильные группы.
-
О


 бразование
гликозидов.
бразование
гликозидов.
HCl сухой + Н2О, Н+

 +
С2Н5ОН
+
С2Н5ОН
–Н2О гидролиз
 О-гликозид
О-гликозид


 +
+
– Н2О

 О–гликозид
(дисахарид)
О–гликозид
(дисахарид)
 +
RNH2
+
RNH2
– H2O – агликон
N–гликозид
Неуглеводная часть гликозида называется агликон.
-
Образование простых эфиров.



+ 5СН3I +Н2О, Н+


– 5HI –СН3ОН
–D–глюкоза пентаметилглюкоза
Гликозиды легко гидролизуются в кислой среде.
-
О

 бразование
сложных эфиров.
бразование
сложных эфиров.

 + 5
+ 5
– 5 СН3СООН
уксусный ангидрид пентаацетилглюкоза
 Сложные
эфиры легко гидролизуются и в кислой и
в щелочной среде.
Сложные
эфиры легко гидролизуются и в кислой и
в щелочной среде.

![]()
 + 2
+ 2
–D–фруктоза 1,6–дифосфат фруктозы
Все процессы метаболизма у растений, животных и человека осуществляются при участии фосфатов.
-
Восстановление моносахаридов.


 + Н2
(Pd)
+ Н2
(Pd)
глюкоза сорбит заменители сахара для больных диабетом


+ Н2

ксилоза ксилит
-
Окисление моносахаридов.
а )
В щелочной среде (качественные реакции
на альдегидную группу).
)
В щелочной среде (качественные реакции
на альдегидную группу).
NaOH, to
 +
[Ag(NH3)2]OH
Ag
+ продукты
окисления глюкозы
+
[Ag(NH3)2]OH
Ag
+ продукты
окисления глюкозы
реактив Толленса
реакция серебряного зеркала

NaOH, to
 +
Cu2+
Cu2O
+ продукты окисления глюкозы
+
Cu2+
Cu2O
+ продукты окисления глюкозы
реактив Фелинга красно-коричневый
осадок
б) в нейтральной среде


глюконовая кислота
Br2 [O] (Са–соль–укрепляющее)
 +
+
в )
образование уроновых кислот
)
образование уроновых кислот


[O2] + H2O (H+)


гликозид α-D-глюкуроновая кислота
Галактуроновая кислота входит в состав пектиновых веществ плодов и ягод. Глюкуроновая кислота входит в состав гепарина. Уроновые кислоты служат для выведения с мочой токсичных веществ из организма.
г )
Окисление в кислой среде.
)
Окисление в кислой среде.

[O]HNO3 разб.

глюкоза глюкаровая кислота
-
Брожение.
 дрожжи
2С2Н5ОН
+ 2СО2
спиртовое
дрожжи
2С2Н5ОН
+ 2СО2
спиртовое
 молочнокислые бактерии 2СН3СНОН–СООН
молочнокислое
молочнокислые бактерии 2СН3СНОН–СООН
молочнокислое
С 6Н12О6
+ анаэробные бактерии СН3СН2СН2–СООН
+ 2СО2
+ 2Н2
маслянокислое
6Н12О6
+ анаэробные бактерии СН3СН2СН2–СООН
+ 2СО2
+ 2Н2
маслянокислое

![]() + 3/2 О2
грибы плесени
+ 3/2 О2
грибы плесени
![]() НООС–СН2–С–СН2–СООН
+ 2Н2О
лимоннокислое
НООС–СН2–С–СН2–СООН
+ 2Н2О
лимоннокислое
Производные моносахаридов.
Аминосахара.


2–глюкозамин (входит в состав хитина) 2–галактозамин (входит в состав хрящей)
Дезоксисахара.

–2–дезоксирибоза (входит в состав ДНК)
Роль моносахаридов.
Глюкоза. Встречается в соках, плодах, фруктах, входит в состав маннозы, лактозы, сахарозы, крахмала, гликогена, клечатки. Источник энергии для клеточных реакций. Входит в состав крови и тканей.
Фруктоза. В плодах и меде, в сахарозе.
Галактоза. Входит в состав лактозы молока.
Рибоза и д-рибоза. Входит в состав нуклеиновых кислот и нуклеотидов, витамина В2.
А скорбиновая
кислота.
скорбиновая
кислота.



восстановленная форма окисленная форма
Содержится в цитрусовых, шиповнике, черной смородины, овощах, молоке. Участвует в окислительно-восстановительных реакциях организма.
