
Khimia_002
.pdf
Виконаємо демонстраційний дослід, відомий під назвою «неви# диме чорнило», і пересвідчимося у водовідбірних властивостях концентрованої сульфатної кислоти. Для цього на ватмані напи# шемо розбавленою сульфатною кислотою Н2SO4 (роль пензля ви# конає скляна паличка) (рис. 26а) й почнемо знизу нагрівати напис на помірному вогні, тримаючи папір від прямого вогню на відста# ні, що унеможливлює його займання. Мине небагато часу, й напис стане видимим — літери набудуть чорно#сірого кольору (рис. 26б).
Пояснюється це тим, що в процесі нагрівання через випарову# вання води з розчину концентрація сульфатної кислоти збільшилася настільки, що речовина почала проявляти свої окисні властивості. Як вам відомо з 9 класу, целюлоза (з неї виготовлено ватман) — при# родний полімер, склад якого можна записати формулою (С6Н10О5)n. Концентрована сульфатна кислота окиснює целюлозу з утворенням вуглецю (його колір проявився в написі) та води, що випарувалася.
На водовідбірних властивостях концентрованої сульфатної кисло# ти ґрунтується демонстраційний дослід «ескімо на паличці». Для його проведення цукрову пудру С12Н22О11 змочують невеликою кількістю концентрованої сульфатної кислоти й ретельно перемішують. Уміст посудини темніє (обвуглюється), збільшується в об’ємі настільки, що виходить за межі посудини, зберігаючи її контури (рис. 26в, г).
а
б |
в |
г |
Рис. 26. Окиснення органічних речовин сульфатною кислотою
У реакціях з металами окиснювальні властивості концентрова# ної сульфатної кислоти проявляються в тому, що водень не виділя# ється, а утворюється сіль сульфатної кислоти, вода та один із про# дуктів відновлення Сульфуру (рис. 27).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
м |
|
|
|
|
|
|
|
один з продуктів |
|
||
|
е |
|
H2SO4 |
|
сіль |
|
|
|
|
|||
|
|
|
|
|
|
відновлення кислоти: |
|
|||||
|
т |
+ |
= |
+ |
вода |
+ |
|
|||||
|
(конц.) |
(сульфат) |
+4 |
0 |
–2 |
|
||||||
|
а |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
SO2, |
S, |
H2S |
|
|
|
л |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 27. Схема взаємодії концентрованої сульфатної кислоти з металами
71

Концентрована сульфатна кислота взаємодіє з міддю, продук# том відновлення є сульфур(ІV) оксид:
Сu + 2H2SO4 = СuSO4 + 2H2O + SO2
У такий спосіб добувають сірчистий газ у лабораторії.
Користуючись схемою, складіть рівняння реакції цинку з концен# трованою сульфатною кислотою, якщо продуктом відновлення є сірка.
Якісна реакція на сульфат/іони. Наявність сульфат#іонів у розчині виявляють за допомогою катіонів Барію.
За таблицею розчинності переконайтеся, що з#поміж наведених у ній сульфатів барій сульфат є нерозчинною у воді речовиною.
Цю властивість барій сульфату використовують для якісного виявлення сульфат#іонів у розчині.
Проведемо демонстраційний дослід. В одну пробірку наллємо розчин сульфатної кислоти, у другу — розчин натрій сульфату, у третю — розчин купрум(ІІ) сульфату. До однієї з них доллємо розчин барій нітрату, до другої — розчин барій гідроксиду, до тре# тьої — розчин барій хлориду (рис. 28). У кожній з трьох пробірок утворився однаковий білий дрібнокристалічний осад. З’ясуємо, чому різні речовини утворили однаковий осад. Усі реагенти роз# чинні у воді, тож дисоціювали на йони:
H2SO4 = 2H+ + SO24–
Na2SO4 = 2Na+ + SO24–
CuSO4 = Cu2+ + SO24–
Ba(NO3)2 = Ba2+ + 2NO–3
Ba(OH)2 = Ba2+ + 2OH–
BaCl2 = Ba2+ + 2Cl–
З рівнянь електролітичної дисоціації бачимо, що розчини в пробірках мали спільні аніони SO24–, долиті до кожного з них розчини містять катіони Ba2+. Як свідчить таблиця розчинності, ка# тіони Барію із сульфат#аніонами утворюють нерозчинну сіль барій сульфат BaSO4.
Напишіть молекулярні та повні йонні рівняння реакцій, прове# дених у цьому демонстраційному досліді (у другій і третій про# бірках).
72

1 2 3
Рис. 28. Якісна реакція на сульфат!іони
Якісною реакцією на сульфат/аніони є взаємодія їх з катіонами Барію (розчинними у воді сполуками Барію), у результаті чого утворюється нерозчинний у воді і кислотах білий дрібнокристалічний
осад барій сульфату.
Скорочене йонне рівняння якісної реакції таке: Ba2+ + SO24– = BaSO4
Закріпіть знання про якісну реакцію на сульфат#іони, виконав# ши завдання лабораторного досліду 5.
Найважливіші природні сульфати — гіпс СаSO4 · 2Н2О; глау/ берова сіль Na2SO4 · 10H2О; гірка сіль MgSO4 · 7H2О. Із наведених формул стає зрозуміло, що це кристалогідрати, тобто вони містять кристалізаційну воду, яка при нагріванні випаровується. На цій властивості кристалогідратів ґрунтується виробництво алебастру 2СаSO4 · Н2О з природного гіпсу, який нагрівають до 120–190 °С, унаслідок чого він втрачає частину води. При змочу# ванні водою кімнатної температури алебастр легко приєднує воду й знову перетворюється на гіпс. Це відбувається щоразу при накладанні гіпсових пов’язок на травмовані частини тіла, під час виготовлення гіпсових виробів художнього та будівельного при# значення. Глауберову сіль Na2SO4 · 10H2О застосовують у вироб# ництві скла, соди, фарб, у медицині. Гірку сіль MgSO4 · 7H2О ви# користовують в обробці тканин, дубінні шкіри, виготовленні медичних препаратів.
Закріпіть знання про природні сполуки Сульфуру, виконавши завдання лабораторного досліду 4.
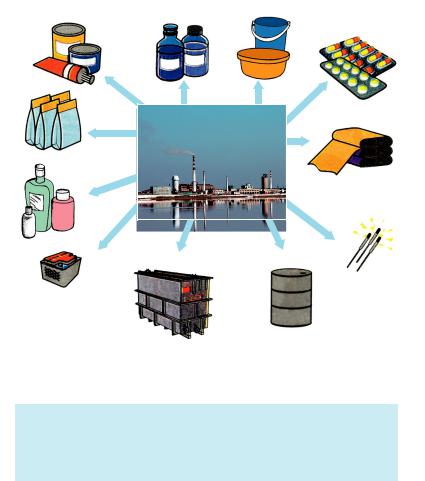
Застосування сульфатної кислоти. Розгляньте рисунок 29, який відображає застосування сульфатної кислоти й дає змогу зрозуміти, чому цю речовину називають «хлібом» хімічної промис# ловості.
73
|
|
|
Виробництво |
Пластмаси |
|
|
Барвники |
||||
|
|
кислот |
|
Лікарські |
|
|
|
|
|
||
|
|
|
H3PO |
|
препарати |
|
|
|
|||
|
|
|
|
|
|
Добрива |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2SO4 |
|
|
|
Свинцеві |
|
|
|
|
|
|
|
|
|
|
акумулятори |
|
|
|
|
|
|
У хромуванні |
Очистка нафти |
|||
|
металевих виробів |
|
Хімічні волокна |
||
|
|
|
|
|
(віскоза, шовк, |
|
|
|
|
|
поліамідні волокна) |
Миючі засоби |
|
|
|
|
|
|
|
|
|
|
Вибухові |
|
|
|
|
|
речовини |
Рис. 29. Схема застосування сульфатної кислоти
Найбільша кількість сульфатної кислоти використовується у виробництві мінеральних добрив, інших кислот, сульфатів, органічних речовин, очищенні нафтопродуктів тощо.
Охорона навколишнього середовища від забруднення вики/ дами сульфуровмісних речовин. Серед сульфуровмісних забруд# ників навколишнього середовища найбільш шкідливими є суль# фур(ІV) оксид і гідроген сульфід, або сірководень. Про шкідли# вість першої речовини ви дізналися в § 8.
Щодо гідроген сульфіду, то потрібно наголосити на високій токсичності цієї газуватої речовини з неприємним запахом тухлих яєць (утворюється при гнитті білка курячого яйця й спричинює його неприємний запах). Фізіологічна дія гідроген сульфіду про# являється в тому, що він блокує дихальний центр. Смертельною дозою для людини є вдихання протягом 5–10 хв повітря з об’єм# ною часткою гідроген сульфіду 0,08 %.
74

Забруднюють повітря сульфуровмісними речовинами вики# ди нафтопереробних заводів, теплові електростанції. Охорона навколишнього середовища полягає насамперед у зменшенні ви# кидів, а отже, у модернізації виробництва, запровадженні техно# логії замкненого циклу, коли гази, що є відходами названих ви# робництв, використовують як сировину для інших виробництв. Користь від цього подвійна — не забруднюється навколишнє се# редовище, а вироблена з гідроген сульфідних відходів нафтопе# реробної промисловості сульфатна кислота має найменшу вар# тість.
Удосконаленням технології виробництва сульфатної кислоти займався український хімік Іван Євграфович Ададуров (1879–1938).
Досліджуємо речовини та їх властивості
Лабораторний дослід 4. Ознайомлення із зразками
природних сполук Сульфуру.
Завдання. Ознайомтеся з виданими вам зразками сульфатів і сульфідів. Дослідіть агрегатний стан й такі їх фізичні властивості: колір, розчинність у воді. Викорис# товуючи міжпредметні зв’язки з географією, назвіть поклади природних сульфатів і сульфідів в Україні.
Одержані результати оформіть у робочому зошиті у вигляді таблиці.
Сполука |
|
Фізичні властивості |
|
||
|
|
Агрегат/ |
|
|
Поклади |
|
|
|
Розчин/ |
||
|
|
ний стан |
|
в Україні |
|
Назва |
Формула |
|
Колір |
ність |
|
|
|
|
|
у воді |
|
|
|
|
|
|
|
Лабораторний дослід 5. Експериментальне виявлен/
ня сульфат/іонів.
Завдання 1. Проведіть якісну реакцію на сульфат# іони. Налийте в пробірку 1–2 мл розчину сульфатної кислоти, долийте 1 мл розчину барій нітрату чи барій хлориду. Спостерігаючи за змінами, що сталися, дайте їм пояснення. Напишіть повне та скорочене йонні рівняння проведеної реакції.
Завдання 2. Запропонуйте спосіб розпізнавання води, сульфатної кислоти й розчину натрій сульфату в пробір# ках без етикеток. Перевірте висунуту гіпотезу експе# риментально. Запишіть рівняння проведених реакцій.
75

Для тих, хто вивчає хімію на академічному рівні

 Розрахункові задачі: обчислення маси (об’єму, кількості речовини) продукту реакції за масою (об’ємом, кількістю речовини) реагентів, один з яких узято в надлишку.
Розрахункові задачі: обчислення маси (об’єму, кількості речовини) продукту реакції за масою (об’ємом, кількістю речовини) реагентів, один з яких узято в надлишку.
Для проведення хімічної реакції можна взяти будь# яку масу чи об’єм реагентів, але це зовсім не означає, що вони без залишку перетворяться на продукти реакції. Кожна з них прореагує в кількості, на яку вказують кіль# кісні відношення речовин у реакції. Наприклад, взаємо# дію нітратної кислоти з магній оксидом відображає рів# няння реакції:
2HNO3 + 1MgO = 1Mg(NO3)2+ H2O
Коефіцієнти перед формулами реагентів свідчать про те, що речовини взаємодіють без залишку, якщо для про# ведення реакції нітратну кислоту й магній оксид брати у кількісному відношенні 2:1. Реагент, кількість речовини якого за умовою задачі менша, аніж у встановленому за рівнянням реакції кількісному відношенні 2:1, перебуває в недостачі й у реакції витратиться повністю. Другий реагент прореагує неповністю, і якась його порція зали# шиться. Про такий реагент кажуть, що його узято з над#
лишком.
Задача, в умові якої вказані маса, об’єм чи кількість речовини обох реагентів, потребує з’ясування
їх кількісного відношення. І якщо один з реагентів узято в надлишку, то задачу розв’язують, користуючись даними про речовину, що перебуває в недостачі.
Задача. Обчислити масу осаду, який утвориться з ба# рій хлориду масою 41,6 г і натрій сульфату масою 42,6 г.
Ро з в’ я з а н н я
1.Запишемо скорочений запис умови задачі.
Дано:
mBaCl2 = 41,6 г mNa2SO4 = 42,6 г
mосаду — ?
76

2. Напишемо рівняння реакції:
BaCl2 + Na2SO4 = BaSO4 + 2NaCl
1 моль 1 моль |
1 моль |
3. З’ясуємо за рівнянням реакції кількісні відношен# ня реагентів і нерозчинного продукту:
νBaCl2 : νNa2SO4 : νBaSO4 = 1 : 1 : 1
З’ясуємо кількісні відношення реагентів за умовою задачі. Для цього спочатку обчислимо кількість речови# ни кожного з реагентів за формулою ν = Мm :
41,6
νBaCl2 = 208 = 0,2 (моль)
42,6
νNa2SO4 = 142 = 0,3 (моль) νBaCl2 : νNa2SO4 = 0,2 : 0,3 = 2 : 3 = 1 : 1,5
Як бачимо, за умовою задачі з надлишком узято Na2SO4, а BaCl2 прореагує повністю. Тому обчислення маси утвореного осаду BaSO4 проводимо з використан# ням даних про BaCl2, а не про Na2SO4 — речовину, узяту
внадлишку.
4.Обчислюємо кількість речовини барій сульфату.
Оскільки кількісні відношення νBaCl2 : νBaSO4 у цій реакції становлять 1 : 1, то:
νBaSO4 = νBaCl2 = 0,2 моль
5. Обчислюємо масу барій сульфату кількістю речо# вини 0,2 моль за формулою:
m = ν· М
mBaSO4 = 0,2 моль · 233 г/моль = 46,6 г
Відповідь: маса утвореного осаду барій сульфату до# рівнює 46,6 г.
77

Запитання і завдання для самоконтролю знань
1. Виберіть правильне твердження щодо сульфатної кислоти А одноосновна Б двохосновна
В сильний електроліт Г слабкий електроліт Д оксигеновмісна
Ебезоксигенова
2.Як можна розпізнати розчини сульфатної кислоти, амоній хло# риду й амоній сульфату, що перебувають у пробірках без етикеток? Відповідь підтвердіть записом молекулярних та йонних рівнянь реакцій.
3.З якими з перелічених речовин взаємодіє розбавлена сульфат# на кислота: залізо, купрум(ІІ) оксид, мідь, натрій гідроксид, нітратна кислота, калій карбонат, нітроген(ІІ) оксид? Напишіть молекулярні рівняння реакцій, зазначте їх типи.
4*. Запропонуйте спосіб розпізнавання концентрованої та розбав# леної сульфатної кислоти, що перебувають у банках без етикеток. Мотивуйте його.
5*. Обчисліть масову частку кристалізаційної води в гіркій солі. 6*. Обчисліть масу амоній сульфату, який утвориться при пропус#
канні через розчин сульфатної кислоти масою 200 г з масовою часткою розчиненої речовини 9,8 % амоніаку об’ємом 11,2 л (н. у.).
§10. Нітратна кислота і нітрати
Як і сульфатна, нітратна кислота НNO3 належить до основних продуктів хімічної промисловості.
Фізичні властивості нітратної кислоти. Нітратна кислота — безбарвна рідина з густиною 1,51 г/см3 і різким характерним запа# хом. При зберіганні на світлі набуває бурого кольору внаслідок розкладу з виділенням нітроген(ІV) оксиду. Стійкою в зберіганні є нітратна кислота з масовою часткою розчиненої речовини 60–68 %. У разі потрапляння на шкіру зумовлює опіки, утворення жовтих плям (пригадайте кольорові реакції на білки). Увага! Поводитися з нітратною кислотою потрібно обережно.
Хімічні властивості нітратної кислоти. Нітратна кислота — сильний електроліт, що дисоціює на йони:
НNO3 Н+ + NO–3
78

Як і всі кислоти, нітратна кислота взаємодіє з: 1) металами; 2) основними та амфотерними оксидами; 3) основами; 4) ам фотерними гідроксидами; 5) солями, якщо під час реакції виділя# ється газ. Проте її взаємодія з металами відмінна від загальних властивостей кислот, а подібна на взаємодію з ними концентрова# ної сульфатної кислоти, тобто відбувається утворення солі, води й одного з продуктів відновлення кислоти (рис. 30).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
м |
|
|
|
|
|
|
|
|
|
|
|
|
один з продуктів |
|
|
||
|
е |
|
|
|
|
|
сіль |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
відновлення кислоти: |
|
||||||
|
т |
|
+ |
HNO3 |
|
= |
|
+ |
вода |
|
+ |
|
||||||
|
|
|
(нітрат) |
|
|
+4 |
+2 |
+1 |
0 |
–3 |
|
|||||||
|
а |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
NO2, |
NO, |
N2O, |
N2, |
NH3 |
|
|
|
л |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 30. Схема взаємодії нітратної кислоти з металами
Концентрована нітратна кислота при нагріванні взаємодіє з більшістю металів, крім золота, платини та деяких інших. На холоді частина металів, зокрема залізо і хром, не взаємодіють
з нітратною кислотою.
Концентрована нітратна кислота в реакціях з металами і неме# талами відновлюється до нітроген(ІV) оксиду NO2:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
У реакціях розбавленої нітратної кислоти з металами віді# грає роль активність металу та масова частка кислоти в розчині, проте найчастіше відновлення відбувається до нітроген(ІІ) ок# сиду NO:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Взаємодія нітратної кислоти з основними та амфотерними оксидами, основами, амфотерними гідроксидами та солями відбу# вається так само, як і в інших кислот.
Напишіть рівняння реакцій нітратної кислоти з оксидом, гідро# ксидом і сіллю Магнію (зважте, що сіль має бути утворена кисло# тою слабким електролітом, наприклад карбонатною).
79
Ще одну властивість нітратної кислоти — розкладатися на світ# лі чи при нагріванні — ми вже згадували. Це відбувається за таким рівнянням:
4HNO3 = 4NO2 + 2H2O + О2
Ви дізнаєтеся також про взаємодію нітратної кислоти з органіч# ними речовинами, вивчаючи в 11 класі властивості органічних сполук.
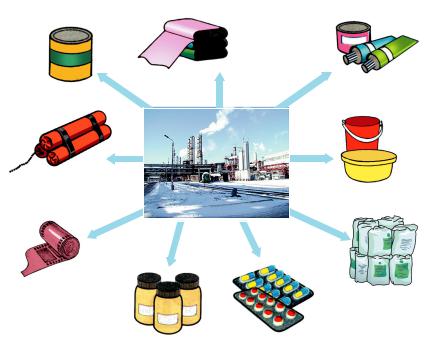
Застосування нітратної кислоти відображено на рисунку 31.
|
Хімічні |
|
|
волокна |
|
Нітролаки |
|
Барвники |
|
|
|
|
|
|
|
HNO3 |
|
Вибухові |
|
Пластмаси |
речовини |
|
|
|
|
|
Фотоплівка
Добрива
Дезінфікуючі засоби |
Лікарські засоби |
Рис. 31. Схема застосування нітратної кислоти
Вагомий внесок у розвиток технології виробництва нітратної кислоти з азоту повітря зробив український хімік доктор технічних наук, професор Василь Іванович Атрощенко (1906–1991).
Нітрати. За назвою нітрат#іону, який утворюється при дисоціа# ції нітратної кислоти, її солі називають нітратами. Нітрати Ка# лію, Натрію, амонію, Кальцію називають ще селітрами, наприк# лад: КNO3 — калій нітрат, або калієва селітра, Са(NO3)2 — кальцій
80
