
- •Методические указания к занятию № 4
- •Кислотно-основное титрование. Общая характеристика метода
- •Определение точки эквивалентности в кислотно-основном титровании. Кислотно-основные индикаторы
- •Подбор индикаторов при кислотно-основном титровании
- •Кривые титрования многоосновных (полипротонных) кислот, многокислотных оснований и их солей
- •Применение кислотно-основного титрования
- •Расчет: вычисляют средний объем (V) кислоты, пошедшей на титрование с точностью до сотых мл
- •Методические указания к занятию № 5
- •Редоксиметрия. Общая характеристика и классификация методов
- •Кривые титрования в редоксиметрии
- •Способы определения точки эквивалентности
- •Перманганатометрия
- •Иодометрия
- •Расчет: вычисляют средний объем (V) kMnO4,, пошедший на титрование с точностью до сотых
Кривые титрования в редоксиметрии
При оксидиметрическом титровании вследствие изменения концентраций участвующих в реакции веществ происходит непрерывное изменение окислительно-восстановительного потенциала системы (Е) подобно тому, как при кислотно-основном титровании всё время изменяется рН раствора. В связи с этим кривые титрования в редоксиметрии строят в координатах – величина редокс-потенциала как функция объёма добавленного титранта (рис. 41). Причём значения точек для построения такой кривой титрования можно измерить экспериментально с помощью потенциометрии или рассчитать теоретически по уравнению Нернста.
Как следует из рисунка 41, сперва редокс-потенциал системы при добавлении рабочего раствора изменяется медленно и незначительно, но в области точки эквивалентности при переходе от раствора недотитрованного на 0,1% к перетитрованному на 0,1%, потенциал изменяется резко и скачкообразно. Причём чем больше разность стандартных потенциалов титранта и исследуемого раствора, тем больше скачок титрования.
Для оксидиметрического титрования можно использовать такие окислительно-восстановительные пары, у которых разность их стандартных редокс-потенциалов (∆Е = Е0(окислителя) – Е0(восстановителя)) не меньше 0,4В.
В противном случае отсутствует резкий скачок потенциала вблизи точки эквивалентности.
На величину скачка титрования будут оказывать влияние и все те факторы, от которых зависят значения электродных потенциалов окислителя и восстановителя. Так, например, если в реакции, протекающей при титровании, принимают участие протоны или гидроксильные ионы, то ход кривой титрования станет определяться и значением рН системы.
В то же время, исходные концентрации титруемого вещества и титранта не будут оказывать влияния на вид кривой титрования.
Наличие резкого скачка на кривой титрования позволяет определить точку эквивалентности непосредственно с помощью потенциометрических измерений или использовать для этих целей определённые окислительно-восстановительные (редокс) индикаторы, окраска которых изменяется в зависимости от величины потенциала системы.
Способы определения точки эквивалентности
В редоксиметрии точку эквивалентности можно определить с помощью различных инструментальных методов (например, потенциометрически) либо визуально.
Визуальное обнаружение конечной точки титрования может быть проведено по изменению окраски одного из участников протекающей реакции, либо с помощью индикаторов. Например, в перманганатометрии критерием достижения точки эквивалентности обычно служит появление неисчезающей розовой окраски вследствие добавления к бесцветному титруемому раствору одной лишней капли ярко-малинового раствора KМnO4.
Индикаторы, используемые для определения точки эквивалентности, могут быть специфическими либо окислительно-восстановительными.
Специфические индикаторы реагируют на изменение концентрации одного из участников химической реакции, протекающей при титровании, образуя с ним нестойкое яркоокрашенное соединение.
Оно легко может разрушаться при добавлении второго реагента. Например, в иодометрии для этих целей используют раствор крахмала, образующий с I2 соединение ярко-синего цвета. По исчезновении (в результате расходования I2) или возникновении (при добавлении лишней капли раствора I2) синей окраски судят о достижении точки эквивалентности.
Окислительно-восстановительными, или редокс-индикаторами, называются вещества, которые изменяют свою окраску в зависимости от величины окислительно-восстановительного потенциала системы.
Под действием окислителя или восстановителя в структуре молекулы редокс-индикатора происходят изменения, вызывающие возникновение новой окраски. Таким образом, в растворе редокс-индикатора существует равновесие между его окисленной и восстановленной формами, имеющими разную окраску, которое сдвигается при изменении потенциала системы:
Indox + ne- ↔IndRed
где Indox – окисленная, а IndRed – восстановленная формы индикатора; n – число электронов, принимающих участие при переходе молекулы индикатора из одной формы в другую.
Потенциал такой индикаторной системы может быть рассчитан по уравнению Нернста:
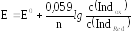
где Е0 – стандартный электродный потенциал, возникающий в системе, когда молярные концентрации окисленной (с(Indox)) и восстановленной (с(IndRed)) форм индикатора будут равны друг другу.
Как и в случае индикаторов других типов, изменение окраски редокс-индикаторов происходит в некотором интервале изменения величины их электродного потенциала. Можно показать, что крайние значения этого интервала определяются соотношением:
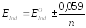
Редокс-индикатор можно использовать в окислительно-восстановительном титровании, если его интервал перехода лежит внутри скачка редокс-потенциала системы на кривой титрования.
Редокс-индикаторы могут быть двухцветными (каждая из его форм имеет свою специфическую окраску) и одноцветными (табл. 22). В первом случае в точке эквивалентности мы наблюдаем переход одной окраски раствора в другую. Во втором случае – исчезновение или возникновение окраски титруемого раствора.
Таблица 22. Некоторые окислительно-восстановительные индикаторы
|
Индикатор |
Е0, В |
Окраска | |
|
Окисленная форма |
Восстановленная форма | ||
|
Нейтральный красный |
+0,240 |
красная |
нет |
|
Метиловый синий |
+0,532 |
синяя |
нет |
|
Дифениламин |
+0,76 |
фиолетовая |
нет |
|
Эриоглауцин А |
+0,99 |
оранжевая |
жёлтая |
|
Ферроин |
+1,06 |
бледно-голубая |
красная |
|
5-Нитроферроин |
+1,25 |
бледно-голубая |
красная |
Редокс-индикаторы бывают обратимыми и необратимыми. Первые могут изменять свою окраску в растворе в зависимости от величины электродного потенциала системы неограниченное число раз. Вторые изменяют свою окраску необратимо, например, при окислении разрушаются с образованием бесцветных продуктов, как индиго под действием гипохлоритов или нафтоловый сине-чёрный под действием ионов BrO3-.
