
всё о тепломассобмене
.pdfНАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
трубами, которые окружают горящий факел.
На рис. 2.3 показаны зависимости тепловыделения при горении горючей смеси Qр=ƒ(T) и теплопоглощение экранными трубами Qт=ƒ(T).
Если теплопоглощение соответствует зависимости Qт2=ƒ(T), то горючая смесь нагревается до точки 3, а затем может произойти ее воспламенение, сопровождающееся бурным выделением теплоты. Точка 3 в этих процессах соответствует равновесному состоянию, в котором количество выделяющейся теплоты равно количеству отводимой теплоты (Qр3 = Qт3), поэтому факел может погаснуть.
Если же зависимость теплопоглощения на графике будет соответствовать положению Qт1=ƒ(T), то тогда равновесное состояние наступит в точке 1 (Qт1 = Qр1), и воспламенения смеси не произойдет, так как теплопоглощение Qт оказывается больше тепловыделения Qр. Если же горящая смесь окажется в точке 2, то тогда процесс горения может продолжаться, если Qр > Qт2 или произойдет погасание факела, если Qт2 > Qр.
Устойчивому горению смеси будут соответствовать значения на кривой тепловыделения Qр, распологающиеся выше зависимостей теплопоглощения Qт (Qр > Qт).
2.4. Влияние температуры и избытка воздуха на конечный состав продуктов сгорания
в топочных процессах
Основными горючими составляющими органического топлива являются водород и углерод, а также углеводороды CmHn. Термодинамический анализ и экспериментальные исследования показывают, что предельные углеводороды (C2H6 — этан, C3H8 — пропан, C4H10 — бутан) в топочных процессах разлагаются с образованием метана CH4 и сажистого углерода C. При высоких температурах и избытке воздуха (α в > 0,6) метан подвергается конверсии, реагируя с водяным паром и углекислым газом, образуя в конечном итоге CO и H2. Вероятным является также непосредственное взаимодействие метана с кислородом воздуха:
31
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
CH + |
1 O |
2 |
↔ CO+2H . |
(2.24) |
4 |
2 |
2 |
|
Равновесный состав продуктов сгорания любых видов топлива газообразного, жидкого или твердого в топочном процессе определяется соотношением простейших компонентов H2, O2, CO, CO2, H2O. При достижении некоторых предельных температур углекислый газ и водяной пар диссоциируют с образованием CO, H2 и O2.
Отношение количества диссоциированного водяного па-
ра gдис |
или углекислого газа gдис |
к их исходным количе- |
|||||||
H2O |
|
|
|
CO2 |
|
|
|
||
ствам gисх , gисх называется степенью диссоциации ψ |
|||||||||
|
H2O |
CO2 |
|
|
|
|
|
|
|
|
gдис |
/ gисх ; |
ψ CO |
|
|
gдис |
|||
ψ H O = |
2 |
= |
/ gисх . (2.25) |
||||||
|
2 |
H O |
H2O |
|
|
CO |
2 |
CO2 |
|
|
|
2 |
|
|
|
|
|
|
|
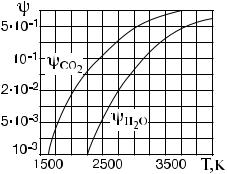
Наибольшее практическое значение имеет зависимость равновесных составов топочных продуктов при атмосферном давлении. Зависимость степени диссоциации углекислого газа и водяного пара при атмосферном давлении приведены в виде графиков на рис. 2.4.
Рис. 2.4. Зависимость степени диссоциации углекислого газа и водяного пара от температуры
Приведенные графики показывают, что при действительных температурах в экранированных котельных топках, не превышающих 2000 K, диссоциации H2O не происходит, а
32
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
степень диссоциации CO2 ψ CO2 < 0,02. В верхней части топки, где температура Tг = 1500 K, создаются условия для обратного окисления продуктов диссоциации. Учитывая, что реальные процессы протекают с определенной скоростью, равновесные составы газов в топке не достигаются, однако составы продуктов сгорания стремятся к определенному равновесию при данной температуре.
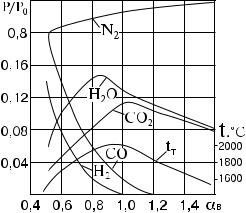
Большое влияние на полноту окисления горючих элементов оказывают скорости прямых реакций, зависящие от аэродинамики и режимных параметров топки. При стехиометрических соотношениях реагентов полное завершение прямой (целевой) реакции не достигается, так как при снижении концентрации исходных веществ скорость реакции стремится к нулевому значению. Поэтому для достижения полноты окисления горючих веществ в топку подается воздух с определенным избытком.
Рис. 2.5. Зависимость состава продуктов реакции горения от избытка воздуха:
tт — теоретическая температура горения; N2, H2O, CO2, H2, CO — содержание в продуктах сгорания соответственно азота, водяных паров, двуокиси углерода, водорода и оксида углерода
33
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
Применительно к газогенераторам, а также полугазовым процессам практическое значение имеют равновесные составы реагирующих веществ при избытке воздуха α < 1,0.
2.5. Тепломассообмен в процессах воспламенения и горения гетерогенных смесей
Организация процесса горения твердого топлива связана с его подогревом, подсушкой, возгонкой летучих горючих веществ и их горением, образованием кокса и его горением. Из перечисленных стадий определяющей является стадия горения кокса, занимающая около 90% времени полного сгорания топливной частицы.
При горении твердого топлива самой химической реакции предшествуют тепломассообменные процессы: нагревание частиц топлива за счет лучистого и конвективного видов теплообмена, подвод окислителя к поверхности реагирования турбулентной и молекулярной диффузий, и только после этого возможна химическая реакция окисления на гетерогенной поверхности.
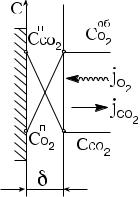
Гетерогенные реакции протекают на поверхности раздела фаз, схема которых показана на рис. 2.6.
Рис. 2.6. Схема массообмена при горении углеродной поверхности:
Соб ; Сп — концентрации кисло-
O2 O2
рода в объеме и у поверхности;
Соб ; Сп — концентрации двуо-
СO2 СO2
киси углерода в объеме и у поверхности
При сжигании твердого топлива (углерода) в атмосфере воздуха реакция протекает на поверхности частиц (кусков) с частичным проникновением кислорода внутрь частиц. При горении бурых углей в начальной стадии реакция осуществ-
34
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
ляется в парообразном пограничном слое, охватывающем поверхность частиц топлива.
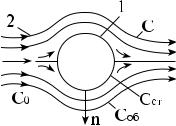
Физико-химическая сущность процесса горения твердых частиц в газовоздушном потоке показана на рис. 2.7.
Рис. 2.7. Схема диффузии кислорода из газовоздушного потока к поверхности горящей частицы:
1 — твердая частица топлива; 2 — линии тока газовоздушного потока; n — нормаль к поверхности частицы; Соб — концентрация кислорода в объеме; Сст — концентрация кислорода у горящей поверхности
При обтекании газовоздушным потоком частиц топлива часть кислорода вступает в реакцию окисления. Расходуемый на горение кислород подтекает к поверхности частицы под влиянием возникающего градиента концентрации
Вследствие того, что часть кислорода расходуется на реакцию, концентрация кислорода C в потоке после взаимодействия с частицей становится меньше начальной C0. Следовательно, возникает также градиент концентрации вдоль линии тока.
Точное решение данной модели процесса довольно сложное. Приближенная модель процесса горения твердого топлива представляется в следующем виде.
Теория гетерогенного горения рассматривается на примере сферической частицы углерода при условии равномерного распределения концентрации кислорода у поверхности частицы, а также при условии, что скорость реагирования кислорода с углеродом пропорциональна концентрации кислорода у поверхности, т. е. имеет место реакция перво-
35
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
го порядка. Реакция протекает на поверхности частицы с образованием конечных продуктов сгорания.
Скорость реакции v определяется интенсивностью химического реагирования кислорода на поверхности частицы
v = k xCст, |
(2.26) |
а также плотностью массового потока кислорода из газовоздушной среды к горящей поверхности
v = α m (Cоб − Cст) , |
(2.27) |
где kx — константа химической реакции; α m — коэффициент массообмена, кг/(м2ч.ед.концентрации); Cст — концентрация кислорода у поверхности частицы, кг/м3; Cоб — концентрация кислорода в объеме, кг/м3.
Решение данной системы уравнений (2.26 — 2.27) приводит к общему уравнению для определения скорости гетерогенной реакции. Из (2.26) выражаем Cст = v/kx и подставляем в (2.27):
|
|
v |
|
|
v |
||
v = α |
m Cоб − |
|
|
= α |
mCоб − α m |
|
; |
|
|
||||||
|
|
k x |
|
|
k x |
||
и далее |
|
|
|
|
|
|
|
|
α m |
|
|
|
|
|
v 1− |
|
= α |
mCоб. |
(2.28) |
||
|
||||||
|
k x |
|
|
|
||
После преобразований получаем скорость реакции горения
v = |
α mCоб |
= |
|
|
1 |
|
|
Cоб = k прCоб. (2.29) |
||
|
|
1 |
|
1 |
|
|||||
|
1+ |
α m |
|
+ |
|
|
||||
|
k x |
α m |
k x |
|||||||
|
|
|
||||||||
Уравнение (2.29) показывает, что скорость реакции (по кислороду) зависит от кинетического 1/kx и диффузионного 1/α m сопротивлений, а также от концентрации кислорода в газовоздушном потоке, обтекающем частицу топлива.
В низкотемпературной области, в которой kx = k0ƒ(T) хи-
36
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
мическое сопротивление намного больше диффузионного 1/kx >> 1/α m и является определяющим, поэтому данная область называется кинетической (уравнение 2.26).
Кинетическое сопротивление быстро убывает при повышении температуры, т.е. скорость химических реакций значительно возрастает. В области высоких температур преобладающим является диффузионное сопротивление, тогда
v 1/ α m . |
(2.30) |
В области умеренных температур, называемой переходной, кинетическое и диффузионное сопротивления примерно одинаковы и скорость реакции горения определяется уравнением (2.29).
Температурные пределы указанных областей зависят от реакционной способности топлива и размеров частиц.
Учитывая, что значение коэффициента массообмена α m
( α m = NuD D / dч) обратно пропорционально диаметру
частиц dч, диффузионное сопротивление зависит от диаметра частиц. Поэтому переход в диффузионную область горения частиц меньшего размера происходит при более высоких температурах.
По этой причине соотношение между кинетическим и диффузионным сопротивлениями меняется по мере выгорания частиц. Процесс горения частиц начального диаметра d0, протекающий в начальной стадии в диффузионной области, по мере выгорания может перейти в кинетическую область. Ориентировочно горение пылевидных угольных частиц переходит в диффузионную область при температурах tг > 1500°C, в то время как кинетическая область наблюдается при температурах tг > 1200°C.
2.6.Кинетика сгорания топливных частиц при стехиометрическом расходе воздуха
Стехиометрия — учение о количественных соотношениях между массами веществ, вступающих в химическую реакцию, включает в себя правила составления химических формул и уравнений.
Уравнение кинетики химических реакций имеет следую-
37
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
щий вид
dG |
= − |
k пр |
f ρ к Cоб, |
(2.31) |
|
dτ |
χ |
||||
|
|
|
где G — масса топливной частицы, кг; f — поверхность частицы, м2; ρ к — плотность кислорода, кг/м3; Cоб — концентрация кислорода в объеме кг/м3; χ — стехиометрический коэффициент; kпр — приведенная константа скорости реакции.
Левая часть уравнения (2.31) выражает изменение массы топливной частицы во времени, а правая — массу кислорода, подведенная к поверхности реагирования.
Примем, что отношение концентраций кислорода в объеме Cоб и у поверхности реагирования Cп пропорционально отношению текущего радиуса r к начальному r0 в третьей степени.
|
C |
об |
= |
|
r |
3 |
Сп r3 |
|
3 |
||
|
|
|
|
и Cоб = |
/ r |
0 . (2.32) |
|||||
|
Сп |
r0 |
|||||||||
|
|
|
|
|
|
|
|||||
Масса топливной частицы равна |
|
|
|
||||||||
|
|
|
|
G = ρ |
тVч = |
4 |
ρ |
т π r3. |
|
(2.33) |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
3 |
|
|
|
|
|
В дифференциальной форме изменение массы топливной частицы имеет вид
dG = 4 π r2ρ тdr . |
(2.34) |
Подставим (2.34) в уравнение (2.31) с учетом, что f = 4π r2,
тогда |
|
|
|
|
4 π r2ρ тdr = − |
k пр ρ к r3 Cп |
4 π r2dτ . |
(2.35) |
|
|
||||
|
χ r |
3 |
|
|
|
|
0 |
|
|
В уравнении (2.35) разделим переменные и проинтегрируем в пределах от r0 до r1:
38
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
|
|
|
|
|
r1dr |
|
k пр ρ к Сп |
τ |
г |
|
|
|
||||||||
|
|
|
|
|
∫ |
|
|
|
|
= − |
|
|
|
|
|
∫ dτ , |
(2.36) |
|||
|
|
|
|
|
|
|
|
|
|
χ ρ т r03 |
|
|||||||||
|
|
|
|
|
r0 r3 |
|
|
|
0 |
|
|
|
||||||||
тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
1 |
|
1 |
|
|
|
k пр ρ к Сп |
τ |
|
|
|
|||||||
− |
|
|
|
|
− |
|
|
|
|
= − |
|
|
|
|
|
|
г |
. |
(2.37) |
|
|
|
2 |
|
|
2 |
|
|
|
|
3 |
|
|||||||||
|
2 |
|
r |
|
|
r |
|
|
χ ρ |
|
r |
|
|
|
|
|||||
|
|
1 |
|
|
0 |
|
|
т |
0 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
При этом длительность горения топливной частицы при изменении радиуса топливной частицы от r0 до r1 равна
τ |
|
= |
χ ρ |
т r3 |
|
1 |
− |
1 |
|
|
||
|
|
0 |
|
|
|
|
|
. |
(2.38) |
|||
г |
|
|
|
2 |
|
2 |
||||||
|
|
|
|
|
r |
|
r |
|
|
|||
|
|
|
2 kпр ρ к Сп |
1 |
|
0 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||
Из уравнения (2.37) следует, что длительность горения топливной частицы при стехиометрическом расходе воздуха обратно пропорциональна разности квадратов начального r0 и текущего r1 радиусов.
Если r1 → 0, что соответствует полному выгоранию частиц топлива, тогда длительность горения стремится к бесконечности (τ г → ∞ ).
В диффузионной области приведенная константа скорости химической реакции kпр равна коэффициенту массообмена α m (kпр = α m). Если принять, что коэффициент массообмена уменьшается пропорционально изменению радиуса частицы при выгорании, тогда его можно выразить со-
отношением α m = α |
m0 r2 / r02 . |
|
||||
Уравнение кинетики выгорания топливной частицы при |
||||||
данных допущениях приобретает вид |
|
|||||
|
dG |
|
|
α m0 r2 |
|
|
|
|
= − |
|
|
f ρ к Соб. |
(2.39) |
|
dτ |
|
||||
|
|
|
χ r02 |
|
||
Разделим переменные и проинтегрируем данное уравнение
39
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
r1 |
α m0 ρ к Соб |
τ г |
|
||
∫ |
dr |
= − |
∫ dτ . |
(2.40) |
|
|
ρ т r02 |
||||
r0 r2 |
0 |
|
|||
Длительность выгорания частицы топлива от радиуса r0
до r1 в диффузионной области равна |
|
|
|
|
|||||
τ г = |
χ ρ т r02 |
|
|
1 |
|
− |
1 |
|
|
|
|
|
|
|
|
. |
(2.41) |
||
α m0 ρ к С |
|
r1 |
|
||||||
|
об |
|
r0 |
|
|||||
При полном выгорании частицы топлива r1 → |
0 длитель- |
||||||||
ность выгорания частицы топлива стремится к бесконечности (τ г → ∞ ), по этой причине в топках поддерживают избыток воздуха α т > 1,0.
2.7.Сгорание твердых топливных частиц
внеограниченном объеме (Соб = С0 = const)
Вкинетической области горения уравнение кинетики горения имеет следующий вид
|
4 |
ρ тπ d(r3) = − |
k x |
4 π r2ρ кС0 dτ |
(2.42) |
|
3 |
|
|||||
|
χ |
|
|
|||
или |
|
|
|
|
||
|
|
r1 |
k x ρ к С0 |
τ г |
|
|
|
|
∫ dr = − |
∫ dτ . |
(2.43) |
||
|
|
|
||||
|
|
r0 |
|
χ ρ т |
0 |
|
После интегрирования уравнения (2.43) получаем дли-
тельность горения топливной частицы |
|
||||
τ г |
= |
χ ρ |
т(r0 − r1) |
|
|
|
|
. |
(2.44) |
||
|
|
||||
|
|
k x ρ к С0 |
|
||
Длительность полного выгорания топливной частицы (при
r1 → 0) |
|
|
|
|
τ = |
χ ρ т r0 |
. |
(2.45) |
|
|
||||
|
г |
k x ρ к С0 |
|
|
|
|
|
|
|
|
|
40 |
|
|
