
g2
.docxСПЕКТРОСКОПИЯ (от лат. spectrum-образ, представление и греч. skopeo-смотрю), раздел физики, изучающий спектры электромагн. излучения. Спектры возникают при переходах между уровнями энергии в атомах, молекулах и образованных из них макроскопич. системах. Различают спектры испускания (эмиссионные), поглощения (абсорбционные), отражения, рассеяния и люминесценции, к-рые изучают соответствующие виды спектроскопии (см., напр., Абсорбционная спектроскопия, Комбинационного рассеяния спектроскопия, Спектральный анализ, Спектроскопия отражения). В зависимости от природы объекта исследования выделяют атомную и молекулярную спектроскопию, а также спектроскопию в-ва в конденсир. состоянии, включая спектроскопию кристаллов (см. Атомные спектры, Молекулярные спектры). В соответствии с видами движения в молекуле молекулярную спектроскопию делят на электронную, колебательную и вращательную (см. Электронные спектры, Колебательные спектры, Вращательные спектры). Аналогично различают электронную и колебательную спектроскопию кристаллов. По диапазону длин волн (или частот) электромагн. излучения выделяют радиоспектроскопию, микроволновую спектроскопию, оптическую спектроскопию (см. Инфракрасная спектроскопия, Молекулярная оптическая спектроскопия, Ультрафиолетовая спектроскопия), рентгеновскую спектроскопию и гамма-спектроскопию (см. Мёссбауэровская спектроскопия, Гамма-абсорбционный анализ). Оптическую спектроскопию на практике иногда отождествляют со спектрофотометрией. В каждом разделе спектроскопии используются свои приборы для получения, регистрации и измерения спектров. В соответствии с различием конкретных эксперим. методов выделяют спец. разделы спектроскопии, напр. Фурье-спектроскопия, лазерная спектроскопия. Систематич. изучение спектров началось во 2-й пол. 19 в. В 1859 Г. Р. Кирхгоф сформулировал принципы спектрального анализа. Н. Бор в 1913 объяснил закономерности в расположении спектральных линий. Изучение спектров атомов послужило основой создания квантовой механики. По спектрам были открыты неск. хим. элементов. Методы спектроскопии используют для исследования уровней энергии атомов, молекул и образованных из них макроскопич. систем, изучения строения и св-в хим. соединений, для проведения качеств. и количеств. анализа в-в (см. Атомно-абсорбционный анализ, Атомно-флуоресцентный анализ, Люминесцентный анализ, Фотометрический анализ, Фотометрия пламени эмиссионная, Фотоэлектронная спектроскопия).
Кондуктометрия (от англ, conductivity - электропроводность и греч. metreo - измеряю), совокупность электрохимических методов анализа, основанных на измерении электропроводности жидких электролитов, которая пропорциональна их концентрации. Достоинства кондуктометрия: высокая чувствительность (нижняя граница определяемых концентраций ~10-4-10-5 М), достаточно высокая точность (относительная погрешность определения 0,1-2%), простота методик, доступность аппаратуры, возможность исследования окрашенных и мутных растворов, а также автоматизации анализа. Методы кондуктометрии бывают постояннотоковые и переменнотоковые последние могут быть низкочастотными (частота тока <105 Гц) или высокочастотными (>105 Гц). Различают контактную и бесконтактную кондуктометрия в зависимости от наличия или отсутствия контакта между электролитом и входными цепями измерительного прибора. Наиболее распространены контактный низкочастотный и бесконтактный высокочастотный методы.
Контактные методы. Измерения проводят с помощью контактных ячеек (рис.1, а). При этом используют электроды из Pt, Ti, нержавеющей стали и др. Для измерения растворов с высокой концентрацией электролита (10-2-10-3 М) применяют платинированные электроды с развитой поверхностью.
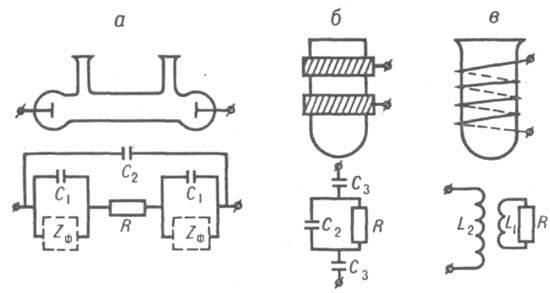
Рис. 1. Кондуктометрические ячейки и их эквивалентные электрические схемы: a-контактная ячейка; б-емкостная ячейка; в-индуктивная ячейка; R-сопротивление электролита; С1-емкость двойного электрического слоя на межфазной границе электрод - электролит; С2-емкость раствора; С3-емкость конденсатора, образованного раствором, стенкой ячейки и внешним электродом; Zф-фарадеевский импеданс, связанный с протекающей на границе электрод-электролит электрохимической реакцией; L1 и L2-индуктивности соотв. электролита и катушки. В прямой кондуктометри непосредственно определяют концентрацию электролита по х его раствора (если между этими величинами имеется линейная зависимость). Метод применяется главным образом для анализа разбавленных растворов. В случае концентрирированных растворов необходимо строить градуировочные графики. Определение веществ в присутствии других электролитов возможно, если концентрации последних постоянны. На методе прямой кондуктометрия основаны конструкции солемеров и др. кондуктометрических устройств, позволяющих определятьолеум. а также различных соли в минеральной, речной и морской водах, физиологических жидкостях и др. Прямую кондуктометрию применяют при контроле регенерации ионитов, очистки воды, промывки осадков, при оценке качества вин, соков и других напитков, чистоты органических растворителей, газов, твердых солей, текстильных материалов, бумаги, зерна, почвы и т.д. Часто анализируемые образцы предварительно сжигают, а выделяющиеся газы поглощают подходящими растворами. По электропроводности поглотителей определяют количества газов (в частности, СО2, NO2, SO2), следовательно - содержание соответствующих элементов, например С, N, S, в металлах,сплавах и органических соединениях. В косвенной кондуктометрия, позволяющей исследовать смеси электролитов, наряду с электропроводностью растворов измеряют рефракцию, вязкость, рН, плотность или др. величины. Например, при анализе промышленных нитрующих смесей, содержащих H2SO4, HNO3 и Н2О, дополнительно измеряют плотность. По совокупности всех экспериментальных данных определяют количеств, состав смеси. Кондуктометрическое титрование (кондуктометрия) основано на изменении х раствора при химических реакциях, связанном с изменением концентрации ионов различной подвижности. Кондуктометрическое титрование проводят в водных, водно-органических и неводных средах. Кривые титрования, представляющие собой зависимость х от количества прибавленного реагента (титранта), имеют излом в точке эквивалентности. При титровании смесейэлектролитов число изломов равно числу определяемых компонентов, взаимодействующих с титрантом. Форма кривых может быть разной (рис. 2).
КУЛОНОМEТРИЯ,
электрохим метод исследования и анализа,
основанный на измерении кол-ва
электричества (Q), прошедшего через
электролизер при электрохим. окислении
или восстановлении в-ва на рабочем
электроде. Согласно объединенному
Фарадея закону, масса электрохимически
превращенного в-ва (Р) в г связана с Q в
Кл соотношением: Р=QM/Fn, где М-молекулярная
или атомная масса в-ва, п- число электронов,
вовлеченных в электрохим. превращение
одной молекулы (атома) в-ва (М/n - электрохим.
эквивалент в-ва), F - постоянная Фарадея.
Кулонометрия - единственный физ.-хим.
метод анализа, в к-ром не требуются
стандартные образцы. Различают прямую
кулонометрию и кулонометрическое
титрование. В первом случае определяют
электрохимически активное в-во, во
втором случае - независимо от электрохим.
активности определяемого в-ва в испытуемый
р-р вводят электрохимически активный
вспомогат. реагент, продукт электрохим.
превращения к-рого (кулонометрич.
титрант) с большой скоростью и количественно
химически взаимодействует с определяемым
в-вом. Оба варианта кулонометрии можно
проводить при постоянном потенциале Е
рабочего электрода (потенциостатич.
режим) или при постоянном токе электролиза
Iэ (гальваностатич. режим). наиб. часто
используются прямая кулонометрия при
постоянном Е и кулонометрическое
титрование при постоянном Iэ. Для
кулонометрич. анализа необходимо
соблюдение след. условий: электрохим.
превращение в-ва должно протекать со
100%-ным выходом по току (h), т.е. должны
отсутствовать побочные электрохим. и
хим. процессы; нужны надежные способы
определения кол-ва электричества и
установления момента завершения
электрохим. или хим. р-ции. В прямой
кулонометрии 100%-ный выход по току
обеспечивается, если значение Е
поддерживать постоянным в области
предельного диффузионного тока Iпp на
вольтамперограмме определяемого в-ва
(см. Вольтамперометрия). При этом в
анализируемом р-ре должны отсутствовать
посторонние в-ва, способные электрохимически
превращ. в тех же условиях. Кол-во
электричества определяют обычно с
помощью электронных интеграторов тока.
Иногда пользуются менее точными приборами
- кулонометрами разл. типа, а также
планометрическим и расчетными методами.
В последних двух случаях завершением
электролиза считают момент, когда Iэ
падает до значения фонового тока Iф,
поэтому кол-во электричества, необходимое
для завершения электродной р-ции, равно
разности Qоб—Qф, где Qоб - общее кол-во
электричества, Qф - кол-во электричества,
измеренное в тех же условиях за то же
время электролиза tэ, но в отсутствие
определяемого в-ва. Если электрохим.
р-ция первого порядка, то It=I0е-Kt=I0.10-Kt,
К=2,30ЗК'=SD/Vd, где It и I0 - ток электролиза
соответственно в момент времени т и при
t=0, S - площадь пов-сти электрода, D - коэф.
диффузии электрохимически активного
в-ва, d - толщина диффузионного слоя, V -
объем р-ра в ячейке. Продолжительность
электролиза не зависит от начальной
концентрации в-ва, но заметно сокращается
с увеличением соотношения S/V и при
интенсивном перемешивании р-ра (уменьшении
6). Можно считать электролиз завершенным,
когда Iэ станет равен 0,1 I0 или 0,01 I0 (в
зависимости от требуемой точности
анализа). В планометрич. способе для
установления Q измеряют площадь под
кривой It - t, т.к. . В расчетном способе
решают последнее ур-ние, подставляя в
него выражение для It. После интегрирования
получают Q=I0/К=I0/2,303K'. Для нахождения I0 и
К' выражение для It логарифмируют и по
нескольким (5-7) точкам строят прямую
lgIt-t, тангенс угла наклона к-рой равен
К', а точка пересечения с осью ординат
соответствует lgI0, т.е. для определения
Q нет необходимости проводить электролиз
до конца и измерять I0, значение к-рого
плохо воспроизводится. В др. расчетном
способе Q вычисляют по ф-ле
Q=[Q22-Q1Q3]/(2Q2-Q1-Q3), где Q1, Q2 и Q3 - кол-ва
электричества в моменты времени t1, t2 и
t3 соотв., причем (t2-t1)~(t3-t2). Прямая
кулонометрия при постоянном Iэ осуществима,
только когда определяемое в-во находится
или предварительно выделено в виде
твердой фазы на рабочем электроде.
Анодное (катодное) растворение при
постоянном Iэ и измерение tэ в момент
резкого изменения Е позволяет рассчитать
Q=Iэtэ. Преимущество прямой кулонометрии
перед кулонометрическим титрованием
- высокая селективность. Однако наиб.
распространенный метод кулонометрич.
анализа - кулонометрическое тирование
в гальваностатич. режиме, т. к. он
отличается простотой аппаратурного
оформления и более высокой точностью.
Для нахождения оптим. условий проведения
эксперимента вычисляют значения выхода
по току по ф-ле h=(iэ-iф).100/iэ, где iэ и iф -
плотности тока электролиза (т. е. отношения
Iэ/S) соотв. в присут. вспомогат. реагента
и без него при одних и тех же значениях
Е. Варьируя т-ру, рН среды, концентрации
электрохимически активного в-ва и разл.
фоновых электролитов, а также значения
iэ, строят графики h=f(iэ) и находят область
iэ, при к-рой h~100%. Существуют и другие,
реже используемые способы расчета
оптим. значения iэ. Обычно вычисляют
также эффективность титрования Qэ.100/Qt
(%), где Q, и (Qt - соотв. эксперим. и тeорeтич.
значения кол-ва электричества при
кулонометрическом титровании известной
массы определяемого в-ва. Если определяемое
в-во А электрохимически активно, его
предельный ток должен быть меньше тока
электролиза и значительно меньше
предельного тока (I'пр) вспомогат. реагента
С. При этом в электролизере происходят
электрохим. р-ции: A6ne:В и Сbme:D, а также
хим. р-ция (окисление-восстановление,
комплексообраювание, осаждение или
кислотно-основное взаимод.) mA+nD:mB+nС или
mА+nD:AmDn. При электролизе концентрация
реагента С остается постоянной (если
он регенерируется) или меняется
незначительно, т.к. его концентрация в
р-ре на 3-4 порядка превышает концентрацию
определяемого в-ва. Т. обр., значение
I'пр практически постоянно. Поэтому в-во
С называют электрохим. буфером,
поддерживающим постоянное значение Е.
В кулонометрическом титровании время
электролиза мало, т. к. содержание А в
электролизере уменьшается одновременно
вследствие электрохим. и хим. р-ций. Если
А неэлектроактивно, то для выбора оптим.
значения iэ предварительно определяют
зависимость выхода по току в-ва D от iэ,
как описано выше. Конец хим. р-ции
устанавливают с помощью цветных
индикаторов или физ. - хим. методами.
Среди последних наиб. удобны потенциометры
и амперометрия с одним или двумя
поляризованными электродами (см.
Амперометричeское титрование). Кол-во
электричества рассчитывают по ф-ле
Q=Iэtэ. Кулонометрич. титрант получают
из растворимых солей, твердых
электрохимически активных материалов
(Ag, Hg), амальгам, электродов второго рода
и из воды (при определении к-т и оснований)
в присут. инертных электролитов, создающих
необходимую электропроводность р-ра.
Преимущества кулонометрического
титрования перед обычными титримeтрич.
методами: нет необходимости стандартизовать
р-ры титранта; титрант прибавляется
очень малыми порциями (практически
непрерывно); р-р не разбавляется; можно
генерировать электрохимически неактивные
титранты, напр. комплексон III, а также
малоустойчивые сильные окислители и
восстановители, в частности Mn(III), Pb(IV),
Сr(П), V(II), Ti(III). Установки для кулонометрич.
анализа (рис. 1,2) состоят из потенциостата
или гальваностата, регистрирующего
потенциометра или интегратора тока,
электролизера и индикац. системы (в
случае использования физ.-хим. методов
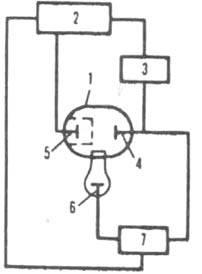
для Рис. 1. Схема установки для прямой
кулономeтрии при постоянном E: 1
электролизер; 2 источник постоянного
токa с регулируемым напряжением: 3 прибор
для определения кол-ва злектричества:
4 рабочий электрод; 5 вспомогательный
электрод; 6 электрод сравнения, относительно
к-рого контролируют потенциал рабочего
электрода: 7 устройство, измеряющее
разность потенциалов. установления
конца хим. р-ции в кулонометрическом
титровании). Приборы для кулонометрии
легко автоматизируются. Электролизеры
(см., напр., на рис. 2) представляют собой,
как правило, стеклянные сосуды, катодные
и анодные камеры в к-рых разделены
диафрагмой (напр., из пористого стекла).
В качестве рабочих и вспомогательных
(замыкающих цепь электролиза) электродов
используют благородные металлы (Pt, Au),
электроды второго рода и, реже, углеродные
материалы (графит, стеклоуглерод и др.).
Р-р, в к-рый погружен рабочий электрод,
перемешивают обычно магн. мешалкой; при
необходимости эксперимент проводят в
атмосфере инертного газа.Кулонометрию
применяют для определения как следовых,
так и весьма больший кол-в в-в с высокой
точностью. Погрешность прямой кулонометрии
в потенциостатич. режиме обычно 0,5-1%, а
кулонометрического титрования в
гальваностатич. режиме - 0,1-0,3%. Особенно
точен дифференциальный вариант
кулонометрии. В этом случае в цепь
последовательно включают два идентичных
электролизера, в один из к-рых вносят
стандартное в-во в известном кол-ве,
эквивалентном кол-ву электричества Q1,
к-рое на величину Q2 меньше кол-ва
электричества, необходимого для
завершения электрохим. или хим. р-ции
определяемого в-ва во втором электролизере.
Электролиз проводят в одинаковых
условиях при строгом контроле значений
Е и Iэ. Все погрешности сказываются
только на кол-ве электричества Q2, к-рое
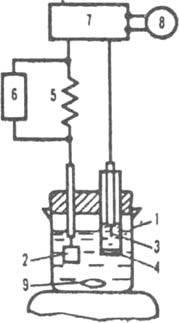
обычно Рис. 2. Схема установки для
кулонометрического титрования: 1
электролизер: 2 рабочий электрод (электрод
генерации): 3 - вспомогательный электрод:
4 пористое стекло: 5 прецизионное
сопротивление: 6 устройство, измеряющее
разность потенциалов: 7 источник
постоянного тока: 8 хронометр: 9 магнитная
мешалка. составляет 2-5% Q1. Содержание
определяемого в-ва соответствует сумме
Q1+Q2. Чувствительность кулонометрич.
методов определяется в осн. способами
установления момента завершения
электрохим. или хим. р-ции и составляет
10-8-10-9 моль/л. Использование неводных и
водно-орг. сред расширяет область
потенциалов, в к-рой протекают электрохим.
и хим. р-ции, и таким образом увеличивает
круг в-в, анализируемых кулонометрически.
Кулонометрию применяют для анализа мн.
неорг. (практически все металлы, галогены,
S и др.) и орг. в-в (ароматич. амины, нитро-
и нитрозоcоединения, фенолы, азокрасители,
алифатич. амиды и др.); определения воды
в орг. в-вах; установления толщины и
анализа металлич. покрытий; изучения
процессов коррозии; исследования
кинетики и механизма хим. р-ций (в т.ч.
каталитических); определения констант
равновесия р-ций; установления числа
электронов, участвующих в электрохим.
и хим. взаимодействиях, и т.д. Кулонометрич.
детекторы широко используются в
проточно-инжeкционном анализе и
хроматографии (см. Детекторы
хроматографические). ===
ПОТЕНЦИОМЕТРИЯ (от лат. potentia-сила, мощность и греч. metreo- измеряю), электрохим. метод исследования и анализа в-в, основанный на зависимости равновесного электродного потенциала Е от термодинамич. активности а компонентов электрохим. р-ции: aА + bВ + ... + nе mМ + рP + Эта зависимость описывается Нернста уравнением
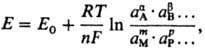
где Е0 стандартный потенциал, R-газовая постоянная, Т-абс. т-ра, F-постоянная Фарадея, n-число электронов, участвующих в р-ции, a, b, ..., т, р ...-стехиометрич. коэф. при компонентах р-ции А, В, ..., М, Р (к-рыми м.б. ионы и молекулы в жидкой, твердой или газовой фазе). Активности твердых и газообразных компонентов и р-рителей принимают за единицу. При потенциометрич. измерениях составляют гальванич. элемент с индикаторным электродом (см. Электроды в электрохимии), потенциал к-рого зависит от активности хотя бы одного из компонентов электрохим. р-ции, и электродом сравнения и измеряют электродвижущую силу (эдс) этого элемента (см. Электрохимические цепи). В потенциометрии используют гальванич. элементы без переноса, когда оба электрода помещают в один и тот же исследуемый р-р, и с переносом, когда электроды находятся в разных р-рах, имеющих между собой электролитич. контакт. Последний осуществляют таким образом, что р-ры могут смешиваться друг с другом только путем диффузии. Обычно их разделяют пористой керамической или пластмассовой перегородкой или прочно пришлифованной стеклянной муфтой. Элементы без переноса используют в осн. для измерения констант равновесия хим. р-ций, констант диссоциации электролитов, констант устойчивости комплексных соед., произведений р-римости, стандартных электродных потенциалов, а также активностей и коэф. активности ионов. Элементы с переносом используют для определения "кажущихся" констант равновесия (поскольку при этом не учитывают жидкостной потенциал), активностей и коэф. активности ионов, а также в потенциометрич. методах анализа. Среди этих методов различают прямую потенциометрию и потенциометрич. титрование. Прямая потенциометрия применяется для непо-средств. определения а ионов (напр., Ag+ в р-ре AgNO3) по значению Е соответствующего индикаторного электрода (напр., серебряного); при этом электродный процесс должен быть обратимым. Исторически первыми методами прямой потенциометрии были способы определения водородного показателя рН (см. рН-Метрия). Появление мембранных ионоселективных электродов привело к возникновению ионометрии (рХ-мет-рии), где рХ = — lg ах, ах-активность компонента X элект-рохим. р-ции. Иногда рН-метрию рассматривают как частный случай ионометрии. Градуировка шкал приборов потенциометров по значениям рХ затруднена из-за отсутствия соответствующих стандартов. Поэтому при использовании ионоселективных электродов активности (концентрации) ионов определяют, как правило, с помощью градуировоч-ного графика или методом добавок. Применение таких электродов в неводных р-рах ограничено из-за неустойчивости их корпуса и мембраны к действию орг. растворителей. К прямой потенциометрии относится также редоксметрия - измерение стандартных и реальных окислит.-восстановит. потенциалов и констант равновесия окислит.-восстановит. р-ций. Окислит.-восстановит. потенциал зависит от активностей окисленной (О и восстановленной (aвос) форм в-ва. Редокс-метрию применяют также для определения концентрации ионов в р-рах. Методом прямой потенциометрии с использованием металлич. электродов изучают механизм и кинетику р-ций осаждения и комплексообразования. Прямая потенциометрия обладает важными достоинствами. В процессе измерений состав анализируемого р-ра не меняется. При этом, как правило, не требуется предварит. отделения определяемого в-ва. Метод можно легко автоматизировать, что позволяет использовать его для непрерывного контроля технол. процессов. Более распространены методы потенциометрич. титрования, с помощью к-рых определяют широкий круг в-в в водных и неводных средах. В этих методах регистрируют изменение потенциала индикаторного электрода в процессе титрования исследуемого р-ра стандартным р-ром реагента (см. Титриметрия)в зависимости от объема последнего. Потенциометрич. титрование проводят с использованием разл. р-ций: кислотно-основного и окислит.-восстановит. взаимодействий, осаждения и комплексообразования. В методах кислотно-основного титрования в качестве индикаторного можно использовать любой электрод, обратимый к ионам Н+ (водородный, хингидронный, сурьмяный, стеклянный); наиб. распространен стеклянный электрод. Окис-лит.-восстановит. титрование проводят с электродами из благородных металлов (чаще всего с платиновым). В методах осадительного и комплексометрич. титрования индикаторный (ионоселективный или металлич.) электрод должен быть обратимым относительно одного из ионов, участвующих в р-ции. Вблизи точки эквивалентности наблюдается резкое изменение (скачок) электродного потенциала E, обусловленное заменой одной электрохим. р-ции другой с соответствующим изменением E0. Напр., при титровании ионов Сl- р-ром AgNO3 с серебряным индикаторным электродом до точки эквивалентности при избытке ионов Cl ~ потенциал электрода определяется р-цией AgCl + eAg + Cl- с Е = 0,222 — 0,059 lg aCl_, а после точки эквивалентности при избытке ионов Ag+-р-цией Ag+ + eAg с E = 0,799 + + 0,059 lg АAg+ Потенциометрич. титрование имеет ряд преимуществ по сравнению с титриметрич. методами, в к-рых применяют химические индикаторы: объективность и точность в установлении конечной точки титрования, низкая граница определяемых концентраций, возможность титрования мутных и окрашенных р-ров, возможность дифференцированного (раздельного) определения компонентов смесей из одной порции р-ра, если соответствующие Е0 достаточно различаются. Потенциометрич. титрование можно проводить автоматически до заданного значения потенциала, кривые титрования записывают как в интегральной, так и в диффе-ренц. форме. По этим кривым можно определять "кажущиеся" константы равновесия разл. процессов. Для определения компонентов обратимых систем, когда на электродах устанавливаются равновесные значения потенциалов, потенциометрич. титрование проводят при силе тока I = 0. В случае необратимых электродных процессов исследуемый р-р титруют с одним или двумя поляризованными электродами, т.е. при контролируемой силе тока I . 0. В этом случае Е устанавливается быстро и расширяется круг используемых титрантов и определяемых соединений. Потенциометрич. методы анализа широко используют для автоматизации контроля технол. процессов в хим., нефтехим., пищ. и др. отраслях пром-сти, в медицине, биологии, геологии, а также при контроле загрязнений окружающей среды.
ГАЗОВАЯ ХРОМАТОГРАФИЯ (ГХ), вид хроматографии, в к-рой подвижной фазой служит газ (пар). В зависимости от агрегатного состояния неподвижной фазы различают газоадсорбционную хроматографию (неподвижная фаза - твердое тело) и газо-жидкостную хроматографию (неподвижная фаза - жидкость, нанесенная тонким слоем на твердый носитель). Разделение компонентов в газовой хроматографии основано на различии скоростей движения и размывания концентрац. зон исследуемых в-в, движущихся в потоке газовой фазы относительно слоя неподвижной, причем эти в-ва распределены между обеими фазами. Газ-носитель (воздух, N2, Аr, СО2 и др.) должен обычно иметь небольшую вязкость и обеспечивать высокую чувствительность детектирования.
Проведение эксперимента. Газохроматографич. разделение и анализ осуществляются в спец. приборе - газовом хроматографе. В ходе эксперимента газ-носитель из баллона повыш. давления непрерывно поступает в блок подготовки, где дополнительно очищается. Устройство для ввода пробы обычно представляет собой проточную независимо термостатируемую цилиндрич. камеру. Анализируемая проба (1-10мкл) вводится в поток газа при повыш. т-ре дозатором (напр., шприцем) через резиновую термостойкую мембрану. Существуют также автоматич. системы ввода проб (самплеры). Жидкая проба быстро испаряется и потоком газа переносится в хроматографич. колонку, находящуюся в термостате. Разделение обычно проводят при 20-400 °С, но иногда (в осн. при разделении изотопов низкокипящих газов) при значительно более низких т-pax - до т-ры кипения жидкого азота. Для аналит. разделения используют насадочные колонки дл. 0,5-5 м и диам. 0,2-0,6 см, а также капиллярные полые колонки дл. 10-100 м и диам. 0,1-1 мм, и капиллярные насадочные колонки дл. 0,1-20м. Насадкой служат твердый сорбент с развитой пов-стью (50-500 м2/г) или твердый макропористый носитель с уд. пов-стью 0,2-2,0 м2/г, на к-рую тонким слоем нанесена нелетучая жидкость - неподвижная жидкая фаза. Масса жидкой фазы составляет обычно 2-20% от массы носителя. Средний диаметр частиц сорбента 0,1-0,4 мм (колонку заполняют близкими по размеру частицами). Применяют также (обычно в капиллярных наса-дочных колонках) микронасадки с диаметром частиц сорбента 10-50 мкм.

Зоны разделенных компонентов в потоке газа поступают в детекторы хроматографические. В газовой хроматографии используются практически только дифференциальные детекторы (катарометр, пламенно-ионизационный, электронно-захватный, пламенно-фотометрический). Регистратор записывает изменение сигнала во времени. Полученная диаграмма наз. хроматограммой (см. рис.). Хроматограммы, полученные при разделении смеси соединений с разл. т-рами кипения: А и Б-изотермич. разделение при 45 и 120°С соотв.; В-разделение при программировании т-ры (скорость повышения т-ры 4,7°С/мин); 1 -пропан; 2-бутан; 3-пентан; 4-гексан; 5-гептан; 6-октан; 7-бромоформ; 8-м-хлортолуол; 9 - броммезити лен. При использовании сразу неск. детекторов появляется возможность качеств. и количеств. определения состава хроматографич. зон, содержащих два и более соединений. Использование в кач-ве высокоселективного детектора масс-спектрометра привело к созданию высокоэффективного аналит. метода -хромато-масс-спектрометрии. Для управления хроматографом и обработки полученных данных используют ЭВМ. В частности, спец. интеграторы подсчитывают площади пиков на хроматограммах.
ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ, жидкостная хроматография, основанная на разл. способности разделяемых ионов к ионному обмену с фиксир. ионами сорбента, образующимися в результате диссоциации ионогенных групп последнего. Для разделения катионов используют катиониты, для разделения анионов - аниониты (см. Иониты). Элюентом в первом случае служит р-р кислоты, во втором - р-р щелочи. Разделение ионов регулируют подбором оптим. значений рН элюента. Сильнокислотные сульфокатиониты и высокоосновные аниониты могут использоваться при любых значениях рН, слабокислотные карбоксильные катиониты - только при рН > 6; слабоосновные аниониты находятся в ионизованном состоянии при рН < 8. Варьируя рН элюента, можно резко изменять степень ионизации компонентов разделяемой смеси (сорбатов) и, следовательно, время их удерживания, добиваясь необходимой селективности разделения. Многозарядные ионы удерживаются ионитом сильнее однозарядных. При равных величинах зарядов удерживание падает с ростом радиуса гидратир. иона. Поэтому при ионообменной хроматографии в разб. р-рах на сульфокатионитах время удерживания катионов падает в ряду: Ва2+ > РЬ2+ > Sr2+ > Са2+ > Ni2+ > Cd2+ > Сu2+ > Со2+ > Zn2+ > Mg2+ > UO2+ > Тl+ > Ag+ > Cs+ > Rb+ > K+ > NH4+ > Na+ > H+ > Li+. Для орг. ионов на электростатич. взаимод. с фиксир. зарядами ионита накладывается еще и гидрофобное взаимод. орг. части иона с матрицей ионита. Чтобы уменьшить его вклад в удерживание орг. ионов и добиться оптим. селективности их разделения, к водному элюенту добавляют орг. компонент (1-25% метанола, изопропанола, ацетонитрила или диоксана). Элюент в ионообменной хроматографии кроме к-ты или основания и орг. добавок может содержать нейтральный электролит, напр. NaNO3, ионы к-рого конкурируют с разделяемыми ионами за взаимод. с сорбентом; при этом удерживание однозарядных ионов падает пропорционально концентрации соли в р-ре, двухзарядных ионов - пропорционально ее квадрату. Важна также природа нейтрального электролита: чем выше сродство его ионов к сорбенту, тем выше элюирующая сила р-ра. В ионообменной хроматографии анионов часто используют фосфатные р-ры, к-рые обладают большой элюирующей способностью при высоких значениях рН, где фосфат приобретает заряд - 3. Мн. неорг. катионы разделяют на сульфокатионитах, используя в качестве элюента комплексообразователи (орг. к-ты или гидроксикислоты). Разделение основано на том, что константы устойчивости образующихся комплексов, а значит и их сорбционные св-ва, даже таких близких по св-вам катионов, как лантаноиды и актиноиды, при определенных значениях рН различаются достаточно сильно; при этом заряд комплекса можно менять (вплоть до отрицательного). С помощью ионообменной хроматографии разделяют нек-рые нейтральные соед., если они способны превращ. в заряженные комплексы, как, напр., комплексы углеводов с борат-ионом. Удерживание разделяемых ионов в колонке пропорционально обменной емкости ионита. Для используемых в ионообменной хроматографии полимерных ионитов емкость 3-6 мг-экв/г, для ионитов на основе силикагеля с привитыми к его пов-сти функц. группами - на порядок ниже. При равном размере зерен (обычно 5-15 мкм) иониты на основе силикагеля обладают более высокой скоростью ионного обмена, что повышает эффективность хроматографич. колонок, однако их гидролитич. устойчивость при рН / 8 недостаточна. Для увеличения эффективности (числа теоретич. тарелок) колонки с полимерными ионитами обычно используют при повыш. т-рах (50-80 °С); при этом увеличиваются коэф. диффузии ионов в фазе ионита. В качестве сорбентов для ионообменной хроматографии могут использоваться нейтральные носители, пропитанные жидкими ионитами, т.е. несмешивающимися с водой орг. основаниями или к-тами, напр., триоктиламином, триоктилметиламмонием, алкиловыми зфирами алкилфосфорной к-ты. Разбавленные р-ры ионогенных ПАВ в сочетании с нейтральными гидрофобными носителями находят применение в ион-парной хроматографии (см. Жидкостная хроматография), к-рая отличается высокой эффективностью и большим числом варьируемых параметров для подбора оптим. селективности разделения. Детектирование в ионообменной хроматографии осуществляют с помощью любого детектора, применяемого в жидкостной хроматографии (см. Детекторы хроматографические). Наиб. универсален для ионных соединений кондуктометр, на применении к-рого основан вариант ионообменной хроматографии - ионная хроматография.Ионообменная хроматография применяется для разделения катионов металлов, напр., смесей лантаноидов и актиноидов, Zr и Hf Мо и W, Nb и Та; последние разделяют на анионитах в виде анионных хлоридных комплексов в р-рах соляной и плавиковой к-т. Щелочные металлы разделяют на катионитах в водных и водно-орг. средах, щел.-зем. и редкоземельные металлы на катионитах в присут. комплексонов. Большое значение имеет автоматич. анализ смесей прир. аминокислот на тонкодисперсном сульфокатионите в цитратном буфере при повыш. т-ре. Аминокислоты детектируют фотометрически после их р-ции с нингидрином или флюориметрически после дериватизации фталевым альдегидом. Высокоэффективная ионообменная хроматография (колонки, упакованные сорбентом с размером зерен 5-10 мкм, давление для прокачивания элюента до 107 Па) смесей нуклеотидов, нуклеозидов, пурияовых и пиримидиновых оснований и их метаболитов в биол. жидкостях (плазма крови, моча, лимфа и др.) используется для диагностики заболеваний. Белки и нуклеиновые к-ты разделяют с помощью ионообменной хроматографии на гидрофильных высокопроницаемых ионитах на основе целлюлозы, декстранов, синтетич. полимеров, широкопористых силикагелей; гидрофильность матрицы ионита уменьшает неспецифич. взаимод. биополимера с сорбентом. В препаративных масштабах ионообменную хроматографию используют для выделения индивидуальных РЗЭ, алкалоидов, антибиотиков, ферментов, для переработки продуктов ядерных превращений.
