
Розділ 1. Способи визначення концентрації розчинів
Розчин – це гомогенна (однорідна) система, яка складається з розчинника, розчинених речовин і продуктів їх взаємодії.
За агрегатним станом розчини поділяються на рідкі і тверді (деякі мінерали, металічні сплави, пластмаси). За співвідношенням між розчинником і розчиненою речовиною розрізняють розчини насичені, ненасичені і перенасичені, а також розведені та концентровані.
Розчин у якому речовина більше не розчиняється за даної температури, називається насиченим. Наприклад у воді масою 100 г при t=20 0С розчиняється хлорид натрію масою 36 г. Більше хлориду натрію в цьому розчині розчинитися не може, тобто маємо насичений розчин.
Розчин у якому речовина ще може розчинитися за даної температури називається ненасиченим.
Здатність речовин, змішуючись з іншою речовиною, утворювати гомогенні системи називається розчинністю.
Основні поняття:
Моль (ν) - кількість речовини, що містить скільки певних структурних частинок, скільки атомів міститься в 12 г С12 ( Це число 6,02 • 1023).
Молярна маса (М)- це маса 1 моля речовини.
![]() ,
,
![]()
ν - кількість молів речовини, m - її маса.
На практиці молярну масу визначають виходячи із молекулярної формули речовини, як суму мас всіх атомів, які входять до складу молекули. Наприклад М(H2SO4) = 2*1+32+4*16=98 г/моль.
Еквівалент (Е) в кислотно-основних реакціях - це умовна частина, яка може приєднати, заміщати чи якимось іншим способом взаємодіяти з одним молем йонів водню. Еквівалент в реакціях окислення - відновлення - умовна частина, яка може приєднати чи віддавати один електрон.
Число еквівалентності (z) - число, яке показує з кількома йонами водню може взаємодіяти дана речовина в кислотно-основних реакціях; або кількість прийнятих чи відданих електронів в окисно-відновних реакціях.
Фактор еквівалентності (f) - число, яке показує, яка частка умовної частини речовини еквівалентна або реагує з одним йоном водню в даній кислотно- оcновній реакції чи з одним електроном в даній окисно-відновній реакції.
Молярна
маса еквівалента (МE)
- це маса одного моля еквівалентів даної
речовини яку можна визначити як добуток
фактора еквівалентності на молярну
масу.
![]()
![]() [г/моль]
[г/моль]
Для елементів z - валентність елементу
ME=
f
.M
=
![]() . М
. М
Наприклад
для А1:
M(![]() Аl)=
Аl)=![]() =
=![]() =9г/моль
=9г/моль
Для кислот: z - основність кислоти (кількість Н+, які заміщуються в даній реакції)
![]()
Для
Н2SO4
:
М(![]()
![]()
Для основ: z - кислотність основи ( кількість ОН- )
![]()
![]()
Для
Са(ОН)2
: М(![]() Са(ОН)2)=
Са(ОН)2)=![]() =
=![]() =37
г/моль
=37
г/моль
Для солей: z - добуток кількості атомів металу на їх валентність
![]()
Для Al2
(SO4)3:
![]() =
57 г/моль
=
57 г/моль
Концентрації розчинів можна виражати як через масу, так і за кількістю молів розчиненої речовини. Розрізняють такі основні способи вираження концентрації:
1). Масова частка (ω) - величина, що показує скільки грам розчиненої речовини міститься в 100 г розчину і виражається як відношення маси розчиненої речовини до маси розчину:
m розчину = m розч.реч. + m розчинника
![]()
Виражають в безрозмірних одиницях, частках одиниці або у відсотках:
![]()
Для розчинів, які містять дуже мало розчиненої речовини можна виразити масову частку в проміле ( ‰ ) - тисячна частка цілого 1 ‰ = 0,1%
2). Молярна концентрація (См) – величина, що показує скільки молів розчиненої речовини знаходиться в 1 л розчину. Визначається як відношення кількості речовини (ν) до об’єму розчину:
![]()
визначається
в моль/л
чи моль/дм3
(в системі SI
використовують розмірність моль/м3
)
враховуючичи, що
![]()
![]() можна записати:
можна записати:
![]()
або якщо V вимірюється в мл, то
![]()
3). В об’ємних методах аналізу при титруванні, а також в науковій літературі використовують спосіб вираження концентрації – молярна концентрація еквівалентів, який в застарілій літературі зустрічається як нормальність (N).
Молярна концентрація еквівалентів (СЕ) - це величина, що показує скільки еквівалентів розчиненої речовини міститься в 1 л розчину. Визначається як відношення кількості еквівалентів речовини до об’єму розчину.
![]() або
або
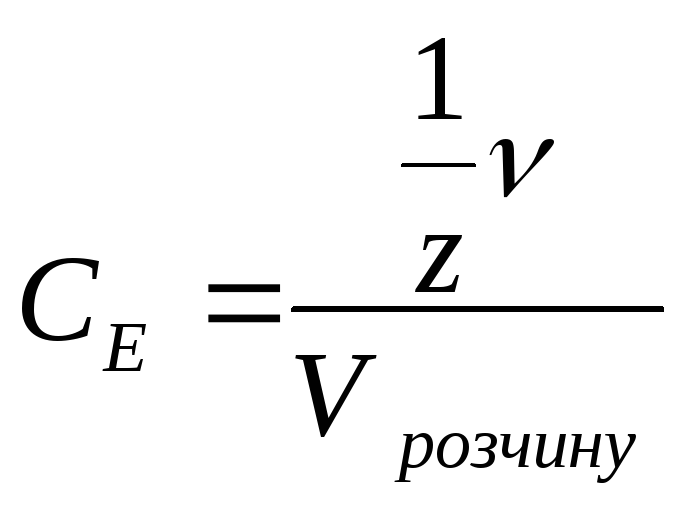
якщо
врахувати, що кількість еквівалентів
![]() , або
, або
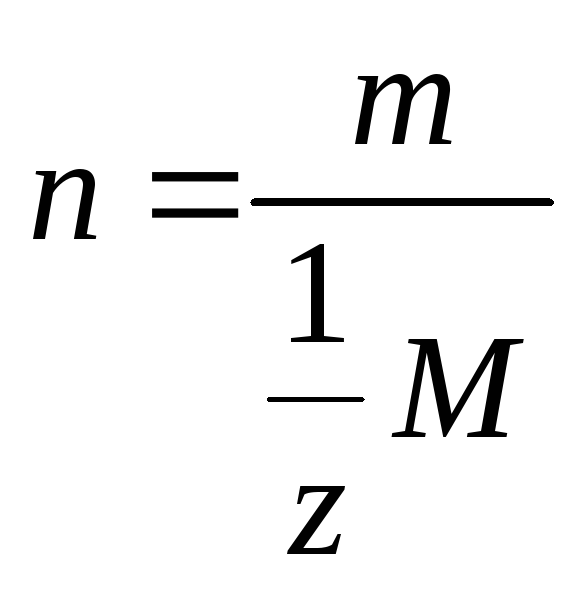
тоді:
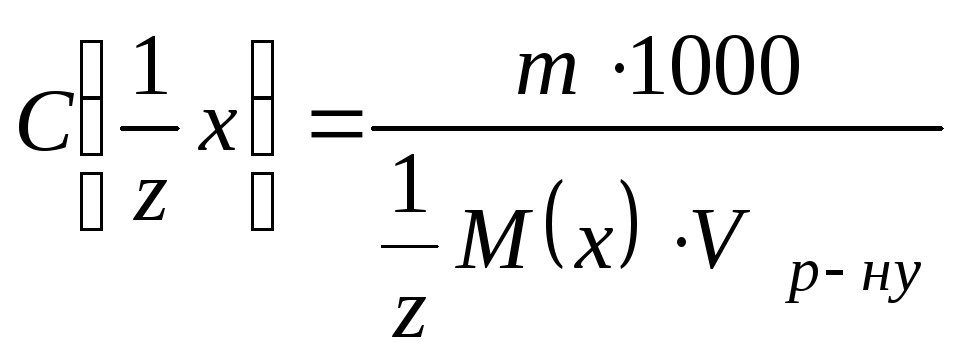
де
![]() M(x)
- молярна маса еквівалентів
M(x)
- молярна маса еквівалентів
V- об’єм розчину, мл
m- маса розчиненої речовини, г.
Виражають молярну концентрацію еквівалентів розчину в моль-екв./л, або в моль/л чи моль/дм3 .
4). Масова концентрація — це відношення маси розчиненої речовини в розчині до об’єму розчину. Одиницями вимірювання можуть бути кг/м3, г/см3,г/л, г/мл. Найбільш поширеним виразом масової концентрації є титр, що виражає кількість грам розчиненої речовини в 1 мл розчину.
![]() г/мл
г/мл
Якщо
відомо СЕ
, то Т=![]()
Звідки
СЕ=![]()
5). Моляльна концентрація (моляльність) - це відношення кількості речовини (моль) до маси розчинника, або кількість молів речовини в 1000 г розчинника (найчастіше Н2О).
![]()
![]()
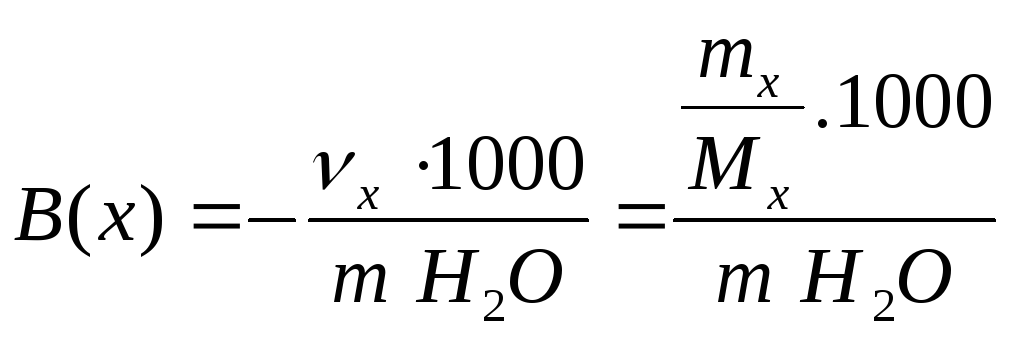
де В(х) - моляльна концентрація речовини х в моль/кг;
mx- маса речовини в г;
Мх- молярна маса речовини х, г/моль;
mН2О- маса розчинника в г.
Приклад перерахунку концентрації розчину, вираженої в масових частках на молярну концентрацію.
Яка молярна концентрація розчину питної соди, якщо його масова частка 2,5%, а густина 1,02 г/см3?
Розв’язування задач здійснюється послідовною відповіддю на поставлені питання:
1) Що необхідно знайти?
2) Що дано в умові для цього?
Питна
сода - це гідрокарбонат натрію NaHCO3.
Молярну концентрацію розчину визначють
як кількість молів речовини в 1
л
розчину
![]()
Отже,
для того,
щоб
розв’язати цю задачу необхідно визначити
кількість молів розчину ν=![]() і об’єм розчинуV.
і об’єм розчинуV.
В умові задачі дано, що ω=2,5 %. Якщо розчин має масову частку 2,5 %, то це означає, що в 100 г розчину міститься 2,5 г соди. Отже, можна прийняти, що m (NаНСОз) =2,5 г, а m розчину=100 г.
Знайдемо
кількість молів соди:
![]()
M(NаНСОз) = 23+1+12+3.16= 84 г/моль
ν
=
![]() =0,03
моль
NаНСО3
=0,03
моль
NаНСО3
Знайдемо
об’єм 100
г
розчину використовуючи, що ρ=![]() звідки:
звідки:
V=![]() = 100
г
: 1,02
г/см3
=
98,04 см3
=
0,098 л
= 100
г
: 1,02
г/см3
=
98,04 см3
=
0,098 л
Отже, тепер можна визначити молярну концентрацію розчину:
![]()
Задачу можна розрахувати іншим способом:
Масова частка цього розчину:
![]() (1)
(1)
Молярна концентрація цього розчину:
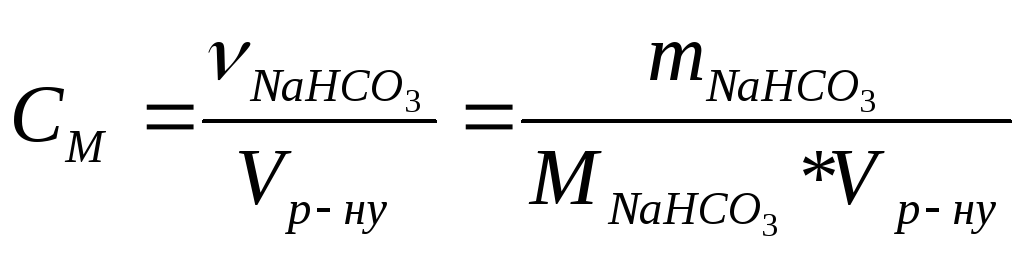 (2)
(2)
Знайшовши із рівності (1) m(NaHCO3) і підставивши її у рівність (2), одержимо:
![]()
![]()
Проведемо обчислення:
![]()
Задачі для самостійної роботи студента:
1. Розрахуйте масу хлориду натрію, яка необхідна для приготування 250 мл фізіологічного розчину з масовою часткою 0,9 % ( ρ=1 г/см3). Визначте молярність і титр розчину.
2.Який об’єм 5 % гіпертонічного розчину хлориду натрію (ρ=1,05 г/м3) можна приготувати з фіксаналу, який містить наважку 0,1 моль речовин.
3. В 100 мл спирту (ρ=0,8 г/см) розчинено 5,4 г йоду. Чому дорівнює масова частка йоду в розчині (%) ?
4. З 4,2 г гідрокарбонату натрію приготували 250 мл розчину. Розрахуйте молярність розчину. Чому дорівнює молярна концентрація еквівалента гідрокарбонату натрію і титр розчину?
5. Скільки грам сульфату магнію (MgSO4 7Н2О) необхідно взяти для приготування 250 мл розчину з молярною концентрацією еквівалентів 0,2 моль/л.
6. Вміст соляної кислоти в шлунковому соці складає 0,4-0,5 %. Вирахувати молярну концентрацію кислоти, прийнявши густину соку рівного 1 г/см3.
7. Скільки моль хлориду натрію міститься в 200 мл фізіологічного розчину 0,9 % NаСІ (ρ=1 г/см3).
8. Визначити масову частку (в %) розчину хлориду кальцію, молярна концентрація еквівалентів якого 0,15моль/л(ρ= 1 г/см).
