
- •Министерство образования российской федерации
- •Методические указания
- •Часть III
- •1 Окислительно-восстановительные процессы
- •1.1 Cтепень окисленности. Окисление и восстановление
- •1.2 Составление уравнений окислительно-восстановительных реакций (овр)
- •2)В нейтральной среде:
- •Контрольные задания
- •2. Электродные потенциалы
- •Контрольные задания
- •3 Гальванические элементы
- •0,01Моль 0,1моль
- •Контрольные задания
- •4. Электролиз
- •4.1. Процессы на катоде
- •4.2. Процессы на аноде
- •4.3 Законы электролиза
- •Контрольные задания
- •5 Коррозия металлов
- •6 Методы защиты металлов от коррозии
- •Контрольные задания
- •Издательство «Нефтегазовый университет»
- •625000, Г. Тюмень, ул. Володарского, 38
- •625000, Г. Тюмень, ул. Володарского, 38
2)В нейтральной среде:
K MnO4
+ Na2SO3
+ H2O
MnO2
+ KOH + Na2SO3
MnO4
+ Na2SO3
+ H2O
MnO2
+ KOH + Na2SO3
K +
+(MnO4)-
+2Na+
+(SO3)2
+H2O
MnO2
+K+
+OH-
+2Na+
+(SO3)2-
+
+(MnO4)-
+2Na+
+(SO3)2
+H2O
MnO2
+K+
+OH-
+2Na+
+(SO3)2-
( MnO4)-
+(SO3)2
+H2O
MnO2
+ OH +(SO3)2-
MnO4)-
+(SO3)2
+H2O
MnO2
+ OH +(SO3)2-
2


 (MnO4)-
+ 2H2O
+3e
= (MnO2)-
+ 4OH-
процесс восстановления
(MnO4)-
+ 2H2O
+3e
= (MnO2)-
+ 4OH-
процесс восстановления
6 -1 -4
3 (SO3)2- + H2O – 2e = (SO4)2- + 2H+ процесс окисления


-2 0
2MnO4- + 4H2O + 3SO32- + 3H2O = 2MnO2 + 8OH- + 3SO42- + 6H+
2MnO4- + 7H2O + 3SO32- = 2MnO2 + 6H2O + 3SO42- + 2OH-
2MnO4- + H2O + 3SO32- = 2MnO2 + 3SO42- + 2OH-
В молекулярном виде:
2KMnO4 + H2O + 3Na2SO3 = 2MnO2 + 3Na2SO4 + 2KOH .
3)в щелочной среде:
K MnO4
+ Na2SO3
+ KOH K2MnO4
+ Na2SO4
+ H2O
MnO4
+ Na2SO3
+ KOH K2MnO4
+ Na2SO4
+ H2O
K ++(MnO4)-+2Na++(SO3)2-
+ K+
+ OH-
2K+
+(MnO4)2-
+2Na+
+ +(SO3)2-+H2O
++(MnO4)-+2Na++(SO3)2-
+ K+
+ OH-
2K+
+(MnO4)2-
+2Na+
+ +(SO3)2-+H2O
( MnO4)-+(SO3)2-+OH-
(MnO4)2-
+(SO3)2-+H2O
MnO4)-+(SO3)2-+OH-
(MnO4)2-
+(SO3)2-+H2O
2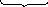


 (MnO4)-
+ 1e
= (MnO4)2-
процесс восстановления
(MnO4)-
+ 1e
= (MnO4)2-
процесс восстановления
2 -1 -2
1
 (SО3)2-
+ 2OH-
– 2e
= (SO4)2-
+ H2O
процесс окисления
(SО3)2-
+ 2OH-
– 2e
= (SO4)2-
+ H2O
процесс окисления
-4 -2
2(MnO4)- + (SO3)2- + 2OH- = 2(MnO4)2- + (SO3)2- + H2O
В молекулярном виде:
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
Контрольные задания
1. Найдите окислитель и восстановитель, расставьте коэффициенты в уравнениях реакций, идущих по схемам:
A l
+ HNO3
Al (NO3)3
+ N2O
+ H2O
l
+ HNO3
Al (NO3)3
+ N2O
+ H2O
C u
+ H2SO4конц.
CuSO4
+ H2O
+ SO2
u
+ H2SO4конц.
CuSO4
+ H2O
+ SO2
2. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях:
а

 )Cl0
Cl+7 б)Cr+3
Cr+6 в)S+6
S-2
)Cl0
Cl+7 б)Cr+3
Cr+6 в)S+6
S-2
На основании электронно-ионного баланса расставьте коэффициенты в уравнении реакции, идущей по схеме:
H 2SO4конц
+ Zn ZnSO4
+ H2O
+ H2S
2SO4конц
+ Zn ZnSO4
+ H2O
+ H2S
Укажите окислитель и восстановитель.
3. Реакции выражаются схемами:
P + H JO3
+ H2O
H3PO
+ HJ
+ H JO3
+ H2O
H3PO
+ HJ
H 2S
+ Cl2
+ H2O
H2SO4
+ HCl
2S
+ Cl2
+ H2O
H2SO4
+ HCl
Расставьте коэффициенты в уравнениях реакций на основании электронно-ионного баланса. Для каждой реакции укажите, какое вещество окисляется, какое - восстановляется, что является окислителем, а что – восстановителем.
4. В каких превращениях происходит восстановление исходных ионов:
а
 )MnO4-Mn+2г)VO3 V3+
)MnO4-Mn+2г)VO3 V3+
б
 )
Cl-
ClO4-
д) CrO2-
CrO42-
)
Cl-
ClO4-
д) CrO2-
CrO42-
в
 )
Cr2O72-
Cr3+
е) NH3
NO
)
Cr2O72-
Cr3+
е) NH3
NO
На основании электронно-ионных уравнений расставьте коэффициенты в уравнениях реакции:
а) FeSO4 + KClO3 + H2SO4 б) Fe2 (SO4)3 + KCl + H2O
5. Исходя из степени окисления хлора в соединениях HCl,HClO3 ,HClO4, определите, какое из них является только окислителем, какое – только восстановителем, какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
K 2MnO4+H2OKMnO4+MnO2
+KOH
2MnO4+H2OKMnO4+MnO2
+KOH
6. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронно-ионного баланса расставьте коэффициенты в уравнениях, идущих по схемам:
K I
+ NaNO2
+ H2SO4
NO + I2
+ H2O
+ K2SO4
+ Na2SO4
I
+ NaNO2
+ H2SO4
NO + I2
+ H2O
+ K2SO4
+ Na2SO4
K NO2
+ KMnO4
+ H2SO4
MnSO4
+ KNO3
+ K2SO4
+ H2O
NO2
+ KMnO4
+ H2SO4
MnSO4
+ KNO3
+ K2SO4
+ H2O
7. Найдите окислитель и восстановитель, расставьте коэффициенты в уравнениях реакций, идущих по схемам:
F eSO4
+ KMnO4
+H2SO4
Fe2(SO4)3
+ MnSO4
+ K2SO4
+ H2O
eSO4
+ KMnO4
+H2SO4
Fe2(SO4)3
+ MnSO4
+ K2SO4
+ H2O
K CrO2
+ Br2
+ KOH K2CrO4
+ KBr + H2O
CrO2
+ Br2
+ KOH K2CrO4
+ KBr + H2O
8. Найдите окислитель и восстановитель, расставьте коэффициенты в уравнениях реакций, идущих по схемам:
K 2Cr2O7
+ H2S
+ H2SO4
Cr2(SO4)3
+ S + K2SO4
+ H2O
2Cr2O7
+ H2S
+ H2SO4
Cr2(SO4)3
+ S + K2SO4
+ H2O
K 2MnO4
+ Cl2 KMnO4
+ KCl
2MnO4
+ Cl2 KMnO4
+ KCl
9. Найдите окислитель и восстановитель, расставьте коэффициенты в уравнениях реакций, идущих по схемам:
J 2
+ NaOH NaJO + NaJ
2
+ NaOH NaJO + NaJ
C u
+ H2SO4
CuSO4
+ SO2
+ H2O
u
+ H2SO4
CuSO4
+ SO2
+ H2O
10. Найдите окислитель и восстановитель, расставьте коэффициенты в уравнениях реакций, идущих по схемам:
H NO3
+ Zn N2O
+ Zn(NO3)2
+ H2O
NO3
+ Zn N2O
+ Zn(NO3)2
+ H2O
C r2O3
+ KClO3
+ KOH K2CrO4
+ KCl + H2O
r2O3
+ KClO3
+ KOH K2CrO4
+ KCl + H2O
11. Найдите окислитель и восстановитель, расставьте коэффициенты в уравнениях реакций, идущих по схемам:
J 2
+ Cl2
+ H2O
HJO3 +
HCl
2
+ Cl2
+ H2O
HJO3 +
HCl
H NO3
+ Ca NH4NO3
+ Ca(NO3)2
+ H2O
NO3
+ Ca NH4NO3
+ Ca(NO3)2
+ H2O
12. Составьте электронно-ионные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях:
а

 )
Cu0
Cu+2
б) N02
N+2
в) S+6
S+2
)
Cu0
Cu+2
б) N02
N+2
в) S+6
S+2
На основании электронно-ионного баланса расставьте коэффициенты в уравнении реакции, идущей по схеме:
S O2
+ NaJO3
+ H2O
NaJ + H2SO4
O2
+ NaJO3
+ H2O
NaJ + H2SO4
13. Oпределите степень окисления элементов в следующих соединениях: сульфат железа (III), нитрат алюминия, карбонат натрия. Расставьте коэффициенты методом полуреакций в уравнении реакции, идущей по схеме:
P bS
+ HNO3
S + Pb (NO3)2
+ NO + H2O
bS
+ HNO3
S + Pb (NO3)2
+ NO + H2O
14. Как меняется число электронов в атомах при следующих степенях окисления:
а

 )
S+4
S-2 б)
S-2
S+6 в)
Mn+4
Mn+7
)
S+4
S-2 б)
S-2
S+6 в)
Mn+4
Mn+7
В каких случаях идет окисление, а в каких восстановление? На основании электронно-ионных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
H 3AsO3
+ KMnO4
+ H2SO4
H3AsO4
+ MnSO4
+ K2SO4
+ H2O
3AsO3
+ KMnO4
+ H2SO4
H3AsO4
+ MnSO4
+ K2SO4
+ H2O
15. Почему сернистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронно-ионных уравнений расставьте коэффициенты в уравнениях реакций, идущих по схемам:
N a2SO3
+ KClO3
KCl + Na2SO4
a2SO3
+ KClO3
KCl + Na2SO4
H 2SO3
+ H2S
H2O
+ S
2SO3
+ H2S
H2O
+ S
16. Исходя из степени окисления фосфора, хрома, серы в соединениях PH3,K2Cr2O7,H2SO3, определите, какое из них окислитель, какое восстановитель, а какое может проявлять как окислительные, так и восстановительные свойства. Почему? Расставьте коэффициенты в уравнениях реакции, идущей по схеме:
N a2Cr2O7
+ NaNO2
+H2SO4
Cr2(SO4)3
+NaNO3
+ Na2SO3
+ H2O
a2Cr2O7
+ NaNO2
+H2SO4
Cr2(SO4)3
+NaNO3
+ Na2SO3
+ H2O
17. Завершите составление уравнений следующих реакций и расставьте коэффициенты:
N aNO3
+ NaJ + H2SO4
NO + J2
+…
aNO3
+ NaJ + H2SO4
NO + J2
+…
C r2(SO4)3
+ FeSO4
+ H2SO4
Cr2(SO4)3
+ Fe2(SO4)3
+ …
r2(SO4)3
+ FeSO4
+ H2SO4
Cr2(SO4)3
+ Fe2(SO4)3
+ …
18. Завершите составление уравнений следующих реакций и расставьте коэффициенты:
Z n
+ HNO3
N2
+ Zn(NO3)2
+ …
n
+ HNO3
N2
+ Zn(NO3)2
+ …
C r2(SO4)3
+NaOH + Cl2
NaCl + Na2CrO4
+ …
r2(SO4)3
+NaOH + Cl2
NaCl + Na2CrO4
+ …
19. Составьте уравнение следующих окислительно-восстановительных реакций, если известны конечные степени окисления элементов:
C +HNО3конц.(C+4,N+2)
+HNО3конц.(C+4,N+2)
P H3
+ KMnO4
+ H2SO4
(Mn+2
, P+5)
H3
+ KMnO4
+ H2SO4
(Mn+2
, P+5)
20. Могут ли происходить окислительно-восстановительные реакции между веществами:
а) NH3иKMnO4б)HNO2иHJв)HClиH2Se
Почему? На основании электронного баланса расставьте коэффициенты в уравнении, идущей по схеме:
N aCrO2
+ PbO2
+ NaOH Na2CrO4
+ Na2
PbO2
+ H2O
aCrO2
+ PbO2
+ NaOH Na2CrO4
+ Na2
PbO2
+ H2O
21. Могут ли происходить окислительно-восстановительные реакции между веществами?
а) PH3 иHBrб)K2Cr2O7иH3PO3 в)HNO3 иH2S
Почему? На основании электронного баланса расставьте коэффициенты в уравнении, идущем по схеме:
A u
+ HNO3
+ HCl AuCl3
+ NO + H2O
u
+ HNO3
+ HCl AuCl3
+ NO + H2O
22. Серебряные предметы чернеют под действием сероводорода, содержащегося во влажном воздухе по схеме:
A g+H2S+O2Ag2S+H2O
g+H2S+O2Ag2S+H2O
Расставьте коэффициенты на основании электронно-ионного баланса, укажите окислитель и восстановитель.
23. Какие функции могут выполнять в реакциях окисления-восстановления атомы металлов?
Исходя из степени окисления азота в соединениях NH3,HNO2,HNO3, объясните, какое из них может быть только окислителем, какое только восстановителем, а какое может проявлять как те так и другие свойства?
Составьте уравнение реакции, идущей по схеме:
K MnO4
+ H3PO3
+ H2SO4
MnSO4
+ H3PO4
+ K2SO4
+ H2O
MnO4
+ H3PO3
+ H2SO4
MnSO4
+ H3PO4
+ K2SO4
+ H2O
24. В чем состоит сущность процессов окисления и восстановления? Как называются вещества, отдающие электроны, принимающие электроны? Исходя из степени окисления хлора в соединениях HClO4,KClO3,HClO,HCl, объясните, какое из них проявляет только окислительные, а какое только восстановительные свойства. Составьте уравнение реакции, идущей по схеме:
C r2O3
+ KNO3
+ KOH K2CrO4
+ KNO2
+ H2O
r2O3
+ KNO3
+ KOH K2CrO4
+ KNO2
+ H2O
25. Что называется степенью окисления? Чему равна степень окисления простого вещества?
Исходя из степени окисления серы в соединениях H2SO4,K2SO3,H2S, объясните, какие из них могут быть только окислителями, а какие только восстановителями, а также какие могут проявлять и окислительные, и восстановительные свойства?
Составьте уравнение реакции, идущей по схеме:
P +HNO3+H2OH3PO4+NO
+HNO3+H2OH3PO4+NO
26. Как изменяются восстановительные свойства элементов в периодах периодической системы Д.И. Менделеева? Исходя из степени окисления фосфора в соединениях PH3,H3PO4,H3PO3, объясните, какие из них могут быть только окислителями, а какие только восстановителями, а также какие могут проявлять и окислительные, и восстановительные свойства? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
P bS
+ HNO3
S + Pb(NO3)2
+ NO + H2O
bS
+ HNO3
S + Pb(NO3)2
+ NO + H2O
27. Какие химические реакции относятся к окислительно-восстановительным? Какими признаками это определяется? Чем объясняется их «двойное» название?
Составьте электронно-ионные уравнения и укажите, какой процесс (окисление или восстановление) происходит при следующих превращениях:
а

 )Mn2+ Mn+6б)Cl+5Cl-в)N-3N+5
)Mn2+ Mn+6б)Cl+5Cl-в)N-3N+5
На основании электронного баланса расставьте коэффициенты в уравнении, идущем по схеме:
N aCrO2
+ PbO2
+ NaOH Na2CrO4
+ Na2PbO2
+ H2O
aCrO2
+ PbO2
+ NaOH Na2CrO4
+ Na2PbO2
+ H2O
