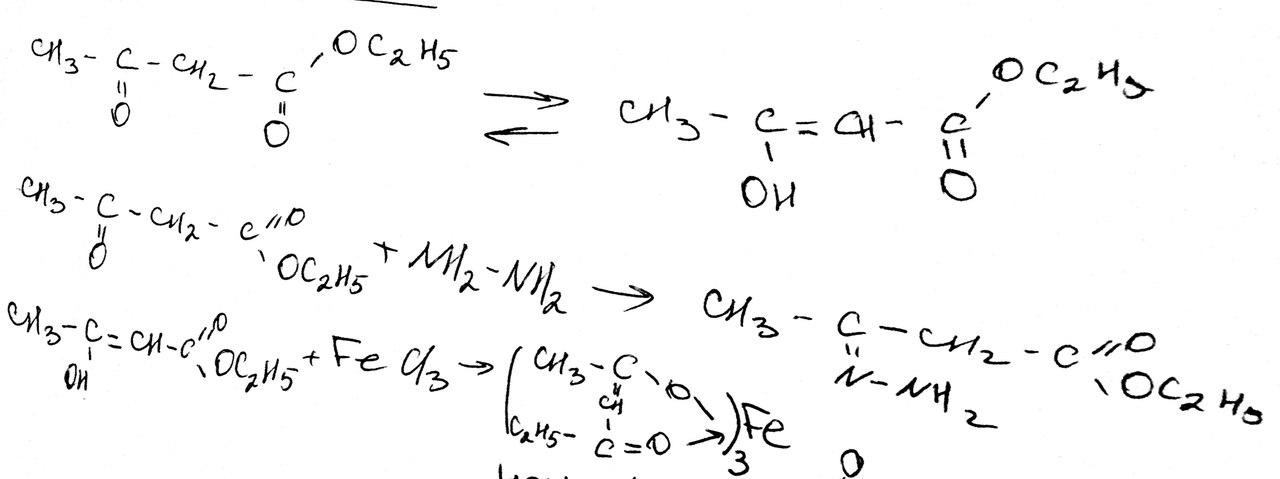- •I. Аминокислоты с неполярными (гидрофобными) r-группами (8):
- •II. Аминокислоты с полярными (гидрофильными) незаряженными
- •III. Аминокислоты с полярными (гидрофильными) положительно заряженными радикалами (3):
- •IV. Аминокислоты с полярными (гидрофильными) отрицательно заряженными радикалами (2):
- •1. Окисление
- •Галактаровая и др.) кислоты
- •1. Окисление
- •1. Окисление
- •Галактаровая и др.) кислоты
1. Окисление
а) мягкое (см. лабораторные работы)



Cu2O

t°

 +
Сu(OH)2
+ CuOH
+
Сu(OH)2
+ CuOH
H2O
альдоновые кислоты (глюконовая,
галактоновая и др.)


2Ag(NH3)2OH
 +
3NH3 +
H2O +
2Ag
+
3NH3 +
H2O +
2Ag
t°
б)
жесткое:
альдаровые (глюкаровая,
Галактаровая и др.) кислоты
в) ферментативное:



фермент
альдуроновые (глюкуроновая,
галактуроновая и др.)
2. Восстановлениемоноз проводят под действием водорода в присутствии катализаторов (Pt,Pd,Ni) или гидридов металлов (особенноNaBH4). Если при этом возникает новый хиральный центр, то образуется два многоатомных спирта:



+2H2
 Pt
+
Pt
+
D–фруктозаD-cорбитD–маннит
3. Дегидратация моноз(см. лабораторную работу).
При
действии минеральных кислот на
моносахариды (пентозы или гексозы)
происходит отщепление воды с образованием
фурфурола (из пентоз) или
5-гидроксиметил-фурфурола (из гексоз):

Ванилин-,D–глюкопиранозид
(ваниль)
Кверцитрин
(анютины глазки,
роза, чай, хмель, дуб) – гликозид
L-рамнозы
Арбутин
(толокнянка, 
брусника)
Понятие о полипептиднах и первичной структуре белка. Напишите трипептид, АЛА-ГИС-ГЛН дайте характеристику физико – химических свойств данного полипептида.


Билет №26. (Комплект 2)
Молекулярно – кинетические свойства гидрофобных коллоидных растворов: броуновское движение, диффузия, осмос, оптические свойства. Диализ, его применение в медицине. Агрегативная и седиментационна устойчивость коллоидных растворов.
Молекулярно – кинетическая свойства к ним относятся свойства, связанные с тепловым движением частиц: броуновскоедвижение, диффузия, осмос. Эти свойства зависят от размеров и массы частиц дисперсной фазы (броуновское движение и диффузия), а также от числа частиц в единице объема системы (осмотическое давление).
Броуновское движение –беспорядочное движение микроскопических видимых, взвешенных в жидкости или газе частиц твердого вещества, вызываемое тепловым движением частиц жидкости или газа.
Диффузией в растворе называется самопроизвольный направленный процесс переноса частиц растворенного веществ и растворителя, который осуществляется при наличии градиента концентрации растворенного вещества и приводит к выравниванию концентрации этого вещества по всему объему раствора.
Осмосом называется самопроизвольная диффузия молекул растворителя сквозь мембрану с избирательной проницаемостью.
Оптические свойства. Специфическим свойством коллоидных растворов является их способность рассеивать свет. Это обусловлено гетерогенностью коллоидных систем и размерами коллоидных частиц.
Грубодисперсные системы, размеры частиц в которых значительно превышают длины волн видимого света, отражают свет и поэтому выглядят мутными.
Если размеры коллоидных частиц соизмеримы с длинами волн видимого света, то такие коллоидные растворы рассеивают свет вследствие явления дифракции.
Эффект Тиндаля (конус) при точечном боковом.
Обычное боковое освещение – голубоватая опалесценция раствора.
Отчистка коллоидных растворов от истинно растворенных веществ основывается на том, что относительно крупные коллоидные частицы, в отличие от молекул и ионов, не проникают сквозь поры животных и растительных мембран.
Диализ – процесс очистки коллоидных растворов от ионов и молекул низкомолекулярных примесей результате их диффузии в чистый растворитель сквозь полупроницаемую мембрану. (Очень медленно, чтобы увеличить скорость нужно увеличить градиент концентраций растворенных веществ по обе стороны).
Для ускорения очистки коллоидных растворов от ионов растворенных электролитов используют также метод электродиализа. В этом случае во внешний сосуд помещают электроды и подают постоянный электрический ток.
Электродиализ – это диализ в условиях наложения постоянного электрического поля, под действие которого катионы и анионы приобретают направленное движение к электродам.
В биологических жидкостях количественное определение низкомолекулярных веществ часто проводят методом компенсационного диализа, или вивидиализа. В этом случае биологическая жидкость в диализаторе омывается не чистым растворителем, а растворами с различными концентрациями определяемого вещества.
По принципу диализа работает аппарат «искусственная почка», применяемая при острой почечной недостаточности, которая может наступить в результате отравления сулемой, сульфаниламидными препаратами, при уремии после переливания крови, при тяжелых ожогах и т.п.
Устойчивость дисперсных систем характеризует способность дисперсной фазы сохранять состояние равномерного распределения частиц дисперсной фазы во всем объеме дисперсионной среды.
В дисперсных системах различают седиментационную и агрегативную устойчивость.
Седиментационная устойчивость характеризует способность частиц дисперсной фазы находиться во взвешенном состоянии и не оседать под действием сил тяжести.
Агрегативная устойчивость характеризует способность частиц дисперсной фазы противодействовать их слипанию между собой и тем самым сохранять неизменным свои размеры.
Грубодиспперсные системы гетерогенны и неустойчивы. Они самопроизвольно расслаиваются на дисперсную фазу и дисперсионную среду, так как относительно крупные частицы дисперсной фазы под действием сил тяжести оседают (седиментируют).
Расклинивающее давление – характеризует состояние тонкого слоя (пленки) жидкости или газа в промежутке между поверхностями тел. Составляющее:
- Электростатическое отталкивание одновременно заряженных частиц за счет большого скопления противоионов в области контакта ионных атмосфер;
- Расклинивание за счет упругих свойств гидратных оболочек, окружающих противоионы и состоящих из ориентированных (упорядоченных) диполей воды;
- Расклинивание за счет осмотического всасывания молекул растворителя в область контакта ионных атмосфер, т.е. в область большого скопления противоионов.
Учебник: 716 – 720.
Оксокислоты. Общие химические свойства. Реакции на карбонильную и карбоксильную группы. Взаимодействие пировиноградной кислоты с Н2, NH2 – NH2, C6H5 – NH2, C6H5OH иNaOH.
Оксокислоты - называют соединения, содержащие в молекуле одновременно карбоксильную и альдегидную (или кетонную) группы. Они проявляютобщие свойства, присущие альдегидам или кетонам и кислотам, но как кислоты они сильнее соответствующих карбоновых кислот (сказывается –Iэффект карбонильной группы)
П Специфические свойства, обусловленные взаимным влиянием
>C=Oи -COOHгрупп:
1. Расщепление - и- оксокислот при нагревании – декарбоксилирование:
ˉ
 +
+
t°, H2SO4разб.
+
+
t°, H2SO4разб.
а) + CO2
ˉ
t°
комн.
 б)
+ CO2
б)
+ CO2
2. Кето-енольная таутомерия -оксокислот.
+



:
–
кето-форма
енольная форма
ацетоуксусная
кислота (АУК)
Реакции
на карбоксильную группу 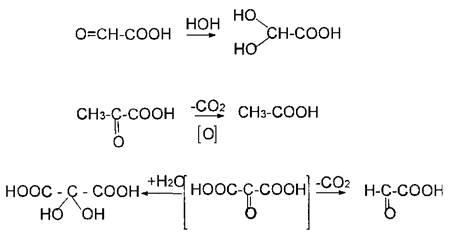

Аминокислоты. Классификация альфа – аминокислот на основные
физико- химические свойства их радикалов. Примеры каждого класса. Строение. Название. Поведение в водных растворах. Понятие о биполярных ионах. Влияние рН среды на суммарный заряд аминокислот, пептидов. Изоэлектрическая точка.
Аминокислотаминазываются органические соединения, содержащиекарбоксильную и аминогруппу: (NH2)m-R –(COOH)n
Классификация:
1) по количеству СООН- и NH2-групп аминокислоты делятся на моноаминокарбоновые, диаминокарбоновые, моноаминодикарбоновые и т.д.
2) по взаимному расположению двух функциональных групп: ,,- и т.д. аминокислоты.
Изомерия: 1) по строению углеродного скелета; 2) оптическая (стерео) изомерия.
Формула Название Биологическая роль
NH2-CH-COOH* - аланин Входит в состав пеп-
(- аминопро- тидов, белков
СН3 пионовая кислота)
H2N-CH2-CH2-COOH -Аланин Входит в состав
(-аминопро- пантотеновой кислоты
пионовая кислота) (витамина В3)
H2N-CH2-CH2- СН2 –COOH -Аминомасляная Природный транкви-
кислота (ГАМК) лизатор
Примечание: * - оптически активна
С биологической точки зрения огромное значение имеют - аминокислоты. Это «кирпичики», из которых построены молекулы белка –протеиногенные аминокислоты. Основным источником- аминокислот для живого организма служат белки пищи. Большинство- аминокислот синтезируются в организме, но некоторые, необходимые для синтеза белков, не синтезируются в организме или синтезируются в недостаточном количестве и должны поступать извне. Такие аминокислоты называются незаменимыми, это:
Валин, лейцин, изолейцин, фенилаланин, метионин, триптофан, треонин, лизин, гистидин, аргинин.
Классификация -аминокислот.
Общая структурная формула протеиногенных аминокислот:
|
H2N-CH-COOH |
R
Специфические свойстваобусловлены взаимным влиянием двух функциональных групп.-,- и- Аминокислоты при нагревании вступают в реакции, аналогичные реакциям соответствующих оксикислот.
- Аминокислоты при нагревании образуют дикетопиперазины.
Реакция идет межмолекулярно через промежуточное образование дипептидов:
дипептидов:

Дикетопиперазин
2. -Аминокислоты образуютнепредельные кислоты:
t°
 R-CH-CH2-C=O
R-CH=CH-C=O
R-CH-CH2-C=O
R-CH=CH-C=O
-NH3
NH2OHOH
3. - и-Аминокислоты образуют циклические амиды, называемые- и - лактамами. Для них характерно таутомерное превращение (лактамлактим):
t°
 R-CH-CH2-CH2-C=O
R-CH-CH2-CH2-C=O
-H2O
NH2OH
лактам

Лактим
Цвиттер-ион (биполярный ион) — молекула которая, являясь в целом электронейтральной, в своей структуре имеет части, несущие как отрицательный, так и положительный заряды, локализованные на несоседних атомах. К цвитер-ионным соединениям зачастую относят и внутримолекулярные соли (например, внутримолекулярные соли аминокислот) и, иногда, ионные диполярные соединения, в том числе и с зарядами на соседних атомах (например, N-оксиды аминов). Цвиттер-ионные соединения высокополярны и поэтому, как правило, обладают хорошей растворимостью в полярных растворителях (воде, диметилсульфоксиде и т. п.) и слабой — в большинстве органических неполярных растворителей.
Различаются они только боковыми цепями (R-группами), которые у разных аминокислот неодинаковы по структуре, суммарному заряду (полярности) и растворимости в воде (гидрофильности или гидрофобности).
Аминокислоты классифицируют на основе химического строения радикалов, хотя были предложены и другие принципы. Различают ароматические и алифатические аминокислоты, а также аминокислоты, содержащие серу или гидроксильные группы. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группу), то они называются нейтральными аминокислотами. Если же аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой.
Современная рациональная классификация аминокислот основана на полярности радикалов, т.е. способности их к взаимодействию с водой. Она включает четыре класса аминокислот:
неполярные(гидрофобные)
полярные (гидрофильные) незаряженные
отрицательно заряженные
положительно заряженные при физиологических значениях pH
Во всех - -аминокислотах, за исключением глицина,- атом углерода
связан с четырьмя различными замещающими группами и, следовательно, является асимметрическим, или хиральным. Такие молекулы встречаются в двух стереоизомерных формах и проявляют оптическую активность.
Все аминокислоты, входящие в состав молекул белков, являются L-стереоизомерами.
Водные растворы аминокислот окрашиваются в синий цвет при прибавлении небольшого количества сульфата или хлорида меди (II), в особенности после связывания образующихся при этом в растворе ионов водорода буферным раствором. Такая же окраска появляется при кипячении водного или спиртового раствора аминокислоты с окисью меди или с карбонатом меди. Водный раствор аминокислоты после обработки в нейтральной среде карбонатом, окисью, фосфатом или ацетатом меди становится темносиним и при выпаривании выделяет очень красивые кристаллы. Образующиеся соединения в водном растворе ионизованы слабо и, вероятно, представляют собой комплексы, в которых медь связана не только карбоксильной группой, но также, при помощи вторичных валентных связей, азотом. Обычно принято считать, что в этих комплексах на 2 молекулы аминокислоты приходится 1 атом меди.
Влияние рН средына ионизацию аминокислот. Изменение рН среды от кислой до щелочной влияет на заряд растворенных аминокислот. В кислой среде (рН<7) все аминокислоты несут положительный заряд (существуют в виде катиона), так как избыток протонов в среде подавляет диссоциацию карбоксильной группы:

В кислой среде аминокислоты в электрическом поле движутся к катоду.
В щелочной среде (рН>7), где имеется избыток ионов ОН-, аминокислоты находятся в виде отрицательно заряженных ионов (анионов), так как диссоциирует NН+3-группа:
![]()
В этом случае аминокислоты перемещаются в электрическом поле к аноду.
Следовательно, в зависимости от рН среды аминокислоты имеют суммарный нулевой, положительный или отрицательный заряд.
Состояние, в котором заряд аминокислоты равен нулю, называется изоэлектрическим. Значение рН, при котором наступает такое состояние и аминокислота не перемещается в электрическом поле ни к аноду, ни к катоду, называется изоэлектрической точкой и обозначается рНI. Изоэлектрическая точка очень точно отражает кислотно-основные свойства разных групп в аминокислотах и является одной из важных констант, характеризующих аминокислоту.
Изоэлектрическая точка неполярных (гидрофобных) аминокислот приближается к нейтральному значению рН (от 5,5 для фенилаланина до 6,3 для пролина), у кислых она имеет низкие значения (для глутаминовой кислоты 3,2, для аспарагиновой 2,8). Изоэлектрическая точка для цистеина и цистина равна 5,0, что указывает на слабые кислотные свойства этих аминокислот. У основных аминокислот — гистидина и особенно лизина и аргинина — изоэлектрическая точка значительно выше 7.
Билет №29.
Хлорсеребряный электрод сравнения.
Хлорсеребряный электрод состоит из серебряной проволоки, покрытой слоем малорастворимой соли AgCl, опущенной в раствор KClопределенной концентрации (обычно насыщенный раствор KCl) и солевого мостика, соединяющего этот раствор с исследуемым раствором.
В хлорсеребряном электрода на межфазной границе протекает следующая реакция:
AgCl (т) + e-⇌Ag(т) + Cl-.
Так как активность твердых веществ AgClиAg постоянна, то потенциал хлорсеребряного электрода зависит от активности ионов Cl- в растворе.
хл. сер. = 0,197 В.
Анод – осадок
Каток – растворение, распад
Учебник:671 – 672.
Оксикислоты. Структура молочной, яблочной , винной, лимонной, β гидроксимасляной кислоты. Химические свойства. Реакция образования солей и сложных эфиров. Их названия по кислотным остаткам. Биологическая роль.
Оксикислоты–карбоновые кислоты, в которых одновременно содержатсякарбоксильнаягидроксильная группы. Проявляют общие свойствва спиртов и кислот. В зависимости от реагентов и условий проведения реакции. Гидроксикислоты проявляютспецифические свойства, которые обусловлены взаимным влиянием ОН- и СООН- групп.Например, своеобразная реакция отщепления воды при нагревании.
Она
позволяет отличить -,-,-
и другие гидроксикислоты.

а)
t°


гидролиз + 2H2O
+
H+ или OH-
б)


t°

-H2O
-оксимасляная кислота кротоновая кислота
в)
t°


 +
H2O
+
H2O
гидролиз
H+
-гидроксимасляная - бутиролактон
кислота (ГОМК)
ГОМК обладает наркотическим действием, нетоксична, применяется в виде натриевой соли как снотворное средство и при неингаляционном наркозе при операциях.
г)


t°

 +
H2O
+
H2O
гидролиз
H+
-гидроксивалериановая - валеролактон
лактон
Лактиды и лактоны могут гидролизоваться в кислой среде с образованием исходных гидроксикислот.
2. Разложение -гидроксикислот при нагревании в присутствии H2SO4:

t°, H2SO4
 CH3–CHO
+ HCOOH
CH3–CHO
+ HCOOH
Многоосновные кислоты ведут себя так же. Например,
а) при нагревании лимонная кислота будет вести себя как -гидроксикислоты:


t°


-Н2О
лимонная
кислота цис-аконитовая
к-та
+ Н2О

против правила
Марковникова
изолимонная кислота
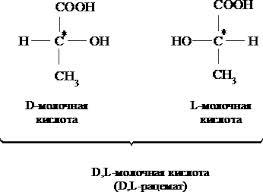
Молочная (α – гидроксипропионовая (лактаты)) ИЮПАК – 2 гидроксипропановая (2х атомная и одноосновная) является продуктом жизнедеятельности ряда бактерий. Используется как консервант, предохраняющий от продуктов гниения. Встречается в виде 2х стереоизомерных форм

Яблочная –α гидроксиянтарная (малаты) ИЮПАК 2 гидроксибутандиовая 3 атомная 2 основная . в рябине, яблоках. Один из продуктов распада углеводов в организме. Соли железа (малаты) применяются в медецине при малокровии. Существ в виде 2х формах.

Винная
(виноградная), или,-дигидроксиянтарная
кислота (тартраты) 2,3-дигидрокси
бутандиовая кислота 4х атомная 2 основная.
Винная кислота — распространённое
природное соединение. В значительном
количестве она содержится в
кисломсокемногих
фруктов, например, ввиноградномсоке.
Соли винной кислоты — тартраты
При пиролизе D-винная кислота декарбоксилируется с образованием пировиноградной СН3СОСООН и пировинной (метилянтарной) НООССН(СН3)СН2СООН кислот. Она восстанавливается до янтарной кислоты, восстанавливает аммиачный раствор AgNO3 до Ag; в щелочной среде растворяет Сu(ОН)2 с образованием прозрачного ярко-синего раствора - реактива Фелинга. Применяется в пищевой промышленности (пищевая добавка Е334), в медицине, ваналитической химиидля обнаружения альдегидов, сахаров и др., в химической и фармакологической промышленности для разделения рацематов органических веществ на изомеры.Соливинной кислоты (тартраты) используются в медицине, при крашениитканей
Лимонная,
или-гидрокси--карбокси-глутаровая
(цитраты) 3-гидрокси-3-карбоксипентандиовая
4х атомная 3 основная. Соли и эфиры
лимонной кислоты называютсяцитратами.
Лимонная кислота, являясь главным
промежуточным продуктом метаболическогоцикла
трикарбоновых кислот, играет важную
роль в системе биохимических
реакцийклеточного
дыханиямножества организмов.
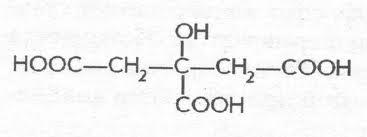
Β - гидроксимасляная 1-3гидроскибутановая - как промежуточный продукт окисления жирных кислот накапливается в организме у больных сахарным диабетом, являясь, в свою очередь, предшественником ацетоуксусной кислоты.
Сложные эфиры можно рассматривать как производные кислот, водород карбоксильной группы которых замещен радикалом (R'). Их можно также рассматривать как производные спиртов, в молекуле которых водород гидроксила замещен остатком кислоты.
Получение сложных эфиров сводится к взаимодействию соответствующих спирта и кислоты в присутствии водоотнимающих средств или действием на спирт ангидридов кислот (амил-нитрит).
Низкомолекулярные сложные эфиры - подвижные жидкости с характерным специфическим запахом, высокомолекулярные - твердые вещества. Все сложные эфиры нерастворимы в воде и хорошо растворимы в органических растворителях. Если эфир образован кислотой, которая является окислителем, то он взрывоопасен, так как возможно внутримолекулярное окисление спирта, например, нитроглицерин.
Характерным свойством сложных эфиров является их способность легко гидролизоваться. Гидролиз катализируется присутствием щелочей, кислот, нагреванием, присутствием окислителей и восстановителей
Глицерин тринаитрат глицерина тринаитрат глицерина взрычатое в-во. В малых концентрациях ( в виде 1% раствора в этаноле) прим как сосудорасширяющее средство.
СН2ОН
СН2О
-NO2
 СН2ОН
3НNO3 H2SO4
СНО -NO2
+ 3H2SO4
(3NO2HSO4 вначале)
СН2ОН
3НNO3 H2SO4
СНО -NO2
+ 3H2SO4
(3NO2HSO4 вначале)
СН2ОН
-3H2 OСН2О -NO2

3) Аминокислоты. Декарбоксилирование гистидина и лизина
Билет №29.
Понятие о диффузии. Осмос. Осмотическое давление и факторы, влияющие на его величину. Закон Вант-Гоффа. Изотонический коэффициент, его значения для разбавленных растворов различных веществ. Сравните при одинаковой температуре и молярной концентрации осмотическое давление растворов следующих веществ:
а)NaCl, C6H12O6, CaCl2;
б)CH3COOH, KCl, C2H5OH
Диффузией в растворе называется самопроизвольный направленный процесс переноса частиц растворенного веществ и растворителя, который осуществляется при наличии градиента концентрации растворенного вещества и приводит к выравниванию концентрации этого вещества по всему объему раствора.
Осмосом называется самопроизвольная диффузия молекул растворителя сквозь мембрану с избирательной проницаемостью.
Осмотическим давлением (π) называют избыточное гидростатическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя сквозь мембрану с избирательной проницаемостью.
Факторы: число частиц в растворе, температура.
Закон Вант-Гоффа: «Осмотическое давление подчиняется объединенному газовому закону Менделеева – Клайперона π=icRT»
Изотонический коэффициент – для учета межмолекулярных взаимодействий в реальных растворах
i=
Для растворов неэлетролитов, молекулы которых не диссонируют и мало склонны к ассоциации, i = 1.
Для водных растворов электролитов вследствие диссоциации I> 1, причем максимальное его значении (Imax) для данного электролита равно числу ионов в его молекуле. NaClimax= 2, CaCl2imax=3, Na3PO4imax=4, Al2(SO4)3 = 5.
Для растворов, в которых вещество находится в виде ассоциатов, i< 1, что характерно для коллоидных растворов. Для растворов белков и ВМС величина i зависит от концентрации и природы этих веществ.
Сравните при одинаковой температуре и молярной концентрации осмотическое давление растворов следующих веществ:
а)NaCl, C6H12O6, CaCl2 (по изотоническому коэффициенту) NaCl и CaCl2 – электролиты, i для электролитов всегда > 1, следовательно, осмотическое давление электролитов NaCl и CaCl2 будет больше осмотического давления неэлетролита C6H12O6, потому что i для неэлетролитов всегда = 1. (π=icRT). Осмотическое давление CaCl2 (3) <NaCl (2) (по количеству ионов). CaCl2>NaCl>C6H12O6
б)CH3COOH, KCl, C2H5OH Осмотическое давление KCl> осмотического давления CH3COOH и C2H5OH. CH3COOH> 2, HCl = 2, C2H5OH<1. CH3COOH>HCl>C2H5OH.
Учебник: 140-142.
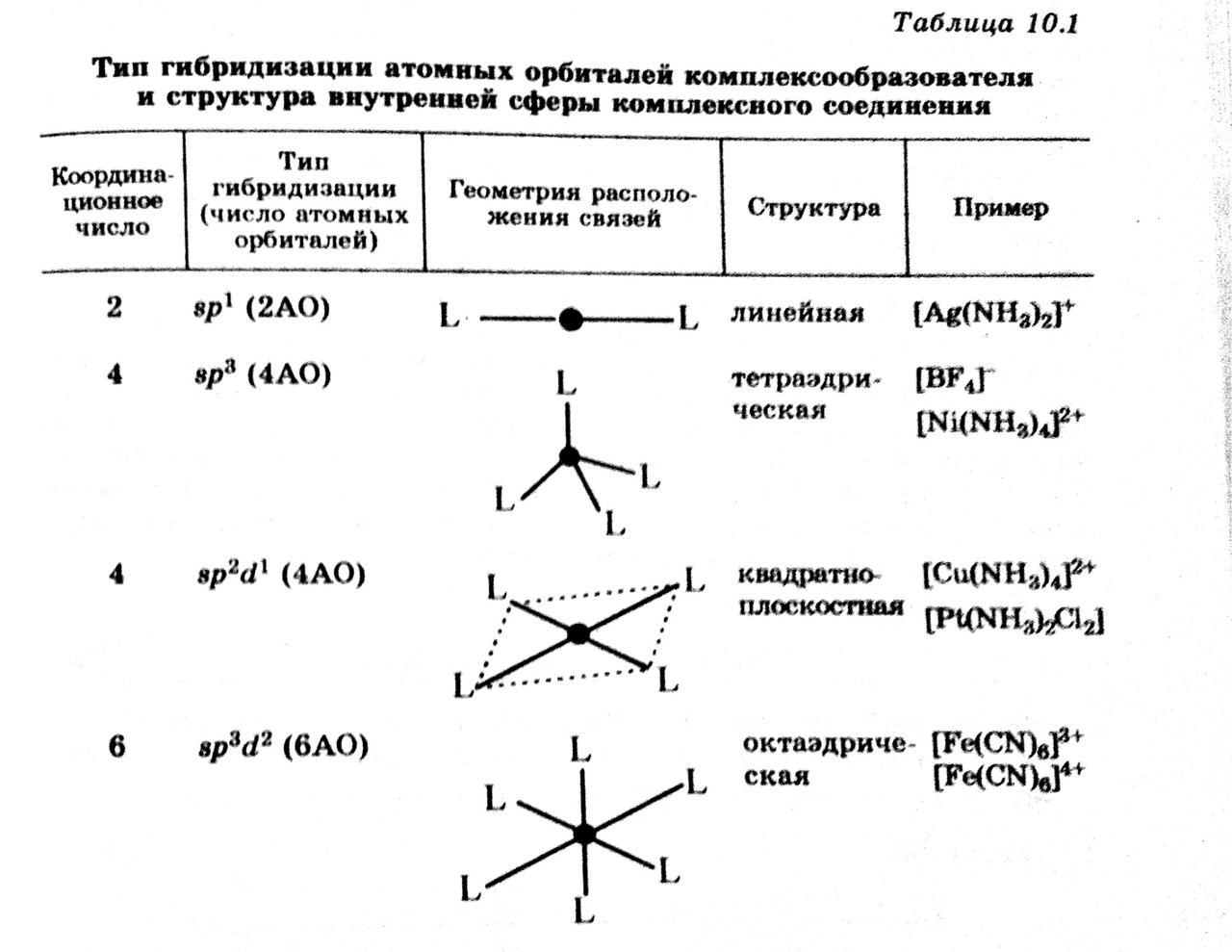
Химическая связь в комплексных соединениях. Особенности строения внутренней сферы. Жесткие и мягкие акцепторы и лиганды в теории Пирсона. Хелаты. Диссоциация комплексных соединений в растворах. Константы нестойкости.
В образовании химической связи в комплексах главную роль играет донорно – акцепторное взаимодействиелигандов (доноры) и комплексообразователя (акцептор). При этому между ними возникает ковалентная и не сильно полярная связь.
Особенности свойств внутренней сферы комплекса: строго определённое пространственное расположение лигандов вокруг комплексообразователя, и достаточно высокая устойчивость к диссоциации связи лиганда с комплексообразователем.
Структура внутренней сферы определяется типом гибридизации исходных свободных атомных орбиталей комплексообразователя.

Если два одинаковых лиганда расположены рядом, то такое соединение называется цис – изомером, если эти лиганды расположены по разные стороны от комплексообразователя, то это транс – изомер. [Pt(NH3)2Cl2] – пример.
Поляризуемость – способность трансформировать свои электронные оболочки под внешним воздействием.
По
этому признаку реагенты подразделяются
на «жесткие»,
или малополяризуемые, и «мягкие»
- легкополяризуемые. Чем меньше
радиус
и число e-
у частицы, тем менее она поляризуема.
Хелаты – устойчивые комплексы металлов с полидентантными лигандами, в которых центральный атом является компонентом циклической структуры. (глицин, этилендиаминтетрауксусная кислота (EDTA) или ее динатриевая соль, называемая трилон Б – образуют хелаты)
Диссоциация комплексов:
Первичная диссоциация комплексного соединения – это распад комплексного соединения в растворе на комплексный ион внутренней сферы и на ионы внешней сферы.
[Ag(NH3)2)]Cl [Ag(NH3)2]+ + Cl-
Вторичная диссоциация комплексного соединения – это распад внутренней сферы комплекса на составляющие ее компоненты.
[Ag(NH3)2)]+⇌[Ag(NH3)]+ + NH3 – 1 ступень
[Ag(NH3)]+⇌Ag+ + NH3 – 2 ступень
Константа нестойкости (Кнест) – константа равновесия, описывающая полную ее диссоциацию.
[Ag(NH3)2)]+ = Ag+ + 2NH3
Kнест
=

Чем меньшеKнест, тем стабильнее внутренняя сфера комплекса, т.е. тем меньше диссоциирует в водном растворе.
Учебник: 246 - 252.
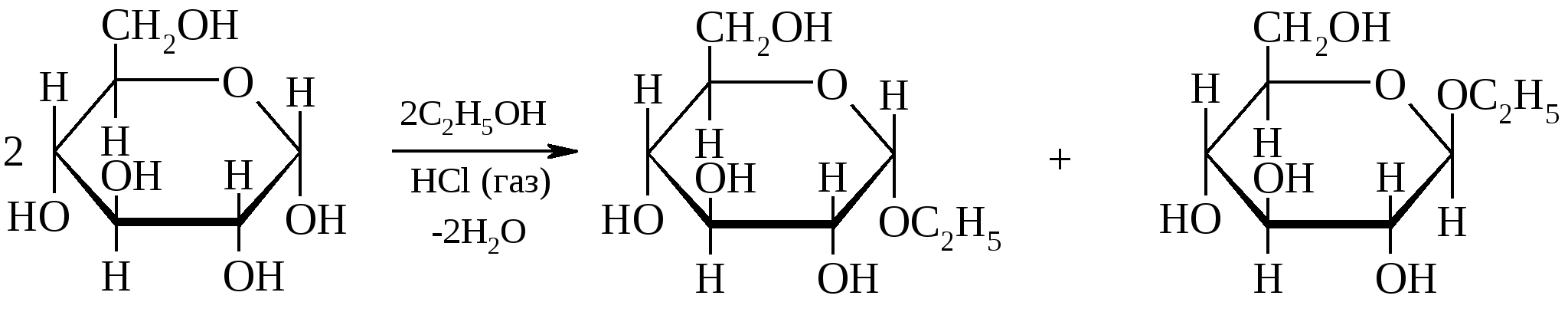
Невосстанавливающие дисахариды. Сахароза. Структура. Тип связи между моносахаридными звеньями. Номенклатура.
К этой группе принадлежит небольшое число дисахаридов, важнейшим из которых является сахароза.
Сахароза.Молекула сахарозы образована из остатков,D–глюкопиранозы и,D–фруктофуранозы, соединенных между собой 1,2–гликозидо-гликозидной связью. Нет свободных полуацетальных гидроксилов, поэтому сахароза не дает таутомерных форм, ее растворы не мутаротируют, не проявляют восстановительных свойств. Все это позволяет отнести сахарозу к невосстанавливающим дисахаридам.


Билет №30
Гидрофобные коллоидные растворы, способы и условия их получения. Строение структурных частиц дисперсной фазы. Приведите схему строения мицеллы коллоидного раствора AgI, полученного обменной реакцией между AgNO3 и KI в избытке KI. Укажите составные частицы мицеллы и причины возникновения межфазного (термодинамического) и электрокинетического потенциалов.
В биологических системах, например, в крови человека, содержится малорастворимые соли кальция, магния, а также холестерин и другие малорастворимые вещества, существующие в виде лиофобных коллоидных растворов. В литературе такие коллоидные растворы часто называют золямиили лиозолями.
Такие системы являются термодинамически неустойчивыми, в них самопроизвольно происходят процессы, сопровождающиеся уменьшением свободной энергии (ΔGs< 0).
Условия:
Малая растворимость дисперсной фазы, т.е. плохое сродство к ее дисперсионной среде;
Определенные размеры частиц дисперсной фазы (10-9– 10-6м);
Присутствие в системе стабилизатора.
Любое вещество может бытьполучено в коллоидном состоянии.
Получить коллоидный раствор можно двумя путями: измельчением крупных частиц до размеров коллоидных в присутствии стабилизатора –диспергационныеметоды – или объединением молекул и ионов в истинных растворах в более крупные коллоидные частицы –конденсационныеметоды.
Условияконденсационного метода:
- Использование достаточно разбавленных растворов;
- Небольшой избыток одного из реагирующих веществ, которое выполняет роль стабилизатора образующихся коллоидных частиц.
Лиофобные раствора обязательно требуютприсутствиестабилизатора – электролита. Ионы стабилизатора адсорбируются на их поверхности ДЭС, следовательно, обеспечивается устойчивость дисперсионной системы.
Мицеллой лиофобной системыназывается гетерогенная микросистема, которая состоит из микрокристалла дисперсной фазы, окруженного сольватированными ионами стабилизатора.
-
KI(избыток)⇌K+
+ I—
{[mAgI]*nI-(n-x)K+}*xK+
nI – потенциалопределяющий ион
(n-x)K+ - адсорбционные противоионы
xK+ - диффузные противоионы
- KNO3 (избыток) ⇌K+ + NO3-
{[mAgI]*nAg+(n-x)NO3-}*xNO3-
nAg+ - потенциалопределяющий ион
(n-x)NO3- - адсорбционные противоионы.
xNO3-- диффузные противоионы.
Ядром мицеллы лиофобного коллоидного раствора называется микрокристалл малорастворимого вещества, на поверхности которого адсорбированы потенциалопределяющие ионы, сообщающие заряд ядру мицеллы.
В мицелле с ионными стабилизатором во всякой гетерогенной системе, в которой на границе раздела фаз есть ДЭС, различают 2 потенциала:
- Межфазным потенциалом называется потенциал ДЭС на границе раздела между твердой и жидкой фазами в мицелле. Значение зависит от природы твердой фазы, а также от заряда и концентрации потенциалопределяющих ионов, адсорбированных на твердой фазе.
- Электрокинетическим потенциалом (дзета-потенциал) называется потенциал на границе скольжения между адсорбционной и диффузионной частями ЛЖС мицеллы. Значение определяется толщиной диффузного слоя, чем выше заряд противоионов и больше их концентрация, тем больше противоионов находится в плотном слое и меньше остается в диффузном слое.
Учебник: 710-715.
Строение и химические свойства фосфора и его соединений. Роль фосфатов в организме (структурообразующая и энергетическая). Взаимосвязь обмена фосфора и кальция в организме. Круговорот фосфора в природе.
В
периодической системе фосфор, как и
азот, находится в группе VA,
но вIIIпериоде. Его
электронная конфигурация 1s22s22p63s23p3.
Его электронная конфигурация приводит
к образованию трех связей. Однако, фосфор
имеет в валентном слое свободные 3d– орбитали. Поэтому при возбуждении
атома фосфора легко достигается состояние
с пятью неспаренными электронами
1s22s22p63s13p33d1,
что позволяет ему образовывать пять
связей. Таким образом, фосфор в своих
соединениях проявляет валентность 3 и
5. Степень окисления атома фосфора в
соединениях может меняться от -3 до +5.
В природе встречается только в формах, содержащих фосфат – анион PO43-. Это обусловлено тем, что фосфор образует с кислородом более прочные связи, чем с другими органогенами.
В организме фосфор встречается только в виде фосфатов, неорганических и органических. Все они имеют тетраэдрическую структуру, в которой атом фосфора расположен в центре тетраэдра, а атомы кислорода – в его вершинах.
Фосфаты в живых организмах играют две ключевые роли. Во-первых, служат структурными компонентами скелета, клеточных мембран и НК.Во-вторых, роль фосфатов, точнее полифосфатов организме заключается в аккумуляции и переносе энергии от экзэргонических к эндорганическим реакциям и процессам.
Кислотные свойства:
Из оксидов фосфора наибольшее значение имеет оксид фосфора (V)P2O5, проявляющий кислотные свойства и существующий в молекулярной формеP4O10. Главная особенность оксидаP2O5– очень большое сродство к воде. Поэтому он часто используется как эффективный осушитель для газов и органических растворителей.
Оксид фосфора (V) может присоединять одну, две, три и более молекул воды. При это образуются метафосфорная, дифосфорная или пирофосфорная, ортофосфорная и полифосфорные кислоты.
Самое замечательное свойство этих кислот – способность превращаться друг в друга в результате гидролиза (присоединения воды) или в результате дегидратации (потери воды).
Ортофосфорная кислотаH3PO4– трехосновная кислота. Она образует средние (Na3PO4) кислые (Na2HPO4иNaH2PO4) соли. В водных растворах соли ортофосфорной кислоты гидролизуются.
Совокупность кислых фосфатов HPO42-иH2PO4-образует в крови фосфатную буферную систему, которая вместе с другими буферными системами обеспечивает постоянствоpHкрови.
Обмен фосфора в организме тесно связан с обмене кальция, но эта связь антагонистична. При увеличении содержания кальция в крови наблюдается уменьшение содержания фосфатов, прежде всего неорганических.
Дифосфорная кислотаH4P2O7– хорошо растворима в воде и в растворе постепенно (а при нагревании – быстрее) превращается в ортофосфорную кислоту в результате гидролиза по ангидридной группе.
Дифосфорная кислота является более сильной, чем ортофосфорная, в соответствии с общим правилом увеличения силы кислот при их конденсации.
Фосфор присутствует в живых клетках в виде ортофосфатной и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2. В состав зубной эмали входит фторапатит. Основнуюрольв превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800—1500 мг. При недостатке фосфора в организме развиваются различные заболевания костей.
Круговорот фосфора в природе осуществляется посредством фосфатов, поэтому он не сложен, так как не сопровождается изменениями степени окисления атома фосфора. Значительная часть фосфора рано или поздно попадает в океан и откладывается в виде фосфатов в осадочных породах.
Учебник: 311 – 318.
Стереоизомерия. Диастереоизомерия и энантиомерия на примере яблочной и винной кислот D и L стереохимические ряды. Глицериновый альдегид как стандарт конфигураций D и L стереоизомеров.
Стереоизомерия- более широкое понятие структуры молекулы (сюда включают конфигурацию и конформацию, они отражают трехмерность молекулы). Молекулы, обладающие одинаковым химическим строением, на различные в пространственном строении и есть стереоизомеры (пространственные изомеры). Могут быть конфигурационными и конформационными.
Конфигурация– это порядок расположения атомов в пространстве без учета различий, возникающих из-за вращения вокруг одинарных связей. Делятся на 2 типа – энантиомеры и дистериомеры.
Энантиомеры– стереоизомеры, относящиеся друг к
другу, как предмет и несовместимое с
ним зеркальное отображение. В виде
энантиомеров могут существовать только
хиральные молекулы. Энантиомеры обладают
одинаковыми химическими и физическими
свойствами (температуры плавления и
кипения, плотность и растворимость) но
проявляют различную оптическую активность
т. е. способность отклонять плоскость
поляризованного света.
Диастереомеры– стереоизомеры, не являющиеся зеркальным отражением друг друга, обладают разными физико-химическими свойствами.
α – диастереомеры- это те которые содержат в молекуле более одного хирального центра, определяется как 2n,n- число центров хиральности. Некоторые пары стереоизомеров будут иметь противоположные конфигурации всех соответствующих стереоцентров и являться, таким образом,энантиомерами. Все остальные парные комбинации стереоизомеров будут различаться лишь некоторыми конфигурациями, не являясь зеркальными отражениями друг друга. Такие пары являются диастереомерами.
Π - диастереомеры – конфигурационные изомеры содержащие π связьπ-Диастереомеры, также называемые геометрическими изомерами, отличаются друг от друга пространственным расположением заместителей относительно плоскости двойной связи. Например,малеиноваяифумароваякислоты отличаются друг от друга взаимным расположениемкарбоксильных группу двойной связи
В
системе классификаций Глицериновый
альдегид(глицераль,
глицериновый альдегид,глицероза,
2,3-дигидроксипропаналь) принят
за стандарт. Его левовращающему
энантиомеру была присвоен а произвольно
приписная формула (I) обозначаетсяL.
Правовращающему приписана (II),
конфигурация обозначается D
D- и L-глицеральдегид представляет собой сладкое бесцветное кристаллическое вещество хорошо растворимое в воде (с образованием вязкого сиропа), малорастворимое в этаноле и диэтиловом эфире, нерастворим в неполярных растворителях. Водный раствор глицеральдегида обладает оптической активностью (вращает плоскость поляризации).
Билет №30. (2 Комплект)
Химическая связь в комплексных соединениях. Особенности строения внутренней сферы. Жесткие и мягкие акцепторы и лиганды в теории Пирсона. Хелаты. Диссоциация комплексных соединений в растворах. Константы нестойкости.
В образовании химической связи в комплексах главную роль играет донорно – акцепторное взаимодействиелигандов (доноры) и комплексообразователя (акцептор). При этому между ними возникает ковалентная и не сильно полярная связь.
Особенности свойств внутренней сферы комплекса: строго определённое пространственное расположение лигандов вокруг комплексообразователя, и достаточно высокая устойчивость к диссоциации связи лиганда с комплексообразователем.
Структура внутренней сферы определяется типом гибридизации исходных свободных атомных орбиталей комплексообразователя.
Если два одинаковых лиганда расположены рядом, то такое соединение называется цис – изомером, если эти лиганды расположены по разные стороны от комплексообразователя, то это транс – изомер. [Pt(NH3)2Cl2] – пример.
Поляризуемость – способность трансформировать свои электронные оболочки под внешним воздействием.
По
этому признаку реагенты подразделяются
на «жесткие»,
или малополяризуемые, и «мягкие»
- легкополяризуемые. Чем меньше
радиус
и число e-
у частицы, тем менее она поляризуема.
Хелаты – устойчивые комплексы металлов с полидентантными лигандами, в которых центральный атом является компонентом циклической структуры. (глицин, этилендиаминтетрауксусная кислота (EDTA) или ее динатриевая соль, называемая трилон Б – образуют хелаты)
Диссоциация комплексов:
Первичная диссоциация комплексного соединения – это распад комплексного соединения в растворе на комплексный ион внутренней сферы и на ионы внешней сферы.
[Ag(NH3)2)]Cl [Ag(NH3)2]+ + Cl-
Вторичная диссоциация комплексного соединения – это распад внутренней сферы комплекса на составляющие ее компоненты.
[Ag(NH3)2)]+⇌[Ag(NH3)]+ + NH3 – 1 ступень
[Ag(NH3)]+⇌Ag+ + NH3 – 2 ступень
Константа нестойкости (Кнест) – константа равновесия, описывающая полную ее диссоциацию.
[Ag(NH3)2)]+ = Ag+ + 2NH3
Kнест
=

Чем меньшеKнест, тем стабильнее внутренняя сфера комплекса, т.е. тем меньше диссоциирует в водном растворе.
Учебник: 246 - 252.
Углеводы. Моносахариды. Дезоксирибоза. Ее значение. Аминосахара – глюкозамин, залактозамин. Напишите реакции алкилирования и ацилирования по азоту. Назовите и опишите значение конечных продуктов.
Углеводы -углеводы входят в состав клеток и тканей всех растительных и животных организмов. В живой природе они имеют большое значение как источники энергии в метаболических процессах (в растениях-крахмал, в животных организмах-гликоген). Углеводы образуются в растениях в процессе фотосинтеза из диоксида углерода и воды. Животные организмы не способны синтезировать углеводы и получают их из растительных источников. По способности к гидролизу углеводы делятся на простые- моносахариды и сложные- полисахариды.
Моносахариды-твердые вещества, легко растворимые в воде, плохо-в спирте и совсем не растворимы в эфире. Водные растворы имеют нейтральную реакцию на лакмус. Большинство моносахаридов обладает сладким вкусом. В свободном виде в природе преимущественно встречается глюкоза. Она же является структурной единицей многих полисахаридов. Моносахариды могут существовать как в открытой, так и в циклической формах.
Моносахариды (монозы)– это многоатомные альдегидо- и кетоноспирты, не гидролизующиеся до более простых. По числу атомов углерода моносахариды подразделяют натетрозы (С4 ),пентозы (С5),гексозы (С6)и т.д. Моносахариды, содержащие альдегидную группу, называютальдозами; кетонную –кетозами.

Дезоксирибоза(C5H10O4) играет большую биологическую роль для всего живого. Она содержится в составе нуклеиновых кислот, осуществляет синтез белков в живых организмах и передачу наследственной информации.
Аминосахара-эти производные содержащие вместо гидроксильной аминогруппу, обладают основными свойствами и образуют с кислотами хорошо кристаллизующиеся соли. Одними из главных представителей аминосахаров являются 2-аминоаналогиD-глюкозы и D-галактозы.

Оксокислоты. Кето – енольная таутомерия на примере ацетоуксусного эфира и оксалилуксусной кислоты. Реакции с NH2-NH2, FeCl3
Для ацетоуксусного эфира, как и для других 1,3-дикарбонильных соединений характерна кето-енольная таутомерия: