
- •I. Аминокислоты с неполярными (гидрофобными) r-группами (8):
- •II. Аминокислоты с полярными (гидрофильными) незаряженными
- •III. Аминокислоты с полярными (гидрофильными) положительно заряженными радикалами (3):
- •IV. Аминокислоты с полярными (гидрофильными) отрицательно заряженными радикалами (2):
- •1. Окисление
- •Галактаровая и др.) кислоты
- •1. Окисление
- •1. Окисление
- •Галактаровая и др.) кислоты
1. Окисление
а) мягкое (см. лабораторные работы)



Cu2O

t°

 +
Сu(OH)2
+ CuOH
+
Сu(OH)2
+ CuOH
H2O
альдоновые кислоты (глюконовая,
галактоновая и др.)


2Ag(NH3)2OH
 +
3NH3 +
H2O +
2Ag
+
3NH3 +
H2O +
2Ag
t°
б)
жесткое:
альдаровые (глюкаровая,
галактаровая и др.) кислоты
в) ферментативное:



фермент
альдуроновые (глюкуроновая,
галактуроновая и др.)
2. Восстановлениемоноз проводят под действием водорода в присутствии катализаторов (Pt,Pd,Ni) или гидридов металлов (особенноNaBH4). Если при этом возникает новый хиральный центр, то образуется два многоатомных спирта:



+2H2
 Pt
+
Pt
+
D–фруктозаD-cорбитD–маннит
3. Дегидратация моноз(см. лабораторную работу).
При
действии минеральных кислот на
моносахариды (пентозы или гексозы)
происходит отщепление воды с образованием
фурфурола (из пентоз) или
5-гидроксиметил-фурфурола (из гексоз):

3) Оптическая активность аминокислот и кислот на примере аланина, молочной и глицериновой кислоты. (Аланин – CH3. Молочная – CH3-CH(OH)-COOH. Глицериновая - СН2ОН—СНОН—СООН)
Билет №4
Виды межмолекулярных взаимодействий, их роль в формировании агрегатных состояний веществ и структур биологических полимеров.
Межмолекулярные взаимодействие- взаимодействие между молекулами и/или атомами, не приводящее к образованию ковалентных (химических) связей.
Виды межмолекулярных взаимодействий: Ион-ионные, ион-дипольные, ориентационные (диполь-дипольные), индукционные (ион или диполь-индуцированный диполь), дисперсионные (мгновенный диполь-индуцированный мгновенный диполь), гидрофобные взаимодействия и водородные связи.
Ион-ионноевзаимодействие характерно при наличии в системе противоположно заряженных ионов и наблюдается не только для веществ с ионной кристаллической решеткой, но также в белках и нуклеиновых кислотах. Зависимость энергии взаимодействия от расстояния 1/r. Энергия колеблется в широких пределах: 140-460 кДж/моль.
Ион-дипольное взаимодействие. Этот вид взаимодействия наблюдается между ионом и полярной молекулой или полярной группой, обладающими постоянными дипольным моментом. Когда ион взаимодействует с дипольном, то к нему притягивается полюс диполя, несущий заряд, противоположный по знаку заряда иона. Зависимость энергии взаимодействия от расстояния 1/r2. Энергия взаимодействия 40-160 кДж/моль.
Ориентационное взаимодействие. Этот вид взаимодействия наблюдается между полярными молекулами, обладающими постоянным дипольным моментом. Полярные молекулы взаимно ориентируется таким образом, что отрицательный полюс одного диполя располагается вблизи положительного полюса другого диполя, что обеспечивает из взаимное притяжение. Зависимость энергии взаимодействия от расстояния 1/r6. Энергия взаимодействия 2-4 кДж/моль.
Индукционное взаимодействие наблюдается между неполярной молекулой и ионом или молекулой с постоянным диполем. Под действие электрического поля последних электронное облако неполярной молекулы деформируется, т.е. в ней индуцируется диполь. Зависимость энергии взаимодействия от расстояния 1/r4, 1/r6. Энергия взаимодействия 1-3 кДж/моль.
Дисперсионные взаимодействия. Это взаимодействие мгновенный диполь – индуцированный мгновенный диполь. Оно является самым слабым изо всех видов межмолекулярных взаимодействий, но в то же время наиболее универсальным. В чисто виде проявляется при взаимодействии неполярных молекул. Постоянное движение электронов в молекуле, а также колебание ядер вызывает появление в молекуле мгновенного диполя, под действие которого в соседней молекуле индуцируется также мгновенный диполь. Зависимость энергии взаимодействия от расстояния 1/rЭнергия взаимодействия меньше 2 кДж/моль.
Водородная связь. Ее виды и энергия. Влияние водородной связи на свойства соединений H2O, ROH, RCOOH.
Водородная связь - это взаимодействие между двумя электроотрицательными атомами одной или разных молекул посредством атома водорода. (например N,O,F). Является разновидностью донорно – акцепторной связи. Графически обозначается тремя точками.
Бывает:
- Межмолекулярная (у спиртов) связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы.
- Внутримолекулярная водородная связь объединяет части одной молекулы (Это особенно характерно для многих органических соединений).
Водородные связи играют важную роль в формировании пространственной структуры высокомолекулярных соединений. У спиртов за счет Н-свей температура кипения значительно выше, например, у этилового. Также Н-связи способствуют улучшению растворимости. При благоприятном пространственном расположении в молекуле соответствующих групп атомов, специфически влияет на свойства. У салициловой к-ты повышает ее кислотность.

Теория кислотности – основности Лоури – Бренстеда. Сравните кислотные св-ва следующих соединений:
А) 3 хлор -1 бутанол, 3 метил -1 бутанол, 2 хлор –1–бутанол(312)
Б) этиловый спирт, этиленгликоль, глицерин (321)
В) фенол, п-фторфенол, п –аминофенол (213)
Г) уксусная кислота, α – хлорпропионовая, α – фторпропионовая, β –хлорпропионовая. (3241)Дайте ответ на основе электронных эффектов заместителей подтвердите свой ответ соответствующими реакциями.
По Бренстеду-Лоури, кислоты представляют собой вещества, способные отдавать протон, а основания - вещества, присоединяющие протон. Согласно протонной теории кислот и оснований Бренстеда-Лоури, кислотно-основное взаимодействие - это процесс, который ведет к переносу протона от одной частицы (кислоты) к другой (основанию). По Бренстеду, основание - это частица, способная поделиться одной из своих электронных пар с протоном и образовать с ним ковалентную связь (протонироваться). Кислотой Бренстеда является частица, способная к отщеплению протона (депротонированию). Самой сильной кислотой является сам протон. Свободные протоны существуют лишь в газовой фазе, в растворах они связаны с тем или иным основанием, в роли которого чаще всего выступает молекула растворителя. Поэтому результатом реакции переноса протона является образование новой пары частиц кислота (В-Н+) - основание (А-):


Билет №5.
Скорость химических реакции. Понятие о средней и истинной скорости реакции, о простых и сложных реакциях. Виды сложных реакций. Влияние концентрации реагентов на скорость химической реакции. Закон действующих масс, его применении к простым и сложным реакциям.
Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени.
 =
=

Истиннаяскорость химической реакции характеризуется скорость в данный момент времени (Δt 0)
![]()
Средняя скорость химической реации по данному компоненту является усредненной скоростью за данный промежуток времени.

Простые, или элементарные, реакции– это реакции, протекающие в одну стадию.
Сложные реакции– это реакции, протекающие в несколько стадий, каждая из которых является простой реакцией.
Виды сложных реакций:
Последовательно друг за другом
Параллельно
Последовательно-параллельно
Циклически
Влияние концентрации реагентов на скорость химической реакции заключается в том, что увеличение концентрацииреагентов соответствует увеличению числа частиц в объеме, что приводит к более частым их столкновениями, а, следовательно, к увеличению скорости реакции.
Количественная зависимость скорости реакции от концентрации выражается основным постулатом химической кинетики, называемым законом действующих масс:
«Скорость простой гомогенной реакции при постоянной температуре пропорциональна произведению концентрации реагирующих веществ, возведенных в степени, численно равные их стехиометрическим коэффициентам».
![]()
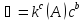 (B)
(B)
Учебник:98 - 100
Электрокинетические свойства в дисперсных системах: потенциал течения, потенциал оседания, электрофорез, электроосмос. Использование этих явлений в медицине.
Термин «электрокинетические свойства»отражает взаимосвязь между электрическим полем и взаимным перемещением частиц дисперсной фазы и дисперсионной среды в дисперсных системах. (ДЭС)
Потенциалом теченияназывается разность потенциалов, возникающая на концах капиллярной системы при протекании через систему жидкой дисперсионной среды.
При сокращениях сердечной мышцы (миокарда) кровь проталкивается через капиллярную систему, что приводит к возникновению потенциала течения. Возникновение потенциала течения объясняется тем, что при движении через капиллярную систему жидкая дисперсионная среда увлекает за собой подвижные противоионы диффузного слоя, вследствие чего на конце капиллярной системы накапливается заряд, имеющий знак противоионов.
Использования методов электроосмоса и потенциала течения дает возможность определить заряд поверхности костной ткани и других пористых или волокнистых биологических структур.
Потенциалом седиментации (оседания) называется разность потенциалов, возникающая при оседании частиц дисперсной фазы в жидкой дисперсионной среде. Возникновение потенциала седиментации объясняется тем, что при оседании частиц дисперсной фазы нижние слои дисперсной системы приобретают заряд этих частиц, а верхние слои, обогащенные противоионами диффузной части ДЭС, приобретают заряд противоионов. (ПРОТИВОПОЛОЖНЫЙ ЭЛЕКТРОФОРЕЗ)
Электрофорезомназывается направленное движение заряженных частиц дисперсной фазы относительно дисперсионной среды под действием электрического поля.
Методом электрофореза получены важные экспериментальные данные об электрохимических свойствах биологических систем. Внутренняя поверхность биологических мембран (клеточной стенки) заряжена отрицательно. Например, дзета – потенциал эритроцитов в крови человека практически постоянен и равен – 16,3 мВ.
Метод электрофореза позволяет разделять белки, аминокислоты и другие системы на отдельные фракции, пользуясь различием в скорости движения частиц дисперсной фазы в электрическом поле.
Электроосмосомназывается направленное движение дисперсионной среды (жидкости) в капиллярной системе под действием электрического тока.
Одним из широкого используемых физиотерапевтических методов лечения многих заболевания является ионофорез, в основе которого лежит проникновение жидкостей, содержащих лечебные ионы и молекулы, через капиллярную систему кожного покрова под действием электрического поля. По существу – это явление электроосмосма.
Учебник: 760 – 763.
Водородная связь. Покажите образование межмолекулярных водородных связей на примере этилового спирта, уксусной кислоты. Как это явление проявляется на физических свойствах этих соединений. Приведите примеры роли водородных связей в природных соединения.
Н-связь – это связь по типу диполь-дипольного притяжения между электроотрицательным элементом одной молекулы (таким, как O, N, F, Cl, S), являющимся отрицательным концом диполя, и атомом водорода другой молекулы, являющимся положительным концом диполя. Эта связь слабая – 4–5 ккал/моль. Ее обозначают тремя точками. За счет Н-связи молекулы, способные к ее образованию, находятся в ассоциированном состоянии. Это объясняет повышенную температуру кипения и хорошую растворимость низкомолекулярных спиртов. Водородная связь увеличивает длину связи Х-Н.
При образовании водородной связи полярность связи Х-Н возрастает, что приводит к повышению дипольного момента молекулярного комплекса в сравнении с расчетными данными, полученными путем векторного сложения диполей молекул R-X-H и B-Y.
Протоны, участвующие в водородной связи, характеризуются более низкой электронной плотностью, поэтому они деэкранируются.
А первую очередь, она оказываект влияние на физические свойства веществ. Например, метан - газ, но метанол уже жидкость (межмолекул. водородная связь), а метаналь опять газ (в ряду альдегидов межмолекулярная водородная связь невозможна) Благодаря наличию этой связи вещества приобретают такое свойство как гигроскопичность (глюкоза, фруктоза, мальтоза, сахароза, глицерин и прочие многоатомняе спирты обладают способностью поглощать влагу из воздуха благодаря наличию водородной связи).
Водородные связи играют важную роль в формировании пространственной структуры высокомолекулярных соединений. У спиртов за счет Н-свей температура кипения значительно выше, например, у этилового. Также Н-связи способствуют улучшению растворимости. При благоприятном пространственном расположении в молекуле соответствующих групп атомов, специфически влияет на свойства. У салициловой к-ты повышает ее кислотность.
Благодаря водородным связям между группами,расположенными на соседних витках спирали, образуется вторичная структура белка.

Билет №6. (3 комплект)
Энтропия системы. Факторы, влияющие на энтропию системы. Стандартная энтропия образования вещества и энтропия химической реакции. Формулировка II закона термодинамики для изолированных систем.
Энтропия (S)– термодинамическая функция, характеризующая меру неупорядоченности системы, т.е. неоднородности расположения и движения ее частиц.
Энтропия простых веществ зависит от аллотропной формы.S(Cграфит) > S(Cалмаз), S(O2) <S(O3).
Энтропия системы при повышении температуры возрастает, так как увеличивается неупорядоченность движения частиц:
Если T1>T2, то S1>S2
Энтропия системы при повышении давления уменьшается, так как снижается неупорядоченность движения частиц:
Если p1>p2, то S1<S2
Энтропия системы с увеличением ее сложности повышается, так как возрастает число видов частиц и вариантов их расположения.
Стандартная энтропия S0, т.е. энтропия при давлении р=1,01·105 Па (1 атм);
Стандартная энтропия химической
реакции ![]() т.е.
разница стандартных энтропий
продуктов и реагентов.
т.е.
разница стандартных энтропий
продуктов и реагентов.
Формулировка II закона термодинамики для изолированных систем: «В Изолированных системах самопроизвольно могут совершать только такие необратимые процессы, при которых энтропия системы возрастает, т.е. ΔS>0
Учебник: 85-86.
Необратимые и обратимые реакции. Приведите примеры. Понятие о химическом равновесии. Кинетическое и термодинамическое условия равновесного состояния, их особенности. Константа химического равновесия, факторы, влияющие на ее значение.
Необратимыми называются реакции, которые протекают только в одном направлении до полного израсходования одного из реагирующих веществ.
Ba(ClO2)2 + H2SO4 → 2HClO2 + BaSO4↓
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
2Ca + O2 → 2CaO
Обратимыми называются процессы, в которых одновременно протекают две взаимно противоположные реакции – прямая и обратная.
3H2 + N2 ⇌ 2NH3.
N2O4 ⇌ 2NO2
H2 + I2⇌ 2HI
Химическим равновесием называется такое состояние обратимого процесса, при котором скорости прямо и обратной реакций равны.
Состояние химического равновесия имеет следующие особенности:
- Динамический характер химического равновесия – прямая и обратная реакции не прекращаются, а протекают с равными скоростями.
- Постоянство состояние химического равновесия о времени - при неизменных внешних условиях состав равновесной системы не меняется (равновесные концентрации постоянны).
- подвижность равновесия – при изменении внешних условий происходит смещение химического равновесия, т. е. установление новых равновесных концентраций всех реагирующих веществ.
- возможность подхода к состоянию равновесия с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
Константа химического равновесия обратимого процесса равна отношению произведения равновесных концентраций конечных продуктов к произведению равновесных концентраций исходных веществ, возведенных в степени, равные стехиометрическим коэффициентам при формулах соответствующих веществ в уравнении химической реакции (закон действующих масс для обратимых процессов).
Термодинамическим
условием наступления
равновесия в
любой системе является равенство нулю
изменения энергии Гиббса
 =0,
а также отсутствие изменения и других
параметров системы во времени.
=0,
а также отсутствие изменения и других
параметров системы во времени.
Факторы, влияющие на константу химического равновесия: природа реагирующих веществ и температура.
Учебник: 109 - 114
3) Расставить этанол, этандиол, глицерин учитывая кислотность. Доказать реакциями.
Билет №6.
Скорость химических реакции. Понятие о средней и истинной скорости реакции, о простых и сложных реакциях. Виды сложных реакций. Влияние концентрации реагентов на скорость химической реакции. Закон действующих масс, его применении к простым и сложным реакциям.
Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени.
 =
=

Истиннаяскорость химической реакции характеризуется скорость в данный момент времени (Δt 0)
![]()
Средняя скорость химической реации по данному компоненту является усредненной скоростью за данный промежуток времени.

Простые, или элементарные, реакции– это реакции, протекающие в одну стадию.
Сложные реакции– это реакции, протекающие в несколько стадий, каждая из которых является простой реакцией.
Виды сложных реакций:
Последовательно друг за другом
Параллельно
Последовательно-параллельно
Циклически
Влияние концентрации реагентов на скорость химической реакции заключается в том, что увеличение концентрацииреагентов соответствует увеличению числа частиц в объеме, что приводит к более частым их столкновениями, а, следовательно, к увеличению скорости реакции.
Количественная зависимость скорости реакции от концентрации выражается основным постулатом химической кинетики, называемым законом действующих масс:
«Скорость простой гомогенной реакции при постоянной температуре пропорциональна произведению концентрации реагирующих веществ, возведенных в степени, численно равные их стехиометрическим коэффициентам».
![]()
 (B)
(B)
Учебник:98 - 100
Дисперсные системы. Классификация их по различным признакам. Краткая характеристика дисперсных систем. Виды устойчивости этих систем. Электрофорез и Электроосмос.
Дисперсной системой называется гетерогенная система, в которой одна из фаз представлена мелкими частицами, равномерно распределенными в объеме другой однородной фазы.
Всяка дисперсная система состоит из дисперсной фазы идисперсионной среды.
Дисперсионную фазусоставляет мелкораздробленные частицы, равномерно распределенные в дисперсной системе.
Дисперсионную среду составляет однороднаянепрерывная фаза, в которой распределены частицы дисперсной фазы.
Классификацияпо размеру частиц дисперсной фазы:
Микрогетерогенные: суспензии, эмульсии, пены, аэрозоли. (М). не проходят через бумажный фильтр
Ультрамикрогетерогенные: коллоидные растворы. (П). проходят через бумажный фильтр, но не проходят через животные и растительные мембраны.
Молекулярно – дисперсные: истинные растворы низкомолекулярных веществ. (П). проходит через животные и растительные мембраны.
По агрегатному состоянию дисперсной фазы и дисперсионной среды:
Твердая – Газ – т/г – Дымы, пыли
Жидкая – Газ – ж/г – Туманы
Твердая – Жидкая – т/ж – Суспензии, коллоидные растворы
Жидкая – Жидкая – ж/ж – Эмульсии
Газ – Жидкая – г/ж – Пены.
По характеру взаимодействия дисперсной фазы с дисперсионной средой:
- Лиофобные системы: коллоидные растворы со стабилизатором (золи), суспензии, эмульсии, пены, аэрозоли. Слабое взаимодействие между дисперсной фазой и дисперсионной средой. Образуются за счет затраты энергии извне. Эндэргонический процесс. Необходим стабилизатор.
- Лиофильные системы: коллоидные растворы ПАВ и ВМС. Сильное взаимодействие между дисперсной фазой и дисперсионной средой. Образуются самопроизвольно. Экзэргонический процесс. термодинамические устойчивы. Стабилизатор не требуется.
По структурно – механическим свойствам:
- Свободнодисперсные системы: лиозоли, суспензии, эмульсии, кровь, аэрозоли (туманы, дымы, пыли). Дисперсная фаза подвижна, так как представлена отдельными не связанными между собой частицами, более или менее равномерно распределенными в объеме дисперсионной среды
- Связнодисперсные системы: лиогели, студни, волокнистые и пористые капиллярные системы (костная ткань, биологические мембраны). Дисперсная фаза практические неподвижна, так как образует сплошную структуру (сетку, каркас), внутри которой заключена дисперсионная среда.
Коллоидные растворы, как и другие дисперсные системы, могут быть лиофобнымиилиофильными. И в тех, и в других структурными единицами являютсямицеллы– микроструктуры, образующиеся при взаимодействии компонентов дисперсной фазы и дисперсионной среды.
Электрофорезомназывается направленное движение заряженных частиц дисперсной фазы относительно дисперсионной среды под действием электрического поля.
Методом электрофореза получены важные экспериментальные данные об электрохимических свойствах биологических систем. Внутренняя поверхность биологических мембран (клеточной стенки) заряжена отрицательно. Например, дзета – потенциал эритроцитов в крови человека практически постоянен и равен – 16,3 мВ.
Метод электрофореза позволяет разделять белки, аминокислоты и другие системы на отдельные фракции, пользуясь различием в скорости движения частиц дисперсной фазы в электрическом поле.
Электроосмосомназывается направленное движение дисперсионной среды (жидкости) в капиллярной системе под действием электрического тока.
Одним из широкого используемых физиотерапевтических методов лечения многих заболевания является ионофорез, в основе которого лежит проникновение жидкостей, содержащих лечебные ионы и молекулы, через капиллярную систему кожного покрова под действием электрического поля. По существу – это явление электроосмосма.
3) Все о водородных связях на примере ацетоуксусной кислоты и этилового спирта. (Ацетоуксусная – CH3-C(O)-CH2-COOH)
Билет №8.
Энергия Гиббса системы, стандартная энергия Гиббса образования вещества. Термодинамические критерии самопроизвольного протекания процесса – общая формулировка II-го закона термодинамики для любых систем.
Энергия Гиббсаявляется обобщенной термодинамической функцией состояния системы, учитывающей энергетику и неупорядоченность системы при изобарно-изотермических условиях.
G=H-TS
Под стандартной энергией Гиббса образования ΔG°, понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии. Это определение подразумевает, что стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю. Термодинамический критерий самопроизвольности протекания процесса:
ΔG< 0 – экзэргонические (самопроизвольные) процессы
ΔG> 0 – эндэргонические процессы
ΔG= 0 – химическое равновесие
Общая формулировка II-го закона термодинамики для любых систем:«В системе при постоянной температуре и давлении самопроизвольно могут совершать только такие процессы, в результате которых энергия Гиббса уменьшается, т.е.ΔGкон < ΔGнач, или ΔG<0.
Учебник: 86 – 88.
2) Влияние внешних факторов на протекание окислительно – восстановительных реакциях. Рассмотрите это влияние на следующих реакциях:
Факторы: концентрация реагента, температура реакции, наличие катализатора, влияние характера среды.
а) Zn + H2SO4 (разб.) = … ; Zn + H2SO4 (конц.) = … ;
Zn0 + H+12SO4 (разб.) = Zn+2SO4 + H2 (окислитель H+)
Zn0 + H2S+6O4 (конц.) = 3Zn+2SO4 + S0 + 4H2O (окислитель S+6)
б) Cl2+KOH(холод) = … ;Cl2+KOH(горяч.) = … ;
Cl20+KOH(холод) =K-1Cl+KCl+1O+H2O
Cl2+KOH(горяч.) = 5K-1Cl+KCl+5O3 + 3H2O
в) KMnO4 + Na2SO3 + (1) H2SO4 = … + (2) H2O = … + (3)NaOH(в картинкеKOH(!) будьте осторожны)(Коэффициенты не правильные!)

Учебник: 211.
Оптическая активность гидроксикислот и аминокислот. Определение оптической активности у молекул глицериновой кислоты, винной кислоты, глюкозы, рибита, аланина. Укажите условия проявления оптической активности.
Оптическая
активность— это способность среды
(кристаллов, растворов, паров
вещества)вращать
плоскость поляризованного света вправо
и влево.Метод исследования оптической
активности —поляриметрия.
Глицериновая кислотаСН2ОН—СНОН—СООНполучаетсяокислениемглицерина, чаще всего действиемазотной кислоты– оптическинедеятельна.Кристаллизациейсолейбруцинаона может быть разделена наоптические антиподы. Особым окислительнымброжениемглицерина(Bacillus aethaceticus) она может быть получена в виде правовращающегостереоизомера
Рибит
- получается
из L-рибозы при
восстановлении её амальгамой натрия. Кроме
право- и левовращающих, есть и третий
тип изомеров – оптически неактивные.
Это обнаружил в 1830 знаменитый немецкий
химик Йёнс Якоб Берцелиус на
примере виноградной (дигидроксиянтарной)
кислоты НООС–СН(ОН)–СН(ОН)–СООН: эта
кислота оптически неактивна, а винная
кислота точно такого же состава обладает
в растворе правым вращением.
Рибит
Ксилит
Позднее была открыта и не встречающаяся в природе «левая» винная кислота– антипод правовращающей. Различить оптические изомеры можно с помощью поляриметра – прибора, измеряющего угол поворота плоскости поляризации.
Для
растворов этот угол линейно зависит от
толщины слоя и концентрации оптически
активного вещества (закон Био). Для
разных веществ оптическая активность
может изменяться в очень широких
пределах. Так, в случае водных растворов
разных аминокислот при 25° С удельная
активность (она обозначается как [a]D и
измеряется для света с длиной волны 589
нм при концентрации 1 г/мл и толщине слоя
10 см) для аланина, +13,5°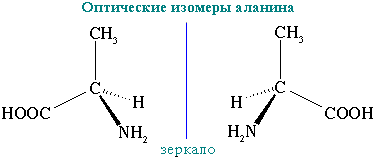
Глюкозаоптически
активна, вращает поляризованный луч
вправо. Принадлежность
к D
или L
ряду по хиральному центру наиболее
удаленного от оксогруппы. Для
медицинских целей
употребляютглюкозувпорошкахитаблетках,
а также изотонический (4,5—5%) и
гипертонический (10—40%)растворы
глюкозы.Изотонические
растворыприменяют (вводят подкожно
и в клизмах) для пополненияорганизмажидкостью;
они являются также источником легко
усвояемого питательного
Билет №10. (= Варианту №30)
1) Гидрофобные коллоидные растворы, способы и условия их получения. Строение структурных частиц дисперсной фазы. Приведите схему строения мицеллы коллоидного раствора AgI, полученного обменной реакцией между AgNO3 и KI в избытке KI. Укажите составные частицы мицеллы и причины возникновения межфазного (термодинамического) и электрокинетического потенциалов.
В биологических системах, например, в крови человека, содержится малорастворимые соли кальция, магния, а также холестерин и другие малорастворимые вещества, существующие в виде лиофобных коллоидных растворов. В литературе такие коллоидные растворы часто называют золямиили лиозолями.
Такие системы являются термодинамически неустойчивыми, в них самопроизвольно происходят процессы, сопровождающиеся уменьшением свободной энергии (ΔGs< 0).
Условия:
Малая растворимость дисперсной фазы, т.е. плохое сродство к ее дисперсионной среде;
Определенные размеры частиц дисперсной фазы (10-9– 10-6м);
Присутствие в системе стабилизатора.
Любое вещество может бытьполучено в коллоидном состоянии.
Получить коллоидный раствор можно двумя путями: измельчением крупных частиц до размеров коллоидных в присутствии стабилизатора –диспергационныеметоды – или объединением молекул и ионов в истинных растворах в более крупные коллоидные частицы –конденсационныеметоды.
Условияконденсационного метода:
- Использование достаточно разбавленных растворов;
- Небольшой избыток одного из реагирующих веществ, которое выполняет роль стабилизатора образующихся коллоидных частиц.
Лиофобные раствора обязательно требуютприсутствиестабилизатора – электролита. Ионы стабилизатора адсорбируются на их поверхности ДЭС, следовательно, обеспечивается устойчивость дисперсионной системы.
Мицеллой лиофобной системыназывается гетерогенная микросистема, которая состоит из микрокристалла дисперсной фазы, окруженного сольватированными ионами стабилизатора.
-
KI(избыток)⇌K+
+ I—
{[mAgI]*nI-(n-x)K+}*xK+
nI – потенциалопределяющий ион
(n-x)K+ - адсорбционные противоионы
xK+ - диффузные противоионы
- KNO3 (избыток) ⇌K+ + NO3-
{[mAgI]*nAg+(n-x)NO3-}*xNO3-
nAg+ - потенциалопределяющий ион
(n-x)NO3- - адсорбционные противоионы.
xNO3-- диффузные противоионы.
Ядром мицеллы лиофобного коллоидного раствора называется микрокристалл малорастворимого вещества, на поверхности которого адсорбированы потенциалопределяющие ионы, сообщающие заряд ядру мицеллы.
В мицелле с ионными стабилизатором во всякой гетерогенной системе, в которой на границе раздела фаз есть ДЭС, различают 2 потенциала:
- Межфазным потенциалом называется потенциал ДЭС на границе раздела между твердой и жидкой фазами в мицелле. Значение зависит от природы твердой фазы, а также от заряда и концентрации потенциалопределяющих ионов, адсорбированных на твердой фазе.
- Электрокинетическим потенциалом (дзета-потенциал) называется потенциал на границе скольжения между адсорбционной и диффузионной частями ЛЖС мицеллы. Значение определяется толщиной диффузного слоя, чем выше заряд противоионов и больше их концентрация, тем больше противоионов находится в плотном слое и меньше остается в диффузном слое.
Учебник: 710-715.
Строение и химические свойства фосфора и его соединений. Роль фосфатов в организме (структурообразующая и энергетическая). Взаимосвязь обмена фосфора и кальция в организме. Круговорот фосфора в природе.
В
периодической системе фосфор, как и
азот, находится в группе VA,
но вIIIпериоде. Его
электронная конфигурация 1s22s22p63s23p3.
Его электронная конфигурация приводит
к образованию трех связей. Однако, фосфор
имеет в валентном слое свободные 3d– орбитали. Поэтому при возбуждении
атома фосфора легко достигается состояние
с пятью неспаренными электронами
1s22s22p63s13p33d1,
что позволяет ему образовывать пять
связей. Таким образом, фосфор в своих
соединениях проявляет валентность 3 и
5. Степень окисления атома фосфора в
соединениях может меняться от -3 до +5.
В природе встречается только в формах, содержащих фосфат – анион PO43-. Это обусловлено тем, что фосфор образует с кислородом более прочные связи, чем с другими органогенами.
В организме фосфор встречается только в виде фосфатов, неорганических и органических. Все они имеют тетраэдрическую структуру, в которой атом фосфора расположен в центре тетраэдра, а атомы кислорода – в его вершинах.
Фосфаты в живых организмах играют две ключевые роли. Во-первых, служат структурными компонентами скелета, клеточных мембран и НК.Во-вторых, роль фосфатов, точнее полифосфатов организме заключается в аккумуляции и переносе энергии от экзэргонических к эндорганическим реакциям и процессам.
Кислотные свойства:
Из оксидов фосфора наибольшее значение имеет оксид фосфора (V)P2O5, проявляющий кислотные свойства и существующий в молекулярной формеP4O10. Главная особенность оксидаP2O5– очень большое сродство к воде. Поэтому он часто используется как эффективный осушитель для газов и органических растворителей.
Оксид фосфора (V) может присоединять одну, две, три и более молекул воды. При это образуются метафосфорная, дифосфорная или пирофосфорная, ортофосфорная и полифосфорные кислоты.
Самое замечательное свойство этих кислот – способность превращаться друг в друга в результате гидролиза (присоединения воды) или в результате дегидратации (потери воды).
Ортофосфорная кислотаH3PO4– трехосновная кислота. Она образует средние (Na3PO4) кислые (Na2HPO4иNaH2PO4) соли. В водных растворах соли ортофосфорной кислоты гидролизуются.
Совокупность кислых фосфатов HPO42-иH2PO4-образует в крови фосфатную буферную систему, которая вместе с другими буферными системами обеспечивает постоянствоpHкрови.
Обмен фосфора в организме тесно связан с обмене кальция, но эта связь антагонистична. При увеличении содержания кальция в крови наблюдается уменьшение содержания фосфатов, прежде всего неорганических.
Дифосфорная кислотаH4P2O7– хорошо растворима в воде и в растворе постепенно (а при нагревании – быстрее) превращается в ортофосфорную кислоту в результате гидролиза по ангидридной группе.
Дифосфорная кислота является более сильной, чем ортофосфорная, в соответствии с общим правилом увеличения силы кислот при их конденсации.
Фосфор присутствует в живых клетках в виде ортофосфатной и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2. В состав зубной эмали входит фторапатит. Основнуюрольв превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800—1500 мг. При недостатке фосфора в организме развиваются различные заболевания костей.
Круговорот фосфора в природе осуществляется посредством фосфатов, поэтому он не сложен, так как не сопровождается изменениями степени окисления атома фосфора. Значительная часть фосфора рано или поздно попадает в океан и откладывается в виде фосфатов в осадочных породах.
Учебник: 311 – 318.
Стереоизомерия. Диастереоизомерия и энантиомерия на примере яблочной и винной кислот D и L стереохимические ряды. Глицериновый альдегид как стандарт конфигураций D и L стереоизомеров.
Стереоизомерия- более широкое понятие структуры молекулы (сюда включают конфигурацию и конформацию, они отражают трехмерность молекулы). Молекулы, обладающие одинаковым химическим строением, на различные в пространственном строении и есть стереоизомеры (пространственные изомеры). Могут быть конфигурационными и конформационными.
Конфигурация– это порядок расположения атомов в пространстве без учета различий, возникающих из-за вращения вокруг одинарных связей. Делятся на 2 типа – энантиомеры и дистериомеры.
Энантиомеры– стереоизомеры, относящиеся друг к
другу, как предмет и несовместимое с
ним зеркальное отображение. В виде
энантиомеров могут существовать только
хиральные молекулы. Энантиомеры обладают
одинаковыми химическими и физическими
свойствами (температуры плавления и
кипения, плотность и растворимость) но
проявляют различную оптическую активность
т. е. способность отклонять плоскость
поляризованного света.
Диастереомеры– стереоизомеры, не являющиеся зеркальным отражением друг друга, обладают разными физико-химическими свойствами.
α – диастереомеры- это те которые содержат в молекуле более одного хирального центра, определяется как 2n,n- число центров хиральности. Некоторые пары стереоизомеров будут иметь противоположные конфигурации всех соответствующих стереоцентров и являться, таким образом,энантиомерами. Все остальные парные комбинации стереоизомеров будут различаться лишь некоторыми конфигурациями, не являясь зеркальными отражениями друг друга. Такие пары являются диастереомерами.
Π - диастереомеры – конфигурационные изомеры содержащие π связьπ-Диастереомеры, также называемые геометрическими изомерами, отличаются друг от друга пространственным расположением заместителей относительно плоскости двойной связи. Например,малеиноваяифумароваякислоты отличаются друг от друга взаимным расположениемкарбоксильных группу двойной связи
В
системе классификаций Глицериновый
альдегид(глицераль,
глицериновый альдегид,глицероза,
2,3-дигидроксипропаналь) принят
за стандарт. Его левовращающему
энантиомеру была присвоен а произвольно
приписная формула (I) обозначаетсяL.
Правовращающему приписана (II),
конфигурация обозначается D
D- и L-глицеральдегид представляет собой сладкое бесцветное кристаллическое вещество хорошо растворимое в воде (с образованием вязкого сиропа), малорастворимое в этаноле и диэтиловом эфире, нерастворим в неполярных растворителях. Водный раствор глицеральдегида обладает оптической активностью (вращает плоскость поляризации).
Билет №11. (ВАРИАНТ 1) ( = Варианту №15).
Буферные растворы, их классификация, механизм буферного действия. Уравнение Гендерсона – Хассельбаха для расчета pH буферных растворов. Область буферного действия. Буферная емкость, ее виды и факторы, от которых зависит ее значение.
Буферный раствор– это раствор, содержащий протолитическую равновесную систему, способную поддерживать практически постоянные значениеpHпри разбавлении или при добавлении небольших количеств кислоты или щелочи.
По принадлежности слабого электролита к классу кислот или оснований буферные системы делятся на кислотные и основные.
Кислотнымибуферными системами называются растворы, содержащие слабую кислоту (донор протона) и соль этой кислоты (акцептор протона). (Ацетатная, гидрокарбонатная, гидрофосфатная)
Уравнение Гендерсона – Хассельбаха(Гендерсона – Хассельбальха [Для Элеоноры Григорьевны]):
pH=pKa
+lg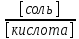
Основнымибуферными растворами называются растворы, содержащие слабое основание (акцептор протона) и соль этого основания (донор протона). (NH3*H2Oи его солиNH4Cl)
Уравнение Гендерсона – Хассельбаха(Гендерсона – Хассельбальха [Для Элеоноры Григорьевны]):
pH=pKa(BH)++lg
Механизм буферного действия: при разбавлении буферных растворов концентрации всех компонентов уменьшаются, но так как они изменяются одинаково, то их отношение остается неизменным. Величина константы диссоциации слабого электролита также не изменяется при разведении. ВеличинаpHтоже не меняется. В действительности это наблюдается до тех пор, пока концентрация компонентом буферных растворов не станет меньше 0,01 моль/л.
При добавлении сильной кислоты или щелочи в буферный раствор моментально вызывает защитную реакцию протолитической буферной системы по поддержанию постоянного значения pHсреды. Это происходит за счет связывания добавляемых ионовH+илиOH- соответствующими компонентами буферной системы с образование малодиссоциирующих соединений.
Защитные свойства буферных растворов по отношению к действию кислот и щелочей будут сохраняться тех пор, пока концентрации компонентов буферных систем, связывающих H+иOH-, будут больше концентрации добавляемых ионов.
Область буферного действия на основании данного слабого электролита можно приготовить буферные растворы, поддерживающие значение pH в диапазоне от pH1=pKa- 1 до pH2 = pKa + 1 (pH=pKa± 1)
Буферная емкость (B) называется число моль – эквивалентов сильной кислоты или щелочи, которые нужно добавить к 1 литру буферного раствора, чтобы изменить величину pH на единицу.

Факторы, от которых зависит значение буферной емкости: концентрация компонентов в буферном растворе и их отношение (чем выше концентрация, тем больше буферная емкость).
Учебник: 194-197.
2) Диффузионный и мембранные потенциалы. Причины их возникновения, факторы, влияющие на их величину. Потенциал покоя и потенциал действия. Регистрация мембранных потенциалов.
Диффузионным потенциалом называется потенциал, возникающий на границе раздела двух растворов, содержащих один и тот же электролит различной концентрации, или двух растворов разных электролитов вследствие различия в подвижности их катионов и анионов.
C1(HCl) >C2(HCl).
При
соприкосновении растворов H+
и Cl-
из более концентрированного раствора
благодаря диффузии будут перемещаться
в разбавленный раствор. Подвижность H+
больше. В разбавленный раствор в единицу
времени ионов H+
переместится больше, чем ионов Cl-.
В результате этого в разбавленном
растворе на границе раздела зарядится
положительно за счет более быстрых
ионов H+,
а концентрированный раствор – отрицательно
за счет медленных ионов Cl-.
Образуется ДЭС.
В биологических системах диффузионный потенциал проявляется при механическом повреждении клеток. Из места повреждения ионы перемещаются в межклеточную жидкость, в результате возникает диффузионный потенциал.
Мембранным
потенциалом называется
потенциал, возникающий между сторонами
мембраны с избирательной проницаемость,
разделяющей два раствора различного
состава.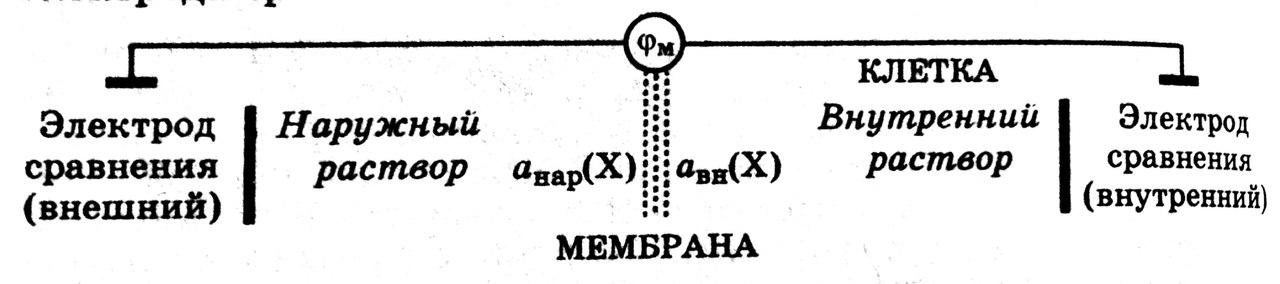
Величину мембранного потенциала можно определить, составив гальваническую цепь, в которой в растворы, разделенные мембраной с избирательной проницаемостью, опущены два электрода сравнения:
ЭДС такой гальванической цепи характеризует величину мембранного потенциала.
Мембранный потенциал зависит от отношения активностей ионов в растворах, разделенных мембраной, и от свойств мембраны.
 Потенциалом
покоя называется
мембранный потенциал, возникающий между
внутренней и наружной сторонами клеточной
мембраны, находящейся в невозбужденном
состоянии.
Потенциалом
покоя называется
мембранный потенциал, возникающий между
внутренней и наружной сторонами клеточной
мембраны, находящейся в невозбужденном
состоянии.
Определить потенциал покоя можно с помощью двух микроэлектродов сравнения, вводимых внутрь клетки и в наружный раствор. (-70 – 90)
При раздражение клетки химическим, электрическим или механическим воздействием она переходит в возбужденное состояние, при этом проницаемость ее мембраны для ионов Na+ становится значительно выше. Чем для K+. Поэтому ионы Na+ из наружного раствора, где их концентрация в 9 раз выше, чем внутри клетки, устремляются через клеточную мембрану во внутренний раствор. Ионы Na+ переносят положительный заряд с наружной поверхности мембраны и перезаряжает ее внутреннюю поверхность, меняя знак заряда с «-» на «+» и вызывая быструю деполяризацию мембрану. После прекращения возбуждения мембрана вновь становится проницаемой для ионов K+ и непроницаемой для Na+. Ионы K+ опять выходят из клетки в соответствии с градиентом концентрации, унося с собой положительный заряд до тех пор, пока на мембране не восстановится потенциал покоя, т.е. не произойдет реполяризация мембраны.
Потенциалом действия называется амплитуда (120-140 мВ) колебания (деполяризация и реполяризация) мембранного потенциала, возникающая при возбуждении клеточной мембраны.
Не только K+Na+, но и Ca2+, Cl-, H+ и других ионов.
Генерирование мембранного потенциала связано с работой сердца, мозга, мышц. Электрические потенциалы, возникающие при деятельности сердца, можно регистрировать с помощью электрокардиографа на электрокардиограмме. Электрокардиограмма – важнейшая характеристика сердечной деятельности. Биоэлектрические потенциалы мозга регистрируются на электроэнцефалограмме, мышц – на электромиограмме, желудка – на электрогастрограмме и т.д.
Учебник: 664 – 670.
Нуклеофильные свойства аминов. Реакции алкилирования по Гофману на примере метиламина с CH3J.Реакция алкилирования аминов на примере анилина с уксусной кислотой.
Нуклеофильные свойства
Алкилирование аминов
Амины обладают нуклеофильными свойствами и алкилируются алкилгалогенидами и спиртами.
Ацилирование аминов
Амины ацилируются карбоновыми кислотами и их производными с образованием амидов карбоновых кислот.
2RNH2 + R/COX ® R/CONHR + RNH3X
2R2NH + R/COX ® R/CONR2 + R2NH2X
(X=Cl,
OCOR/)
б) Исчерпывающее метилалирование – реакция амина с избытком йодистого
метила
(возможно исчерпывающее алкилирование).
Билет №11. (ВАРИАНТ 2)
Дисперсные системы. Классификация их по различным признакам. Краткая характеристика дисперсных систем. Виды устойчивости этих систем.
Дисперсной системой называется гетерогенная система, в которой одна из фаз представлена мелкими частицами, равномерно распределенными в объеме другой однородной фазы.
Всяка дисперсная система состоит из дисперсной фазы идисперсионной среды.
Дисперсионную фазусоставляет мелкораздробленные частицы, равномерно распределенные в дисперсной системе.
Дисперсионную среду составляет однороднаянепрерывная фаза, в которой распределены частицы дисперсной фазы.
Классификацияпо размеру частиц дисперсной фазы:
Микрогетерогенные: суспензии, эмульсии, пены, аэрозоли. (М). не проходят через бумажный фильтр
Ультрамикрогетерогенные: коллоидные растворы. (П). проходят через бумажный фильтр, но не проходят через животные и растительные мембраны.
Молекулярно – дисперсные: истинные растворы низкомолекулярных веществ. (П). проходит через животные и растительные мембраны.
По агрегатному состоянию дисперсной фазы и дисперсионной среды:
Твердая – Газ – т/г – Дымы, пыли
Жидкая – Газ – ж/г – Туманы
Твердая – Жидкая – т/ж – Суспензии, коллоидные растворы
Жидкая – Жидкая – ж/ж – Эмульсии
Газ – Жидкая – г/ж – Пены.
По характеру взаимодействия дисперсной фазы с дисперсионной средой:
- Лиофобные системы: коллоидные растворы со стабилизатором (золи), суспензии, эмульсии, пены, аэрозоли. Слабое взаимодействие между дисперсной фазой и дисперсионной средой. Образуются за счет затраты энергии извне. Эндэргонический процесс. Необходим стабилизатор.
- Лиофильные системы: коллоидные растворы ПАВ и ВМС. Сильное взаимодействие между дисперсной фазой и дисперсионной средой. Образуются самопроизвольно. Экзэргонический процесс. термодинамические устойчивы. Стабилизатор не требуется.
По структурно – механическим свойствам:
- Свободнодисперсные системы: лиозоли, суспензии, эмульсии, кровь, аэрозоли (туманы, дымы, пыли). Дисперсная фаза подвижна, так как представлена отдельными не связанными между собой частицами, более или менее равномерно распределенными в объеме дисперсионной среды
- Связнодисперсные системы: лиогели, студни, волокнистые и пористые капиллярные системы (костная ткань, биологические мембраны). Дисперсная фаза практические неподвижна, так как образует сплошную структуру (сетку, каркас), внутри которой заключена дисперсионная среда.
Коллоидные растворы, как и другие дисперсные системы, могут быть лиофобнымиилиофильными. И в тех, и в других структурными единицами являютсямицеллы– микроструктуры, образующиеся при взаимодействии компонентов дисперсной фазы и дисперсионной среды.
Учебник:709 – 710.
Понятие о металлах жизни. Натрий и калий. Строение атомов и особенности гидратации катионов, определяющие их содержание во внеклеточной и внутриклеточной среде.
Металлы жизни– десять элементов:K,Na,Ca,Mg,Mn,Fe,Co,Cu,Zn,Mo. На их долю в организме приходится 2,4 %. Все металлы жизни в организме или находятся в виде свободных катионов, или являются ионами – комплексообразователями, связанными с биолигандами. Принимают активное участие в обмене веществ.
Натрий и калий – элементы группыIA. Атомы элементов этой группы имеют во внешнем слое один электрон наs- подуровне, который они стремятся отдать в соединениях партнеру, образуя устойчивые симметричные монокатионы с электронной конфигурацией ближайшего благородного газа.
Благодаря устойчивости электронной структуры и низкой плотности положительного заряда на поверхности катионов Na+ иK+ их свободные атомные обитали внешнего уровня не могут эффективно взаимодействовать с неподеленными парами электронов ближайших молекул воды, из-за чего они удерживаются в гидратной оболочке катиона только электростатически. Поэтому катионы натрия и калия не подвергаются гидролизу в водной среде и практически не проявляют склонность к комплексообразованию.
Основное различие в свойствах катионов натрия и калия связано с различием в плотности положительного заряда на их поверхности: у катиона Na+она выше, поэтому его электростатическое поле сильнее удерживает молекулы воды. Вследствие этого для катиона натрия характерна положительная гидратации, а для катиона калия – отрицательная гидратация.
Именно этим, по мнению Слесарева Валерий Ивановича, можно объяснить, почему катионы Na+иK+в живых системах являются антагонистами и почему катионы калия являются преимущественно компонентом внутриклеточных, а катионы натрия – межклеточных жидкостей.
Концентрация ионов K+внутри клетки примерно в 35 раз выше. Чем вне ее, а концентрация ионовNa+во внеклеточной жидкости в 15 раз больше, чем внутри клетки. Для осуществления многих важных биологических процессов необходимо постоянно поддерживать такое неравномерное распределение этих ионов, на что требуется затрата энергии, так как перенос ионов через мембрану должен происходить против градиента их концентраций. Это реализуется с помощью калий – натриевого насоса, который за счёт энергии гидролиза одной молекулы АТФ выводит три катионаNa+из клетки, а два катионаK+посылает внутрь клетки. Вследствие дисбаланса переносимых электрических зарядов внутренняя поверхность мембрану заряжается отрицательно, а внешняя положительно.
Высокая внутриклеточная концентрация ионов Kпрежде всего обеспечивает осмотическое давление внутри клетки, активацию ферментативных систем для синтеза белка на рибосомах и окисление углеводов. В эритроцитах ионыKучаствуют в работе гемоглобиновой и оксигемоглобиновой буферных систем, а также активируют фермент карбоангидразу оксида углерода.
Ионы K+иNa+активируютаденозинтрифосфатазу (АТФ – аза) клеточных мембран, обеспечивающую энергией калий- натриевый насос. Эти ионы оказывают существенное влияние на деятельность центральной нервной системы (ЦНС). Избыток ионовNa+в клетках коры головного мозга вызывают депрессию, т.е. угнетение деятельности ЦНС. Избыток катионовKв этих клетках, наоборот, возбуждает ЦНС, вызывая маниакальное состояние.
Учебник:338–341.
Аминокислоты. Классификация альфа – аминокислот на основные физико- химические свойства их радикалов. Примеры каждого класса. Строение. Название. Поведение в водных растворах. Понятие о биполярных ионах. Влияние рН среды на суммарный заряд аминокислот, пептидов. Изоэлектрическая точка.
Аминокислотаминазываются органические соединения, содержащиекарбоксильную и аминогруппу: (NH2)m-R –(COOH)n
Классификация:
1) по количеству СООН- и NH2-групп аминокислоты делятся на моноаминокарбоновые, диаминокарбоновые, моноаминодикарбоновые и т.д.
2) по взаимному расположению двух функциональных групп: ,,- и т.д. аминокислоты.
Изомерия: 1) по строению углеродного скелета; 2) оптическая (стерео) изомерия.
Формула Название Биологическая роль
NH2-CH-COOH* - аланин Входит в состав пеп-
(- аминопро- тидов, белков
СН3 пионовая кислота)
H2N-CH2-CH2-COOH -Аланин Входит в состав
(-аминопро- пантотеновой кислоты
пионовая кислота) (витамина В3)
H2N-CH2-CH2- СН2 –COOH -Аминомасляная Природный транкви-
кислота (ГАМК) лизатор
Примечание: * - оптически активна
С биологической точки зрения огромное значение имеют - аминокислоты. Это «кирпичики», из которых построены молекулы белка –протеиногенные аминокислоты. Основным источником- аминокислот для живого организма служат белки пищи. Большинство- аминокислот синтезируются в организме, но некоторые, необходимые для синтеза белков, не синтезируются в организме или синтезируются в недостаточном количестве и должны поступать извне. Такие аминокислоты называются незаменимыми, это:
Валин, лейцин, изолейцин, фенилаланин, метионин, триптофан, треонин, лизин, гистидин, аргинин.
Классификация -аминокислот.
Общая структурная формула протеиногенных аминокислот:
|
H2N-CH-COOH |
R
Специфические свойстваобусловлены взаимным влиянием двух функциональных групп.-,- и- Аминокислоты при нагревании вступают в реакции, аналогичные реакциям соответствующих оксикислот.
- Аминокислоты при нагревании образуют дикетопиперазины.
Реакция идет межмолекулярно через промежуточное образование дипептидов:
дипептидов:

Дикетопиперазин
2. -Аминокислоты образуютнепредельные кислоты:
t°
 R-CH-CH2-C=O
R-CH=CH-C=O
R-CH-CH2-C=O
R-CH=CH-C=O
-NH3
NH2OHOH
3. - и-Аминокислоты образуют циклические амиды, называемые- и - лактамами. Для них характерно таутомерное превращение (лактамлактим):
t°
 R-CH-CH2-CH2-C=O
R-CH-CH2-CH2-C=O
-H2O
NH2OH
лактам

Лактим
Цвиттер-ион (биполярный ион) — молекула которая, являясь в целом электронейтральной, в своей структуре имеет части, несущие как отрицательный, так и положительный заряды, локализованные на несоседних атомах. К цвитер-ионным соединениям зачастую относят и внутримолекулярные соли (например, внутримолекулярные соли аминокислот) и, иногда, ионные диполярные соединения, в том числе и с зарядами на соседних атомах (например, N-оксиды аминов). Цвиттер-ионные соединения высокополярны и поэтому, как правило, обладают хорошей растворимостью в полярных растворителях (воде, диметилсульфоксиде и т. п.) и слабой — в большинстве органических неполярных растворителей.
Различаются они только боковыми цепями (R-группами), которые у разных аминокислот неодинаковы по структуре, суммарному заряду (полярности) и растворимости в воде (гидрофильности или гидрофобности).
Аминокислоты классифицируют на основе химического строения радикалов, хотя были предложены и другие принципы. Различают ароматические и алифатические аминокислоты, а также аминокислоты, содержащие серу или гидроксильные группы. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группу), то они называются нейтральными аминокислотами. Если же аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой.
Современная рациональная классификация аминокислот основана на полярности радикалов, т.е. способности их к взаимодействию с водой. Она включает четыре класса аминокислот:
неполярные(гидрофобные)
полярные (гидрофильные) незаряженные
отрицательно заряженные
положительно заряженные при физиологических значениях pH
Во всех - -аминокислотах, за исключением глицина,- атом углерода
связан с четырьмя различными замещающими группами и, следовательно, является асимметрическим, или хиральным. Такие молекулы встречаются в двух стереоизомерных формах и проявляют оптическую активность.
Все аминокислоты, входящие в состав молекул белков, являются L-стереоизомерами.
Водные растворы аминокислот окрашиваются в синий цвет при прибавлении небольшого количества сульфата или хлорида меди (II), в особенности после связывания образующихся при этом в растворе ионов водорода буферным раствором. Такая же окраска появляется при кипячении водного или спиртового раствора аминокислоты с окисью меди или с карбонатом меди. Водный раствор аминокислоты после обработки в нейтральной среде карбонатом, окисью, фосфатом или ацетатом меди становится темносиним и при выпаривании выделяет очень красивые кристаллы. Образующиеся соединения в водном растворе ионизованы слабо и, вероятно, представляют собой комплексы, в которых медь связана не только карбоксильной группой, но также, при помощи вторичных валентных связей, азотом. Обычно принято считать, что в этих комплексах на 2 молекулы аминокислоты приходится 1 атом меди.
Влияние рН средына ионизацию аминокислот. Изменение рН среды от кислой до щелочной влияет на заряд растворенных аминокислот. В кислой среде (рН<7) все аминокислоты несут положительный заряд (существуют в виде катиона), так как избыток протонов в среде подавляет диссоциацию карбоксильной группы:

В кислой среде аминокислоты в электрическом поле движутся к катоду.
В щелочной среде (рН>7), где имеется избыток ионов ОН-, аминокислоты находятся в виде отрицательно заряженных ионов (анионов), так как диссоциирует NН+3-группа:
![]()
В этом случае аминокислоты перемещаются в электрическом поле к аноду.
Следовательно, в зависимости от рН среды аминокислоты имеют суммарный нулевой, положительный или отрицательный заряд.
Состояние, в котором заряд аминокислоты равен нулю, называется изоэлектрическим. Значение рН, при котором наступает такое состояние и аминокислота не перемещается в электрическом поле ни к аноду, ни к катоду, называется изоэлектрической точкой и обозначается рНI. Изоэлектрическая точка очень точно отражает кислотно-основные свойства разных групп в аминокислотах и является одной из важных констант, характеризующих аминокислоту.
Изоэлектрическая точка неполярных (гидрофобных) аминокислот приближается к нейтральному значению рН (от 5,5 для фенилаланина до 6,3 для пролина), у кислых она имеет низкие значения (для глутаминовой кислоты 3,2, для аспарагиновой 2,8). Изоэлектрическая точка для цистеина и цистина равна 5,0, что указывает на слабые кислотные свойства этих аминокислот. У основных аминокислот — гистидина и особенно лизина и аргинина — изоэлектрическая точка значительно выше 7.
Билет №12. (Вариант 1)
1) Коллоидные гибридные растворы, высаливающее действие, и какое - то явление.
2) Особенности строения атома кислорода. Кислотно – основные, окислительно – восстановительные и комплексообразующие свойства кислорода. Его роль в организме и в окружающей среде.
Кислород– самый распространенный элемент биосферы (более 50 % по массе). Без кислорода невозможны многочисленные чрезвычайно важные жизненные процессы, прежде всего дыхание и окисление биосубстартов. Только немногие живые организмы, называемые анаэробными, могут обходиться без кислорода.
Кислород в периодической системе находится во втором периоде в группе VIA. Электронная конфигурация его атома 1s22s22p4. Наличие двух неспаренных электронов обеспечивает образование двух связей. Отсутствие вакантных атомных орбиталей во внешнем слое не позволяет кислороду повысить валентность за счет распаривания электронов, как это имеет место у его ближайшего соседа по группе атома серы. Наличие двух неподеленных пар электронов дает возможность атому кислорода выступать в роли донор одной из них при образовании донорно – акцепторной связи.
Степень окисления кислорода в соединениях обычно равна -2. (Бывает -1H2O2, +2OF2).
Кислород существуют в двухаллотропных модификациях: дикислородO2(кислород) и трикислородO3(озон).
Высокая химическая активность кислорода, определяющая его ведущую роль в процессах метаболизма, объясняется тем. Что молекула кислорода имеет структуру бирадикала («Триплетный кислород»).
Кислотно – основные свойства кислорода:
Рассмотрите соединение вида: Элемент-О-Н. Если в этом соединении слабее первая связь (т.е. легче отрывается гидроксид) - то это соединение проявляет больше свойства основные, если слабее вторая связь (т.е. легче отщепляется протон) - это уже кислота. А прочность первой связи будет завесить (вспомните закон Кулона) от расстояния между атомами и заряда их. Поскольку заряд атома кислорода - в данном случае постоянен, подумаем пока только о заряде этого некоего элемента. Чем он меньше, и чем больше его заряд, тем больше кислотных свойств будет он проявлять. А это - элементы, находящиеся в правом верхнем углу таблицы, металлы в высших степенях окисления. А если элемент имеет низкую степень окисления (малый заряд), да еще и "толстые" электронные оболочки (левый нижний угол таблицы) - он проявляет основные свойства.
Окислительно – восстановительные свойства.
Главная химическая функция кислорода в организме – окисление веществ, которое всегда сопровождается выделением энергии.
Для клетки очень важно, чтобы происходила полная утилизация кислорода:
O2+ 4e-+ 4H+2H2O
Пероксид водорода H2O2широкого используется в медицинской практике в основном как наружное бактерицидное средство. ДействиеH2O2основано на его окислительной способности и безвредности образующихся продуктовO2иH2O. Выделяющийся кислород оказывает противомикробное, дезодорирующее и депигментирующее действие. В то же время образующаяся пена способствует очищению ран, удаляя из них частицы тканевого распада.
Чистый пероксид термодинамически нестабилен и легко разлагается на воду и кислород, а на свету этот процесс протекает со взрывом.
2H2O2-12H2O-2 +O20
Восстановительные свойства пероксид водорода проявляет только по отношению к сильным окислителям, окисляясь до свободного кислорода:
5H2O2-1 + 2KMn+7O4 + 3H2SO4 = 2Mn+2SO4 + K2SO4 + 8H2O + 5O20
Комплексообразующиесвойства.
Молекула кислорода, хотя и содержит неподеленные электронные пары, является малоактивным лигандом. Кислород плохо растворим в воде.
Функцию транспорта кислорода у высших животных выполняет находящийся в эритроцитах гемоглобин, который, соединяясь в легких с кислородом, образует легко диссоциирующий комплекс оксигемоглобин.
Кислородосодержащие
соединения из-за низкой подвижности
неподеленных электронных пар атома
кислорода также являются малоактивными
лигандами. Однако, если кислородосодержащая
группа в соединении образует анион, то
подвижность электронных пар в системе,
несущей отрицательный заряд, резко
возрастает. Это способствует образованию
комплексных соединений. Так, многоатомные
спирты или многоосновные органические
кислоты дают в щелочной среде устойчивые
хелатные комплексы с катионами d– металлов:
Основной (фактически единственной) функцией кислорода является его участие как окислителя в окислительно-восстановительных реакциях в организме. Благодаря наличию кислорода, организмы всех животных способны утилизировать (фактически «сжигать») различные вещества (углеводы, жиры, белки) с извлечением определенной энергии «сгорания» для собственных нужд. В покое организм взрослого человека потребляет 1,8-2,4 г кислорода в минуту.
Учебник:318 - 322.
Оксикислоты. Структура молочной, яблочной , винной, лимонной, β гидроксимасляной кислоты. Химические свойства. Реакция образования солей и сложных эфиров. Их названия по кислотным остаткам. Биологическая роль.
Оксикислоты–карбоновые кислоты, в которых одновременно содержатсякарбоксильнаягидроксильная группы. Проявляют общие свойствва спиртов и кислот. В зависимости от реагентов и условий проведения реакции. Гидроксикислоты проявляютспецифические свойства, которые обусловлены взаимным влиянием ОН- и СООН- групп.Например, своеобразная реакция отщепления воды при нагревании.
Она
позволяет отличить -,-,-
и другие гидроксикислоты.

а)
t°


гидролиз + 2H2O
+
H+ или OH-
б)


t°

-H2O
-оксимасляная кислота кротоновая кислота
в)
t°


 +
H2O
+
H2O
гидролиз
H+
-гидроксимасляная - бутиролактон
кислота (ГОМК)
ГОМК обладает наркотическим действием, нетоксична, применяется в виде натриевой соли как снотворное средство и при неингаляционном наркозе при операциях.
г)


t°

 +
H2O
+
H2O
гидролиз
H+
-гидроксивалериановая - валеролактон
лактон
Лактиды и лактоны могут гидролизоваться в кислой среде с образованием исходных гидроксикислот.
2. Разложение -гидроксикислот при нагревании в присутствии H2SO4:

t°, H2SO4
 CH3–CHO
+ HCOOH
CH3–CHO
+ HCOOH
Многоосновные кислоты ведут себя так же. Например,
а) при нагревании лимонная кислота будет вести себя как -гидроксикислоты:


t°


-Н2О
лимонная
кислота цис-аконитовая
к-та
+ Н2О

против правила
Марковникова
изолимонная кислота
Молочная
(α – гидроксипропионовая (лактаты))
ИЮПАК – 2 гидроксипропановая (2х
атомная и одноосновная) является
продуктом жизнедеятельности ряда
бактерий. Используется как консервант,
предохраняющий от продуктов гниения.
Встречается в виде 2х стереоизомерных
форм
Яблочная
–α гидроксиянтарная (малаты) ИЮПАК
2 гидроксибутандиовая 3 атомная 2 основная
. в рябине, яблоках. Один из продуктов
распада углеводов в организме. Соли
железа (малаты) применяются в медецине
при малокровии. Существ в виде 2х формах.

Винная
(виноградная), или,-дигидроксиянтарная
кислота (тартраты) 2,3-дигидрокси
бутандиовая кислота 4х атомная 2 основная.
Винная кислота — распространённое
природное соединение. В значительном
количестве она содержится в
кисломсокемногих
фруктов, например, ввиноградномсоке.
Соли винной кислоты — тартраты
При пиролизе D-винная кислота декарбоксилируется с образованием пировиноградной СН3СОСООН и пировинной (метилянтарной) НООССН(СН3)СН2СООН кислот. Она восстанавливается до янтарной кислоты, восстанавливает аммиачный раствор AgNO3 до Ag; в щелочной среде растворяет Сu(ОН)2 с образованием прозрачного ярко-синего раствора - реактива Фелинга. Применяется в пищевой промышленности (пищевая добавка Е334), в медицине, ваналитической химиидля обнаружения альдегидов, сахаров и др., в химической и фармакологической промышленности для разделения рацематов органических веществ на изомеры.Соливинной кислоты (тартраты) используются в медицине, при крашениитканей
Лимонная,
или-гидрокси--карбокси-глутаровая
(цитраты) 3-гидрокси-3-карбоксипентандиовая
4х атомная 3 основная. Соли и эфиры
лимонной кислоты называютсяцитратами.
Лимонная кислота, являясь главным
промежуточным продуктом метаболическогоцикла
трикарбоновых кислот, играет важную
роль в системе биохимических
реакцийклеточного
дыханиямножества организмов.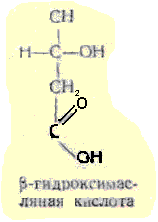
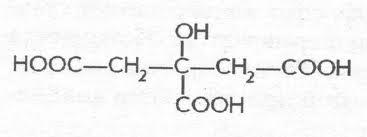
Β - гидроксимасляная 1-3гидроскибутановая - как промежуточный продукт окисления жирных кислот накапливается в организме у больных сахарным диабетом, являясь, в свою очередь, предшественником ацетоуксусной кислоты.
Сложные эфиры можно рассматривать как производные кислот, водород карбоксильной группы которых замещен радикалом (R'). Их можно также рассматривать как производные спиртов, в молекуле которых водород гидроксила замещен остатком кислоты.
Получение сложных эфиров сводится к взаимодействию соответствующих спирта и кислоты в присутствии водоотнимающих средств или действием на спирт ангидридов кислот (амил-нитрит).
Низкомолекулярные сложные эфиры - подвижные жидкости с характерным специфическим запахом, высокомолекулярные - твердые вещества. Все сложные эфиры нерастворимы в воде и хорошо растворимы в органических растворителях. Если эфир образован кислотой, которая является окислителем, то он взрывоопасен, так как возможно внутримолекулярное окисление спирта, например, нитроглицерин.
Характерным свойством сложных эфиров является их способность легко гидролизоваться. Гидролиз катализируется присутствием щелочей, кислот, нагреванием, присутствием окислителей и восстановителей
Глицерин тринаитрат глицерина тринаитрат глицерина взрычатое в-во. В малых концентрациях ( в виде 1% раствора в этаноле) прим как сосудорасширяющее средство.
СН2ОН
СН2О
-NO2
 СН2ОН
3НNO3 H2SO4
СНО -NO2
+ 3H2SO4
(3NO2HSO4 вначале)
СН2ОН
3НNO3 H2SO4
СНО -NO2
+ 3H2SO4
(3NO2HSO4 вначале)
СН2ОН
-3H2 OСН2О -NO2

Билет №12. (Комплект 1)
Адсорбция, физическая и химическая, их особенности. Закономерности адсорбции газов и паров на неподвижной поверхности раздела фаз. Изотермы адсорбции. Теория Лэнгмюра. Полимолекулярная адсорбция.
Адсорбция– процесс поглощение вещества, концентрация которого происходит на поверхности раздела контактирующих фаз.
Адсорбент– компонент, на поверхности которого идет адсорбция.
Адсорбат– компонент, который концентрируется на поверхности адсорбента.
Физическая адсорбцияобусловлена межмолекулярным взаимодействием за счет силВан-дер-Ваальса: ориентационных, индукционных и дисперсионных – или водородной связи.
Особенности: обратимость (адсорбция – десорбция), неспецифичность («подобное о подобном»), экзотермичность (выделение теплоты).
Способствует: снижение температуры, увеличение концентрации поглощаемого вещества или повышение давления в системе при адсорбции газа или пара.
Химическая адсорбцияпроисходит при взаимодействии адсорбента с адсорбатом с образованием химической связи.
Особенности: необратима, специфична и локализована. Повышение температуры при хемосорбции приводит обычно к большему связыванию адсорбата. При любом виде адсорбции изменяются химический состав и свойства поверхности раздела фаз, причем это приводит к уменьшению удельной свободной поверхностной энергии и тем самым обеспечивает самопроизвольное протекание адсорбции.
Удельная адсорбция– это равновесное количество поглощаемого вещества, приходящееся на единицу поверхности или массы твердого адсорбента.
Г=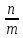 (моль/г)
(моль/г)
Адсорбция газов и паровна твердых адсорбентах является число поверхностным процессом, который заключается во взаимодействии молекул адсорбента с поверхностью адсорбента за счет сил Ван-дер-Ваальса и водородных связей.
Количество поглощенного газа или пара твердым адсорбентом в результате адсорбции зависит от следующих факторов:
- Природы и площади поверхности адсорбента;
- Природы поглощаемого газа или пара;
- Концентрации или давления газа или пара;
- Температуры;
Адсорбция газов и паровна твердых адсорбентах зависит прежде всего от свободной поверхностной энергии, которая весьма велика для адсорбентов с аморфной структурой (активированный уголь) на выступах, впадинах и в капиллярах, а для кристаллических (оксиды кремния, алюминия) – на ребрах, углах и в трещинах кристаллов. Поэтому адсорбент тем эффективней, чем мельче измельчен и чем выше его пористость. Важной характеристикой твердых адсорбентов является удельная поверхностьSуд(м2/г). в зависимости от природы адсорбенты подразделяются на неполярные (гидрофобные) – сажа, активированный уголь, тальк (3MgO*H2O*4SiO2), фторопласт – и полярные (гидрофильные) – силикагель ((SiO2)n), алюмогель ((Al2O3)n), глины, цеолиты.
Адсорбируемость газа или параопределяется его сродством к поверхности адсорбента. Полярные вещества лучше адсорбируются на полярных адсорбентах, а неполярные – на неполярных адсорбентах. При этом, чем больше адсорбат склонен к межмолекулярным взаимодействиям, тем лучше он адсорбируется.
При физической адсорбциииз смеси газов или паров лучше адсобируется тот компонент, который легче сжимается, поскольку его молекулы более склонны к межмолекулярным взаимодействиям.
Влияние концентрации(или давления) газов или паров на процесс адсорбции имеет сложный характер. Одновременно с адсорбцией протекает десорбция адсорбированных молекул в газовую фазу. При равенстве скоростей этих процессов наступает адсорбционное равновесие.
Скорость адсорбциина легкодоступной поверхности больше, а в порах пористых адсорбентом – меньше, причем чем тоньше поры адсорбентам, тем меньше скорости адсорбции.
Графическая зависимостьудельной адсорбции Г от концентрации поглощаемого вещества в системе при постоянной температуре называетсяизотермой адсорбции.
Теория Ленгмюра. Основные положения:
- Адсорбция молекул происходит не на всей поверхности адсорбента, а только на адсорбционных центрах (вершины неровностей и узкие поры), где имеются участки с наиболее нескомпенсированными силовыми полями, т.е. Gsmax.
- Каждый адсорбционный центр может удерживать только одну молекулу адсорбата, при этом адсорбированные молекулы не взаимодействуют со свободными молекулами, что и приводит к образованию мономолекулярного слоя поглощаемого вещества.
- Процесс адсорбции обратим и носит динамический характер, так как адсорбированные молекулы удерживаются адсорбционными центрами только в течение определенного промежутка времени, после чего происходит десорбция этих молекул и адсорбция того же числа новых молекул.
При
больших концентрациях адсорбата в
системе на изотерме адсорбции после
участка, соответствующего насыщению
поверхности, обычно наблюдается резкое
увеличении удельной адсорбции. Это
происходит из-за перехода от мономолекулярной
адсорбции к полимолекулярной вследствие
взаимодействия между адсорбированными
молекулами и наслаивания их друг на
друга. Для пористыхадсорбентов
полимолекулярная адсорбция наблюдается
при адсорбции паров, сопровождающейся
их капиллярной конденсацией. Сначала
пар адсорбируется в порах, а затем
конденсируется в жидкость, заполняя
самые тонки капилляры с образованием
вогнутого мениска.
Учебник:688 – 692.
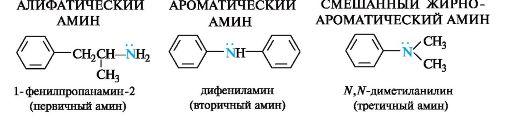
Амины. Классифификация. Химические свойства. Основность по теории Лоури – Бренстеда. Сравните основность этиламина, диэтиламина, триэтиламина, анилина. Напишите реакции взаимодействия анилина с соляной кислотой.
Аминами называются органические производные аммиака, в которых один, два или три атома водорода замещены на углеводородные радикалы (первичные, вторичные и третичные амины).
Все протеиногенные -аминокислоты – за исключением пролина – содержат первичную аминогруппу Классификация аминов разнообразна и определяется тем, какой признак строения взят за основу.
В зависимости от числа органических групп, связанных с атомом азота, различают:
- Первичные амины – одна органическая группа у азота RNH2
- Вторичные амины – две органических группы у азота R2NH, органические группы могут быть различными R'R"NH
- Третичные амины – три органических группы у азота R3N или R'R"R"'N
По типу органической группы, связанной с азотом, различают
- Алифатические СH3 – N<
- Ароматические С6H5 – N< амины, возможны и смешанные варианты.
По числу аминогрупп в молекуле амины делят:
- Моноамины СH3 – NН2,
- Диамины H2N(СH2)2NН2,
- Триамины и т.д.
Сравните Основность этиламина, диэтиламина, триэтиламина, анилина. 2143
В 1923 г. Бренстед и Лоури выдвинули новую теорию кислот и оснований, основанную на представлении о переносе протона. Согласно этой теории, кислота представляет собой вещество, состоящее из молекул или ионов-доноров протонов (т. к. они отдают протоны), а основание-вещество, состоящее из молекул или ионов-акцепторов протонов (т.к. они принимают протоны).
С6Н5NН2 + HCl → С6Н5NН3Сl.
Полисахариды. Классификация. Гомосахариды и полисахариды. Крахмал. Компоненты крахмала – амилоза и амилопектин. Состав. Строение. Виды связей между моносахаридными звеньями. Первичная и вторичная структура. Биологическая роль.
Полисахариды-высокомолекулярные углеводы.
Гомополисахариды состоят из остатков одинаковых моносахаридов;
Гетерополисахариды – из разных.
Важнейшими гомополисахаридами являются целлюлоза, крахмал (амилоза и амилопектин) и гликоген, построенныеиз фрагментовD-глюкозы.
Крахмал – белый аморфный порошок, представляет собой смесь двух различных гомополисахаридов:амилозы (20–30 %) иамилопектина(70–80 %).
Амилоза.Имеет молекулярную массу 150 тыс.-600 тыс. Растворяется в воде.
Первичная структураамилозы – последовательность,D–глюкопиранозных звеньев, соединенных между собой-1,4–гликозидными связями.


Вторичная структурапредставляет собой спираль с шестью остатками молекул,D– глюкопиранозы в каждом витке:
Амилоза дает качественную реакцию с йодом. При этом молекулы йода проникают внутрь витков спирали, образуя соединение включения синего цвета.
Амилопектин
– полисахарид с молекулярной массой
1-6 млн. [Да]. Не растворяется в воде, но в
горячей воде набухает, образуя клейстер.
В отличие от амилозы имеет разветвленную
структуру. В молекуле амилопектина,D-глюкопиранозные
звенья соединяются между собой-1,4–
и-1,6- гликозидными
связями. Между точками ветвлений 20-25
остатков,D–
глюкопиранозы.
Амилопектин образует с йодом комплекс фиолетового цвета.
Амилоза и амилопектин как компоненты крахмала являются главными полисахаридами пищи человека.
Расщепляются пищеварительными ферментами сначала до олигосахаридов (декстринов), затем до мальтозы, а, в конечном счете, до глюкозы, которая всасывается в кровь. Таким образом, крахмал пищи является основным источником глюкозы для человека.
Крахмал обнаруживается в некоторых простейших, бактериях и водорослях, но основным его источником являются семена, плоды, листья и луковицы растений, где содержание крахмала составляет от нескольких процентов до 75 % и более (зерна хлебных злаков). Выполняет в растениях резервную функцию.
Билет №13. (Вариант 1)
Коагуляция гидрофобных коллоидных растворов. Влияние электролитов и смеси электролитов на коагуляцию. Правило Щульце – Гарди. Концентрационный и нейтрализационный механизмы коагуляции. Гетерокоагуляция.
Коагуляцией называется процесс слипания коллоидных частиц с образованием более крупных агрегатов из-за потери коллоидным раствором агрегативной устойчивости. Причиной коагуляции является потеря агрегативной устойчивости коллоидным раствором, а следствием коагуляции – уменьшение его седиментационной устойчивости. Практически коагуляцию можно вызвать различными внешними воздействиями: добавлением небольших количеств электролита концентрированием коллоидного раствора, изменением температуры, действием ультразвука, электромагнитного поля и др.
Коагуляция проявляется в процессе свертывания крови. Свертывание крови играет в организме две противоположные роли: с одной стороны, уменьшает потерю крови при повреждении ткани, с другой – вызывает образование тромбов в кровеносной системе.
Порогом коагуляции называется минимальное количество электролита, которое надо добавить к коллоидному раствору, чтобы вызывать явную коагуляцию (заметную на глаз) – помутнение раствора или изменение его окраски.
Cпк
= , где
, где
Cэл – исходная концентрация раствора электролита;
Vэл – объем раствора электролита, добавленного к коллоидному раствору;
Vкр – объем коллоидного раствора.
Величина, обратная порогу коагуляции, называется коагулирующим действием(у):
У
=

Коагулирующее действие электролитов на коллоидные растворы с ионным стабилизатором подчиняется правилу Шульце – Гарди: «Коагуляцию коллоидных растворов вызывают любые ионы, которые имеют знак заряда, противоположный заряжу гранул. Коагулирующее действие ионов (у) тем сильнее, чем выше заряд иона коагулянта».
Коагулирующее действие иона – коагулянта прямо пропорциональна его заряду в шестой степени: у=f(z6). Например, коагуляция золя AgI с отрицательно заряженными гранулами (потенциалопределяющие ионы – анионы I-) происходит за счет действия положительно заряженных ионов. Поэтому при добавлении к этому золю растворов NaCl, CaCl2, AlCl3 коагулирующее действие катионов Na+, Ca2+, Al3+ будет резко возрастать; y(Na+) :y(Ca2+) : y(Al3+) = 1 : 64 : 729.
Роль
электролитов при
коагуляции заключается в уменьшение
расклинивающего давления между
сближающимися коллоидными частицами.
Это может происходит двумя путями: за
счет уменьшения заряда поверхности
твердой фазы (заряда поверхности ядра),
т.е. за счет снижения межфазного потенциала
![]() фм,
или за счет уменьшения толщины (сжатия)
ионных атмосфер мицелл при неизменном
заряде поверхности их ядер. в связи с
этим возможны два вида
коагуляции:нейтрализационная
и
концентрационная.
фм,
или за счет уменьшения толщины (сжатия)
ионных атмосфер мицелл при неизменном
заряде поверхности их ядер. в связи с
этим возможны два вида
коагуляции:нейтрализационная
и
концентрационная.
Нейтрализационная коагуляция наступает под действием электролита, который химически взаимодействует с потенциалопределяющими ионами, связывая их в прочное соединение (например, переводя в осадок) и тем самым уменьшая заряд поверхности ядра. Это происходит, например, при добавлении K2S к коллоидному раствору AgI с положительно заряженными гранулами (потенциалопределяющие ионы – катионы Ag+). Между анионами и катионами происходит реакция с образованием малорастворимого соединения Ag2S, что приводит к разрушению мицеллы AgI.

В
результате связывания потенциалопределяющих
катионов Ag+
межфазный потенциал
![]() фм
падает и число противоионовNO3-уменьшается.
Таким образом ионные атмосферы вокруг
ядер становятся тоньше, снижается
расклинивающее давление между
сближающимися частицами, а это в свою
очередь приводит к их слипанию в более
крупные агрегаты.
фм
падает и число противоионовNO3-уменьшается.
Таким образом ионные атмосферы вокруг
ядер становятся тоньше, снижается
расклинивающее давление между
сближающимися частицами, а это в свою
очередь приводит к их слипанию в более
крупные агрегаты.
Концентрационнаянаступает под действием электролита, который химические не взаимодействует с ионами стабилизатора и не изменяет заряд поверхности ядра мицеллы. Концентрационная коагуляция наблюдается, например, при добавлении нитратов к коллоидному растворуAgI, мицеллы которого содержат противоионыNO3-.

По мере увеличения концентрации добавляемых ионов NO3-они способствуют внедрению противоионов диффузного слоя в адсорбционный слой. При этом диффузный слой сжимается, и может наступить такое состояние, при котором диффузный слой исчезнет вовсе, и гранула станет электронейтральной в таком состоянии расклинивающее давление между сближающимися частицами минимально, и это приводит к слипанию частиц в более крупные агрегаты.
Существуют тривозможных варианта взаимодействия между электролитами:аддитивное действие,антагонизм исинергизм.
Аддитивность– это суммирование коагулирующего действия ионов, вызывающих коагуляцию. (Электролиты, содержащие коагулирующие ионы, не взаимодействуют химически с собой, KCl, NaNO3)
Антагонизм– это ослабление коагулирующего действия одного электролита в присутствии другого. (осадок выпал,Pb2++ 2Cl-=PbCl2)
Синергизм– это усиление коагулирующего действия одного электролита в присутствии другого. (между электролитами проиходит химическое взаимодействие, в результате которого образуется многозарядный ион, обладающий очень высокой коагулирующей способностью.FeCl3+ 6KCNSF3[Fe(CNS)6] + 3KCl
Гетерокоагуляцией называется коагуляция коллоидных растворов, содержащих разнородные частицы, отличающиеся по химической природе, знаку или величине заряда.
Учебник:720 – 726.
Особенности строения молекулы воды и особенности жидкого состояния воды, ее уникальные физико – химические свойства и ее роль в жизнедеятельности организма. Вода – растворитель газообразных, жидких и твердых веществ.
Большая роль воды в живой природе связана с рядом уникальных ее свойств, благодаря которым вода является средой, растворителем и метаболитом для живых организмов. Вследствие высокой теплоемкости (75,3 Дж/(моль * К)) и большой теплоты испарения (40,8 кДж/моль) вода обеспечивает термостатирование нашего организма. Высокая диэлектрическая проницаемость воды (ԑ=78,5) способствует растворению солей, кислот, основания и их диссоциации на ионы, так как сила электростатического взаимодействия между ионами обратно пропорциональна диэлектрической проницаемости среды.
Высокий дипольный момент молекулы воды (1,82 Д) и способность образовывать четыре водородные связи: две – как донор протонов и две – как акцептор протонов, не только увеличивают растворяющую способность воды по отношению к полярным веществам, но и благоприятствуют формированию определенных структур водных ассоциатов в самой воде, а также у молекул биополимеров в водных растворах. Перечисленные особенности воды и ее низкая вязкость (0,001 Па * с при 293 К) способствуют выполнению ею транспортных функций.
Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений
Наличие в воде различных ассоциатов, имеющих разную структуру и разное время жизни, позволяет обосновать еще одну особенность воды – структурно – информационную память.
Вода – амфолит.
В зависимости от сродства к воде функциональные группы подразделяют на гидрофильные и гидрофобные. К гидрофильным относятся ионы и полярные группы: гидроксильная, амино, карбоксильная, нитро, фосфатная, сульфо. К гидрофобным относятся неполярные группы: углеводородные радикалы предельных и непредельных и ароматических соединений.
Вода является лучшим растворителем для твердых, жидких и газообразных веществ. Мы привыкли к тому, что вода свободно растворяет соли и сахар, и никто этому не удивляется. А что вода растворяет металл, или вместо гниения мертвой органики происходит на самом деле ее растворение - никто над этим даже не задумывается. А ведь все происходит именно так!
Сверхтонкие частицы фемтополя воды, имея высокий энергетический уровень, проникают в твердое пространство и, благодаря отталкивающим силам, возникающим при взаимодействии полей, разрушают его - растворяют. Так, проникая например, в черный металл, частицы фемтополя воды вызывают постепенное разрушение верхнего слоя, а затем происходит его окисление.
В живом организме фемтополе свободной (капиллярной) влаги, взаимодействуя с энергетикой клеток, продвигает по капиллярам питательную среду и обеспечивает биохимический процесс. В мертвой же органике с прекращением биохимического процесса фемтополе внешней влаги, а потом и капиллярной, начинает разрушать клетки - растворять первичную органическую материю клетки проникновением частиц фемтополя воды. Начинается процесс, который принято называть гниением.
Достаточно прекратить доступ внешней и капиллярной влаги к клеткам мертвой органики, как процесс их растворения прекращается. Для длительного сохранения органики необходимо кроме изоляции ее от внешней влаги, удалить полностью капиллярную гигроскопическую воду.
Учебник: 125-134.
Оксокислоты. Общие химические свойства. Реакции на карбонильную и карбоксильную группы. Взаимодействие пировиноградной кислоты с Н2, NH2 – NH2, C6H5 – NH2, C6H5OH иNaOH.
Оксокислоты - называют соединения, содержащие в молекуле одновременно карбоксильную и альдегидную (или кетонную) группы. Они проявляютобщие свойства, присущие альдегидам или кетонам и кислотам, но как кислоты они сильнее соответствующих карбоновых кислот (сказывается –Iэффект карбонильной группы)
П Специфические свойства, обусловленные взаимным влиянием
>C=Oи -COOHгрупп:
1. Расщепление - и- оксокислот при нагревании – декарбоксилирование:
ˉ
 +
+
t°, H2SO4разб.
+
+
t°, H2SO4разб.
а) + CO2
ˉ
t°
комн.
 б)
+ CO2
б)
+ CO2
2. Кето-енольная таутомерия -оксокислот.
+



:
–
кето-форма
енольная форма
ацетоуксусная
кислота (АУК)
Реакции
на карбоксильную группу 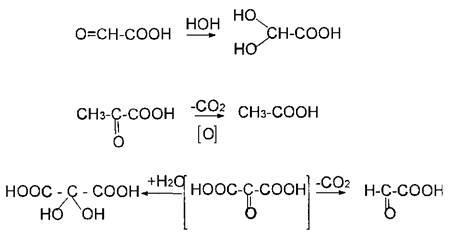

Билет №13. (Вариант 2)
Энергия Гиббса системы, стандартная энергия Гиббса образования вещества. Термодинамические критерии самопроизвольного протекания процесса – общая формулировка II-го закона термодинамики для любых систем.
Энергия Гиббсаявляется обобщенной термодинамической функцией состояния системы, учитывающей энергетику и неупорядоченность системы при изобарно-изотермических условиях.
G=H-TS
Под стандартной энергией Гиббса образования ΔG°, понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии. Это определение подразумевает, что стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю. Термодинамический критерий самопроизвольности протекания процесса:
ΔG< 0 – экзэргонические (самопроизвольные) процессы
ΔG> 0 – эндэргонические процессы
ΔG= 0 – химическое равновесие
Общая формулировка II-го закона термодинамики для любых систем:«В системе при постоянной температуре и давлении самопроизвольно могут совершать только такие процессы, в результате которых энергия Гиббса уменьшается, т.е.ΔGкон < ΔGнач, или ΔG<0.
Учебник: 86 – 88.
Влияние внешних факторов на протекание окислительно – восстановительных реакциях. Рассмотрите это влияние на следующих реакциях:
Факторы: концентрация реагента, температура реакции, наличие катализатора, влияние характера среды.
а) Zn + H2SO4 (разб.) = … ; Zn + H2SO4 (конц.) = … ;
Zn0 + H+12SO4 (разб.) = Zn+2SO4 + H2 (окислитель H+)
Zn0 + H2S+6O4 (конц.) = 3Zn+2SO4 + S0 + 4H2O (окислитель S+6)
б) Cl2+KOH(холод) = … ;Cl2+KOH(горяч.) = … ;
Cl20+KOH(холод) =K-1Cl+KCl+1O+H2O
Cl2+KOH(горяч.) = 5K-1Cl+KCl+5O3 + 3H2O
в) KMnO4 + Na2SO3 + (1) H2SO4 = … + (2) H2O = … + (3)NaOH(в картинкеKOH(!) будьте осторожны)
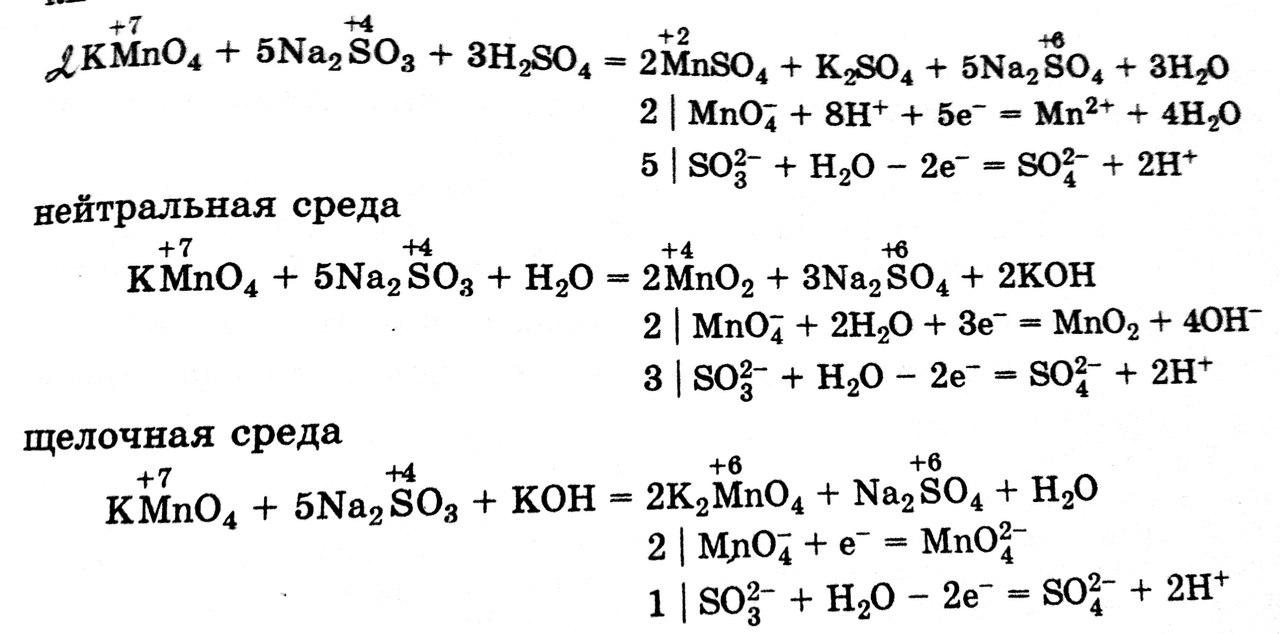
Учебник: 211.
Оптическая активность гидроксикислот и аминокислот. Определение оптической активности у молекул глицериновой кислоты, винной кислоты, глюкозы, рибита, аланина. Укажите условия проявления оптической активности.
Оптическая
активность— это способность среды
(кристаллов, растворов, паров
вещества)вращать
плоскость поляризованного света вправо
и влево.Метод исследования оптической
активности —поляриметрия.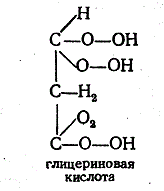
Глицериновая кислотаСН2ОН—СНОН—СООНполучаетсяокислениемглицерина, чаще всего действиемазотной кислоты– оптическинедеятельна.Кристаллизациейсолейбруцинаона может быть разделена наоптические антиподы. Особым окислительнымброжениемглицерина(Bacillus aethaceticus) она может быть получена в виде правовращающегостереоизомера
Рибит
- получается
из L-рибозы при
восстановлении её амальгамой натрия. Кроме
право- и левовращающих, есть и третий
тип изомеров – оптически неактивные.
Это обнаружил в 1830 знаменитый немецкий
химик Йёнс Якоб Берцелиус на
примере виноградной (дигидроксиянтарной)
кислоты НООС–СН(ОН)–СН(ОН)–СООН: эта
кислота оптически неактивна, а винная
кислота точно такого же состава обладает
в растворе правым вращением.
Рибит
Ксилит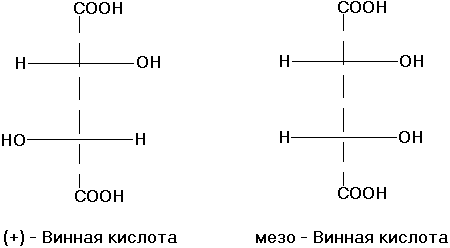
Позднее была открыта и не встречающаяся в природе «левая» винная кислота– антипод правовращающей. Различить оптические изомеры можно с помощью поляриметра – прибора, измеряющего угол поворота плоскости поляризации.
Для
растворов этот угол линейно зависит от
толщины слоя и концентрации оптически
активного вещества (закон Био). Для
разных веществ оптическая активность
может изменяться в очень широких
пределах. Так, в случае водных растворов
разных аминокислот при 25° С удельная
активность (она обозначается как [a]D и
измеряется для света с длиной волны 589
нм при концентрации 1 г/мл и толщине слоя
10 см) для аланина, +13,5°

Глюкозаоптически активна, вращает поляризованный луч вправо. Принадлежность к D или L ряду по хиральному центру наиболее удаленного от оксогруппы. Для медицинских целей употребляютглюкозувпорошкахитаблетках, а также изотонический (4,5—5%) и гипертонический (10—40%)растворы глюкозы.Изотонические растворыприменяют (вводят подкожно и в клизмах) для пополненияорганизмажидкостью; они являются также источником легко усвояемого питательного материала.
Билет №13. (Комплект 1)
Межфазные электрические потенциалы, их виды и причины возникновения. Электродный потенциал и факторы, влияющие на его величину. Стандартный электродный потенциал, его определение. Уравнение Нернста. Метод прямой потенциометрии.
Двойным электрическим слоем (ДЭС) называется упорядоченное распределение противоположно заряженных частиц на межфазной границе.
В зависимости от природы соприкасающихся фаз и характера процессов, протекающих на границе их раздела, различают следующие виды электрических потенциалов:
- Электродный потенциал возникает на границе металл – раствор в результате протекания окислительно – восстановительных реакция на межфазной границе, сопровождаемых переходом катионов металла через нее.
- Восстановительный потенциал возникает на границе инертный электропроводник – раствор, содержащий сопряженную окислительно – восстановительную пару, - в результате протекания окислительно – восстановительных реакций на межфазной границе за счет перехода электронов через нее. (Раньше назывался окислительно – восстановительным)
- Диффузионный потенциал возникает на границе раздела двух различных растворов в результате направленного перехода ионов через границу раздела с разной скоростью.
- Мембранный потенциал возникает на мембране с избирательной проницаемостью, разделяющей два различных раствора, в результате направленного перехода ионов через эту мембрану.
Потенциалопределяющими ионами называют ионы, переход которых через границу раздела приводит к возникновении на ней двойного электрического слоя.
Электродом,
или полуэлементом,
называется система, состоящая из двух
контактирующих разнородных проводников
– электронного (металл) и ионного
(раствор электролита), на межфазной
границе между которыми возникает двойной
электрический слой, характеризующийся
определенным значением потенциала
![]() .
.
Факторы, влияющие на его величину:
Природа металла (энергии его кристаллической решетки, энергии ионизации атомов металла и энергии гидратации его катионов);
Активности (эффективной концентрации) потенциалопределяющих ионов в растворе;
Температуры раствора.
Стандартным электродным потенциалом называется потенциал, возникающий на границе металл – раствора при активности потенциалопределяющих ионов в растворе 1 моль/л и температуре 298 К. Абсолютное значение стандартного электродного потенциала отдельно взятого электрода измерить или рассчитать невозможно, но можно определить его значение относительно какого – либо электрода, выбранного в качестве эталона. Согласно Международному соглашению таким эталоном служит стандартный однородный электрод.
Уравнение Нернста.
Значение электродного потенциала, возникающего на границе металл – раствор, зависит от природы металла, активности его ионов в растворе и от температуры. Влияние всех перечисленных факторов на величину электродного потенциала металла выражается уравнением Неранста:
Потенциометрией
называется физико – химический метод
анализа, позволяющий определять
активности (концентрации) ионов на
основании измерения ЭДС гальванической
цепи, состоящей из электрода сравнений
и электрода определения, опущенных в
исследуемый раствор.
Электродов сравнения называется электрод, потенциал которого практически постоянен, легко воспроизводим и не зависит от протекания побочных реакций.
Стандартный водородный электрод – общепринятый электрод для сравнения. Потенциал его условно принят за ноль при любой температуре.
Электродом
определения
называется электрод, потенциал которого
зависит от активности (концентрации)
анализируемых ионов и практически не
зависит от содержания других ионов в
растворе.

Электродами определения являются ионоселективные электроды, среди которых наибольшее применении находят стеклянные электроды.
Учебник: 652 – 656, 670 – 671.
Оптическая активность гидроксикислот и аминокислот. Определение оптической активности у молекул глицериновой кислоты, винной кислоты, глюкозы, рибита, аланина. Укажите условия проявления оптической активности.
Оптическая
активность— это способность среды
(кристаллов, растворов, паров
вещества)вращать
плоскость поляризованного света вправо
и влево.Метод исследования оптической
активности —поляриметрия.
Глицериновая кислотаСН2ОН—СНОН—СООНполучаетсяокислениемглицерина, чаще всего действиемазотной кислоты– оптическинедеятельна.Кристаллизациейсолейбруцинаона может быть разделена наоптические антиподы. Особым окислительнымброжениемглицерина(Bacillus aethaceticus) она может быть получена в виде правовращающегостереоизомера
Рибит
- получается
из L-рибозы при
восстановлении её амальгамой натрия. Кроме
право- и левовращающих, есть и третий
тип изомеров – оптически неактивные.
Это обнаружил в 1830 знаменитый немецкий
химик Йёнс Якоб Берцелиус на
примере виноградной (дигидроксиянтарной)
кислоты НООС–СН(ОН)–СН(ОН)–СООН: эта
кислота оптически неактивна, а винная
кислота точно такого же состава обладает
в растворе правым вращением.
Рибит
Ксилит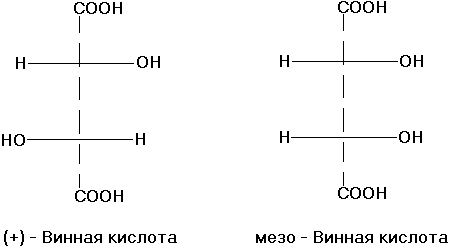
Позднее была открыта и не встречающаяся в природе «левая» винная кислота– антипод правовращающей. Различить оптические изомеры можно с помощью поляриметра – прибора, измеряющего угол поворота плоскости поляризации.
Для
растворов этот угол линейно зависит от
толщины слоя и концентрации оптически
активного вещества (закон Био). Для
разных веществ оптическая активность
может изменяться в очень широких
пределах. Так, в случае водных растворов
разных аминокислот при 25° С удельная
активность (она обозначается как [a]D и
измеряется для света с длиной волны 589
нм при концентрации 1 г/мл и толщине слоя
10 см) для аланина, +13,5°
Глюкозаоптически
активна, вращает поляризованный луч
вправо. Принадлежность
к D
или L
ряду по хиральному центру наиболее
удаленного от оксогруппы. Для
медицинских целей
употребляютглюкозувпорошкахитаблетках,
а также изотонический (4,5—5%) и
гипертонический (10—40%)растворы
глюкозы.Изотонические
растворыприменяют (вводят подкожно
и в клизмах) для пополненияорганизмажидкостью;
они являются также источником легко
усвояемого питательного материала.
Оксикислоты. Структура молочной, яблочной , винной, лимонной, β гидроксимасляной кислоты. Химические свойства. Реакция образования солей и сложных эфиров. Их названия по кислотным остаткам. Биологическая роль.
Оксикислоты–карбоновые кислоты, в которых одновременно содержатсякарбоксильнаягидроксильная группы. Проявляют общие свойствва спиртов и кислот. В зависимости от реагентов и условий проведения реакции. Гидроксикислоты проявляютспецифические свойства, которые обусловлены взаимным влиянием ОН- и СООН- групп.Например, своеобразная реакция отщепления воды при нагревании.
Она
позволяет отличить -,-,-
и другие гидроксикислоты.

а)
t°


гидролиз + 2H2O
+
H+ или OH-
б)


t°

-H2O
-оксимасляная кислота кротоновая кислота
в)
t°


 +
H2O
+
H2O
гидролиз
H+
-гидроксимасляная - бутиролактон
кислота (ГОМК)
ГОМК обладает наркотическим действием, нетоксична, применяется в виде натриевой соли как снотворное средство и при неингаляционном наркозе при операциях.
г)


t°

 +
H2O
+
H2O
гидролиз
H+
-гидроксивалериановая - валеролактон
лактон
Лактиды и лактоны могут гидролизоваться в кислой среде с образованием исходных гидроксикислот.
2. Разложение -гидроксикислот при нагревании в присутствии H2SO4:

t°, H2SO4
 CH3–CHO
+ HCOOH
CH3–CHO
+ HCOOH
Многоосновные кислоты ведут себя так же. Например,
а) при нагревании лимонная кислота будет вести себя как -гидроксикислоты:


t°


-Н2О
лимонная
кислота цис-аконитовая
к-та
+ Н2О

против правила
Марковниковаизолимонная кислота

Молочная (α – гидроксипропионовая (лактаты)) ИЮПАК – 2 гидроксипропановая (2х атомная и одноосновная) является продуктом жизнедеятельности ряда бактерий. Используется как консервант, предохраняющий от продуктов гниения. Встречается в виде 2х стереоизомерных форм
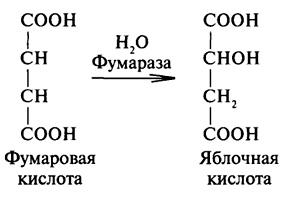
Яблочная –α гидроксиянтарная (малаты) ИЮПАК 2 гидроксибутандиовая 3 атомная 2 основная . в рябине, яблоках. Один из продуктов распада углеводов в организме. Соли железа (малаты) применяются в медецине при малокровии. Существ в виде 2х формах.

Винная (виноградная), или,-дигидроксиянтарная кислота (тартраты) 2,3-дигидрокси бутандиовая кислота 4х атомная 2 основная. Винная кислота — распространённое природное соединение. В значительном количестве она содержится в кисломсокемногих фруктов, например, ввиноградномсоке. Соли винной кислоты — тартрат
При
пиролизе D-винная кислота декарбоксилируется
с образованием пировиноградной СН3СОСООН
и пировинной (метилянтарной)
НООССН(СН3)СН2СООН
кислот. Она восстанавливается до янтарной
кислоты, восстанавливает аммиачный
раствор AgNO3 до
Ag; в щелочной среде растворяет Сu(ОН)2 с
образованием прозрачного ярко-синего
раствора - реактива Фелинга. Применяется
в пищевой промышленности (пищевая
добавка Е334), в медицине, ваналитической
химиидля обнаружения альдегидов,
сахаров и др., в химической и фармакологической
промышленности для разделения рацематов
органических веществ на изомеры.Соливинной
кислоты (тартраты)
используются в медицине, при крашениитканей
Лимонная,
или-гидрокси--карбокси-глутаровая
(цитраты) 3-гидрокси-3-карбоксипентандиовая
4х атомная 3 основная. Соли и эфиры
лимонной кислоты называютсяцитратами.
Лимонная кислота, являясь главным
промежуточным продуктом метаболическогоцикла
трикарбоновых кислот, играет важную
роль в системе биохимических
реакцийклеточного
дыханиямножества организмов.

Β - гидроксимасляная 1-3гидроскибутановая - как промежуточный продукт окисления жирных кислот накапливается в организме у больных сахарным диабетом, являясь, в свою очередь, предшественником ацетоуксусной кислоты.
Сложные эфиры можно рассматривать как производные кислот, водород карбоксильной группы которых замещен радикалом (R'). Их можно также рассматривать как производные спиртов, в молекуле которых водород гидроксила замещен остатком кислоты.
Получение сложных эфиров сводится к взаимодействию соответствующих спирта и кислоты в присутствии водоотнимающих средств или действием на спирт ангидридов кислот (амил-нитрит).
Низкомолекулярные сложные эфиры - подвижные жидкости с характерным специфическим запахом, высокомолекулярные - твердые вещества. Все сложные эфиры нерастворимы в воде и хорошо растворимы в органических растворителях. Если эфир образован кислотой, которая является окислителем, то он взрывоопасен, так как возможно внутримолекулярное окисление спирта, например, нитроглицерин.
Характерным свойством сложных эфиров является их способность легко гидролизоваться. Гидролиз катализируется присутствием щелочей, кислот, нагреванием, присутствием окислителей и восстановителей
Глицерин тринаитрат глицерина тринаитрат глицерина взрычатое в-во. В малых концентрациях ( в виде 1% раствора в этаноле) прим как сосудорасширяющее средство.
СН2ОН
СН2О
-NO2
 СН2ОН
3НNO3 H2SO4
СНО -NO2
+ 3H2SO4
(3NO2HSO4 вначале)
СН2ОН
3НNO3 H2SO4
СНО -NO2
+ 3H2SO4
(3NO2HSO4 вначале)
СН2ОН
-3H2 OСН2О -NO2

Билет №14.
Адсорбция, физическая и химическая, их особенности. Закономерности адсорбции газов и паров на неподвижной поверхности раздела фаз. Изотермы адсорбции. Теория Лэнгмюра. Полимолекулярная адсорбция.
Адсорбция– процесс поглощение вещества, концентрация которого происходит на поверхности раздела контактирующих фаз.
Адсорбент– компонент, на поверхности которого идет адсорбция.
Адсорбат– компонент, который концентрируется на поверхности адсорбента.
Физическая адсорбцияобусловлена межмолекулярным взаимодействием за счет силВан-дер-Ваальса: ориентационных, индукционных и дисперсионных – или водородной связи.
Особенности: обратимость (адсорбция – десорбция), неспецифичность («подобное о подобном»), экзотермичность (выделение теплоты).
Способствует: снижение температуры, увеличение концентрации поглощаемого вещества или повышение давления в системе при адсорбции газа или пара.
Химическая адсорбцияпроисходит при взаимодействии адсорбента с адсорбатом с образованием химической связи.
Особенности: необратима, специфична и локализована. Повышение температуры при хемосорбции приводит обычно к большему связыванию адсорбата. При любом виде адсорбции изменяются химический состав и свойства поверхности раздела фаз, причем это приводит к уменьшению удельной свободной поверхностной энергии и тем самым обеспечивает самопроизвольное протекание адсорбции.
Удельная адсорбция– это равновесное количество поглощаемого вещества, приходящееся на единицу поверхности или массы твердого адсорбента.
Г= (моль/г)
(моль/г)
Адсорбция газов и паровна твердых адсорбентах является число поверхностным процессом, который заключается во взаимодействии молекул адсорбента с поверхностью адсорбента за счет сил Ван-дер-Ваальса и водородных связей.
Количество поглощенного газа или пара твердым адсорбентом в результате адсорбции зависит от следующих факторов:
- Природы и площади поверхности адсорбента;
- Природы поглощаемого газа или пара;
- Концентрации или давления газа или пара;
- Температуры;
Адсорбция газов и паровна твердых адсорбентах зависит прежде всего от свободной поверхностной энергии, которая весьма велика для адсорбентов с аморфной структурой (активированный уголь) на выступах, впадинах и в капиллярах, а для кристаллических (оксиды кремния, алюминия) – на ребрах, углах и в трещинах кристаллов. Поэтому адсорбент тем эффективней, чем мельче измельчен и чем выше его пористость. Важной характеристикой твердых адсорбентов является удельная поверхностьSуд(м2/г). в зависимости от природы адсорбенты подразделяются на неполярные (гидрофобные) – сажа, активированный уголь, тальк (3MgO*H2O*4SiO2), фторопласт – и полярные (гидрофильные) – силикагель ((SiO2)n), алюмогель ((Al2O3)n), глины, цеолиты.
Адсорбируемость газа или параопределяется его сродством к поверхности адсорбента. Полярные вещества лучше адсорбируются на полярных адсорбентах, а неполярные – на неполярных адсорбентах. При этом, чем больше адсорбат склонен к межмолекулярным взаимодействиям, тем лучше он адсорбируется.
При физической адсорбциииз смеси газов или паров лучше адсобируется тот компонент, который легче сжимается, поскольку его молекулы более склонны к межмолекулярным взаимодействиям.
Влияние концентрации(или давления) газов или паров на процесс адсорбции имеет сложный характер. Одновременно с адсорбцией протекает десорбция адсорбированных молекул в газовую фазу. При равенстве скоростей этих процессов наступает адсорбционное равновесие.
Скорость адсорбциина легкодоступной поверхности больше, а в порах пористых адсорбентом – меньше, причем чем тоньше поры адсорбентам, тем меньше скорости адсорбции.
Графическая зависимостьудельной адсорбции Г от концентрации поглощаемого вещества в системе при постоянной температуре называетсяизотермой адсорбции.
Теория Ленгмюра. Основные положения:
- Адсорбция молекул происходит не на всей поверхности адсорбента, а только на адсорбционных центрах (вершины неровностей и узкие поры), где имеются участки с наиболее нескомпенсированными силовыми полями, т.е. Gsmax.
- Каждый адсорбционный центр может удерживать только одну молекулу адсорбата, при этом адсорбированные молекулы не взаимодействуют со свободными молекулами, что и приводит к образованию мономолекулярного слоя поглощаемого вещества.
- Процесс адсорбции обратим и носит динамический характер, так как адсорбированные молекулы удерживаются адсорбционными центрами только в течение определенного промежутка времени, после чего происходит десорбция этих молекул и адсорбция того же числа новых молекул.
При
больших концентрациях адсорбата в
системе на изотерме адсорбции после
участка, соответствующего насыщению
поверхности, обычно наблюдается резкое
увеличении удельной адсорбции. Это
происходит из-за перехода от мономолекулярной
адсорбции к полимолекулярной вследствие
взаимодействия между адсорбированными
молекулами и наслаивания их друг на
друга. Для пористыхадсорбентов
полимолекулярная адсорбция наблюдается
при адсорбции паров, сопровождающейся
их капиллярной конденсацией. Сначала
пар адсорбируется в порах, а затем
конденсируется в жидкость, заполняя
самые тонки капилляры с образованием
вогнутого мениска.
Учебник:688 – 692.
Особенности строения атома серы и серосодержащих природных соединений, их роль в организме. Кислородные соединения серы и их свойства. Круговорот серы в природе.
В периодической системе сера расположена в III периоде, в группе VIA. Электронная конфигурация ее атома 1s22s22p63s23p4. Наличие во внешнем слое двух неспаренных электронов позволяет атому серы образовывать две связи. При возбуждении у атома серы могут возникать состояния с четырьмя неспаренными электронами. При возбуждении у атома серы могут возникать состояния с четырьмя неспаренными электронами s23p33d1 и с шестью неспаренными электронами 3s13p33d2, которые позволяют сере образовывать 4 и 6 связей соответственно. Максимальная степень окисления серы +6 (SO3, H2SO4), а минимальная -2 (H2S).в серосодержащих биосубстратах организма сера обычно имеет минимальную степень окисления (-2), что способствует высокой восстановительной активности этих соединений, особенно соединений, содержащих тиофильную группу (R-SH). Эта группа окисляется в дисульфидную группу (R-S-S-R), содержащую атомы серы со степенью окисления -1.
Серанаходится в пятёркиважнейшихбиоэлементов нашей планеты. Без её участия не может обойтись ни один обменный процесс в организме. Роль серы трудно переоценить т.к. этот макроэлемент является составной частью всех без исключения белков. Сера-обязательная составная часть клеточных структур, тканей, кожные покровы, волосы и т.д.
Кислородныесоединения серы.
Сера с кислородом образует два кислотных оксида: SO2 – оксид серы (IV) и SO3 – оксид серы (VI).
При растворении в воде оксида серы (IV)образует сложную равновесную систему на основе слабой малоустойчивой сернистой кислоты:
SO2+H2OH2SO3
Эта кислота образует два типа солей: средние – сульфиты (Na2SO3,K2SO3) и кислые – гидросульфиты (NaHSO3,KHSO3).
Оксид серы (VI)SO3активно поглощает воду, образуя сильную серную кислоту, которая полностью диссоциирована по первой ступени и в меньшей степени по второй ступени:
SO3+H2OH2SO4
Соли серной кислоты – сульфаты и гидросульфаты – в водном растворе не подвергаются гидролизу по аниону. Многие сульфаты хорошо растворимы в воде и применяются в качестве лекарственных препаратов: Na2SO4* 7H2O– глауберова соль,MgSO4* 7H2O– горькая соль,CuSO4* 5H2O– медный купорос.
Образующаяся в организме эндогенная серная кислота участвует в обезвреживании ядовитых соединений фенола, крезола, индиола, вырабатываемых в кишечнике из аминокислот микробами. С этими соединениями серная кислота образует эфиры сульфаты, которые выводятся из организма с мочой.
В разбавленных растворах серная кислота- окислитель за счёт катионов водорода, которые восстанавливаются до элементарного водорода.
Тиосульфат натрия Na2S2O3. Поскольку один из атомов серы в тиосульфат - ионе эквивалентен атому кислорода, считают, что его степень окисления равна -2, а степень окисления центрального атома серы +6. Тиосульфат - ион проявляет окислительно- восстановительную двойственность, является активным лигандом в реакциях комплексообразования, для него характерны также реакции осаждения.
Круговорот серы в природе.
По содержанию в природе сера - один из распространённых элементов. В земной коре она присутствует в виде свободной серы, сульфидов и сульфатов. Последних много и в гидросфере. Потребности животных в соединениях серы удовлетворяются только за счёт растений, которые усваивают ее в основном из почвы в виде сульфатов и включают в состав серосодержащих белков. В результате сжигания ископаемого топлива, загрязненного серой, и плавки сульфидных руд в атмосферу поступают загрязняющие ее оксиды серы. В круговороте серы большую роль играют аэробные и анаэробные микроорганизмы, которые восстанавливают и окисляют серосодержащие соединения.
Учебник:322 - 331.
Аминокислоты. Классификация альфа – аминокислот на основные физико- химические свойства их радикалов. Примеры каждого класса. Строение. Название. Поведение в водных растворах. Понятие о биполярных ионах. Влияние рН среды на суммарный заряд аминокислот, пептидов. Изоэлектрическая точка.
Аминокислотаминазываются органические соединения, содержащиекарбоксильную и аминогруппу: (NH2)m-R –(COOH)n
Классификация:
1) по количеству СООН- и NH2-групп аминокислоты делятся на моноаминокарбоновые, диаминокарбоновые, моноаминодикарбоновые и т.д.
2) по взаимному расположению двух функциональных групп: ,,- и т.д. аминокислоты.
Изомерия: 1) по строению углеродного скелета; 2) оптическая (стерео) изомерия.
Формула Название Биологическая роль
NH2-CH-COOH* - аланин Входит в состав пеп-
(- аминопро- тидов, белков
СН3 пионовая кислота)
H2N-CH2-CH2-COOH -Аланин Входит в состав
(-аминопро- пантотеновой кислоты
пионовая кислота) (витамина В3)
H2N-CH2-CH2- СН2 –COOH -Аминомасляная Природный транкви-
кислота (ГАМК) лизатор
Примечание: * - оптически активна
С биологической точки зрения огромное значение имеют - аминокислоты. Это «кирпичики», из которых построены молекулы белка –протеиногенные аминокислоты. Основным источником- аминокислот для живого организма служат белки пищи. Большинство- аминокислот синтезируются в организме, но некоторые, необходимые для синтеза белков, не синтезируются в организме или синтезируются в недостаточном количестве и должны поступать извне. Такие аминокислоты называются незаменимыми, это:
Валин, лейцин, изолейцин, фенилаланин, метионин, триптофан, треонин, лизин, гистидин, аргинин.
Классификация -аминокислот.
Общая структурная формула протеиногенных аминокислот:
|
H2N-CH-COOH |
R
Специфические свойстваобусловлены взаимным влиянием двух функциональных групп.-,- и- Аминокислоты при нагревании вступают в реакции, аналогичные реакциям соответствующих оксикислот.
- Аминокислоты при нагревании образуют дикетопиперазины.
Реакция идет межмолекулярно через промежуточное образование дипептидов:
дипептидов:

Дикетопиперазин
2. -Аминокислоты образуютнепредельные кислоты:
t°
 R-CH-CH2-C=O
R-CH=CH-C=O
R-CH-CH2-C=O
R-CH=CH-C=O
-NH3
NH2OHOH
3. - и-Аминокислоты образуют циклические амиды, называемые- и - лактамами. Для них характерно таутомерное превращение (лактамлактим):
t°
 R-CH-CH2-CH2-C=O
R-CH-CH2-CH2-C=O
-H2O
NH2OH
лактам

Лактим
Цвиттер-ион (биполярный ион) — молекула которая, являясь в целом электронейтральной, в своей структуре имеет части, несущие как отрицательный, так и положительный заряды, локализованные на несоседних атомах. К цвитер-ионным соединениям зачастую относят и внутримолекулярные соли (например, внутримолекулярные соли аминокислот) и, иногда, ионные диполярные соединения, в том числе и с зарядами на соседних атомах (например, N-оксиды аминов). Цвиттер-ионные соединения высокополярны и поэтому, как правило, обладают хорошей растворимостью в полярных растворителях (воде, диметилсульфоксиде и т. п.) и слабой — в большинстве органических неполярных растворителей.
Различаются они только боковыми цепями (R-группами), которые у разных аминокислот неодинаковы по структуре, суммарному заряду (полярности) и растворимости в воде (гидрофильности или гидрофобности).
Аминокислоты классифицируют на основе химического строения радикалов, хотя были предложены и другие принципы. Различают ароматические и алифатические аминокислоты, а также аминокислоты, содержащие серу или гидроксильные группы. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группу), то они называются нейтральными аминокислотами. Если же аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой.
Современная рациональная классификация аминокислот основана на полярности радикалов, т.е. способности их к взаимодействию с водой. Она включает четыре класса аминокислот:
неполярные(гидрофобные)
полярные (гидрофильные) незаряженные
отрицательно заряженные
положительно заряженные при физиологических значениях pH
Во всех - -аминокислотах, за исключением глицина,- атом углерода
связан с четырьмя различными замещающими группами и, следовательно, является асимметрическим, или хиральным. Такие молекулы встречаются в двух стереоизомерных формах и проявляют оптическую активность.
Все аминокислоты, входящие в состав молекул белков, являются L-стереоизомерами.
Водные растворы аминокислот окрашиваются в синий цвет при прибавлении небольшого количества сульфата или хлорида меди (II), в особенности после связывания образующихся при этом в растворе ионов водорода буферным раствором. Такая же окраска появляется при кипячении водного или спиртового раствора аминокислоты с окисью меди или с карбонатом меди. Водный раствор аминокислоты после обработки в нейтральной среде карбонатом, окисью, фосфатом или ацетатом меди становится темносиним и при выпаривании выделяет очень красивые кристаллы. Образующиеся соединения в водном растворе ионизованы слабо и, вероятно, представляют собой комплексы, в которых медь связана не только карбоксильной группой, но также, при помощи вторичных валентных связей, азотом. Обычно принято считать, что в этих комплексах на 2 молекулы аминокислоты приходится 1 атом меди.
Влияние рН средына ионизацию аминокислот. Изменение рН среды от кислой до щелочной влияет на заряд растворенных аминокислот. В кислой среде (рН<7) все аминокислоты несут положительный заряд (существуют в виде катиона), так как избыток протонов в среде подавляет диссоциацию карбоксильной группы:

В кислой среде аминокислоты в электрическом поле движутся к катоду.
В щелочной среде (рН>7), где имеется избыток ионов ОН-, аминокислоты находятся в виде отрицательно заряженных ионов (анионов), так как диссоциирует NН+3-группа:
![]()
В этом случае аминокислоты перемещаются в электрическом поле к аноду.
Следовательно, в зависимости от рН среды аминокислоты имеют суммарный нулевой, положительный или отрицательный заряд.
Состояние, в котором заряд аминокислоты равен нулю, называется изоэлектрическим. Значение рН, при котором наступает такое состояние и аминокислота не перемещается в электрическом поле ни к аноду, ни к катоду, называется изоэлектрической точкой и обозначается рНI. Изоэлектрическая точка очень точно отражает кислотно-основные свойства разных групп в аминокислотах и является одной из важных констант, характеризующих аминокислоту.
Изоэлектрическая точка неполярных (гидрофобных) аминокислот приближается к нейтральному значению рН (от 5,5 для фенилаланина до 6,3 для пролина), у кислых она имеет низкие значения (для глутаминовой кислоты 3,2, для аспарагиновой 2,8). Изоэлектрическая точка для цистеина и цистина равна 5,0, что указывает на слабые кислотные свойства этих аминокислот. У основных аминокислот — гистидина и особенно лизина и аргинина — изоэлектрическая точка значительно выше 7.
Билет №15. (Вариант 1)
Буферные системы плазмы крови: Гидрокарбонатная, Белковая и Гидрофосфатная. Основные компоненты и их соотношение в этих системах. Сопряжение гидрокарбонатной и белковой буферных систем. Механизм их действия.
Гидрокарбонатная буферная система образована оксидом углерода (IV), взаимодействие которого с водой приводит к равновесной системе:
CO2+H2O ⇌ CO2*H2O ⇌ H2CO3⇌ H+ + HCO3-
Донор – угольная кислота H2CO3
Акцептор – гидрокарбонат – ион HCO3-‑.
Физиологические условия:
Ka*I= = 7, 95 * 10-7 pKa*I=6,1
= 7, 95 * 10-7 pKa*I=6,1
Стандартные условия:
KaI= = 4,45 * 10-7 pKaI=6,36
= 4,45 * 10-7 pKaI=6,36
pH=pKa(BH)++lg = 6,1 +lg
= 6,1 +lg
Если в кровь поступает кислота и увеличивается концентрация иона водорода, то он, взаимодействуя с HCO3-, смещает равновесие в сторону H2CO3 и приводит к выделению газообразного CO2, который выводится из организма в процессе дыхания через легкие.
H+ + HCO3- ⇌H2CO3⇌CO2 ↑ + H2O
Если в кровь поступает основание, оно связывается с угольной кислотой, и равновесие смещается в сторону HCO3-:
OH- + H2CO3⇌HCO3- + H2O
Главное значение гидрокарбонатного буфера заключается в нейтрализации кислот + обеспечивает 55 % буферной ёмкости крови.
Белковые (протеиновые) буферные системы бывают:
- Анионного типа. Анионный белковый буфер работает при pH>pIбелка и состоит из донора протонов – молекулы белка HProt и акцептора протонов –аниона белка (Prot)-.
H3N+-Prot-COO-⇌ H+ +H2N-Prot-COO-
H2Prot⇌ H+ + (HProt)-
При добавлении кислоты это равновесие смещается в сторону образования молекулы белка, а при добавлении основания в системе увеличивается содержание аниона белка.
- Катионного типа. Катионный белковый буфер работает при pH<pIбелка и состоит из донора протонов – катиона белка (H2Prot)+ и акцептора протона – молекулы белка HProt.
H3N+-Prot-COOH ⇌ H+ +H3N+-Prot-COO-
(H2Prot)+⇌ H+ + HProt
Гидрофосфатная буферная система
В клетках представлена K2HPO4 и KH2PO4, а в плазме крови и межклеточной жидкости Na2HPO4 и NaH2PO4.
Донор – ион H2PO4- (pKa = 6,8)
Акцептор – ион HPO42-
Работа буферной системы описывается уравнением буферного действия:
pH = 6,8 + lg ([HPO42-]/[H2PO4-]) (в норме 4/1)
При увеличении концентрации катионов H+ во внутриклеточной жидкости, например, в результате переработки мясной пищи, происходит их нейтрализация ионами HPO42-
H+ + HPO42- ⇌H2PO4-
При увеличении концентрации оснований в организме, например, при употреблении растительной пищи, они нейтрализуются ионами H2PO4-:
OH- + H2PO4-⇌HPO42- + H2O
Избыточный гидрофосфат и дигидрофосфат выделяется с помощью почек.
Учебник: 197 – 203.
Диффузионный и мембранные потенциалы. Причины их возникновения, факторы, влияющие на их величину. Потенциал покоя и потенциал действия. Регистрация мембранных потенциалов.
Диффузионным потенциалом называется потенциал, возникающий на границе раздела двух растворов, содержащих один и тот же электролит различной концентрации, или двух растворов разных электролитов вследствие различия в подвижности их катионов и анионов.
C1(HCl) >C2(HCl).
При
соприкосновении растворов H+
и Cl-
из более концентрированного раствора
благодаря диффузии будут перемещаться
в разбавленный раствор. Подвижность H+
больше. В разбавленный раствор в единицу
времени ионов H+
переместится больше, чем ионов Cl-.
В результате этого в разбавленном
растворе на границе раздела зарядится
положительно за счет более быстрых
ионов H+,
а концентрированный раствор – отрицательно
за счет медленных ионов Cl-.
Образуется ДЭС.
В биологических системах диффузионный потенциал проявляется при механическом повреждении клеток. Из места повреждения ионы перемещаются в межклеточную жидкость, в результате возникает диффузионный потенциал.
Мембранным потенциалом называется потенциал, возникающий между сторонами мембраны с избирательной проницаемость, разделяющей два раствора различного состава.
Величину мембранного потенциала можно определить, составив гальваническую цепь, в которой в растворы, разделенные мембраной с избирательной проницаемостью, опущены два электрода сравнения:
ЭДС
такой гальванической цепи характеризует
величину мембранного потенциала.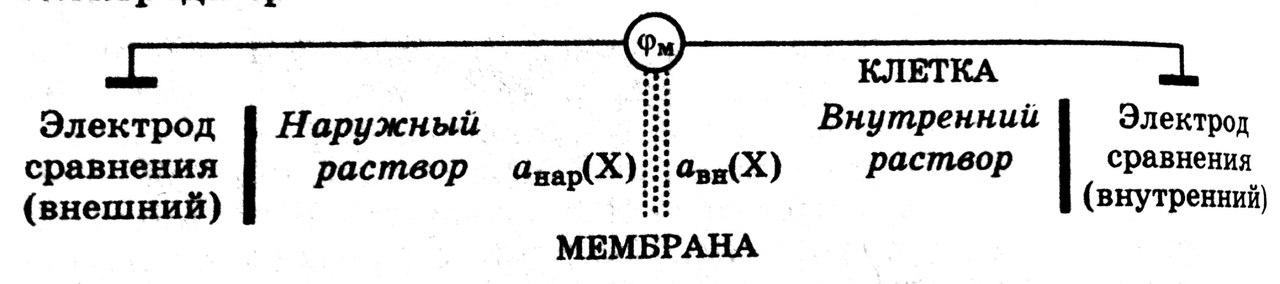
Мембранный потенциал зависит от отношения активностей ионов в растворах, разделенных мембраной, и от свойств мембраны.
 Потенциалом
покоя называется
мембранный потенциал, возникающий между
внутренней и наружной сторонами клеточной
мембраны, находящейся в невозбужденном
состоянии.
Потенциалом
покоя называется
мембранный потенциал, возникающий между
внутренней и наружной сторонами клеточной
мембраны, находящейся в невозбужденном
состоянии.
Определить потенциал покоя можно с помощью двух микроэлектродов сравнения, вводимых внутрь клетки и в наружный раствор. (-70 – 90)
При раздражение клетки химическим, электрическим или механическим воздействием она переходит в возбужденное состояние, при этом проницаемость ее мембраны для ионов Na+ становится значительно выше. Чем для K+. Поэтому ионы Na+ из наружного раствора, где их концентрация в 9 раз выше, чем внутри клетки, устремляются через клеточную мембрану во внутренний раствор. Ионы Na+ переносят положительный заряд с наружной поверхности мембраны и перезаряжает ее внутреннюю поверхность, меняя знак заряда с «-» на «+» и вызывая быструю деполяризацию мембрану. После прекращения возбуждения мембрана вновь становится проницаемой для ионов K+ и непроницаемой для Na+. Ионы K+ опять выходят из клетки в соответствии с градиентом концентрации, унося с собой положительный заряд до тех пор, пока на мембране не восстановится потенциал покоя, т.е. не произойдет реполяризация мембраны.
Потенциалом действия называется амплитуда (120-140 мВ) колебания (деполяризация и реполяризация) мембранного потенциала, возникающая при возбуждении клеточной мембраны.
Не только K+Na+, но и Ca2+, Cl-, H+ и других ионов.
Генерирование мембранного потенциала связано с работой сердца, мозга, мышц. Электрические потенциалы, возникающие при деятельности сердца, можно регистрировать с помощью электрокардиографа на электрокардиограмме. Электрокардиограмма – важнейшая характеристика сердечной деятельности. Биоэлектрические потенциалы мозга регистрируются на электроэнцефалограмме, мышц – на электромиограмме, желудка – на электрогастрограмме и т.д.
Учебник: 664 – 670.
Амины. Классифификация. Химические свойства. Основность по теории Лоури – Бренстеда. Сравните основность этиламина, диэтиламина, триэтиламина, анилина. Напишите реакции взаимодействия анилина с соляной кислотой.
Аминами называются органические производные аммиака, в которых один, два или три атома водорода замещены на углеводородные радикалы (первичные, вторичные и третичные амины).
Все протеиногенные -аминокислоты – за исключением пролина – содержат первичную аминогруппу Классификация аминов разнообразна и определяется тем, какой признак строения взят за основу.
В зависимости от числа органических групп, связанных с атомом азота, различают:
- Первичные амины – одна органическая группа у азота RNH2
- Вторичные амины – две органических группы у азота R2NH, органические группы могут быть различными R'R"NH
- Третичные амины – три органических группы у азота R3N или R'R"R"'N
По типу органической группы, связанной с азотом, различают
- Алифатические СH3 – N<
- Ароматические С6H5 – N< амины, возможны и смешанные варианты.
По числу аминогрупп в молекуле амины делят:
- Моноамины СH3 – NН2,
- Диамины H2N(СH2)2NН2,
- Триамины и т.д.
Сравните Основность этиламина, диэтиламина, триэтиламина, анилина. 2143
В 1923 г. Бренстед и Лоури выдвинули новую теорию кислот и оснований, основанную на представлении о переносе протона. Согласно этой теории, кислота представляет собой вещество, состоящее из молекул или ионов-доноров протонов (т. к. они отдают протоны), а основание-вещество, состоящее из молекул или ионов-акцепторов протонов (т.к. они принимают протоны).

С6Н5NН2 + HCl → С6Н5NН3Сl.
Нуклеофильные свойства аминов. Реакции алкилирования по Гофману на примере метиламина с CH3J.Реакция алкилирования аминов на примере анилина с уксусной кислотой.
Нуклеофильные свойства
Алкилирование аминов
Амины обладают нуклеофильными свойствами и алкилируются алкилгалогенидами и спиртами.
Ацилирование аминов
Амины ацилируются карбоновыми кислотами и их производными с образованием амидов карбоновых кислот.
2RNH2 + R/COX ® R/CONHR + RNH3X
2R2NH + R/COX ® R/CONR2 + R2NH2X
(X=Cl,
OCOR/)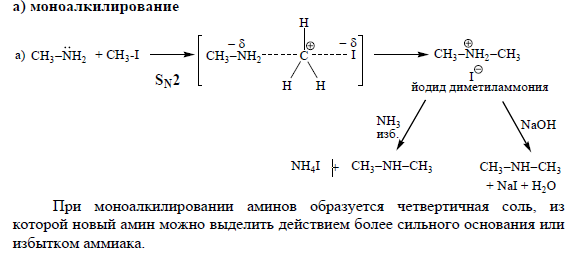
б) Исчерпывающее метилалирование – реакция амина с избытком йодистого
метила
(возможно исчерпывающее алкилирование).
Билет №15. (Вариант 2)
Коагуляция гидрофобных коллоидных растворов. Влияние электролитов и смеси электролитов на коагуляцию. Правило Щульце – Гарди. Концентрационный и нейтрализационный механизмы коагуляции. Гетерокоагуляция.
Коагуляцией называется процесс слипания коллоидных частиц с образованием более крупных агрегатов из-за потери коллоидным раствором агрегативной устойчивости. Причиной коагуляции является потеря агрегативной устойчивости коллоидным раствором, а следствием коагуляции – уменьшение его седиментационной устойчивости. Практически коагуляцию можно вызвать различными внешними воздействиями: добавлением небольших количеств электролита концентрированием коллоидного раствора, изменением температуры, действием ультразвука, электромагнитного поля и др.
Коагуляция проявляется в процессе свертывания крови. Свертывание крови играет в организме две противоположные роли: с одной стороны, уменьшает потерю крови при повреждении ткани, с другой – вызывает образование тромбов в кровеносной системе.
Порогом коагуляции называется минимальное количество электролита, которое надо добавить к коллоидному раствору, чтобы вызывать явную коагуляцию (заметную на глаз) – помутнение раствора или изменение его окраски.
Cпк
= , где
, где
Cэл – исходная концентрация раствора электролита;
Vэл – объем раствора электролита, добавленного к коллоидному раствору;
Vкр – объем коллоидного раствора.
Величина, обратная порогу коагуляции, называется коагулирующим действием(у):
У
=
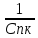
Коагулирующее действие электролитов на коллоидные растворы с ионным стабилизатором подчиняется правилу Шульце – Гарди: «Коагуляцию коллоидных растворов вызывают любые ионы, которые имеют знак заряда, противоположный заряжу гранул. Коагулирующее действие ионов (у) тем сильнее, чем выше заряд иона коагулянта».
Коагулирующее действие иона – коагулянта прямо пропорциональна его заряду в шестой степени: у=f(z6). Например, коагуляция золя AgI с отрицательно заряженными гранулами (потенциалопределяющие ионы – анионы I-) происходит за счет действия положительно заряженных ионов. Поэтому при добавлении к этому золю растворов NaCl, CaCl2, AlCl3 коагулирующее действие катионов Na+, Ca2+, Al3+ будет резко возрастать; y(Na+) :y(Ca2+) : y(Al3+) = 1 : 64 : 729.
Роль
электролитов при
коагуляции заключается в уменьшение
расклинивающего давления между
сближающимися коллоидными частицами.
Это может происходит двумя путями: за
счет уменьшения заряда поверхности
твердой фазы (заряда поверхности ядра),
т.е. за счет снижения межфазного потенциала
![]() фм,
или за счет уменьшения толщины (сжатия)
ионных атмосфер мицелл при неизменном
заряде поверхности их ядер. в связи с
этим возможны два вида
коагуляции:нейтрализационная
и
концентрационная.
фм,
или за счет уменьшения толщины (сжатия)
ионных атмосфер мицелл при неизменном
заряде поверхности их ядер. в связи с
этим возможны два вида
коагуляции:нейтрализационная
и
концентрационная.
Нейтрализационная коагуляция наступает под действием электролита, который химически взаимодействует с потенциалопределяющими ионами, связывая их в прочное соединение (например, переводя в осадок) и тем самым уменьшая заряд поверхности ядра. Это происходит, например, при добавлении K2S к коллоидному раствору AgI с положительно заряженными гранулами (потенциалопределяющие ионы – катионы Ag+). Между анионами и катионами происходит реакция с образованием малорастворимого соединения Ag2S, что приводит к разрушению мицеллы AgI.

В
результате связывания потенциалопределяющих
катионов Ag+
межфазный потенциал
![]() фм
падает и число противоионовNO3-уменьшается.
Таким образом ионные атмосферы вокруг
ядер становятся тоньше, снижается
расклинивающее давление между
сближающимися частицами, а это в свою
очередь приводит к их слипанию в более
крупные агрегаты.
фм
падает и число противоионовNO3-уменьшается.
Таким образом ионные атмосферы вокруг
ядер становятся тоньше, снижается
расклинивающее давление между
сближающимися частицами, а это в свою
очередь приводит к их слипанию в более
крупные агрегаты.
Концентрационнаянаступает под действием электролита, который химические не взаимодействует с ионами стабилизатора и не изменяет заряд поверхности ядра мицеллы. Концентрационная коагуляция наблюдается, например, при добавлении нитратов к коллоидному растворуAgI, мицеллы которого содержат противоионыNO3-.

По мере увеличения концентрации добавляемых ионов NO3-они способствуют внедрению противоионов диффузного слоя в адсорбционный слой. При этом диффузный слой сжимается, и может наступить такое состояние, при котором диффузный слой исчезнет вовсе, и гранула станет электронейтральной в таком состоянии расклинивающее давление между сближающимися частицами минимально, и это приводит к слипанию частиц в более крупные агрегаты.
Существуют тривозможных варианта взаимодействия между электролитами:аддитивное действие,антагонизм исинергизм.
Аддитивность– это суммирование коагулирующего действия ионов, вызывающих коагуляцию. (Электролиты, содержащие коагулирующие ионы, не взаимодействуют химически с собой, KCl, NaNO3)
Антагонизм– это ослабление коагулирующего действия одного электролита в присутствии другого. (осадок выпал,Pb2++ 2Cl-=PbCl2)
Синергизм– это усиление коагулирующего действия одного электролита в присутствии другого. (между электролитами проиходит химическое взаимодействие, в результате которого образуется многозарядный ион, обладающий очень высокой коагулирующей способностью.FeCl3+ 6KCNSF3[Fe(CNS)6] + 3KCl
Гетерокоагуляцией называется коагуляция коллоидных растворов, содержащих разнородные частицы, отличающиеся по химической природе, знаку или величине заряда.
Учебник:720 – 726.
Особенности строения молекулы воды и особенности жидкого состояния воды, ее уникальные физико – химические свойства и ее роль в жизнедеятельности организма. Вода – растворитель газообразных, жидких и твердых веществ.
Большая роль воды в живой природе связана с рядом уникальных ее свойств, благодаря которым вода является средой, растворителем и метаболитом для живых организмов. Вследствие высокой теплоемкости (75,3 Дж/(моль * К)) и большой теплоты испарения (40,8 кДж/моль) вода обеспечивает термостатирование нашего организма. Высокая диэлектрическая проницаемость воды (ԑ=78,5) способствует растворению солей, кислот, основания и их диссоциации на ионы, так как сила электростатического взаимодействия между ионами обратно пропорциональна диэлектрической проницаемости среды.
Высокий дипольный момент молекулы воды (1,82 Д) и способность образовывать четыре водородные связи: две – как донор протонов и две – как акцептор протонов, не только увеличивают растворяющую способность воды по отношению к полярным веществам, но и благоприятствуют формированию определенных структур водных ассоциатов в самой воде, а также у молекул биополимеров в водных растворах. Перечисленные особенности воды и ее низкая вязкость (0,001 Па * с при 293 К) способствуют выполнению ею транспортных функций.
Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений
Наличие в воде различных ассоциатов, имеющих разную структуру и разное время жизни, позволяет обосновать еще одну особенность воды – структурно – информационную память.
Вода – амфолит.
В зависимости от сродства к воде функциональные группы подразделяют на гидрофильные и гидрофобные. К гидрофильным относятся ионы и полярные группы: гидроксильная, амино, карбоксильная, нитро, фосфатная, сульфо. К гидрофобным относятся неполярные группы: углеводородные радикалы предельных и непредельных и ароматических соединений.
Вода является лучшим растворителем для твердых, жидких и газообразных веществ. Мы привыкли к тому, что вода свободно растворяет соли и сахар, и никто этому не удивляется. А что вода растворяет металл, или вместо гниения мертвой органики происходит на самом деле ее растворение - никто над этим даже не задумывается. А ведь все происходит именно так!
Сверхтонкие частицы фемтополя воды, имея высокий энергетический уровень, проникают в твердое пространство и, благодаря отталкивающим силам, возникающим при взаимодействии полей, разрушают его - растворяют. Так, проникая например, в черный металл, частицы фемтополя воды вызывают постепенное разрушение верхнего слоя, а затем происходит его окисление.
В живом организме фемтополе свободной (капиллярной) влаги, взаимодействуя с энергетикой клеток, продвигает по капиллярам питательную среду и обеспечивает биохимический процесс. В мертвой же органике с прекращением биохимического процесса фемтополе внешней влаги, а потом и капиллярной, начинает разрушать клетки - растворять первичную органическую материю клетки проникновением частиц фемтополя воды. Начинается процесс, который принято называть гниением.
Достаточно прекратить доступ внешней и капиллярной влаги к клеткам мертвой органики, как процесс их растворения прекращается. Для длительного сохранения органики необходимо кроме изоляции ее от внешней влаги, удалить полностью капиллярную гигроскопическую воду.
Учебник: 125-134.
3) Оксикислоты. Структура молочной, яблочной , винной, лимонной, β гидроксимасляной кислоты. Химические свойства. Реакция образования солей и сложных эфиров. Их названия по кислотным остаткам. Биологическая роль.
Оксикислоты–карбоновые кислоты, в которых одновременно содержатсякарбоксильнаягидроксильная группы. Проявляют общие свойствва спиртов и кислот. В зависимости от реагентов и условий проведения реакции. Гидроксикислоты проявляютспецифические свойства, которые обусловлены взаимным влиянием ОН- и СООН- групп.Например, своеобразная реакция отщепления воды при нагревании.
Она
позволяет отличить -,-,-
и другие гидроксикислоты.

а)
t°


гидролиз + 2H2O
+
H+ или OH-
б)


t°

-H2O
-оксимасляная кислота кротоновая кислота
в)
t°


 +
H2O
+
H2O
гидролиз
H+
-гидроксимасляная - бутиролактон
кислота (ГОМК)
ГОМК обладает наркотическим действием, нетоксична, применяется в виде натриевой соли как снотворное средство и при неингаляционном наркозе при операциях.
г)


t°

 +
H2O
+
H2O
гидролиз
H+
-гидроксивалериановая - валеролактон
лактон
Лактиды и лактоны могут гидролизоваться в кислой среде с образованием исходных гидроксикислот.
2. Разложение -гидроксикислот при нагревании в присутствии H2SO4:

t°, H2SO4
 CH3–CHO
+ HCOOH
CH3–CHO
+ HCOOH
Многоосновные кислоты ведут себя так же. Например,
а) при нагревании лимонная кислота будет вести себя как -гидроксикислоты:


t°


-Н2О
лимонная
кислота цис-аконитовая
к-та
+ Н2О

против правила
Марковникова
изолимонная кислота
Молочная
(α – гидроксипропионовая (лактаты))
ИЮПАК – 2 гидроксипропановая (2х
атомная и одноосновная) является
продуктом жизнедеятельности ряда
бактерий. Используется как консервант,
предохраняющий от продуктов гниения.
Встречается в виде 2х стереоизомерных
форм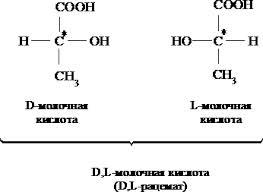

Яблочная –α гидроксиянтарная (малаты) ИЮПАК 2 гидроксибутандиовая 3 атомная 2 основная . в рябине, яблоках. Один из продуктов распада углеводов в организме. Соли железа (малаты) применяются в медецине при малокровии. Существ в виде 2х формах.

Винная
(виноградная), или,-дигидроксиянтарная
кислота (тартраты) 2,3-дигидрокси
бутандиовая кислота 4х атомная 2 основная.
Винная кислота — распространённое
природное соединение. В значительном
количестве она содержится в
кисломсокемногих
фруктов, например, ввиноградномсоке.
Соли винной кислоты — тартраты
При пиролизе D-винная кислота декарбоксилируется с образованием пировиноградной СН3СОСООН и пировинной (метилянтарной) НООССН(СН3)СН2СООН кислот. Она восстанавливается до янтарной кислоты, восстанавливает аммиачный раствор AgNO3 до Ag; в щелочной среде растворяет Сu(ОН)2 с образованием прозрачного ярко-синего раствора - реактива Фелинга. Применяется в пищевой промышленности (пищевая добавка Е334), в медицине, ваналитической химиидля обнаружения альдегидов, сахаров и др., в химической и фармакологической промышленности для разделения рацематов органических веществ на изомеры.Соливинной кислоты (тартраты) используются в медицине, при крашениитканей
Лимонная,
или-гидрокси--карбокси-глутаровая
(цитраты) 3-гидрокси-3-карбоксипентандиовая
4х атомная 3 основная. Соли и эфиры
лимонной кислоты называютсяцитратами.
Лимонная кислота, являясь главным
промежуточным продуктом метаболическогоцикла
трикарбоновых кислот, играет важную
роль в системе биохимических
реакцийклеточного
дыханиямножества организмов.
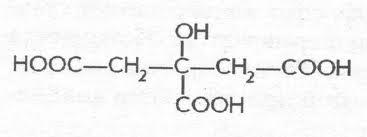
Β - гидроксимасляная 1-3гидроскибутановая - как промежуточный продукт окисления жирных кислот накапливается в организме у больных сахарным диабетом, являясь, в свою очередь, предшественником ацетоуксусной кислоты.
Сложные эфиры можно рассматривать как производные кислот, водород карбоксильной группы которых замещен радикалом (R'). Их можно также рассматривать как производные спиртов, в молекуле которых водород гидроксила замещен остатком кислоты.
Получение сложных эфиров сводится к взаимодействию соответствующих спирта и кислоты в присутствии водоотнимающих средств или действием на спирт ангидридов кислот (амил-нитрит).
Низкомолекулярные сложные эфиры - подвижные жидкости с характерным специфическим запахом, высокомолекулярные - твердые вещества. Все сложные эфиры нерастворимы в воде и хорошо растворимы в органических растворителях. Если эфир образован кислотой, которая является окислителем, то он взрывоопасен, так как возможно внутримолекулярное окисление спирта, например, нитроглицерин.
Характерным свойством сложных эфиров является их способность легко гидролизоваться. Гидролиз катализируется присутствием щелочей, кислот, нагреванием, присутствием окислителей и восстановителей
Глицерин тринаитрат глицерина тринаитрат глицерина взрычатое в-во. В малых концентрациях ( в виде 1% раствора в этаноле) прим как сосудорасширяющее средство.
СН2ОН
СН2О
-NO2
 СН2ОН
3НNO3 H2SO4
СНО -NO2
+ 3H2SO4
(3NO2HSO4 вначале)
СН2ОН
3НNO3 H2SO4
СНО -NO2
+ 3H2SO4
(3NO2HSO4 вначале)
СН2ОН
-3H2 OСН2О -NO2

Билет №16. (Вариант 1) ( = Варианту 25)
Молекулярная адсорбция из растворов на твердых адсорбентах. Факторы, влияющие на этот процесс. Основные правила молекулярной адсорбции из растворов (Шилова и Ребиндера). Выбора эффективного адсорбента. Понятие о лимфосорбции и гемосорбции.
Существенное отличие адсорбции веществ из раствора от адсорбции из газовой фазы заключается в конкуренциимежду растворенным веществом и растворителем за возможность взаимодействовать с адсорбционными центрами на поверхности твердого адсорбента. Молекулярная адсорбция зависит от следующихфакторов:
Природы адсорбента;
Природы растворителя;
Природы поглощаемого вещества (адсорбата);
Концентрации раствора;
Температуры.
Влияние природы адсорбента на процесс молекулярной адсорбции из раствора определяется, как и в случае адсорбции газов, удельной поверхностью адсорбента и его сродствомк поглощаемому веществу.Гидрофильные адсорбенты(силикагель, глины, пористые стекла) хорошо поглощают полярные вещества, а гидрофобные (сажа, активированный уголь) –неполярные вещества.
Природа растворителя должна сильно отличаться от природы растворенного вещества и природы адсорбента. Только в этом случае адсорбция вещества из раствора будет эффективной. Другими словами: чем хуже данный растворитель смачивает поверхность адсорбента и чем хуже растворяет вещество, тем лучше будет происходить адсорбция растворенного вещества.
Влияние природы поглощаемого вещества определяется несколькими правилами. Во-первых, правилом«подобное взаимодействует с подобным», которое указывает на необходимость сродства между адсорбируемым веществом и адсорбентом.Во-вторых,правилом Николая Александровича Шилова: «Чем больше растворимость вещества в данном растворителе, тем хуже оно адсорбируется на поверхности твердого адсорбента».В-третьих,правилом выравнивания полярностей контактирующих фаз, сформулированнымиПетром Александровичем Ребиндером: «на поверхности раздела фаз прежде всего адсорбируются те вещества, при адсорбции которых происходит выравнивание полярностей соприкасающихся фаз, причем с увеличением разности полярности фаз способность к адсорбции этих веществ возрастает».
Поэтому эффективней всего адсорбируются вещества, молекулы которых дифильны(головастик).
Влияние концентрации растворенного вещества на процесс его адсорбции из раствора при постоянной температуре также описывается уравнением Ленгмюра.
При повышении температуры адсорбция веществ из растворов обычно уменьшается.
При отравлениях используется активированный уголь, способный адсорбировать газы, алкалоиды, барбитураты, токсины из пищеварительной системы. Одна таблетка активированного угля массой 0,25 г имеет адсорбционную поверхность около 100 м2. С его помощью осуществляют также сорбционную детоксикацию крови и лимфы больного путем перфузии (пропуская их через активированный уголь). При гемосорбции и лимфосорбции биологические системы очищаются от барбитуратов, дихлорэтана, фосфорорганических соединений, алкалоидов и токсинов.
Учебник:692 – 694.
Полисахариды. Гликоген. Состав. Структура. Виды связей между моносахаридными зввеньями. Отличие от крахмала. Взаимосвязь структуры и функций.
Гликогенимеет молекулярную массу до 100млн. В структурном отношении похож на амилопектин, но более разветвлен. Основные типы связей:-1,4 - и-1,6- гликозидные. Между точками ветвлений – 5-6 остатков,D– глюкопиранозы.
Гликоген– резервный углевод высших животных и человека («животный крахмал»). Образуется и накапливается в печени и в мышцах, а при необходимости очень быстро расщепляется до глюкозы (в печени), или до молочной кислоты (в мышцах), чему способствует большое количество концевых остатков, т.е.разветвленность молекулы. Значительная молекулярная масса гликогена позволяет запасать большое количество глюкозы в клетках.

В животных организмах этот полисахарид является структурным и функциональным аналогом растительного крахмала. По строению подобен амилопектину, но имеет еще большее разветвление цепей. Обычно между точками разветвления содержатся 10-12 глюкозных звеньев, иногда даже 6, условно можно сказать, что разветвленность макромолекулы гликогена вдвое больше, чем амилопектина. Сильное разветвление способствует выполнению гликогеном энергетической функции так как только при наличии большого числа концевых остатков можно обеспечить быстрое отщепление нужного количества глюкозы.
Гликоген — белый аморфный порошок, растворяющийся в воде с образованием опалесцирующих растворов. Растворы гликогена дают с иодом окрашивание от винно-красного и красно-бурого до красно-фиолетового цвета (отличие от крахмала).
3) Аминокислоты,их амфотерность + реакции трех аминокислот с NaOH и HCl
Билет №16. (Вариант 2)
Фазовые равновесия. Диаграмма состояния воды. Давление насыщенного пара над растворами. I – ый закон Рауля. Температура кипения и кристаллизации растворов. II – ой закон Рауля, его применение к реальным системам.
Фазовые равновесия:
При температуре кипения в равновесии сосуществуют две фазы: жидкая и пар.
Температура кипения жидкости– это температура, при которой давление насыщенного пара над жидкостью становится равным внешнему давлению.
При температуре замерзания в равновесии сосуществуют три фазы: твердая, жидкая и пар.
Температура замерзания жидкости– это температура, при которой давление насыщенного пара над жидкостью становится равным давлению насыщенного пара над кристаллами этой жидкости.
Фазовая диаграмма воды
Линия Ap0– линия испарения, разделяющая жидкое и парообразное состояния, - определяет значение давления и температуры, при которых осуществляется кипение чистой воды.
Линия AB– линия плавление – показывает условия существования двухфазной жидкой системы лед – жидкая вода.
Линия AD– линия сублимации – разграничивает твердое и парообразное состояния воды.
В тройной точке A, отвечающей температуре замерзания воды или плавления льда при внешнем давлении, равном давлению насыщенного пара (+0,01oС; 0,006 атм), находясь в равновесии друг с другом, одновременно сосуществуют все три фазы: твердая, жидкая и парообразная.

Давление пара, при котором при данной температуре в системе «жидкость – пар» наступаетдинамическое равновесие, характеризующееся равенством скоростей испарений и конденсации (Uисп=Uконд), называетсядавлением насыщенного пара.
Франсуа Мари Рауль (1886)сформировал свойпервый законследующим образом:
«При постоянной температуре относительное понижение давления насыщенного пара растворителя над идеальным раствором нелетучего вещества равно молярной доле растворенного вещества».
(p0–p)/p0=n/(n+N)
Температура кипения раствора нелетучего вещества всегда выше, чем температура кипения чистого растворителя.
Температура замерзания вещества всегда ниже, чем температура замерзания чистого растворителя.
Второй закон Франсуа Мари Рауля:
«повышение температуры кипения или понижение температуры замерзания идеальных растворов нелетучих веществ прямо пропорционально моляльной концентрации раствора:
 кип=Kэбb(X)
(Kэб
– эбулиоскопическая константа)
кип=Kэбb(X)
(Kэб
– эбулиоскопическая константа)
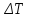 зам=Kкрb(X)
(Kкр
–
криоскопическая константа)
зам=Kкрb(X)
(Kкр
–
криоскопическая константа)
Для реальных растворов в формулы вводится изотонический коэффициент, так как для реальных растворов нужно учитывать межмолекулярные взаимодействия:
 кип=iKэбb(X)
кип=iKэбb(X)
 зам=iKкрb(X)
зам=iKкрb(X)
Законы Франсуа Мари Рауля используются для экспериментальных методов определения молярных масс растворимых веществ – эбулиоскопии и криоскопии основанных на измерении температуры кипения и температуре замерзания растворов этих веществ.
Учебник: 149-152.
Классификация распространенность химических элементов в организме человека и в окружающей среде. Особенности строения атомов углерода и его химических связей с элементами – органогенами. Кислотно – основные, окислительно – восстановительные и комплексообразующие свойства соединений углерода.
Органогены–шестьхимических элементов: углерод, водород, кислород, азот, фосфор и сера. Общая массовая доля этих элементов в организме человека составляет 97,3 %. Из нихC-21,0,H-9,7,O-62,4,N-3,1,P-0,95 иS-0,16 %. Для них характерно разнообразие образуемых ими связей, следовательно, многообразие биомолекул.
Металлы жизни–десятьэлементов:K,Na,Ca,Mg,Mn,Fe,Co,Cu,Zn,Mo. На их долю в организме приходится 2,4 %. Все металлы жизни в организме или находятся в виде свободных катионов, или являются ионами – комплексообразователями, связанными с биолигандами. Принимают активное участие в обмене веществ.
Биогенными элементаминазывают элементы, необходимые для построения и жизнедеятельности различных клеток организмов.
Основные неметаллы: F,Cl,Br,I,Si,Se,As; металлы:Li,Ba,Sr,Sn,Ti,V,Cr. Суммарное содержание всех этих элементов в организме составляет меньше 0,3 %, из них 0, 08 % приходится на хлор. Содержание остальных биогенных элементов находится в пределах 10-6-10-4%.
Макроэлементы– элементы, содержание которых в организме больше 10-3 %. (Ткани, осмотический, водно – электролитный, кислотно-основный, окислительно – восстановительный и металло - лигандный гомеостаз).
Микроэлементы– элементы, содержание которых в организме находится в пределах 10-6-10-3%. (Ферменты, гормоны, витамины и другие биологические активные соединения, в основном в качестве комплексообразователей или активаторов обмена веществ). Йод, Цинк, Стронций.
Элементы – токсиканты–Be,Ba,As,Pb,Cd,Hg,Tl– элементы, способные привести к летальному исходу.
Особенности строения атомов углерода и его химических связей с элементами – органогенами.
Углерод(С) – в периодической системе элементов располагается во втором периоде в группеIVА. Электронная конфигурация атома углерода 1s22s22p2.

Вследствие
этого для углерода характерны степени
окисления: от -4 до +4, и типы гибридизации
sp3,sp2,sp1.
Все рассмотренные данные о свойствах углеродосодержащих связей свидетельствуют о том, что углерод в соединениях образует, с одной стороны, достаточно прочные ковалентные связи между собой и с другими органогенами, а с другой стороны – общие электронные пары этих связей достаточно лабильны. В результате этого может происходить как увеличение реакционной способности этих связей, так и стабилизация. Именно эти особенности углеродосодержащих соединений и делают углерод органогеном номер один.
Кислотно – основныесвойства соединений углерода.
Оксид углерода (IV) кислотным оксидом, а соответствующий ему гидроксид – угольна кислота H2CO3– слабой кислотой.
Угольная кислота существует только в растворе. Она образует два ряда солей – гидрокарбонаты ( NaHCO3, Ca(HCO3)2) и карбонаты ( Na2CO3, CaCO3). В воде гидрокарбонаты растворяются лучше, чем карбонаты.
Совокупность угольной кислоты и гидрокарбонат- иона (H2CO3,HCO3-) образует гидрокарбонатную буферную систему – главную буферную систему плазму крови.
Синильная кислота, или циановодород,HCN– бесцветная, легколетучая жидкость с запахом горького миндаля, смешивающаяся с водой в любых соотношениях. Соли – цианиды.
При длительном воздействии CO2, содержащегося в воздухе, цианиды разлагаются с выделением синильной кислоты:
2KCN + CO2 + H2O K2CO3 + 2HCN.
Окислительно – восстановительныесвойства.
В ходе реакция углерод может и отдавать, и присоединять электроны, выступая соответственно восстановителем или окислителем в зависимости от свойств второго реагента:
C– восстановитель.
C+O2CO2
С – окислитель.
C+ 2H2CH4
При взаимодействии сильных окислителей с органическими веществами может протекать неполное или полное окисление атомов углерода этих соединений.
Неполное окисление:
CH4+O2C+ 2H2O
CH4 + Cl2 CH3Cl + HCl
C2H5OH + O2 CH3CHO + H2O
Полное окисление:
CH4+ 2O2CO2+ 2H2O
CH4 + 4Cl2 CCl4 + 4HCl
C2H5OH + 3O2 2CO2 + 3H2O
В условиях анаэробного окисления при недостатке или отсутствии кислорода атомы углерода органического соединения в зависимости от содержания кислородных атомов в этих соединениях и внешних условий могут превращать CO2,CO,Cи дажеCH4.
В органических соединениях степень окисления изменяют только атомы углерода, а атомы остальных органогенов при этом сохраняют свою степени окисления.
При реакциях гидрирования, т.е. присоединения водорода (восстановителя) по кратной связи, образующие ее атомы углерода понижают свою степени окисления (выступают окислителями).
Атом углерода в соединении – окислитель, если в результате реакции увеличивается число его связей с атомами менее электроотрицательных элементов (водород, металлы), потому что, притягивая к себе общие электроны этих связей, рассматриваемый атом углерода понижает свою степени окисления.
Атом углерода в соединении – восстановитель, если в результате реакции увеличивается число его связей с атомами более электроотрицательных элементов (C,O,N,S), потому что, отталкивая от себя общие электроны этих связей, рассматриваемый атом углерода повышает свою степень окисления.
Комплексообразующиесвойства соединений углерода.
У атом углерода в соединениях нет неподеленных электронных пар, и поэтому лигандами могут выступать только соединения углерода, содержащие кратные связи с его участием.
CO– несолеобразующий оксид,CO– восстановитель приT> 1000K. Хороший лиганд в реакциях комплексооборазования с атомами и катионамиd– металлов, прежде всего с железом, с которым он образует пентакарбонил железа – летучую ядовитую жидкость:
Fe0 + 5 CO [Fe0(CO)5]
Учебник: 284-287, 295–302.
Моносахариды. Цикло-цепная таутомерия моносахаридов на примере глюкозы и фруктозы. Формулы Фишера, Колли- Толленса и Хеуорса. Дайте название каждого таутомера. Явление мутаротации.
Моносахариды (монозы)– это многоатомные альдегидо- и кетоноспирты, не гидролизующиеся до более простых.По числу атомов углерода моносахариды подразделяют натетрозы (С4 ),пентозы (С5),гексозы (С6)и т.д. Моносахариды, содержащие альдегидную группу, называютальдозами; кетонную –кетозами.
Цикло-цепные таутомеры моносахаридов
По мере изучения свойств моносахаридов выяснилось, что открытые (цепные) формулы не описывают полностью химическое поведение сахаров. В основе их образования лежит внутримолекулярная реакция нуклеофильного присоединения спиртовых групп к альдегидной или кетонной группе
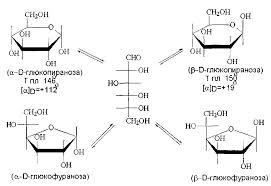
В проекции Фишера химические связи изображаются в виде горизонтальных и вертикальных линий, наперекрестьях которых находятся стереоценты. Углеродный скелет изображают вертикально, при этом сверху находится атом углерода, с которого начинается нумерация скелета. Кроме того, в проекции Фишера все горизонтальные связи направлены в сторону наблюдателя, а вертикальные — удалены от наблюдателя. Данное условие важно для правильного построения проекции Фишера, а также при восстановлении трёхмерной структуры молекулы из её проекции. По этой причине проекцию Фишера нельзя вращать на 90° или 270°, так как это приведёт к изменению конфигурации стереоцентров.
Формулы Колли — Толленса неудобны для изображения циклических структур, более удобны для написания и понимания проекционные формулы Хеуорса. В этом случае циклические формы моносахаридов изображаются в виде плоских многоугольников с атомом кислорода в цикле.
При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
Мутаротация объясняется тем, что кристаллический циклический таутомер, растворяясь в воде, переходит постепенно через открытую форму во все другие таутомерные формы.При этом угол вращения плоскости поляризованного света будет меняться во времени до достижения равновесия между всеми цикло-цепными таутомерами. Это изменение во времени угла вращения плоскости поляризованного света в свежеприготовленных растворах сахаров называется мутаротацией.
Билет №19.
Растворы сильных электролитов. Особенности процессов диссоциации. Расчет активности ионов в растворах сильных электролитов. Экспериментальное определение активности ионов в растворах сильных электролитов. Ионная сила растворов NaCl (0,15М) и KCl (0,146 M). Влияние ионной силы этих электролитов на процессы диссоциации слабых электролитов.
В водных растворах сильные электролиты (например, HCl, NaCl, KOH) полностью диссоциированы, причем гидратированные ионы, образующиеся при их диссоциации, обычно не ассоциируются в молекулы.
HCl H++ Cl-
NaCl Na++Cl-
Диссоциация сильных электролитов необратима, следовательно, значение константы диссоциации будет зависеть от концентрации раствора.
Активность иона a(Xi) – эффективная концентрация иона Xi, соответственно которой он участвует во взаимодействиях, протекающих в растворах сильных электролитов.
a(Xi) = y(Xi)c(Xi)
Коэффициент активности иона y(Xi) показывает, во сколько раз активность иона отличается от его истинной концентрации в растворе сильного электролита.
Гилберт Ньютон Льюис в 1907 году ввел понятие ионной силы раствора электролита.
Ионная сила раствора – величина, характеризующая интенсивность электростатического поля всех ионов в растворе, которая равна полусумме произведений молярной концентрации (ci) каждого иона на квадрат его заряда (zi).
I=
 izi2
izi2
I= (0,15
* 12)
+ (0,15 * 12)
= 0,15 моль/л.
(0,15
* 12)
+ (0,15 * 12)
= 0,15 моль/л.
I= (0,146
* 12)
+ (0,146 * 12)
= 0,146 моль/л.
(0,146
* 12)
+ (0,146 * 12)
= 0,146 моль/л.
Учебник: 159 – 162.
Оксикислоты. Структура молочной, яблочной , винной, лимонной, β гидроксимасляной кислоты. Химические свойства. Реакция образования солей и сложных эфиров. Их названия по кислотным остаткам. Биологическая роль.
Оксикислоты–карбоновые кислоты, в которых одновременно содержатсякарбоксильнаягидроксильная группы. Проявляют общие свойствва спиртов и кислот. В зависимости от реагентов и условий проведения реакции. Гидроксикислоты проявляютспецифические свойства, которые обусловлены взаимным влиянием ОН- и СООН- групп.Например, своеобразная реакция отщепления воды при нагревании.
Она
позволяет отличить -,-,-
и другие гидроксикислоты.

а)
t°


гидролиз + 2H2O
+
H+ или OH-
б)


t°

-H2O
-оксимасляная кислота кротоновая кислота
в)
t°


 +
H2O
+
H2O
гидролиз
H+
-гидроксимасляная - бутиролактон
кислота (ГОМК)
ГОМК обладает наркотическим действием, нетоксична, применяется в виде натриевой соли как снотворное средство и при неингаляционном наркозе при операциях.
г)


t°

 +
H2O
+
H2O
гидролиз
H+
-гидроксивалериановая - валеролактон
лактон
Лактиды и лактоны могут гидролизоваться в кислой среде с образованием исходных гидроксикислот.
2. Разложение -гидроксикислот при нагревании в присутствии H2SO4:

t°, H2SO4
 CH3–CHO
+ HCOOH
CH3–CHO
+ HCOOH
Многоосновные кислоты ведут себя так же. Например,
а) при нагревании лимонная кислота будет вести себя как -гидроксикислоты:


t°


-Н2О
лимонная
кислота цис-аконитовая
к-та
+ Н2О

против правила
Марковникова
изолимонная кислота
Молочная
(α – гидроксипропионовая (лактаты))
ИЮПАК – 2 гидроксипропановая (2х
атомная и одноосновная) является
продуктом жизнедеятельности ряда
бактерий. Используется как консервант,
предохраняющий от продуктов гниения.
Встречается в виде 2х стереоизомерных
форм
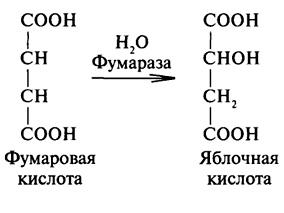
Яблочная –α гидроксиянтарная (малаты) ИЮПАК 2 гидроксибутандиовая 3 атомная 2 основная . в рябине, яблоках. Один из продуктов распада углеводов в организме. Соли железа (малаты) применяются в медецине при малокровии. Существ в виде 2х формах.

Винная
(виноградная), или,-дигидроксиянтарная
кислота (тартраты) 2,3-дигидрокси
бутандиовая кислота 4х атомная 2 основная.
Винная кислота — распространённое
природное соединение. В значительном
количестве она содержится в
кисломсокемногих
фруктов, например, ввиноградномсоке.
Соли винной кислоты — тартраты
При пиролизе D-винная кислота декарбоксилируется с образованием пировиноградной СН3СОСООН и пировинной (метилянтарной) НООССН(СН3)СН2СООН кислот. Она восстанавливается до янтарной кислоты, восстанавливает аммиачный раствор AgNO3 до Ag; в щелочной среде растворяет Сu(ОН)2 с образованием прозрачного ярко-синего раствора - реактива Фелинга. Применяется в пищевой промышленности (пищевая добавка Е334), в медицине, ваналитической химиидля обнаружения альдегидов, сахаров и др., в химической и фармакологической промышленности для разделения рацематов органических веществ на изомеры.Соливинной кислоты (тартраты) используются в медицине, при крашениитканей
Лимонная,
или-гидрокси--карбокси-глутаровая
(цитраты) 3-гидрокси-3-карбоксипентандиовая
4х атомная 3 основная. Соли и эфиры
лимонной кислоты называютсяцитратами.
Лимонная кислота, являясь главным
промежуточным продуктом метаболическогоцикла
трикарбоновых кислот, играет важную
роль в системе биохимических
реакцийклеточного
дыханиямножества организмов.

Β - гидроксимасляная 1-3гидроскибутановая - как промежуточный продукт окисления жирных кислот накапливается в организме у больных сахарным диабетом, являясь, в свою очередь, предшественником ацетоуксусной кислоты.
Сложные эфиры можно рассматривать как производные кислот, водород карбоксильной группы которых замещен радикалом (R'). Их можно также рассматривать как производные спиртов, в молекуле которых водород гидроксила замещен остатком кислоты.
Получение сложных эфиров сводится к взаимодействию соответствующих спирта и кислоты в присутствии водоотнимающих средств или действием на спирт ангидридов кислот (амил-нитрит).
Низкомолекулярные сложные эфиры - подвижные жидкости с характерным специфическим запахом, высокомолекулярные - твердые вещества. Все сложные эфиры нерастворимы в воде и хорошо растворимы в органических растворителях. Если эфир образован кислотой, которая является окислителем, то он взрывоопасен, так как возможно внутримолекулярное окисление спирта, например, нитроглицерин.
Характерным свойством сложных эфиров является их способность легко гидролизоваться. Гидролиз катализируется присутствием щелочей, кислот, нагреванием, присутствием окислителей и восстановителей
Глицерин тринаитрат глицерина тринаитрат глицерина взрычатое в-во. В малых концентрациях ( в виде 1% раствора в этаноле) прим как сосудорасширяющее средство.
СН2ОН
СН2О
-NO2
 СН2ОН
3НNO3 H2SO4
СНО -NO2
+ 3H2SO4
(3NO2HSO4 вначале)
СН2ОН
3НNO3 H2SO4
СНО -NO2
+ 3H2SO4
(3NO2HSO4 вначале)
СН2ОН
-3H2 OСН2О -NO2

3) АТФ. Макроэргические связи. Гидролиз АТФ. Биологическая роль!!!!!!! (Давали на лекциях).
Билет №20.
Буферные системы плазмы крови: Гидрокарбонатная, Белковая и Гидрофосфатная. Основные компоненты и их соотношение в этих системах. Сопряжение гидрокарбонатной и белковой буферных систем. Механизм их действия.
Гидрокарбонатная буферная система образована оксидом углерода (IV), взаимодействие которого с водой приводит к равновесной системе:
CO2+H2O ⇌ CO2*H2O ⇌ H2CO3⇌ H+ + HCO3-
Донор – угольная кислота H2CO3
Акцептор – гидрокарбонат – ион HCO3-‑.
Физиологические условия:
Ka*I= = 7, 95 * 10-7 pKa*I=6,1
= 7, 95 * 10-7 pKa*I=6,1
Стандартные условия:
KaI= = 4,45 * 10-7 pKaI=6,36
= 4,45 * 10-7 pKaI=6,36
pH=pKa(BH)++lg = 6,1 +lg
= 6,1 +lg
Если в кровь поступает кислота и увеличивается концентрация иона водорода, то он, взаимодействуя с HCO3-, смещает равновесие в сторону H2CO3 и приводит к выделению газообразного CO2, который выводится из организма в процессе дыхания через легкие.
H+ + HCO3- ⇌H2CO3⇌CO2 ↑ + H2O
Если в кровь поступает основание, оно связывается с угольной кислотой, и равновесие смещается в сторону HCO3-:
OH- + H2CO3⇌HCO3- + H2O
Главное значение гидрокарбонатного буфера заключается в нейтрализации кислот + обеспечивает 55 % буферной ёмкости крови.
Белковые (протеиновые) буферные системы бывают:
- Анионного типа. Анионный белковый буфер работает при pH>pIбелка и состоит из донора протонов – молекулы белка HProt и акцептора протонов –аниона белка (Prot)-.
H3N+-Prot-COO-⇌ H+ +H2N-Prot-COO-
H2Prot⇌ H+ + (HProt)-
При добавлении кислоты это равновесие смещается в сторону образования молекулы белка, а при добавлении основания в системе увеличивается содержание аниона белка.
- Катионного типа. Катионный белковый буфер работает при pH<pIбелка и состоит из донора протонов – катиона белка (H2Prot)+ и акцептора протона – молекулы белка HProt.
H3N+-Prot-COOH ⇌ H+ +H3N+-Prot-COO-
(H2Prot)+⇌ H+ + HProt
Гидрофосфатная буферная система
В клетках представлена K2HPO4 и KH2PO4, а в плазме крови и межклеточной жидкости Na2HPO4 и NaH2PO4.
Донор – ион H2PO4- (pKa = 6,8)
Акцептор – ион HPO42-
Работа буферной системы описывается уравнением буферного действия:
pH = 6,8 + lg ([HPO42-]/[H2PO4-]) (в норме 4/1)
При увеличении концентрации катионов H+ во внутриклеточной жидкости, например, в результате переработки мясной пищи, происходит их нейтрализация ионами HPO42-
H+ + HPO42- ⇌H2PO4-
При увеличении концентрации оснований в организме, например, при употреблении растительной пищи, они нейтрализуются ионами H2PO4-:
OH- + H2PO4-⇌HPO42- + H2O
Избыточный гидрофосфат и дигидрофосфат выделяется с помощью почек.
Учебник: 197 – 203.
2) Понятие о полипептиднах и первичной структуре белка. Напишите трипептид, АЛА-ГИС-ГЛН дайте характеристику физико – химических свойств данного полипептида.
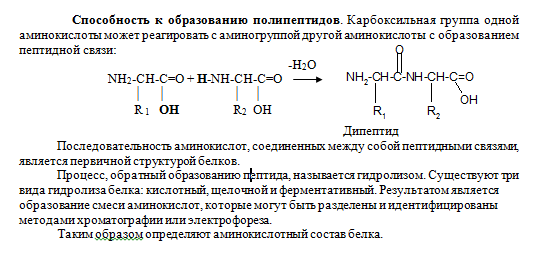

Моносахариды. Цикло-цепная таутомерия моносахаридов на примере глюкозы и фруктозы. Формулы Фишера, Колли- Толленса и Хеуорса. Дайте название каждого таутомера. Явление мутаротации.
Моносахариды (монозы)– это многоатомные альдегидо- и кетоноспирты, не гидролизующиеся до более простых.По числу атомов углерода моносахариды подразделяют натетрозы (С4 ),пентозы (С5),гексозы (С6)и т.д. Моносахариды, содержащие альдегидную группу, называютальдозами; кетонную –кетозами.
Цикло-цепные таутомеры моносахаридов
По
мере изучения свойств моносахаридов
выяснилось, что открытые (цепные) формулы
не описывают полностью химическое
поведение сахаров. В основе их образования
лежит внутримолекулярная реакция
нуклеофильного присоединения спиртовых
групп к альдегидной или кетонной группе
В
проекции
Фишера
химические связи изображаются в виде
горизонтальных и вертикальных линий,
наперекрестьях которых находятся стереоценты.
Углеродный скелет изображают вертикально,
при этом сверху находится атом углерода,
с которого начинается нумерация скелета.
Кроме того, в проекции Фишера все
горизонтальные связи направлены в
сторону наблюдателя, а вертикальные —
удалены от наблюдателя. Данное условие
важно для правильного построения
проекции Фишера, а также при восстановлении
трёхмерной структуры молекулы из её
проекции. По этой причине проекцию
Фишера нельзя вращать на 90° или 270°, так
как это приведёт к
изменению конфигурации стереоцентров.
Формулы Колли — Толленса неудобны для изображения циклических структур, более удобны для написания и понимания проекционные формулы Хеуорса. В этом случае циклические формы моносахаридов изображаются в виде плоских многоугольников с атомом кислорода в цикле.
При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
Мутаротация объясняется тем, что кристаллический циклический таутомер, растворяясь в воде, переходит постепенно через открытую форму во все другие таутомерные формы.При этом угол вращения плоскости поляризованного света будет меняться во времени до достижения равновесия между всеми цикло-цепными таутомерами. Это изменение во времени угла вращения плоскости поляризованного света в свежеприготовленных растворах сахаров называется мутаротацией.
Билет №21.
Типы окислительно – восстановительных реакций:
а) внутримолекулярные,
б) диспропорционирования (простых веществ, оксидов и солей),
в) межмолекулярные. ОВР. Приведите примеры. Типы окислительно – восстановительных реакций в живом организме.
А) Межмолекулярные— реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S+Cl2→S+ 2HCl

Б) Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2+H2O→HClO+HCl

В) Внутримолекулярные— реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O→ 2H2+O2

Моносахариды. Напишите уравнения реакции, доказывающие наличие в структуре альдегидной группы у глюкозы, ее многоатомность и наличие полуацетального гидроксила.
Качественная реакцияглюкозы с аммиачным раствором оксида серебра (I)
Доказать наличие альдегидной группы в глюкозе можно с помощью аммиачного раствора оксида серебра. К аммиачному раствору оксида серебра добавим раствор глюкозы и подогреем смесь на водяной бане. Вскоре на стенках колбы начинает осаждаться металлическое серебро. Эта реакция называется реакцией серебряного зеркала. Ее используют как качественную для открытия альдегидов. Альдегидная группа глюкозы окисляется до карбоксильной группы. Глюкоза превращается в глюконовую кислоту.


Реакции гликозидного (полуацетального) гидроксила.

агликон

гликозидная группа

О--гликозид
3)
Понятие
о полипептиднах и первичной структуре
белка. Напишите трипептид, АЛА-ГИС-ГЛН
дайте характеристику физико – химических
свойств данного полипептида.
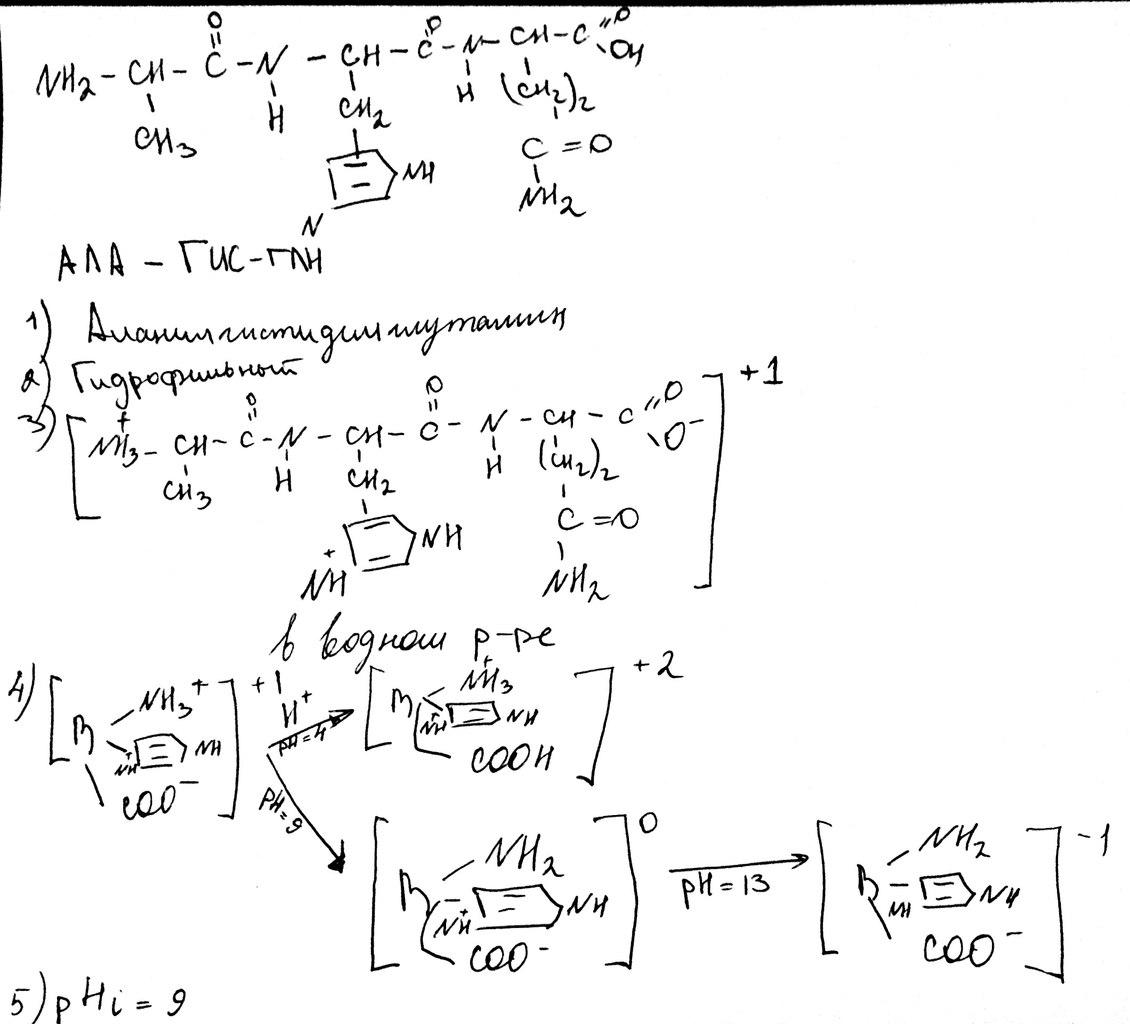
Билет №22. (ВАРИАНТ 1)
Буферные системы плазмы крови: Гидрокарбонатная, Белковая и Гидрофосфатная. Основные компоненты и их соотношение в этих системах. Сопряжение гидрокарбонатной и белковой буферных систем. Механизм их действия.
Гидрокарбонатная буферная система образована оксидом углерода (IV), взаимодействие которого с водой приводит к равновесной системе:
CO2+H2O ⇌ CO2*H2O ⇌ H2CO3⇌ H+ + HCO3-
Донор – угольная кислота H2CO3
Акцептор – гидрокарбонат – ион HCO3-‑.
Физиологические условия:
Ka*I= = 7, 95 * 10-7 pKa*I=6,1
= 7, 95 * 10-7 pKa*I=6,1
Стандартные условия:
KaI= = 4,45 * 10-7 pKaI=6,36
= 4,45 * 10-7 pKaI=6,36
pH=pKa(BH)++lg = 6,1 +lg
= 6,1 +lg
Если в кровь поступает кислота и увеличивается концентрация иона водорода, то он, взаимодействуя с HCO3-, смещает равновесие в сторону H2CO3 и приводит к выделению газообразного CO2, который выводится из организма в процессе дыхания через легкие.
H+ + HCO3- ⇌H2CO3⇌CO2 ↑ + H2O
Если в кровь поступает основание, оно связывается с угольной кислотой, и равновесие смещается в сторону HCO3-:
OH- + H2CO3⇌HCO3- + H2O
Главное значение гидрокарбонатного буфера заключается в нейтрализации кислот + обеспечивает 55 % буферной ёмкости крови.
Белковые (протеиновые) буферные системы бывают:
- Анионного типа. Анионный белковый буфер работает при pH>pIбелка и состоит из донора протонов – молекулы белка HProt и акцептора протонов –аниона белка (Prot)-.
H3N+-Prot-COO-⇌ H+ +H2N-Prot-COO-
H2Prot⇌ H+ + (HProt)-
При добавлении кислоты это равновесие смещается в сторону образования молекулы белка, а при добавлении основания в системе увеличивается содержание аниона белка.
- Катионного типа. Катионный белковый буфер работает при pH<pIбелка и состоит из донора протонов – катиона белка (H2Prot)+ и акцептора протона – молекулы белка HProt.
H3N+-Prot-COOH ⇌ H+ +H3N+-Prot-COO-
(H2Prot)+⇌ H+ + HProt
Гидрофосфатная буферная система
В клетках представлена K2HPO4 и KH2PO4, а в плазме крови и межклеточной жидкости Na2HPO4 и NaH2PO4.
Донор – ион H2PO4- (pKa = 6,8)
Акцептор – ион HPO42-
Работа буферной системы описывается уравнением буферного действия:
pH = 6,8 + lg ([HPO42-]/[H2PO4-]) (в норме 4/1)
При увеличении концентрации катионов H+ во внутриклеточной жидкости, например, в результате переработки мясной пищи, происходит их нейтрализация ионами HPO42-
H+ + HPO42- ⇌H2PO4-
При увеличении концентрации оснований в организме, например, при употреблении растительной пищи, они нейтрализуются ионами H2PO4-:
OH- + H2PO4-⇌HPO42- + H2O
Избыточный гидрофосфат и дигидрофосфат выделяется с помощью почек.
Учебник: 197 – 203.
2)
Понятие
о полипептиднах и первичной структуре
белка. Напишите трипептид, АЛА-ГИС-ГЛН
дайте характеристику физико – химических
свойств данного полипептида.

Моносахариды. Цикло-цепная таутомерия моносахаридов на примере глюкозы и фруктозы. Формулы Фишера, Колли- Толленса и Хеуорса. Дайте название каждого таутомера. Явление мутаротации.
Моносахариды (монозы)– это многоатомные альдегидо- и кетоноспирты, не гидролизующиеся до более простых.По числу атомов углерода моносахариды подразделяют натетрозы (С4 ),пентозы (С5),гексозы (С6)и т.д. Моносахариды, содержащие альдегидную группу, называютальдозами; кетонную –кетозами.
Цикло-цепные таутомеры моносахаридов
По мере изучения свойств моносахаридов выяснилось, что открытые (цепные) формулы не описывают полностью химическое поведение сахаров. В основе их образования лежит внутримолекулярная реакция нуклеофильного присоединения спиртовых групп к альдегидной или кетонной группе


В проекции Фишера химические связи изображаются в виде горизонтальных и вертикальных линий, наперекрестьях которых находятся стереоценты. Углеродный скелет изображают вертикально, при этом сверху находится атом углерода, с которого начинается нумерация скелета. Кроме того, в проекции Фишера все горизонтальные связи направлены в сторону наблюдателя, а вертикальные — удалены от наблюдателя. Данное условие важно для правильного построения проекции Фишера, а также при восстановлении трёхмерной структуры молекулы из её проекции. По этой причине проекцию Фишера нельзя вращать на 90° или 270°, так как это приведёт к изменению конфигурации стереоцентров.
Формулы Колли — Толленса неудобны для изображения циклических структур, более удобны для написания и понимания проекционные формулы Хеуорса. В этом случае циклические формы моносахаридов изображаются в виде плоских многоугольников с атомом кислорода в цикле.
При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
Мутаротация объясняется тем, что кристаллический циклический таутомер, растворяясь в воде, переходит постепенно через открытую форму во все другие таутомерные формы.При этом угол вращения плоскости поляризованного света будет меняться во времени до достижения равновесия между всеми цикло-цепными таутомерами. Это изменение во времени угла вращения плоскости поляризованного света в свежеприготовленных растворах сахаров называется мутаротацией.
Билет №22. (ВАРИАНТ 2)
Адсорбция на подвижной поверхности раздела фаз. Уравнение Гиббса. ПАВ, их классификация, особенности строения. Правило Дюкло – Траубе. Адсорбция ПАВ на границе раздела двух жидкостей.
Адсорбциярастворенных веществ на поверхности
жидких адсорбентов описывается уравнением
Гиббса, отражающим зависимость между
концентрацией вещества на единице
поверхности раздела фаз и концентрацией
его в объеме раствора:
Величина dσ/dc, называемая поверхностной активностью, служит характеристикой поведения растворенного вещества при его адсорбции поверхностью раздела. Поверхностная активность может быть положительной или отрицательной. Если с увеличением концентрации вещества удельное поверхностное натяжение на границе раздела фаз понижается, т.е. dσ/dc< 0, то такое вещество называют поверхностно – активным (ПАВ). В этом случае адсорбция растворенного вещества положительна (Г > 0); это означает, что концентрация растворенного вещества в поверхностном слое больше, чем в объеме раствора.
Вещества, повышающие удельное поверхностное натяжение на границе раздела фаз с увеличением концентрации, называют поверхностно – инактивными (ПИВ, для них dσ/dc> 0 а адсорбция отрицательна (Г < 0).
Молекулы
ПАВ имеют асимметричное строение, так
как содержат два четко выраженных
фрагмента: гидрофобный (неполярный) и
гидрофильный (полярный), т.е. их структура
дифильна. В зависимости от характера
полярной группы различают три вида ПАВ:
У дифильных молекул с короткой углеводородной цепью и эффективной полярной головкой преобладают гидрофильные свойства, и поэтому такие вещества хорошо растворимы в воде, например, CH3OH,CH3COOH,C2H5OH. С удлинением углеводородной цепи усиливаются гидрофобные свойства молекул и понижается растворимость веществ в воде, при этом молекулы вытесняются на поверхность, снижая поверхностное натяжение.
Влияние природы ПАВ на их поверхностную активность описывает правилом Дюкло – Траубе: «Поверхностная активность ПАВ в разбавленных водных растворах при одинаковой молярной концентрации увеличивается в 3-3,5 раза при удлинении гидрофобной части на одну метиленовую группу (-CH2-).
В зависимости от поверхностной активности молекул ПАВ отличие в их поведении на границе раздела фаз особенно четко проявляется на границе раздела двух несмешивающихся жидкостей. Жидкости, резко отличающиеся по полярности, например, вода и масло (машинное или растительное), при смешивании всегда расслоятся с образованием границы раздела между ними. Если в эту систему ввести водорастворимое ПАВ, то его молекулы своей полярной, гидрофильной частью будут ориентированы к воде, а гидрофобной – к маслу (неполярной жидкости).
Учебник:697 – 702.
Кето – енольная таутомерия на примере глюкозы. Эпимеры. Эпимеризация. Чем обусловлен процесс.
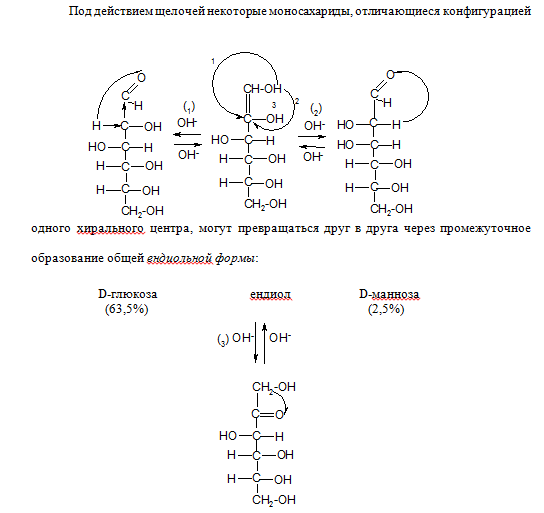
Стереоизомеры, отличающиеся конфигурацией одного хирального центра, называютсяэпимерами, а процесс их взаимного превращения друг в друга в щелочной среде – эпимеризацией.
Процесс эпимеризациизаключается в переходе формы с карбонильным кислородом в альдегидной или кетонной группе в енольную форму (с ОН-группой при углеродном атоме, связанном двойной связью). Благодаря кетоенольной таутомерии эпимерные моносахариды способны превращаться друг в друга. Эпимеризация обясняется тем, что при енолизации эпимерных моносахаридов (например, D-глюкозы, маннозы и фруктозы) образуется один и тот же ендиол. Очевидно, что при обратном превращении ендиола в карбонильную форму могут образоваться все три моносахарида.
Аминокислоты. Классификация альфа – аминокислот на основные физико- химические свойства их радикалов. Примеры каждого класса. Строение. Название. Поведение в водных растворах. Понятие о биполярных ионах. Влияние рН среды на суммарный заряд аминокислот, пептидов. Изоэлектрическая точка.
Аминокислотаминазываются органические соединения, содержащиекарбоксильную и аминогруппу: (NH2)m-R –(COOH)n
Классификация:
1) по количеству СООН- и NH2-групп аминокислоты делятся на моноаминокарбоновые, диаминокарбоновые, моноаминодикарбоновые и т.д.
2) по взаимному расположению двух функциональных групп: ,,- и т.д. аминокислоты.
Изомерия: 1) по строению углеродного скелета; 2) оптическая (стерео) изомерия.
Формула Название Биологическая роль
NH2-CH-COOH* - аланин Входит в состав пеп-
(- аминопро- тидов, белков
СН3 пионовая кислота)
H2N-CH2-CH2-COOH -Аланин Входит в состав
(-аминопро- пантотеновой кислоты
пионовая кислота) (витамина В3)
H2N-CH2-CH2- СН2 –COOH -Аминомасляная Природный транкви-
кислота (ГАМК) лизатор
Примечание: * - оптически активна
С биологической точки зрения огромное значение имеют - аминокислоты. Это «кирпичики», из которых построены молекулы белка –протеиногенные аминокислоты. Основным источником- аминокислот для живого организма служат белки пищи. Большинство- аминокислот синтезируются в организме, но некоторые, необходимые для синтеза белков, не синтезируются в организме или синтезируются в недостаточном количестве и должны поступать извне. Такие аминокислоты называются незаменимыми, это:
Валин, лейцин, изолейцин, фенилаланин, метионин, триптофан, треонин, лизин, гистидин, аргинин.
Классификация -аминокислот.
Общая структурная формула протеиногенных аминокислот:
|
H2N-CH-COOH |
R
Специфические свойстваобусловлены взаимным влиянием двух функциональных групп.-,- и- Аминокислоты при нагревании вступают в реакции, аналогичные реакциям соответствующих оксикислот.
- Аминокислоты при нагревании образуют дикетопиперазины.
Реакция идет межмолекулярно через промежуточное образование дипептидов:
дипептидов:

Дикетопиперазин
2. -Аминокислоты образуютнепредельные кислоты:
t°
 R-CH-CH2-C=O
R-CH=CH-C=O
R-CH-CH2-C=O
R-CH=CH-C=O
-NH3
NH2OHOH
3. - и-Аминокислоты образуют циклические амиды, называемые- и - лактамами. Для них характерно таутомерное превращение (лактамлактим):
t°
 R-CH-CH2-CH2-C=O
R-CH-CH2-CH2-C=O
-H2O
NH2OH
лактам

Лактим
Цвиттер-ион (биполярный ион) — молекула которая, являясь в целом электронейтральной, в своей структуре имеет части, несущие как отрицательный, так и положительный заряды, локализованные на несоседних атомах. К цвитер-ионным соединениям зачастую относят и внутримолекулярные соли (например, внутримолекулярные соли аминокислот) и, иногда, ионные диполярные соединения, в том числе и с зарядами на соседних атомах (например, N-оксиды аминов). Цвиттер-ионные соединения высокополярны и поэтому, как правило, обладают хорошей растворимостью в полярных растворителях (воде, диметилсульфоксиде и т. п.) и слабой — в большинстве органических неполярных растворителей.
Различаются они только боковыми цепями (R-группами), которые у разных аминокислот неодинаковы по структуре, суммарному заряду (полярности) и растворимости в воде (гидрофильности или гидрофобности).
Аминокислоты классифицируют на основе химического строения радикалов, хотя были предложены и другие принципы. Различают ароматические и алифатические аминокислоты, а также аминокислоты, содержащие серу или гидроксильные группы. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группу), то они называются нейтральными аминокислотами. Если же аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой.
Современная рациональная классификация аминокислот основана на полярности радикалов, т.е. способности их к взаимодействию с водой. Она включает четыре класса аминокислот:
неполярные(гидрофобные)
полярные (гидрофильные) незаряженные
отрицательно заряженные
положительно заряженные при физиологических значениях pH
Во всех - -аминокислотах, за исключением глицина,- атом углерода
связан с четырьмя различными замещающими группами и, следовательно, является асимметрическим, или хиральным. Такие молекулы встречаются в двух стереоизомерных формах и проявляют оптическую активность.
Все аминокислоты, входящие в состав молекул белков, являются L-стереоизомерами.
Водные растворы аминокислот окрашиваются в синий цвет при прибавлении небольшого количества сульфата или хлорида меди (II), в особенности после связывания образующихся при этом в растворе ионов водорода буферным раствором. Такая же окраска появляется при кипячении водного или спиртового раствора аминокислоты с окисью меди или с карбонатом меди. Водный раствор аминокислоты после обработки в нейтральной среде карбонатом, окисью, фосфатом или ацетатом меди становится темносиним и при выпаривании выделяет очень красивые кристаллы. Образующиеся соединения в водном растворе ионизованы слабо и, вероятно, представляют собой комплексы, в которых медь связана не только карбоксильной группой, но также, при помощи вторичных валентных связей, азотом. Обычно принято считать, что в этих комплексах на 2 молекулы аминокислоты приходится 1 атом меди.
Влияние рН средына ионизацию аминокислот. Изменение рН среды от кислой до щелочной влияет на заряд растворенных аминокислот. В кислой среде (рН<7) все аминокислоты несут положительный заряд (существуют в виде катиона), так как избыток протонов в среде подавляет диссоциацию карбоксильной группы:

В кислой среде аминокислоты в электрическом поле движутся к катоду.
В щелочной среде (рН>7), где имеется избыток ионов ОН-, аминокислоты находятся в виде отрицательно заряженных ионов (анионов), так как диссоциирует NН+3-группа:
![]()
В этом случае аминокислоты перемещаются в электрическом поле к аноду.
Следовательно, в зависимости от рН среды аминокислоты имеют суммарный нулевой, положительный или отрицательный заряд.
Состояние, в котором заряд аминокислоты равен нулю, называется изоэлектрическим. Значение рН, при котором наступает такое состояние и аминокислота не перемещается в электрическом поле ни к аноду, ни к катоду, называется изоэлектрической точкой и обозначается рНI. Изоэлектрическая точка очень точно отражает кислотно-основные свойства разных групп в аминокислотах и является одной из важных констант, характеризующих аминокислоту.
Изоэлектрическая точка неполярных (гидрофобных) аминокислот приближается к нейтральному значению рН (от 5,5 для фенилаланина до 6,3 для пролина), у кислых она имеет низкие значения (для глутаминовой кислоты 3,2, для аспарагиновой 2,8). Изоэлектрическая точка для цистеина и цистина равна 5,0, что указывает на слабые кислотные свойства этих аминокислот. У основных аминокислот — гистидина и особенно лизина и аргинина — изоэлектрическая точка значительно выше 7.
Билет № 22. (Комплект 2)( = Варианту 24)
1) Сорбционные равновесия. Абсорбция. Константа абсорбционного равновесия и факторы на нее влияющие. Закон Генри. Закон Сеченова. Физико – химические основы кессонной болезни.
Сорбция – гетерогенный процесс самопроизвольного поглощения твердым телом или жидкостью веществ из окружающей среды.
Сорбент – твердые тела или жидкости, способным поглощать веществ из окружающей среды.
Сорбат – поглощаемое вещество.
Сорбция может быть обратимой и необратимой (чаще обратимой).
При достижении и установлении состояния равновесия скорость сорбции равна скорость десорбции. Это равновесное состояние характеризуется константой сорбционного равновесия Kc обычно довольно большим временем установления равновесия
Если Kc> 1, то в основном наблюдается процесс сорбции.
Если Kc< 1, то преобладает процесс десорбции.
Абсорбцией называется самопроизвольное поглощение веществ, при котором поглощаемые вещества (абсорбаты) в результате диффузии распределятся по всему объему вещества – поглотителя (абсорбента).
Константа абсорбционного равновесия – константа распределения (Kраспр).
Kраспр=
 , где c1,
c2
– концентрация поглощаемого вещества
в абсорбенте и в окружающей среде
соответственно.
, где c1,
c2
– концентрация поглощаемого вещества
в абсорбенте и в окружающей среде
соответственно.
Факторы, влияющие на Kраспр: природа контактирующих фаз и температура.
Если поглощаемое вещество – газ, то его абсорбция сопровождается резким изменением объема системы в целом. Поэтому в соответствии с принципом Ле - Шателье абсорбция газов в жидкости при увеличении давления возрастает и подчиняется закону Уильяма Генри:
«При постоянной температуре абсорбция газа в единице объема жидкости прямо пропорциональна парциальному давлению этого газа в газовой смеси над жидкостью».
C = kp((x), (при T = const.), где c – концентрация газа в жидкости, моль/л; p(X) – парциальное давление газа в смеси, Па или мм рт. ст.; k – константа абсорбционного равновесия.
Закон Генри позволяет понять возникновение профессиональных заболеваний у водолазов, рабочих в кессонах, летчиков, космонавтов, которые должны переходить из газовой среды с большим давлением в среду с меньшим давлением. Во время пребывания человека в среде с высоким давлением кровь и ткани насыщаются газовыми компонентами среды, а при резком понижении давления снижается растворимость абсорбированных газов в крови. В результате снижения растворимости газов из крови выделяются пузырьки этих газов, которые закупоривают капиллярные кровеносные сосуды, вызывая кессонную болезнь. При этом особенно велик вклад азота, так как его объемная доля в воздухе составляет 78%. Лучше брать газовую смесь на основе гелия. 80% гелия, 20% кислорода, так как растворимость гелия в крови почти в три раза меньше, чем азота.
Абсорбируемость газа жидкостью зависит не только от природы газа, его давления и температуры, но и от состава жидкости. Абсорбция газов в растворах электролитов подчиняется закону Ивана Михайловича Сеченова:
«Растворимость газов в жидкостях в присутствии электролитов понижается вследствие высаливания газов».
ln(c0/c) = kCcэл,
где c0 – растворимость газа в чистой воде
c – Растворимость газа в присутствии электролита
cэл– концентрация электролита
kс– константа Сеченова.
Учебник: 684 – 687.
Дисахариды. Типы связи. Номенклатура. Восстанавливающая и невосстанавливающая способность. Лактоза, Целлобиоза. Доказательство их восстанавливающей способности.
Природные дисахариды(биозы) состоят из двух одинаковых или разных моносахаридных остатков и представляют собой О-гликозиды (полные ацетали), в которых один из моносахаридов выполняет роль агликогена.
Существуют два типа связывания моносахаридных остатков в природных дисахаридах:
- За счет полуацетальной(гликозидной) ОН-группы одного и любой другой спиртовой ОН-группы другого моносахарида (группа восстанавливающих дисахаридов).
- За счет полуацетальных (гликозидых) ОН-групп обоих моносахаридов (группа невосстанавливающих дисахаридов).
Восстанавливающие дисахариды. Один из моносахаридных остатков учавствует в образовании гликозидной связи за счет гидроксильной группы чаще всего при С-4 или С-6. В дисахариде имеется свободная полуацетальная гидроксильная группа, вследствие чего сохраняется способность к раскрытию цикла. Представителями восстанавливающихся дисахаридов являются: мальтоза, целлобиоза, лактоза.
Невосстанавливающие дисахариды.К этой группе принадлежит небольшое число дисахаридов, важнейшим из которых является сахароза.
Сахарозапостроена из остатковD-глюкопиранозы иD-фруктофуранозы, связанных гликозидной связью между гидроксильными группами при аномерных атомах углерода. Т.к в молекуле сахарозы отсутствуют свободные полуацетальные гидроксильные группы, она не обладает способностью к цикло –оксо-таутомерии. Растворы сахарозы не мутаротируют.

Восстанавливающая способность целлобиозы

Восстанавливающая способность лакт 3) Аминокислоты. Классификация альфа – аминокислот на основные физико- химические свойства их радикалов. Примеры каждого класса. Строение. Название. Поведение в водных растворах. Понятие о биполярных ионах. Влияние рН среды на суммарный заряд аминокислот, пептидов. Изоэлектрическая точка.

Аминокислотаминазываются органические соединения, содержащиекарбоксильную и аминогруппу: (NH2)m-R –(COOH)n
Классификация:
1) по количеству СООН- и NH2-групп аминокислоты делятся на моноаминокарбоновые, диаминокарбоновые, моноаминодикарбоновые и т.д.
2) по взаимному расположению двух функциональных групп: ,,- и т.д. аминокислоты.
Изомерия: 1) по строению углеродного скелета; 2) оптическая (стерео) изомерия.
Формула Название Биологическая роль
NH2-CH-COOH* - аланин Входит в состав пеп-
(- аминопро- тидов, белков
СН3 пионовая кислота)
H2N-CH2-CH2-COOH -Аланин Входит в состав
(-аминопро- пантотеновой кислоты
пионовая кислота) (витамина В3)
H2N-CH2-CH2- СН2 –COOH -Аминомасляная Природный транкви-
кислота (ГАМК) лизатор
Примечание: * - оптически активна
С биологической точки зрения огромное значение имеют - аминокислоты. Это «кирпичики», из которых построены молекулы белка –протеиногенные аминокислоты. Основным источником- аминокислот для живого организма служат белки пищи. Большинство- аминокислот синтезируются в организме, но некоторые, необходимые для синтеза белков, не синтезируются в организме или синтезируются в недостаточном количестве и должны поступать извне. Такие аминокислоты называются незаменимыми, это:
Валин, лейцин, изолейцин, фенилаланин, метионин, триптофан, треонин, лизин, гистидин, аргинин.
Классификация -аминокислот.
Общая структурная формула протеиногенных аминокислот:
|
H2N-CH-COOH |
R
Специфические свойстваобусловлены взаимным влиянием двух функциональных групп.-,- и- Аминокислоты при нагревании вступают в реакции, аналогичные реакциям соответствующих оксикислот.
- Аминокислоты при нагревании образуют дикетопиперазины.
Реакция идет межмолекулярно через промежуточное образование дипептидов:
дипептидов:

Дикетопиперазин
2. -Аминокислоты образуютнепредельные кислоты:
t°
 R-CH-CH2-C=O
R-CH=CH-C=O
R-CH-CH2-C=O
R-CH=CH-C=O
-NH3
NH2OHOH
3. - и-Аминокислоты образуют циклические амиды, называемые- и - лактамами. Для них характерно таутомерное превращение (лактамлактим):
t°
 R-CH-CH2-CH2-C=O
R-CH-CH2-CH2-C=O
-H2O
NH2OH
лактам

Лактим
Цвиттер-ион (биполярный ион) — молекула которая, являясь в целом электронейтральной, в своей структуре имеет части, несущие как отрицательный, так и положительный заряды, локализованные на несоседних атомах. К цвитер-ионным соединениям зачастую относят и внутримолекулярные соли (например, внутримолекулярные соли аминокислот) и, иногда, ионные диполярные соединения, в том числе и с зарядами на соседних атомах (например, N-оксиды аминов). Цвиттер-ионные соединения высокополярны и поэтому, как правило, обладают хорошей растворимостью в полярных растворителях (воде, диметилсульфоксиде и т. п.) и слабой — в большинстве органических неполярных растворителей.
Различаются они только боковыми цепями (R-группами), которые у разных аминокислот неодинаковы по структуре, суммарному заряду (полярности) и растворимости в воде (гидрофильности или гидрофобности).
Аминокислоты классифицируют на основе химического строения радикалов, хотя были предложены и другие принципы. Различают ароматические и алифатические аминокислоты, а также аминокислоты, содержащие серу или гидроксильные группы. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группу), то они называются нейтральными аминокислотами. Если же аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой.
Современная рациональная классификация аминокислот основана на полярности радикалов, т.е. способности их к взаимодействию с водой. Она включает четыре класса аминокислот:
неполярные(гидрофобные)
полярные (гидрофильные) незаряженные
отрицательно заряженные
положительно заряженные при физиологических значениях pH
Во всех - -аминокислотах, за исключением глицина,- атом углерода
связан с четырьмя различными замещающими группами и, следовательно, является асимметрическим, или хиральным. Такие молекулы встречаются в двух стереоизомерных формах и проявляют оптическую активность.
Все аминокислоты, входящие в состав молекул белков, являются L-стереоизомерами.
Водные растворы аминокислот окрашиваются в синий цвет при прибавлении небольшого количества сульфата или хлорида меди (II), в особенности после связывания образующихся при этом в растворе ионов водорода буферным раствором. Такая же окраска появляется при кипячении водного или спиртового раствора аминокислоты с окисью меди или с карбонатом меди. Водный раствор аминокислоты после обработки в нейтральной среде карбонатом, окисью, фосфатом или ацетатом меди становится темносиним и при выпаривании выделяет очень красивые кристаллы. Образующиеся соединения в водном растворе ионизованы слабо и, вероятно, представляют собой комплексы, в которых медь связана не только карбоксильной группой, но также, при помощи вторичных валентных связей, азотом. Обычно принято считать, что в этих комплексах на 2 молекулы аминокислоты приходится 1 атом меди.
Влияние рН средына ионизацию аминокислот. Изменение рН среды от кислой до щелочной влияет на заряд растворенных аминокислот. В кислой среде (рН<7) все аминокислоты несут положительный заряд (существуют в виде катиона), так как избыток протонов в среде подавляет диссоциацию карбоксильной группы:

В кислой среде аминокислоты в электрическом поле движутся к катоду.
В щелочной среде (рН>7), где имеется избыток ионов ОН-, аминокислоты находятся в виде отрицательно заряженных ионов (анионов), так как диссоциирует NН+3-группа:
![]()
В этом случае аминокислоты перемещаются в электрическом поле к аноду.
Следовательно, в зависимости от рН среды аминокислоты имеют суммарный нулевой, положительный или отрицательный заряд.
Состояние, в котором заряд аминокислоты равен нулю, называется изоэлектрическим. Значение рН, при котором наступает такое состояние и аминокислота не перемещается в электрическом поле ни к аноду, ни к катоду, называется изоэлектрической точкой и обозначается рНI. Изоэлектрическая точка очень точно отражает кислотно-основные свойства разных групп в аминокислотах и является одной из важных констант, характеризующих аминокислоту.
Изоэлектрическая точка неполярных (гидрофобных) аминокислот приближается к нейтральному значению рН (от 5,5 для фенилаланина до 6,3 для пролина), у кислых она имеет низкие значения (для глутаминовой кислоты 3,2, для аспарагиновой 2,8). Изоэлектрическая точка для цистеина и цистина равна 5,0, что указывает на слабые кислотные свойства этих аминокислот. У основных аминокислот — гистидина и особенно лизина и аргинина — изоэлектрическая точка значительно выше 7.
Билет №23.
Закон действующих масс для обратимых процессов. Связь значений Кравн с изменением энергии Гиббса обратимого процесса. Напишите выражение Кравн следующих процессов:
А) Гомогенных 2H2 (г.) + O2 ⇌ 2H2O (г.)
Б) Гетерогенных CO2 (г.) + C (т.) ⇌ 2CO(г.)
В) Диссоциации в растворе: кислот CH3COOH⇌CH3COO- + H+,
Оснований NH4OH⇌NH4++ OH-, комплексов [Cu(NH3)4]2+⇌Cu2+ + 4NH3
Г) Реакции в растворе: гидролиза соли CH3COO- + H2O⇌CH3COOH + OH-,
Окисление – восстановление S2- + Sn4+⇌S0 +Sn2+
Закон действующих масс для обратимых процессов: «Константа химического равновесия обратимого процесса равна отношению произведения равновесных концентраций конечных продуктов к произведению равновесных концентраций исходных веществ, возведенных в степени, равные стехиометрическим коэффициентам при формулах соответствующих веществ в уравнении химической реакции».
Связь Кравн и энергии Гиббса (G)
Если
 0р<0,
то Кравн>1.
Это означает, что в равновесной смеси
преобладают продукты прямой
реакции.
0р<0,
то Кравн>1.
Это означает, что в равновесной смеси
преобладают продукты прямой
реакции.
Если
 0р>0,
то Кравн<1.
Это означает, что в равновесной смеси
преобладают исходные
вещества.
0р>0,
то Кравн<1.
Это означает, что в равновесной смеси
преобладают исходные
вещества.
Кравн следующих процессов:
А) Гомогенных 2H2 (г.) + O2 (г.)⇌ 2H2O (г.)
Кравн=
Б) Гетерогенных CO2 (г.) + C (т.) ⇌ 2CO(г.)
Кравн=
В) Диссоциации в растворе: кислот CH3COOH⇌CH3COO- + H+,
Кравн=
Оснований NH4OH⇌NH4++ OH-,
Кравн=
комплексов [Cu(NH3)4]2+⇌Cu2+ + 4NH3
Кравн=
Г) Реакции в растворе: гидролиза соли CH3COO- + H2O⇌CH3COOH + OH-,
Кравн=
Окисление – восстановление S2- + Sn4+⇌S0 +Sn2+
Кравн=
Учебник: 112-114.
Попов задает дополнительный вопрос про смещение константы равновесия, чем меньше константа, тем меньше кислотные свойства, константа равновесия стремится к бесконечности
Теория кислотности – основности Лоури – Бренстеда.
По Бренстеду-Лоури, кислоты представляют собой вещества, способные отдавать протон, а основания - вещества, присоединяющие протон. Согласно протонной теории кислот и оснований Бренстеда-Лоури, кислотно-основное взаимодействие - это процесс, который ведет к переносу протона от одной частицы (кислоты) к другой (основанию). По Бренстеду, основание - это частица, способная поделиться одной из своих электронных пар с протоном и образовать с ним ковалентную связь (протонироваться). Кислотой Бренстеда является частица, способная к отщеплению протона (депротонированию). Самой сильной кислотой является сам протон. Свободные протоны существуют лишь в газовой фазе, в растворах они связаны с тем или иным основанием, в роли которого чаще всего выступает молекула растворителя. Поэтому результатом реакции переноса протона является образование новой пары частиц кислота (В-Н+) - основание (А-):
Дисахариды. Типы связи. Номенклатура. Восстанавливающая и невосстанавливающая способность. Лактоза, Целлобиоза. Доказательство их восстанавливающей способности.
Природные дисахариды(биозы) состоят из двух одинаковых или разных моносахаридных остатков и представляют собой О-гликозиды (полные ацетали), в которых один из моносахаридов выполняет роль агликогена.
Существуют два типа связывания моносахаридных остатков в природных дисахаридах:
- За счет полуацетальной(гликозидной) ОН-группы одного и любой другой спиртовой ОН-группы другого моносахарида (группа восстанавливающих дисахаридов).
- За счет полуацетальных (гликозидых) ОН-групп обоих моносахаридов (группа невосстанавливающих дисахаридов).
Восстанавливающие дисахариды. Один из моносахаридных остатков учавствует в образовании гликозидной связи за счет гидроксильной группы чаще всего при С-4 или С-6. В дисахариде имеется свободная полуацетальная гидроксильная группа, вследствие чего сохраняется способность к раскрытию цикла. Представителями восстанавливающихся дисахаридов являются: мальтоза, целлобиоза, лактоза.
Невосстанавливающие дисахариды.К этой группе принадлежит небольшое число дисахаридов, важнейшим из которых является сахароза.
Сахарозапостроена из остатковD-глюкопиранозы иD-фруктофуранозы, связанных гликозидной связью между гидроксильными группами при аномерных атомах углерода. Т.к в молекуле сахарозы отсутствуют свободные полуацетальные гидроксильные группы, она не обладает способностью к цикло –оксо-таутомерии. Растворы сахарозы не мутаротируют.

Восстанавливающая способность целлобиозы

Восстанавливающая
способн
Билет №25. (Комплект 3)
Молекулярная адсорбция из растворов на твердых адсорбентах. Факторы, влияющие на этот процесс. Основные правила молекулярной адсорбции из растворов (Шилова и Ребиндера). Выбора эффективного адсорбента. Понятие о лимфосорбции и гемосорбции.
Существенное отличие адсорбции веществ из раствора от адсорбции из газовой фазы заключается в конкуренциимежду растворенным веществом и растворителем за возможность взаимодействовать с адсорбционными центрами на поверхности твердого адсорбента. Молекулярная адсорбция зависит от следующихфакторов:
Природы адсорбента;
Природы растворителя;
Природы поглощаемого вещества (адсорбата);
Концентрации раствора;
Температуры.
Влияние природы адсорбента на процесс молекулярной адсорбции из раствора определяется, как и в случае адсорбции газов, удельной поверхностью адсорбента и его сродствомк поглощаемому веществу.Гидрофильные адсорбенты(силикагель, глины, пористые стекла) хорошо поглощают полярные вещества, а гидрофобные (сажа, активированный уголь) –неполярные вещества.
Природа растворителя должна сильно отличаться от природы растворенного вещества и природы адсорбента. Только в этом случае адсорбция вещества из раствора будет эффективной. Другими словами: чем хуже данный растворитель смачивает поверхность адсорбента и чем хуже растворяет вещество, тем лучше будет происходить адсорбция растворенного вещества.
Влияние природы поглощаемого вещества определяется несколькими правилами. Во-первых, правилом«подобное взаимодействует с подобным», которое указывает на необходимость сродства между адсорбируемым веществом и адсорбентом.Во-вторых,правилом Николая Александровича Шилова: «Чем больше растворимость вещества в данном растворителе, тем хуже оно адсорбируется на поверхности твердого адсорбента».В-третьих,правилом выравнивания полярностей контактирующих фаз, сформулированнымиПетром Александровичем Ребиндером: «на поверхности раздела фаз прежде всего адсорбируются те вещества, при адсорбции которых происходит выравнивание полярностей соприкасающихся фаз, причем с увеличением разности полярности фаз способность к адсорбции этих веществ возрастает».
Поэтому эффективней всего адсорбируются вещества, молекулы которых дифильны(головастик).
Влияние концентрации растворенного вещества на процесс его адсорбции из раствора при постоянной температуре также описывается уравнением Ленгмюра.
При повышении температуры адсорбция веществ из растворов обычно уменьшается.
При отравлениях используется активированный уголь, способный адсорбировать газы, алкалоиды, барбитураты, токсины из пищеварительной системы. Одна таблетка активированного угля массой 0,25 г имеет адсорбционную поверхность около 100 м2. С его помощью осуществляют также сорбционную детоксикацию крови и лимфы больного путем перфузии (пропуская их через активированный уголь). При гемосорбции и лимфосорбции биологические системы очищаются от барбитуратов, дихлорэтана, фосфорорганических соединений, алкалоидов и токсинов.
Учебник:692 – 694.
Полисахариды. Гликоген. Состав. Структура. Виды связей между моносахаридными зввеньями. Отличие от крахмала. Взаимосвязь структуры и функций.
Гликогенимеет молекулярную массу до 100млн. В структурном отношении похож на амилопектин, но более разветвлен. Основные типы связей:-1,4 - и-1,6- гликозидные. Между точками ветвлений – 5-6 остатков,D– глюкопиранозы.
Гликоген– резервный углевод высших животных и человека («животный крахмал»). Образуется и накапливается в печени и в мышцах, а при необходимости очень быстро расщепляется до глюкозы (в печени), или до молочной кислоты (в мышцах), чему способствует большое количество концевых остатков, т.е.разветвленность молекулы. Значительная молекулярная масса гликогена позволяет запасать большое количество глюкозы в клетках.

В животных организмах этот полисахарид является структурным и функциональным аналогом растительного крахмала. По строению подобен амилопектину, но имеет еще большее разветвление цепей. Обычно между точками разветвления содержатся 10-12 глюкозных звеньев, иногда даже 6, условно можно сказать, что разветвленность макромолекулы гликогена вдвое больше, чем амилопектина. Сильное разветвление способствует выполнению гликогеном энергетической функции так как только при наличии большого числа концевых остатков можно обеспечить быстрое отщепление нужного количества глюкозы.
Гликоген — белый аморфный порошок, растворяющийся в воде с образованием опалесцирующих растворов. Растворы гликогена дают с иодом окрашивание от винно-красного и красно-бурого до красно-фиолетового цвета (отличие от крахмала).
Аминокислоты. Химические свойства как гетерофункциональных соединений. Амфотерность. Напишите реакции взаимодействия аланина, тиррозина и гистидина с НСl и NаОН Реакции декарбоксилирования. Биогенные амины, гистамин, триптамин. Биологическая роль
Гетерофункциональные соединения содержат в молекуле две и более различных функциональных групп. Эти соединения являются биологически важными соединениями, участниками многих процессов, происходящих в живых организмах, а также лекарственными препаратами. К гетерофункциональным соединениям относятся аминоспирты, оксикислоты, аминокислоты, оксокислоты, витамины, гормоны, коферменты и др
Аминокислоты содержат NH2 и COOH группы. Например,
|
|
2-аминопропановая кислота (аланин). Аланин входит в состав пептидов и белков. |
Амфотерность– способность проявлять как кислотные:
NH2 – R – COOH + HCI == [ N+H3 – R – COOH] CI
так и основные свойства:
NH2–R–COOH+NaOH===NH2–R–COONa+H2O
Амфотерность аминокислот проявляется и внутримолекулярно – в водном
растворе все аминокислоты образуют внутренние соли:
NH2 – R – COOH === N+H3 – R – COO-
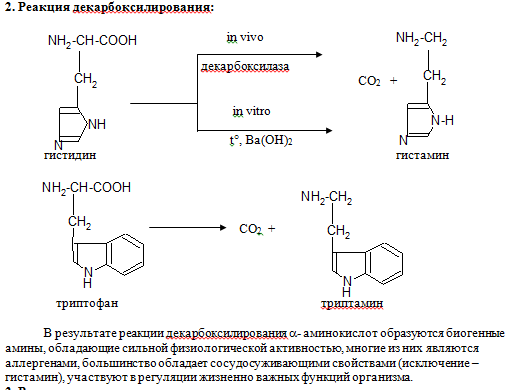
Биоге́нные ами́ны— вещества, образующиеся в организме животных или растений из аминокислот при ихдекарбоксилировании(удалении карбоксильной группы) ферментамидекарбоксилазамии обладающие высокой биологической активностью.
Гистамин — 2-(4-имидазолил)этиламин, бесцветные кристаллы, хорошо растворимые в воде и этаноле, нерастворим в эфире.Биогенный амин,медиатораллергических реакций немедленного типа, также является регулятором многих физиологических процессов. В обычных условиях гистамин находится в организме преимущественно в связанном, неактивном состоянии. При различных патологических процессах (анафилактический шок,ожоги, обморожения,сенная лихорадка,крапивницаи аллергические заболевания), а также при поступлении в организм некоторых химических веществ количество свободного гистамина увеличивается. «Высвободителями» («либераторами») гистамина являютсяd-тубокурарин,морфин, йодсодержащие рентгеноконтрастные препараты, высокомолекулярные соединения (декстрани др.) и другие лекарственные средства.
Свободный гистамин обладает высокой активностью: он вызывает спазм гладких мышц (включая мышцы бронхов), расширение капиллярови понижение артериального давления; застой крови в капиллярах и увеличение проницаемости их стенок; вызывает отёк окружающих тканей и сгущение крови. В связи с рефлекторным возбуждением мозгового вещества надпочечников выделяетсяадреналин, суживаются артериолы и учащаются сердечные сокращения. Гистамин вызывает усиление секрециижелудочного сока.
Триптамин является промежуточным звеном прибиосинтезебольшинстваиндольныхалкалоидови алкалоидов группыхинина. Также предполагается, что триптамин играет рольнейромедиатораинейротрансмитерав головном мозге млекопитающих.
Билет №25.
Межфазные электрические потенциалы, их виды и причины возникновения. Электродный потенциал и факторы, влияющие на его величину. Стандартный электродный потенциал, его определение. Уравнение Нернста. Метод прямой потенциометрии.
Двойным электрическим слоем (ДЭС) называется упорядоченное распределение противоположно заряженных частиц на межфазной границе.
В зависимости от природы соприкасающихся фаз и характера процессов, протекающих на границе их раздела, различают следующие виды электрических потенциалов:
- Электродный потенциал возникает на границе металл – раствор в результате протекания окислительно – восстановительных реакция на межфазной границе, сопровождаемых переходом катионов металла через нее.
- Восстановительный потенциал возникает на границе инертный электропроводник – раствор, содержащий сопряженную окислительно – восстановительную пару, - в результате протекания окислительно – восстановительных реакций на межфазной границе за счет перехода электронов через нее. (Раньше назывался окислительно – восстановительным)
- Диффузионный потенциал возникает на границе раздела двух различных растворов в результате направленного перехода ионов через границу раздела с разной скоростью.
- Мембранный потенциал возникает на мембране с избирательной проницаемостью, разделяющей два различных раствора, в результате направленного перехода ионов через эту мембрану.
Потенциалопределяющими ионами называют ионы, переход которых через границу раздела приводит к возникновении на ней двойного электрического слоя.
Электродом,
или полуэлементом,
называется система, состоящая из двух
контактирующих разнородных проводников
– электронного (металл) и ионного
(раствор электролита), на межфазной
границе между которыми возникает двойной
электрический слой, характеризующийся
определенным значением потенциала
![]() .
.
Факторы, влияющие на его величину:
Природа металла (энергии его кристаллической решетки, энергии ионизации атомов металла и энергии гидратации его катионов);
Активности (эффективной концентрации) потенциалопределяющих ионов в растворе;
Температуры раствора.
Стандартным электродным потенциалом называется потенциал, возникающий на границе металл – раствора при активности потенциалопределяющих ионов в растворе 1 моль/л и температуре 298 К. Абсолютное значение стандартного электродного потенциала отдельно взятого электрода измерить или рассчитать невозможно, но можно определить его значение относительно какого – либо электрода, выбранного в качестве эталона. Согласно Международному соглашению таким эталоном служит стандартный однородный электрод.
Уравнение Нернста.
Значение электродного потенциала, возникающего на границе металл – раствор, зависит от природы металла, активности его ионов в растворе и от температуры. Влияние всех перечисленных факторов на величину электродного потенциала металла выражается уравнением Неранста:
Потенциометрией
называется физико – химический метод
анализа, позволяющий определять
активности (концентрации) ионов на
основании измерения ЭДС гальванической
цепи, состоящей из электрода сравнений
и электрода определения, опущенных в
исследуемый раствор.
Электродов сравнения называется электрод, потенциал которого практически постоянен, легко воспроизводим и не зависит от протекания побочных реакций.
Стандартный водородный электрод – общепринятый электрод для сравнения. Потенциал его условно принят за ноль при любой температуре.
Электродом
определения
называется электрод, потенциал которого
зависит от активности (концентрации)
анализируемых ионов и практически не
зависит от содержания других ионов в
растворе.

Электродами определения являются ионоселективные электроды, среди которых наибольшее применении находят стеклянные электроды.
Учебник: 652 – 656, 670 – 671.
Дисахариды. Типы связи. Номенклатура. Восстанавливающая и невосстанавливающая способность. Лактоза, Целлобиоза. Доказательство их восстанавливающей способности.
Природные дисахариды(биозы) состоят из двух одинаковых или разных моносахаридных остатков и представляют собой О-гликозиды (полные ацетали), в которых один из моносахаридов выполняет роль агликогена.
Существуют два типа связывания моносахаридных остатков в природных дисахаридах:
- За счет полуацетальной(гликозидной) ОН-группы одного и любой другой спиртовой ОН-группы другого моносахарида (группа восстанавливающих дисахаридов).
- За счет полуацетальных (гликозидых) ОН-групп обоих моносахаридов (группа невосстанавливающих дисахаридов).
Восстанавливающие дисахариды. Один из моносахаридных остатков учавствует в образовании гликозидной связи за счет гидроксильной группы чаще всего при С-4 или С-6. В дисахариде имеется свободная полуацетальная гидроксильная группа, вследствие чего сохраняется способность к раскрытию цикла. Представителями восстанавливающихся дисахаридов являются: мальтоза, целлобиоза, лактоза.
Невосстанавливающие дисахариды.К этой группе принадлежит небольшое число дисахаридов, важнейшим из которых является сахароза.
Сахарозапостроена из остатковD-глюкопиранозы иD-фруктофуранозы, связанных гликозидной связью между гидроксильными группами при аномерных атомах углерода. Т.к в молекуле сахарозы отсутствуют свободные полуацетальные гидроксильные группы, она не обладает способностью к цикло –оксо-таутомерии. Растворы сахарозы не мутаротируют.
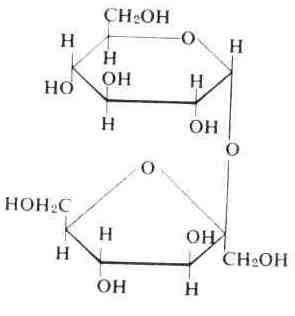
Восстанавливающая способность целлобиозы
Восстанавливающая способность лактозы

Оксикислоты. Структура молочной, яблочной , винной, лимонной, β гидроксимасляной кислоты. Химические свойства. Реакция образования солей и сложных эфиров. Их названия по кислотным остаткам. Биологическая роль.
Оксикислоты–карбоновые кислоты, в которых одновременно содержатсякарбоксильнаягидроксильная группы. Проявляют общие свойствва спиртов и кислот. В зависимости от реагентов и условий проведения реакции. Гидроксикислоты проявляютспецифические свойства, которые обусловлены взаимным влиянием ОН- и СООН- групп.Например, своеобразная реакция отщепления воды при нагревании.
Она
позволяет отличить -,-,-
и другие гидроксикислоты.

а)
t°


гидролиз + 2H2O
+
H+ или OH-
б)


t°

-H2O
-оксимасляная кислота кротоновая кислота
в)
t°


 +
H2O
+
H2O
гидролиз
H+
-гидроксимасляная - бутиролактон
кислота (ГОМК)
ГОМК обладает наркотическим действием, нетоксична, применяется в виде натриевой соли как снотворное средство и при неингаляционном наркозе при операциях.
г)


t°

 +
H2O
+
H2O
гидролиз
H+
-гидроксивалериановая - валеролактон
лактон
Лактиды и лактоны могут гидролизоваться в кислой среде с образованием исходных гидроксикислот.
2. Разложение -гидроксикислот при нагревании в присутствии H2SO4:

t°, H2SO4
 CH3–CHO
+ HCOOH
CH3–CHO
+ HCOOH
Многоосновные кислоты ведут себя так же. Например,
а) при нагревании лимонная кислота будет вести себя как -гидроксикислоты:


t°


-Н2О
лимонная
кислота цис-аконитовая
к-та
+ Н2О

против правила
Марковникова
изолимонная кислота
Молочная
(α – гидроксипропионовая (лактаты))
ИЮПАК – 2 гидроксипропановая (2х
атомная и одноосновная) является
продуктом жизнедеятельности ряда
бактерий. Используется как консервант,
предохраняющий от продуктов гниения.
Встречается в виде 2х стереоизомерных
форм

Яблочная –α гидроксиянтарная (малаты) ИЮПАК 2 гидроксибутандиовая 3 атомная 2 основная . в рябине, яблоках. Один из продуктов распада углеводов в организме. Соли железа (малаты) применяются в медецине при малокровии. Существ в виде 2х формах.

Винная
(виноградная), или,-дигидроксиянтарная
кислота (тартраты) 2,3-дигидрокси
бутандиовая кислота 4х атомная 2 основная.
Винная кислота — распространённое
природное соединение. В значительном
количестве она содержится в
кисломсокемногих
фруктов, например, ввиноградномсоке.
Соли винной кислоты — тартраты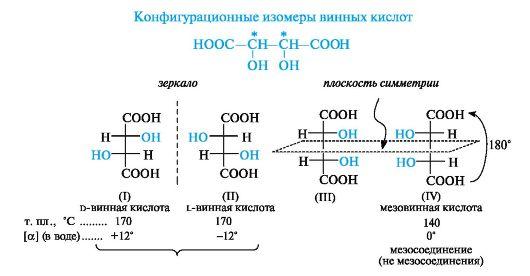
При пиролизе D-винная кислота декарбоксилируется с образованием пировиноградной СН3СОСООН и пировинной (метилянтарной) НООССН(СН3)СН2СООН кислот. Она восстанавливается до янтарной кислоты, восстанавливает аммиачный раствор AgNO3 до Ag; в щелочной среде растворяет Сu(ОН)2 с образованием прозрачного ярко-синего раствора - реактива Фелинга. Применяется в пищевой промышленности (пищевая добавка Е334), в медицине, ваналитической химиидля обнаружения альдегидов, сахаров и др., в химической и фармакологической промышленности для разделения рацематов органических веществ на изомеры.Соливинной кислоты (тартраты) используются в медицине, при крашениитканей
Лимонная,
или-гидрокси--карбокси-глутаровая
(цитраты) 3-гидрокси-3-карбоксипентандиовая
4х атомная 3 основная. Соли и эфиры
лимонной кислоты называютсяцитратами.
Лимонная кислота, являясь главным
промежуточным продуктом метаболическогоцикла
трикарбоновых кислот, играет важную
роль в системе биохимических
реакцийклеточного
дыханиямножества организмов.
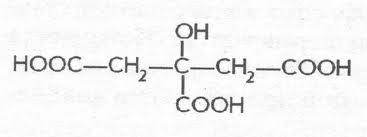
Β - гидроксимасляная 1-3гидроскибутановая - как промежуточный продукт окисления жирных кислот накапливается в организме у больных сахарным диабетом, являясь, в свою очередь, предшественником ацетоуксусной кислоты.
Сложные эфиры можно рассматривать как производные кислот, водород карбоксильной группы которых замещен радикалом (R'). Их можно также рассматривать как производные спиртов, в молекуле которых водород гидроксила замещен остатком кислоты.
Получение сложных эфиров сводится к взаимодействию соответствующих спирта и кислоты в присутствии водоотнимающих средств или действием на спирт ангидридов кислот (амил-нитрит).
Низкомолекулярные сложные эфиры - подвижные жидкости с характерным специфическим запахом, высокомолекулярные - твердые вещества. Все сложные эфиры нерастворимы в воде и хорошо растворимы в органических растворителях. Если эфир образован кислотой, которая является окислителем, то он взрывоопасен, так как возможно внутримолекулярное окисление спирта, например, нитроглицерин.
Характерным свойством сложных эфиров является их способность легко гидролизоваться. Гидролиз катализируется присутствием щелочей, кислот, нагреванием, присутствием окислителей и восстановителей
Глицерин тринаитрат глицерина тринаитрат глицерина взрычатое в-во. В малых концентрациях ( в виде 1% раствора в этаноле) прим как сосудорасширяющее средство.
СН2ОН
СН2О
-NO2
 СН2ОН
3НNO3 H2SO4
СНО -NO2
+ 3H2SO4
(3NO2HSO4 вначале)
СН2ОН
3НNO3 H2SO4
СНО -NO2
+ 3H2SO4
(3NO2HSO4 вначале)
СН2ОН
-3H2 OСН2О -NO2
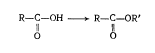
Билет №26.
Сущность окислительно – восстановительного взаимодействия. Сопряженные окислительно – восстановительные пары. Количественная мера силы окислителя и восстановителя в сопряженной паре. Критерий направления протекания ОВР и критерий необратимости реакции. Укажите направление протекания следующий реакций:
а) 2FeCl3 + 2KI = FeCl2 + I2 + 2KCl
б) 2HI + S = I2 + H2S
Окислительно – восстановительными реакцияминазываются химические реакции, протекающие с изменением степени окисления атомов вследствие перераспределения электронов между ними.
Окислениемназывается процесс отдачи электронов атомов вещества, сопровождающийся повышением степени его окисления. (-e)
Восстановлениемназывается процесс присоединения электронов атомом вещества, сопровождающийся понижением степени его окисления. (+e)
В ходе окислительно – восстановительной реакции оба процесса идут одновременно, а общее число отданныхэлектронов равно общему принятых.
Окислителемназывается вещество, в состав которого входят атомы, присоединяющие электроны, т. е. окислитель – акцептор электронов. (+e-)
Восстановителемназывается вещество, в состав которого входят атомы, отдающие электроны, т.е. восстановитель – донор электронов. (-e-)
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, то есть восстановлением, другая — с отдачей электронов, то есть окислением.
Так, в реакции:
3Zn+ 4H2SO43ZnSO4+S+ 4H2O
Участвуют пары: Zn2+,Zn0иSO42-,S0и протекают полуреакции:
3 | Zn0 – 2e- Zn2+ 1 | S+6O42- + 6e- + 8H+ S0 + 4H2O
Эквивалентом окислителя или восстановителяназывается его частица (реальная или условная), которая, соответственно, присоединяет или отдает один электрон.
Окислительно - восстановительные реакции самопроизвольно протекают всегда в сторону превращения сильногоокислителя вслабыйсопряженный восстановитель или сильного восстановителя в слабый сопряженный окислитель.
Восстановительные потенциалы– количественная мера окислительно-восстановительной способности данной сопряженной окислительно восстановительной пары.
Стандартный восстановительный потенциал Ф0– значение, которой принимает Ф при стандартных условиях: концентрация всех компонентов, участвующих в реакции, включая ионы водыH+(в кислой среде) иOH-(в щелочной среде), равна 1 моль/л, температура 298 К.
Суть окислительно – восстановительных реакцийзаключается в конкуренции за присоединение электрона между участвующими окислителями. При этом электрон присоединяет та сопряженная пара, окисленная форма которой сильнее его удерживает.
ЭДС окислительно – восстановительной реакциив стандартных условиях (E0) численно равна разности стандартных потенциалов сопряженных окислительно – восстановительных пар, участвующих в реакции:E0= ф0ок – ф0восст> 0.
Условиемсамопроизвольного протекания окислительно – восстановительной реакции являетсяположительноезначение ее ЭДС.
Если |E0| > 0.35 В, то реакций необратима.
Укажите направление протекания следующий реакций:
а) 2FeCl3 + 2KI => FeCl2 + I2 + 2KCl
ф0восст(I20,I-) = +0,54 В
ф0окисл( Fe+3, Fe+2) = +0,77 В
E0= ф0ок – ф0восст= 0,77 В – 0,54 В = 0,23 В > 0 (самопроизвольно протекает прямая реакция)
б) 2HI + S = I2 + H2S
ф0окисл ( I20,I- ) = +0,54 В
ф0восст( S0, S2-) = 0,17 В
E0= ф0ок – ф0восст= 0,54, В - 0,17 В = 0,37 В > 0 (самопроизвольно протекает прямая реакция)
Учебник: 208-215.
2) Типы окислительно – восстановительных реакций:
а) внутримолекулярные,
б) диспропорционирования (простых веществ, оксидов и солей),
в) межмолекулярные. ОВР. Приведите примеры. Типы окислительно – восстановительных реакций в живом организме.
А) Межмолекулярные— реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S+Cl2→S+ 2HCl

Б) Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2+H2O→HClO+HCl

В) Внутримолекулярные— реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O→ 2H2+O2

Моносахариды. Напишите уравнения реакции, доказывающие наличие в структуре альдегидной группы у глюкозы, ее многоатомность и наличие полуацетального гидроксила.
Качественная реакцияглюкозы с аммиачным раствором оксида серебра (I)
Доказать наличие альдегидной группы в глюкозе можно с помощью аммиачного раствора оксида серебра. К аммиачному раствору оксида серебра добавим раствор глюкозы и подогреем смесь на водяной бане. Вскоре на стенках колбы начинает осаждаться металлическое серебро. Эта реакция называется реакцией серебряного зеркала. Ее используют как качественную для открытия альдегидов. Альдегидная группа глюкозы окисляется до карбоксильной группы. Глюкоза превращается в глюконовую кислоту.


Реакции гликозидного (полуацетального) гидроксила.

агликон

гликозидная группа

О--гликозид
Образование О-гликозидов. Полуацетали взаимодействуют со спиртами в безводной среде в присутствии кислотных катализаторов с образованием ацеталей. Полуацетальные циклические формы углеводов в этих условиях также образуют ацетали, называемые О-гликозидами:


Н+

 +
+ H2O
+
+ H2O
Н+
,D-глюкопираноза 1–О-метил-,D–глюкопиранозид
Одновременно с - аномером образуется и-аномер гликозида.
Аналогично протекают реакции моносахаридов с фенолами и другими гидрокси-
производными. В природе (особенно в растительном мире) распространены
О–гликозиды.

2. Реакции спиртовых групп.
Алкилирование.
Если спирты способны алкилировать только полуацетальный или полукетальный гидроксил, то более сильные алкилирующие агенты: диметилсульфат или йодистый метил в щелочной среде алкилируют все спиртовые группы углеводов с образованием простых эфиров.


 изб.
(СН3)2SO4
изб.
(СН3)2SO4

ОН-
1-О-Метил-2,3,4,6-тетра-О-
метил-,D-глюкопиранозид
Особыми свойствами обладает гликозидная группа (ацеталь). Она легко гидролизуется в кислой среде:

Н2О
 +
CH3OH
+
CH3OH
Н+
2,3,4,6–тетра-О-метил-,D-глюкопираноза
2.2.
Ацилирование.
Моносахариды этерифицируются с образованием сложных эфиров. Наиболее легко вступают в реакцию с кислотами полуацетальная и первичная спиртовая гидроксильная группы, однако, используя более сильные ацилирующие агенты (ангидриды или галогенангидриды кислот), можно получить и полные сложные эфиры сахаров:
 1–ацетил-,D–глюкопираноза
1–ацетил-,D–глюкопираноза
+ 5 (CH3CO)2O

+ 5 CH3–COOH
1,2,3,4,6–пентаацетил-,D–глюкопираноза
