
2. Промышленные катиониты и аниониты
Промышленные катиониты
КУ – 1– катионит универсальный сильнокислотный

Получается поликонденсацией сульфированного фенола в кислой среде с формальдегидом. Бифункционален: содержит фенольные и сульфогруппы. Имеет гелевую структуру.
КУ – 2 – 8
 Получается сульфированием
сополимера стирола с 8% дивинилбензола.
Имеет гелевую структуру, монофункционален.
Катионит КУ-2-8 стоек к разбавленным
кислотам и щелочам, обладает высокой
механической прочностью, термостойкостью
(до 1200С в Н-форме).
Получается сульфированием
сополимера стирола с 8% дивинилбензола.
Имеет гелевую структуру, монофункционален.
Катионит КУ-2-8 стоек к разбавленным
кислотам и щелочам, обладает высокой
механической прочностью, термостойкостью
(до 1200С в Н-форме).
рН раствора оказывает незначительное влияние на обменную емкость катионита, при этом катионит может работать как в Н-форме, так и в солевой форме. Он не отравляется органическими соединениями и легко регенерируется растворами солей или кислот.
КУ-2-8 чС– отличается от КУ-2 особой чистотой.

КБ – 2катионит буферный слабокислотный
Получают сополимеризацией метакрилата (метилового эфира акриловой кислоты СН2= СН – СООСН3) с 2% дивинилбензола. Структура – гелевая. Монофункционален.
Существуют КБ-2-7П (7% ДВБ), КБ-2-10П (10% ДВБ).
Промышленные аниониты
АВ – 17 – 8 анионит высокоосновный
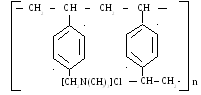
Получают хлорметилированием сополимера стирола и ДВБ (8%) с последующим аминированием хлорметильной группы. Монофункционален.
АВ – 17 – 8 чС – особая чистота
АН – 251 – анионит низкоосновный
П олучают
сополимеризацией 2-метил-5-винилпиридина
с дивинилбензолом. Имеет макропористую
структуру. Монофункционален.
олучают
сополимеризацией 2-метил-5-винилпиридина
с дивинилбензолом. Имеет макропористую
структуру. Монофункционален.
АНКБ – низкоосновный анионит катионит буферный.
3. Технологические показатели ионитов
Ионообменные смолы характеризуются следующими основными показателями:
1. Гранулометрический состав.Выпускаемые промышленностью крупнозернистые иониты имеют размер частиц 0,3 – 2,0 мм, порошкообразные 0,04 – 0,07 мм. Крупнозернистые материалы предназначены для работы в фильтрах насыпного типа, где фильтрующие слои достигают значительной высоты (1 – 3 м); порошкообразные – для работы в фильтрах намывного типа, где высота слоя составляет всего 3 – 10 мм. Размер зерен и фракционный состав товарных ионитов определяют ситовым анализом. Так как при очистке воды иониты используются в набухшем состоянии, применяют метод «мокрого» рассева. Рекомендуется проводить рассев ионитов в дистиллированной воде. Доля рабочей фракции должна составлять ˃ 95%.
Размер частиц ионообменного материала влияет на перепад давления в фильтрах, а при использовании смешанных слоев ионитов – также и на полноту гидравлического разделения отдельных компонентов шихты. При прочих равных условиях с уменьшением размера частиц перепад давления в фильтрующем слое увеличивается.
2. Механическая прочность. Для нормальной эксплуатации ионитных фильтров желательно, чтобы зерна ионитов с течением времени не измельчались. Накопление в фильтрующем слое мелких фракций приводит не только к повышению перепада давления, но и к неравномерному распределению скоростей потока по сечению аппарата (явление «каналообразования»). Избежать соударения зерен между собой, перемещения их относительно друг друга, а также ударов о стенки аппаратуры при эксплуатации ионитных фильтров невозможно. В указанных выше условиях наиболее важная характеристика механической прочности зерен ионитов – их истираемость. Принято считать механически прочными ионообменные материалы, процент истираемости которых не превышает 0,5.
3. Набухаемость. Способность увеличивать свой объем при контакте с водой. Зависит от свойств смолы и раствора. Чем больше в смоле гидрофильных групп, те больше набухаемость. Набухание ионита часто сопровождается растрескиванием.
Набухание ионитов зависит от многих факторов (степени ионизации, природы противоионов, концентрации растворов и т.п.) и оказывает очень большое влияние на ионный обмен, обеспечивая его быстрое течение. Набухание ионитов характеризуется коэффициентом набухания, абсолютной или относительной набухаемостью или изменением объема ионита при переходе из Н- или ОН- формы в солевую.
4. Осмотическая стабильность
Действие осмотических сил проявляется при изменении степени набухания ионообменных материалов. Как известно, степень набухания зависит от строения смолы, природы противоионов, а также от состава раствора, находящегося в контакте с ионитом. Два последних фактора изменяются в процессе использования смолы. При возрастании степени набухания зерен их размер увеличивается, соответственно при понижении степени набухания – уменьшается. Попеременное растягивание и сжатие сетки полимера при наличии дефектов в его структуре сопровождается разрывами цепей в местах наибольших перенапряжений. Микроскопические разрывы со временем превращаются в трещины и, в конце концов, приводят к самопроизвольному растрескиванию зерен. Испытание ионитов на осмотическую стабильность проводят по специальной методике (ГОСТ 17338 – 71). Эта методика предусматривает многократную (150 циклов) обработку порции смолы растворами кислоты и щелочи с промежуточными промывками дистиллированной водой и последующее определение количества неразрушенных гранул в процентах общего количества зерен, взятых на исследование. Осмотическая стабильность должна составлять ˃ 95%.
Смолы гелевой структуры по осмотической стабильности, как правило, значительно уступают смолам макропористой и изопористой структуры. Для увеличения срока службы гелевых смол необходимо избегать ситуаций, при которых возможны осмотические удары. Так, не следует допускать высыхания ионообменных материалов, которые отпускаются заводами-изготовителями в набухшем состоянии. Воздушно-сухие иониты во избежание быстрого набухания должны замачиваться первоначально не в воде, а в концентрированном растворе электролита (обычно применяют NaCl).
5. Химическая стойкость
Химическую стойкость промышленных ионообменных материалов в водоподготовке оценивают, прежде всего, по их растворимости в воде и растворах реагентов, используемых для регенерации. Природные неорганические катиониты из числа минералов группы цеолитов и глауконитов легко разлагаются в кислотах и щелочах. В настоящее время их применение в водоподготовке представляет лишь исторический интерес. С созданием органических ионитов, обладающих удовлетворительной стойкостью в кислых и щелочных растворах, расширилась область ионирования воды; стало возможным применять иониты не только для умягчения воды, но и для снижения ее щелочности и глубокого обессоливания.
Если бы органические ионообменные материалы не содержали никаких примесей и не разрушались с течением времени, их контакт с водой сопровождался бы лишь процессами адсорбции и ионного обмена. В действительности это не так. Из-за несовершенства технологии и синтеза в ионитах в большем или меньшем количестве остаются исходные мономеры и появляются растворимые низкомолекулярные соединения; некоторые металлы (Fe, Pb, Сu, А1) попадают в смолы в процессе их получения вследствие коррозии аппаратуры.
6. Термическая стойкость -нерастворимость и способность ионитапри заданных температурах сохранять обменную емкость.
Несмотря на то обстоятельство, что полистирольная матрица ионитов является стабильной при достаточно высокой температуре (приблизительно до 150 0С), сами иониты подвержены воздействию уже гораздо меньших температур. Так, анионит начинает медленно разрушаться при температуре приблизительно 600С и данный процесс быстро прогрессирует при температуре выше 800С. Катионит же стабилен до температуры 1200С. В связи с тем, что эти температуры значительно ниже температуры теплоносителя первого контура, перед подачей данной воды на ионообменные фильтры ее необходимо охладить. Уменьшение обменной емкости ионитов под действием высокой температуры называетсятермолизомионитов.
Анионит в гидроксильной форме разлагается согласно одного из двух механизмов с одинаковой вероятностью.
Например, АВ-17-8 в гидроксильной форме:
(1) - R-CH2N(CH3)3+OH- → R-CH2OH + N(CH3)3
температура (ТМА)
или
(2) - R-CH2N(CH3)3+OH- → R-CH2N(CH3)2 + CH3OH
температура
В результате реакции (1) происходит деаминирование анионита, что приводит к образованию высокомолекулярного спирта и триметиламина (ТМА). ТМА является слабой щелочью, сходной с аммиаком и реагирует с водой следующим образом:
N(CH3)3+ Н2О → NН(CH3)3++ ОН-
Если в теплоноситель попадает большое количество ТМА, может произойти значительное увеличение рН.
Метиловый спирт (CH3OH), полученный в результате реакции (2), не имеет вредного воздействия на систему теплоносителя первого контура. Другим продуктом данной реакции является [R-CH2N(CH3)2] – амин, который способен к ионному обмену значительно меньше, чем анионит в начальной форме.
Таким образом, обе реакции приводят к частичной (или полной) потере способности к ионному обмену. При воздействии на анионит высокой температуры (долее 80 0С) в течение длительного времени фильтрующий материал приходит в непригодность.
Катионит начинает разлагаться под действием температуры свыше 120 0С посредством следующей реакции:
R-SO3H + H2O → R-H + 2H+ + SO42-
Данная реакция полностью нарушает способность катионита к ионному обмену и приводит к образованию серной кислоты.
7. Радиационная стойкость - способность сохранять обменную емкость под воздействием радиации.
Ионизирующее излучение также вызывает разрушение органических ионитов. Этот фактор приходится учитывать при очистке контурных вод АЭС. Небольшие дозы облучения повреждают функционально-активные группы, вызывая их отщепление и деградацию, которая сопровождается понижением основности анионитов. Образующиеся при этом низкомолекулярные соединения переходят в воду. По составу они близки к продуктам термического разложения. С повышением дозы облучения повреждается каркас полимера, при этом количество органических соединений, поступающих в воду, заметно увеличивается.
Аниониты менее радиационно стойки, чем катиониты. Допустимая радиационная нагрузка ионитов: катионитов - 108рад, анионитов – 107рад.
8. Сорбционная способность
Характеризуется коэффициентом распределения К (отношение концентрации сорбируемого вещества в ионите к концентрации его в растворе при достижении равновесия):
К 1 – ионит обеднен по сравнению с раствором (сорбционная способность низкая), К1 – ионит обогащен (сорбционная способность высокая).
К определяет избирательность ионитов к тому или иному иону.
9. Способность ионитов к ионному обмену
Характеризуется обменной емкостью, т.е. количеством функциональных групп, принимающих участие в обмене, которое выражается в эквивалентных единицах и относится к единице количества ионитов. Различают полную обменную емкость, обменную емкость до «проскока» и рабочую обменную емкость. Кроме того, обменная емкость может быть определена как в статических, так и в динамических условиях, поэтому существуют понятия статической обменной емкости и динамической обменной емкости.
ПОЕ (полная обменная емкость) – общее количество всех ионообменных групп в единице объёма ионита (мг-экв/л).
ПДОЕ (полная динамическая обменная емкость) – это количество ионов, которое может поглотить ионит до момента полного насыщения. Определяется по полному прекращению извлечения данного иона из раствора, т.е. в момент выравнивания концентрации поглощаемого иона в растворе и фильтрате при пропускании раствора через колонку с ионитом (мг-экв/л).
ДОЕ (динамическая обменная емкость) – это количество ионов, которое может поглотить ионит до момента проскока ионов за фильтр, т.е это емкость ионита, определяемая по появлению данного иона в вытекающем из колонки раствора (по «проскоку») (мг-экв/л).
Рассчитать ДОЕ и ПДОЕ можно по формулам:
![]()
![]() ,
где
,
где
С – концентрация ионов (катионов для катионита, анионов для анионита) в воде, мг-экв/л; Vпроскок– количество воды, пропущенной через фильтр до проскока поглощаемого иона, л;Vполный– количество воды, пропущенной через фильтр до момента выравнивания концентраций, л;Vионита– объём ионита, л.
РОЕ (рабочая обменная емкость) – как правило, принимается равной величине ДОЕ, т.к. в производственных условиях рабочий цикл ионообменного фильтра заканчивается именно при появлении ионов в фильтрате, т.е. при «проскоке» ионов за фильтр (мг-экв/л).
СОЕ или РСОЕ (равновесная статическая обменная емкость) – величина ионного обмена между противоионами навески ионита и противоионами из раствора в условиях установившегося равновесия, т.е. когда раствор и ионит находятся в контакте в статистических условиях достаточное время для установления равновесия (мг-экв/г). Определяется выдерживанием точно отмеренного количества ионита в 0,1 н растворе соляной кислоты (для анионитов) или едкого натра (для катионитов) с дальнейшим титрованием раствора.
ПСОЕ (полная статическая обменная емкость) определяется аналогично СОЕ, но при этом должен происходить не только обмен противоионами между раствором и ионитом, но и образование труднодиссоциирующего соединения.
На рабочую обменную емкость влияют: природа ионов, участвующих в обмене; концентрация удаляемых ионов в поступающем растворе; значение рН; высота фильтрующего слоя; скорость фильтрования среды; температура, способ и степень регенерации ионита.
Влияние природы ионана обменную емкость определяется егоэлектрохимической подвижностью; с ростом подвижности увеличивается глубина его проникновения в ионит, что отражается на обменной емкости материала по данному иону. Насыщение фильтрующего материала тем или иным ионом до его проскока в фильтрат происходит в разной степени по высоте фильтрующего слоя. В то время как верхние слои фильтрующего материала насыщаются более подвижными ионами, менее подвижные проникают и улавливаются лежащими ниже слоями до появления их в фильтрате.Чем меньшей подвижностью обладает ион, тем быстрее наступает его проскок через фильтр и тем медленнее нарастает его концентрация в фильтре. Более подвижные ионы вытесняют менее подвижные ионы, поглощенные ионитом, даже тогда, когда их концентрация намного ниже.
По электрохимической подвижности ионы располагаются в следующие ряды:
катионы: Ba2+ ˃ Sr2+ ˃ Ca2+ ˃ Co2+ ˃ Ni2+ ˃ Cu2+ ˃ Mg2+ ˃ Be2+ ˃ Ag+ ˃ Cs+ ˃ Rb+ ˃ K+ ˃ NH4+ ˃ Na+ ˃ H+ ˃ Li+;
анионы: SO42- ˃ I- ˃ NO3- ˃ Br- ˃ HSO3- ˃ Cl- ˃ HCO3- ˃ HSiO3- ˃ OH-.
Иногда данные ряды называют рядами селективностикатионов и анионов. Существует определенная закономерность: ионы с более высоким зарядом поглощаются ионитами лучше.
Значение рН.рН обрабатываемой воды влияет в первую очередь на степень диссоциации функциональных групп ионита.
В большей степени рН исходной воды влияет на емкость анионита, так как помимо сильных анионов Cl¯и SO42-им улавливаются и слабые HCO3¯и HSiO3¯. Степень диссоциации функциональных групп у слабоосновных анионитов, а, следовательно, и их обменная способность будут возрастать с понижением рН раствора и, наоборот, убывать с его повышением. Степень диссоциации сильноосновных анионитов, а, следовательно, и их обменная емкость практически не зависят от рН раствора. Слабоосновные аниониты способны к поглощению преимущественно анионов сильных кислот (SO42-,Cl¯и др.). Сильноосновные аниониты способны к поглощению анионов как сильных, так и слабых кислот (например, угольной НСО3¯, кремниевойHSiO3¯и др.).
На практике было отмечено, что лучший результат очистки воды получается, когда в поступающей на анионитовый фильтр воде находятся кислоты, а не соли. Поэтому в схемах обработки воды перед анионитовым фильтром, как правило, устанавливается Н+-катионитовый фильтр для перевода солей в соответствующие кислоты.
В меньшей степени значение рН исходной воды сказывается на обменной емкости катионита, так как им преимущественно улавливаются сильные катионы Na+, K+, Mg2+, › Ca2+. Тем не менее, возрастание рН выше 7 увеличивает емкость катионита за счет устраненияпротивоиона, т.е. ионов водорода, путем нейтрализации образующейся кислоты.
Влияние скорости фильтрованияисходной воды на обменную емкость связано с продолжительностью контакта воды с ионитами. С увеличением скорости снижается время контакта и обменная емкость. Если за 100 % принять емкость катионита при скорости фильтрования 1,4 мл/с, то при увеличении ее в 10 раз емкость снижается до 85 %. Увеличение скорости фильтрования на снижение обменной емкости анионита сказывается в еще большей степени. Увеличение времени контакта воды с ионитом на практике достигается снижением скорости фильтрования и увеличением высоты фильтрующего слоя.
