
Pat_fiziologiya_Ataman
.pdf(вторинних імунодефіцитів), супроводжується збільшенням частоти виникнення ракових пухлин у 2,5 рази, а лімфоцитарних пухлин — у 35 разів.
26.2.36.Опишіть патогенез лейкозів. Які стадії розвитку проходить
лейкоз?
Під впливом онкогенних вірусів, іонізуючої радіації, хімічних речовин відбувається мутація генів або епігеномне порушення регуляції процесу розмноження й дозрівання кровотворних клітин. При цьому в кістковому мозку утворюється клон пухлинних клітин, для яких характерні безмежний ріст і знижена здатність до диференціювання. Швидкий ріст лейкозних клітин призводить до поширення (метастазування) їх по всій системі крові, включаючи кровотворні органи й кров. У лейкозних клітинах, що циркулюють у крові, виявляють однакові хромосомні маркери. Для хронічного мієлолейкозу таким маркером служить "філадельфійська" хромосома.
Нестабільність генотипу лейкозних клітин призводить до виникнення мутацій, як спонтанних, так і обумовлених тривалим впливом канцерогенних факторів, у результаті чого утворюються нові пухлинні клони.
Таким чином, лейкоз проходить дві стадії свого розвитку: 1) моноклонову (відносно більш доброякісну) і 2) поліклонову (злоякіснішу, термінальну). Перехід з першої стадії в другу є показником пухлинної прогресії — лейкозні клітини набувають більшої злоякісності. Вони стають такими, що їх неможна диференціювати ані морфологічними, ані цитохімічними методами, у кровотворних органах і крові збільшується кількість бластних клітин з дегенеративними змінами ядра і цитоплазми. Лейкозні клітини поширюються за межі кровотворних органів, утворюючи лейкозні інфільтрати в різних органах. Унаслідок добору знищуються клітини тих клонів, на які діяли імунна система й гормони організму, цитостатичні засоби (хімічні, гормональні, променеві). Домінують клони пухлинних клітин, найбільш стійких до цих впливів.
26.2.37.ЯКИМИ КЛІНІЧНИМИ синдромами можуть виявляти себе лейкози?
Усе різноманіття клінічних ознак лейкозів можна розділити на три групи. І. Гематологічні синдроми, пов'язані із заміщенням нормальної кровотворної тканини лейкозною і пригніченням у зв'язку з цим нормального кровотворення. 1. Панцитопенія ~ зменшення вмісту всіх формених елементів крові. Особливо виражена при гострих лейкозах.
2. Анемія. Основу її патогенезу становить порушення еритропоезу Однак при деяких видах лейкозів певне значення може мати імунний гемоліз еритроцитів (наприклад, при хронічному лімфолейкозі) і кровотечі (геморагічний синдром). 3. Геморагічний синдром. Обумовлений в основному тромбоцитопенією та лейкозними інфільтратами в стінках кровоносних судин.
4. Порушення неспецифічного протимікробного захисту, у зв 'язку з чим зменшується резистентність організму до інфекцій. Основною причиною цього є зменшення вмісту функціонально повноцінних гранулоцитів.
5. Імунологічна недостатність. Розвивається як наслідок лімфопенії (при гострих лейкозах і хронічному мієлолейкозі) або неповноцінності лейкозних лімфоцитів (хронічний лімфолейкоз).
II. Синдроми, пов'язані з особливостями функціонування лейкозних клітин. 1. Гарячка. Показано, що тільки у 7-8 % хворих на лейкози підвищення температури на початку захворювання пов'язане з інфекцією. У більшості ж
випадків гарячка має неінфекційне походження.
2.Інтоксикація. Велика кількість лейкозних клітин гине й вивільняє у кров свій вміст. Багато компонентів загиблих клітин мають токсичну дію на центральну нервову систему. Звідси стомлюваність, загальна слабкість, нудота та ін.
3.Аутоімунні процеси. Пов'язані зі змінами, що відбуваються в лімфоци-тарному паростку крові, а саме з появою так званих "заборонених" клонів лімфоцитів, зі зменшенням кількості й функціональної активності Т-супресорів.
III. Синдроми, пов'язані з метастазуванням лейкозних клітин і розвитком лейкозних проліфератів у різних органах і тканинах.
1.Збільшення лімфатичних вузлів, печінки й селезінки.
2.Шкірний синдром. Обумовлений появою в шкірі проліфератів лейкозних клітин - лейкемідів.
3.Виразково-некротичні ураження слизових оболонок (виразково-некротичні стоматит, ангіна, ентеропатії).
4.Кістково-суглобовий синдром, що виявляється болем у кістках і суглобах.
5.Синдром нейролейкозу. Може виявлятися менінгіальним синдромом, синдромом підвищення внутрішньочерепного тиску, різноманітними неврологічними порушеннями: парезами, паралічами, парестезіями. В основі його розвитку — поява лейкозних проліфератів в оболонках головного й спинного мозку, речовині мозку, нервових стовбурах, вегетативних гангліях.
6.Лейкозний пневмоніт. Лейкозні проліферати порушують дихальну функцію легень - розвивається недостатність зовнішнього дихання.
7.Серцева недостатність. Може бути наслідком розмноження лейкозних клітин у м'язі серця.
26=3= Порушення гемостазу
26.3.1.Що таке система гемостазу? Які існують фізіологічні механізми зупинки кровотечі?
Система гемостазу — це система, що забезпечує, з одного боку, збереження рідкого стану крові, з другого - зупинку кровотечі при ушкодженні кровоносних судин.
Існує два механізми гемостазу: судинно-тромбоцитарний і коагуляційний. Судинно-тромбоцитарний (первинний, мікроциркуляторний) гемостаз забезпечує зупинку кровотечі з судин мікроциркуляторного русла, що мають діаметр до 100 мкм. Він обумовлений взаємодією судинної стінки з тромбоцитами. Унаслідок активації судинно-тромбоцитарного гемостазу утворюється білий тромбоцитарний тромб. Порушення цього механізму гемостазу є причиною майже 80 % кровотеч і 95 % випадків тромбоутворення.
Коагуляційний (вторинний, макроциркуляторний) гемостаз є продовженням судинно-тромбоцитарного і здійснюється на його основі. Коагуляційний гемостаз забезпечує зупинку кровотеч із судин, діаметр яких перевищує 100 мкм. У результаті його активації утворюється червоний тромб, що складається з фібрину і формених елементів крові.
26.3.2.Чим обумовлена участь судинної стінки в гемостазі?
Судинна стінка бере участь у реалізації судинно-тромбоцитарного гемостазу, початок якому завжди дає ушкодження ендотелію кровоносних судин. Воно має два важливих наслідки.
I. Активація механізмів гемостазу:
а) демаскування колагену, у результаті чого відбувається так звана контактна
активація тромбоцитів і фактора Хагемана (ф.ХП); б) вивільнення з ушкоджених клітин судинної стінки АДФ, що є сильним активатором адгезії й агрегації тромбоцитів;
в) вивільнення тканинного тромбопластину (ф. Ш), що ініціює зовнішній механізм зсідання крові й утворення невеликої кількості тромбіну безпосередньо в місці ушкодження судини; г) вивільнення фактора Віллебранда — глікопротеїну, що утворюється в ендо-
теліальних клітинах і бере участь в адгезії тромбоцитів. II. Зменшення тромборезистентності судинної стінки:
а) зменшення утворення простацикліну — речовини, що є потужним інгібітором агрегації тромбоцитів;
б) зменшення утворення й секреції антитромбіну III - дуже сильного природного антикоагулянта; в) зменшення здатності ендотелію фіксувати на своїй поверхні комплекс гепа-рин-
антитромбін III;
г) порушення здатності ендотеліальних клітин утворювати й вивільняти потужні
активатори фібринолізу.
26.3.3. Яка роль тромбоцитів у гемостазі?
Тромбоцити беруть участь у здійсненні гемостазу завдяки чотирьом своїм функціям.
1.Ангіотрофічна функція. Це здатність тромбоцитів підтримувати нормальну структуру й функцію стінок мікросудин. Вважають, що тромбоцити є фізіологічними "годувальниками" ендотелію. Ендотеліальні клітини поглинають тромбоцити, з яких вивільняються речовини, необхідні для підтримки структурної цілісності й функціональної активності мікросудин.
2.Вазоконстрикторна функція. Це здатність підтримувати спазм ушкоджених судин завдяки вивільненню із тромбоцитів вазоактивних речовин: адреналіну, нора-дреналіну, серотоніну.
3.Адгезивно-агрегаційна функція. Це здатність тромбоцитів прилипати до ушкоджених ділянок судинної стінки і склеюватися один з одним, утворюючи тромбо-цитарну пробку.
4.Участь у зсіданні крові. Пов'язана з вивільненням так званих тромбоцитарних факторів зсідання крові, зокрема, фактора 3, фактора 4, фактора 6 (тромбостеніну) та ін.
26.3.4. Як ЗДІЙСНЮЄТЬСЯ судинно-тромбоцитарний гемостаз? Судинно-
тромбоцитарний гемостаз складається з таких процесів (рис. 111):
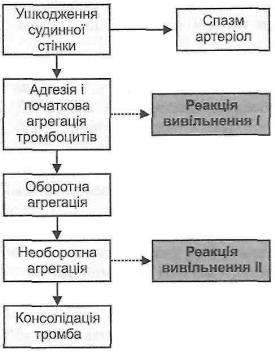
Рис. 111. Схема судинно-тромбоцитарного гемостазу
1. Спазм артеріол. Розрізняють первинний (початковий) і вторинний (відстрочений) спазм. Перший виникає відразу ж після ушкодження судинної стінки, триває кілька секунд, основний механізм його розвитку - рефлекторний. Причиною вторинного відстроченого спазму є біогенні аміни, які вивільняються тромбоцитами, —
катехоламіни, серотонін.
2.Адгезія тромбоцитів — прилипання тромбоцитів до ушкоджених ділянок судинної стінки.
3.Агрегація тромбоцитів — набрякання і склеювання кров'яних пластинок.
4.Реакція вивільнення — вивільнення із тромбоцитів гранул чотирьох типів. Розрізняють реакцію вивільнення І і реакцію вивільнення II. Перша — це реакція раннього вивільнення, вона здійснюється на етапі початкової агрегації тромбоцитів. Наслідком її є вихід гранул І типу (містять біогенні аміни) і гранул II типу (містять білки, зокрема, фактор 4 пластинок, фактор Віллебранда).
Реакція вивільнення II — це реакція пізнього вивільнення, відбувається на етапі необоротної агрегації тромбоцитів. При ушкодженні тромбоцитарних мембран із пластинок виходять гранули III і IV типів, що містять лізосомні ферменти, фактор
5.Консолідація тромбу — його ущільнення, у результаті чого формується остаточний тромбоцитарний тромб. Відбувається в результаті в'язкого метаморфозу тромбоцитів та їх ретракції під впливом тромбостеніну.
26.3.5.Як відбувається адгезія тромбоцитів?
Основною причиною адгезії тромбоцитів є оголення (демаскування) колагену внаслідок ушкодження ендотелію судин.
Розрізняють доконтактну і контактну фази адгезії тромбоцитів.
Під час доконтактної фази в крові ще до контакту з ушкодженою стінкою судини відбувається первинна активація тромбоцитів. Спочатку змінюється форма тромбоцитів від дископодібної до сферичної (набряк). Потім викидаються довгі ниткоподібні відростки (від 3 до 10 у кожному тромбоциті).
Під час контактної фази відбувається взаємодія відростків активованих
тромбоцитів з елементами базальної мембрани судинної стінки. При цьому мають значення:
а) безпосередній контакт відростків тромбоцитів з колагеном; б) опосередкований контакт тромбоцитів з колагеном через фактор Віллебранда;
в) реверсія електричного заряду інтими при її ушкодженні (заряд міняється з "—" на "+"), у результаті чого можлива електростатична взаємодія тромбоцитів, що мають негативний поверхневий заряд, зі стінкою судини; г) уповільнення течії крові в ушкодженій судині.
26.3.6.Які фактори викликають агрегацію тромбоцитів? Яка динаміка цього процесу?
Причиною агрегації тромбоцитів є поява речовин-агрегантів. Вони можуть бути тромбоцитарного (виходять з активованих тромбоцитів) і нетромбоцитарного (вивільняються ушкодженими клітинами, лейкоцитами, утворюються в плазмі крові) походження.
Найбільше значення мають такі агреганти: а) АДФ. Вивільняється з ушкоджених клітин судинної стінки, гемолізованих еритроцитів, тромбоцитів у процесі їх активації;
б) тромбоксан А2 і арахідонова кислота. Тромбоксан А2 є продуктом циклоксигеназ-ного шляху перетворення арахідонової кислоти в тромбоцитах;
в) біогенні аміни — адреналін, серотонін. їхніми джерелами є плазма крові і тромбоцити;
г) фактор агрегації тромбоцитів (ФАТ). Є речовиною ліпідної природи.
Вивільняється тканинними базофілами, базофілами і нейтрофілами крові; ґ) тромбін. Є потужним агрегантом у дозах, значно менших, якщо порівнювати з тими, що викликають зсідання крові. Такі малі кількості тромбіну завжди утворюються в місцях ушкодження судинної стінки завдяки зовнішньому
механізму зсідання крові, пов'язаному з вивільненням клітинного тромбопластину; д) тромбоспондин. Вивільняється з активованих тромбоцитів, адсорбується на їхній мембрані, взаємодіє з білками крові.
Крім речовин-агрегантів, існують фактори, що мають антиагрегантні властивості. До них, зокрема, належать простациклін, продукти фібринолізу, простациклінозалежний макромолекулярний білок, білковий фактор Барнес-Ліана.
У процесі розвитку агрегації тромбоцитів розрізняють такі етапи:
1) початкова агрегація. Відбувається одночасно з адгезією тромбоцитів. її викликає АДФ нетромбоцитарного походження (вивільняється з ушкоджених клітин судинної стінки); 2) оборотна агрегація. На цьому етапі агрегація може бути припинена,
тромбоцити ще не ушкоджені. Оборотну агрегацію обумовлюють тромбоцитарний АДФ, а також тромбоксан А, і арахідонова кислота; 3) необоротна агрегація. У цей період тромбоцити ушкоджуються і гинуть.
Вважають, що основною причиною необоротної агрегації є тромбін, що утворюється локально.
26.3.7.Які механізми лежать в основі агрегації тромбоцитів?
І. Активація тромбоцитів (рис. 112). Речовини-агреганти збільшують проникність тромбоцитарної мембрани до іонів кальцію, у результаті чого концентрація останніх у цитоплазмі кров'яних пластинок зростає. Це викликає щонайменше чотири функціонально важливих ефекти:
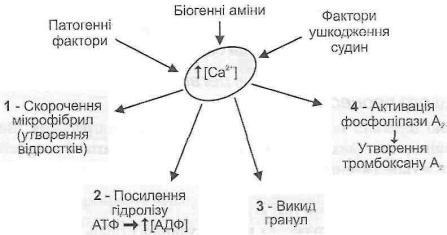
Рис. 112. Механізм активації тромбоцитів
1)скорочення мікрофібрил, у результаті чого утворюються довгі ниткоподібні відростки;
2)посилення гідролізу АТФ, наслідком чого є утворення потужного агреган-та - АДФ;
3)викид гранул тромбоцитів;
4)активація фосфоліпази А2, що викликає утворення арахідонової кислоти, а потім і тромбоксану А .
II. Власне склеювання тромбоцитів. У цьому процесі мають значення:
а) утворення між тромбоцитами "містків", що складаються з АДФ та іонів кальцію;
б) білкове склеювання — утворення "містків", що складаються з білків плазми крові. Ці білки отримали назву плазмових кофакторів агрегації. До них відносять фібриноген, альбуміни, агрексони А і В. Усі ці білки склеюють тромбоцити завдяки взаємодії з глікопротеїновими рецепторами тромбоцитів (існує 5 типів таких рецепторів) і тромбоспондином — агрегантом, адсорбованим на тромбоцитарній мембрані.
26.3.8. Що являє собою процес зсідання крові? Які фактори беруть у ньому участь?
Зсідання крові (коагуляція) є складним багатоетапним ферментативним процесом, що в кінцевому підсумку закінчується утворенням фібринового згустку.
Основу процесу зсідання крові становлять реакції протеолізу, у яких прямо або опосередковано беруть участь 12 факторів зсідання (всі вони, за винятком ф. III, мають плазмове походження) і фактор 3 тромбоцитів.
До факторів зсідання крові відносять: ф. І— фібриноген, ф. П— протромбін* ф.
Ш— тканинний тромбопластин; ф. IV— іони кальцію; ф. V— проакцелерин, ф. VII — проконвертин, ф. VIII — антигемофільний глобулін, ф. IX - фактор Крістмаса, ф. X —фактор Стюарта—Прауера, ф. XI — плазмовий попередник тромбоплас-тину, ф. ХП - фактор Хагемана, ф. ХШ - фібринстабілізуючий фактор.
За функціональними властивостями всі фактори, що беруть участь у зсіданні крові, можна поділити на такі групи:
I. Білки-ферменти. Це в основному протеолітичні ферменти: ф. II, III, VII, IX, X, XI, XII. Один фактор (ф. ХШ) є трансферазою.
Усі зазначені ферменти містяться в крові і тканинах у неактивній формі. їх активація здійснюється шляхом протеолітичного відщеплення пептидів, що
закривають активні центри ферментів. Таке відщеплення відбувається за участю активованого попереднього фактора зсідання (активної протеази). Таким чином, реакції активації зсідання крові мають каскадний, ланцюговий характер.
II. Неферментні білкиакцелератори (білки-прискорювачі). Такими є ф-V і ф.УШ. Ці фактори в сотні разів прискорюють ферментативні реакції зсідання крові. На відміну від ферментів вони споживаються в процесі коагуляції крові.
III. Фосфоліпідна матриця (мікромембрана), на якій відбуваються впорядковані реакції зсідання крові. Роль такої матриці можуть виконувати:
а) фактор 3 тромбоцитів; б) фосфоліпідні фрагменти мембран ушкоджених клітин;
в) фосфоліпідні фрагменти мембран гемолізованих еритроцитів.
IV. Іони кальцію. їхня участь у зсіданні крові полягає у фіксуванні білкових факторів до фосфоліпідних матриць.
V. Субстрат зсідання крові - фібриноген (ф.І).
Більшість факторів зсідання синтезується в печінці. їх поділяють на дві групи:
а) вітамін-К-залежні: ф. П, VII, IX, X. Вітамін К у коферментній формі входить до складу печінкових карбоксилаз, які беруть участь в утворенні зазначених факторів; б) вітамін-К-незалежнї. ф. І, V, XI. їх утворення не вимагає вітаміну К.
26.3.9. З яких фаз складається процес зсідання крові?
Процес зсідання крові проходить три фази.
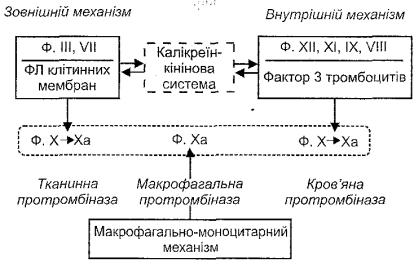
І фаза - утворення протромбінази. Існує три механізми активації цього процесу
(рис. 113):
Рис. 113. Механізми активації системи зсідання крові (ФЛфосфоліпіди)
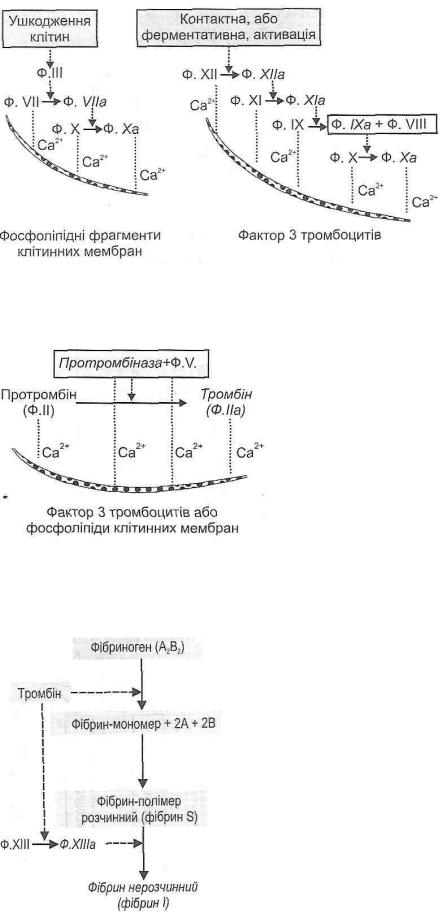
а) зовнішній (тканинний) механізм. Активується при ушкодженні клітин. При цьому вивільняються ферменти - тканинний тромбопластин (ф. Ш) і фосфоліпідні фрагменти мембран, що стають матрицею, на якій фіксуються фактори зсідання крові. Це дуже швидкий механізм активації зсідання. Він забезпечує зсідання крові поза кровоносними судинами (при крововиливах у тканини) і локальне утворення малих доз тромбіну, необхідного для необоротної агрегації тромбоцитів (рис. 114); б) внутрішній (кров 'яний) механізм. Початком його є контактна або ферментативна активація ф. XII крові. Внутрішній механізм зсідання досить тривалий, тому перша його фаза по суті визначає час усього процесу коагуляції крові;
в) макрофагально-моноцитарний механізм. На відміну від двох попередніх є механізмом патологічної активації зсідання крові. Його викликає дія на макрофаги
ендотоксинів бактерій, імунних комплексів, комплементу, продуктів розпаду тканин. При цьому з макрофагів вивільняється уже активна протромбіназа (ф.Ха).
Рис. 114. Зовнішній і внутрішній механізми активації зсідання крові
Цей механізм має певне пристосувальне значення, оскільки завдяки зсіданню крові обмежується поширення патогенних факторів в організмі. її фаза — утворення тромбіну. Відбувається за участю активної протромбінази іф.У(рис.П5).
Рис. 115.7/ фаза зсідання крові
III фаза - утворення фібрину. Складається з кількох послідовних етапів (рисі 16): а) утворення фібрину—мономеру із фібриногену під дією тромбіну;
б) утворення розчинного фібрину-полімеру (фібрину S);
в) утворення нерозчинного фібрину (фібрину І) під дією активного ф. XIII.
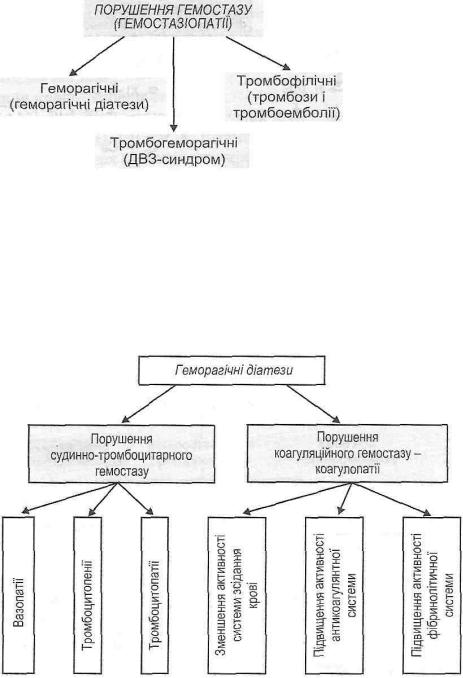
26.3.10.Як класифікують порушення гемостазу?
Порушення гемостазу (гемостазіопатії) поділяють на три групи (рис. 117):
Рис. 117. Класифікація порушень гемостазу
I. Геморагічні гемостазіопатії — геморагічні діатези.
II. Тромбогеморагічні гемостазіопатії- синдром дисемінованого внутрішньосудинного зсідання крові (ДВЗ-синдром),
III. Тромбофілічні гемостазіопатії — тромбози і тромбоемболії.
26.3.11. Що таке геморагічні діатези? Як їх класифікують?
Геморагічний діатез — це схильність організму до повторних кровотеч і крововиливів, що виникають спонтанно або після незначних травм. Геморагічні діатези поділяють на дві великі групи (рис. 118).
Рис. 118. Класифікація геморагічних діатезів
I. Порушення судинно-тромбоцитарного гемостазу:
а) вазопатії)
б) тромбоцитопенії; в) тромбоцитопатії.
II. Порушення коагуляційного гемостазу - коагулопатії.
26.3.12. Що таке вазопатії? Як їх класифікують?
Вазопатії—ц& спадково обумовлені або набуті геморагічні діатези, що виникають як наслідок первинних порушень судинної стінки.
Залежно від механізму розвитку вазопатії поділяють на дві групи:
1)запальні вазопатії— васкуліти;
2)диспластичні вазопатії— ураження судин, пов'язані з порушеннями їхньої
сполучної тканини (неповноцінність судинної стінки).
26.3.13. Які етіологія і патогенез запальних вазопатій?
Залежно від причин виникнення запальні вазопатії поділяють на:
1)інфекційні васкуліти. Є проявом цілого ряду інфекційних захворювань (вірусних геморагічних гарячок, висипного тифу, сепсису);
2)імунні васкуліти. Розвиваються як наслідок імунокомплексних захворювань (алергічних реакцій III типу за класифікацією Кумбса і Джелла), наприклад, при системному червоному вовчаку, вузликовому періартеріїті, геморагічному васкуліті (хвороба Шенляйн-Геноха);
3)інфекційно-імунні васкуліти. Поєднують обидва попередніх механізми.
У патогенезі запальних вазопатій провідна роль належить ушкодженню ендотелію, що може бути обумовлено:
а) |
цитопатичною дією ендотеліотропних вірусів; |
|
б) |
токсинами мікробів, наприклад веротоксином, що його виділяють бактерії |
|
кишкової групи; |
* |
|
в) |
комплексами антиген-антитіло і комплементом. |
|
Наслідком ушкодження ендотелію судин є:
1)діапедез еритроцитів, що клінічно виявляється точковими крововиливами
(пете-хіями);
2)інтенсивне мікротромбоутворення, що викликає порушення мікроциркуляції і живлення тканин;
3)тромбоцитопенія споживання (результат утворення мікротромбів).
26.3.14. Які етіологія і патогенез диспластичних вазопатій?
В основі диспластичних вазопатій лежать набуті або спадково обумовлені порушення сполучної тканини стінки кровоносних судин. Прикладами таких порушень є:
1.Гіповітаміноз С. Аскорбінова кислота— необхідний компонент реакції гідроксилювання проліну, унаслідок якої він перетворюється в оксипролін. Ця реакція вважається однією з ключових в утворенні колагену. При гіповітамінозі С з урахуванням сказаного порушується утворення повноцінного колагену (ламкість судин, випадання зубів і т. д.).
2.Телеангіектазії. Це спадково обумовлені локальні дефекти сполучної тканини судин, що обумовлюють стоншення їх стінок і розширення просвіту. Телеангіектазії є джерелом небезпечних для життя кровотеч, особливо при локалізації у внутрішніх органах.
3.Гемангіоми. Це судинні пухлини, які часто кровоточать.
4.Синдром Елерса-Данло. Його основу складають генетично обумовлені дефекти ] колагену.
У патогенезі диспластичних вазопатій мають значення:
1) стоншення стінок мікросудин і розширення їхнього просвіту;
2) неповноцінний локальний гемостаз. Через недостатню кількість або неповноцінність колагену в субендотелії судин порушується адгезія тромбоцитів;
3) легка ранимість судин.
26.3.15.Що таке тромбоцитопенія? Які механізми можуть лежати в основі розвитку тромбоцитопенії?
Тромбоцитопенія — це зменшення вмісту тромбоцитів в одиниці об'єму периферичної крові нижче 150 109/л.
На думку багатьох авторів, геморагічні прояви тромбоцитопенії з'являються при
