
- •Частина і. Загальна патологія
- •1. Предмет, завдання і методи патологічної фізіології. Патологічна фізіологія як навчальна дисципліна
- •2 Загальна нозологія
- •IV. За патогенезом:
- •I. Фізіологічний апоптоз відбувається:
- •II. Апоптоз в патологічних умовах може відбуватися:
- •I. Зменшення об'єму циркулюючої крові:
- •II. Зменшення хвилинного об'єму серця:
- •IV. Порушення реологічних властивостей крові:
- •I. Патогенетична класифікація:
- •I. Периферичні механізми:
- •II. Периферично-центральні механізми:
- •I. Свд може виявлятися:
- •II. Свд може характеризуватися:
I. Зменшення об'єму циркулюючої крові:
1) крововтрата (геморагічний шок);
2) втрата плазми крові при великому ексудативному запаленні (опіковий шок);
3) вихід рідини з кровоносних судин у тканини при генералізованому підвищенні проникності судин (анафілактичний шок);
4) зневоднення (ангІдремічний шок);
5) перерозподіл крові в судинному руслі (тромбоз і емболія магістральних вен).
II. Зменшення хвилинного об'єму серця:
1) порушення скоротливої функції серця (інфаркт міокарда);
2) тампонада серця (розрив серця, ексудативний перикардит);
3) аритмії (фібриляція шлуночків).
III. Зменшення загального периферичного опору - генерал із оване розширення судин:
1) падіння нейрогенного тонусу артеріол (больові форми шоку);
2) зменшення базального тонусу судин під дією біологічно активних речовин (анафілактичний, панкреатичний шок) або токсичних продуктів (травматичний, турнікетний, інфекційно-токсичний шок).
IV. Порушення реологічних властивостей крові:
1) синдром внутрішньо судинного дисемінованого зсідання крові (панкреатичний шок);
2) агрегація формених елементів крові (септичний, інфекційно-токсичний шок);
3) згущення крові - гемоконцентрація (ангІдремічний шок).
12.5. Чим визначаються важкі наслідки шоку?
Розлади загальної гемодинаміки і мікроциркуляції, що виникають за умов шоку, небезпечні насамперед порушеннями кровообігу: а) мозкового; б) вінцевого; в) ниркового. Результатом зазначених розладів є прогресуюче порушення центральної регуляції життєво важливих функцій, аж до розвитку коми; виникнення явищ гострої серцево-судинної і ниркової недостатності. Патогенні фактори, що виникають при цьому, — гіпоксія, ацидоз та інтоксикація - ведуть до генералізованого і незворотного ушкодження клітин.
12.6. Поясніть патогенез травматичного шоку.
Травматичний шок розвивається внаслідок великих за обсягом ушкоджень тканин. У його клініці розрізняють дві стадії: збудження (еректильну) і гальмування (торпідну).
Стадія збудження короткотривала, для неї характерний стан збудження центральної нервової системи, що виникає в результаті надходження великої кількості больових імпульсів з ушкоджених тканин. Розвивається больовий стрес, що виявляє себе посиленням функцій системи кровообігу, дихання, деяких ендокринних залоз
(аденогіпофіза, мозкової і кіркової речовини надниркових залоз, нейросекреторних ядер гіпоталамуса) з вивільненням у кров великої кількості кортикотропіну, адреналіну, норадреналіну, вазопресину (див. розд. 33).
Стадія гальмування більш тривала (від кількох годин до доби) і характеризується розвитком у центральній нервовій системі гальмівних процесів. Генера-лізоване гальмування захоплює й центри життєво важливих функцій (кровообігу, дихання), вони порушуються, унаслідок чого розвивається кисневе голодування. Гіпоксія, у свою чергу, збільшує порушення в серцево-судинному й дихальному центрах. Розлади гемодинаміки і зовнішнього дихання прогресують - "зачароване коло "замикається.
Крім нервово-рефлекторних механізмів у виникненні і розвитку травматичного шоку певну роль відіграє токсемія, обумовлена всмоктуванням у кров продуктів розпаду нежиттєздатних тканин. Особливе значення надають так званому ішемічному токсину.
Участь токсичних продуктів у патогенезі травматичного шоку доводиться дослідами з "перехресним кровообігом", коли після відтворення шоку в однієї тварини явища цього патологічного процесу виникають у другої, інтактної, пов'язаної з першою загальним кровообігом.
12.7. Що таке колапс?
Колапс — це судинна недостатність, що швидко розвивається і характеризується в першу чергу падінням судинного тонусу, а також гострим зменшенням об'єму циркулюючої крові. При цьому відбувається зменшення припливу венозної крові до серця, зниження серцевого виштовху, падіння артеріального й венозного тиску, порушуються перфузія тканин і обмін речовин, настає гіпоксія головного мозку, пригнічуються життєво важливі функції організму.
12.8. Що таке краш-синдром?
Краш-синдром (синдром тривалого роздавлювання) - це патологічний процес, який розвивається у потерпілих у результаті тривалого (4-8 г і більше) роздавлювання м'яких тканин кінцівок уламками зруйнованих будинків, споруд, брилами ґрунту при обвалах у шахтах та ін.
У перебігу краш-синдрому розрізняють три періоди: 1) ранній (до 3-х діб) з переважанням явищ шоку; [ 2) проміжний (з 3-ї до 12-ї доби) з переважанням гострої ниркової недостатності; 3) пізній (з 8-12-ї доби до 1-2 міс), або період видужання, з переважанням місцевих симптомів.
У розвитку краш-синдрому велике значення мають три патогенетичних фактори:
а) больове подразнення;
б) травматична токсемія, обумовлена всмоктуванням токсичних продуктів аутолі-зу тканин з вогнища ураження;
в) плазмо- і крововтрата, пов'язані з набряком і крововиливами в зоні роздавлених або довготривало ішемізованих тканин.
12.9. Що таке кома?
Кома— це патологічний стан, що характеризується глибоким пригніченням функцій центральної нервової системи і виявляє себе втратою свідомості, відсутністю рефлексів на зовнішні подразники і розладами регуляції життєво важливих функцій організму.
12.10. Як класифікують коматозні стани?
Залежно від етіології розрізняють екзогенні й ендогенні коми.
1. Екзогенні коми виникають унаслідок дії патогенних факторів зовнішнього середовища або в результаті дефіциту факторів, необхідних для існування організму. Прикладами екзогенних ком є травматична (виникає при ушкодженні головного мозку), гіпоксична, гІпер- і гіпотермічна, екзотоксична, аліментарно-дистрофічна (виникає при важкому голодуванні).
2. Ендогенні коми розвиваються внаслідок порушень діяльності функціональних систем організму. Так, при розладах функції системи кровообігу може виникати апоплексична кома, системи крові — гемолітична, видільної системи - уремічна, печінки — печінкова, ендокринної системи — діабетична, гіпоглікемічна, гіпокор-тикоїдна, тиреотоксична та інші види коми.
12.11. Які механізми лежать в основі патогенезу коматозних станів?
1. Енергодефіцитний механізм. Порушення синтезу АТФ у нейронах центральної нервової системи призводить до генералізованого порушення їхніх функцій. Зазначений механізм є провідним у розвитку гіпоксичної, апоплексичної, респіраторної, гемолітичної, гіпоглікемічної, аліментарно-дистрофічної, екзотоксичної ком.
2. Порушення синаптичної передачі в центральній нервовій системі. Вони можуть бути пов'язані з: а) порушенням синтезу, транспорту, депонування і секреції нейромедіаторів; б) витісненням нейромедіаторів так званими псевдомедіаторами (хибними медіаторами); в) надмірною активацією гальмівних постсинаптичних рецепторів; г) блокадою збудливих постсинаптичних рецепторів. Зазначений механізм відіграє велику роль у розвитку печінкової, уремічної і екзотоксичної ком.
3. Загальні водно-електролітні порушення. Мають значення зміни осмотичного тиску крові й порушення балансу електролітів в організмі. Цей механізм є провідним у розвитку гіперосмолярної діабетичної коми, гіпертермічної, гіпокортикоїд-ної та гіпопаратиреоїдної ком.
4. Порушення кислотно-основного стану. Лежать в основі виникнення ацидотич-ної діабетичної, лактацидемічної, хлоргідропенічної та деяких інших ком.
5. Підвищення внутрішньочерепного тиску. Цей механізм діє при первинних ураженнях головного мозку. Він є основним у патогенезі коми при менінгітах та енцефалітах, а також травматичної коми при черепно-мозкових травмах.
13. Місцеві розлади кровообігу Порушення мікроциркуляції
13.1. Назвіть основні форми місцевих розладів кровообігу.
Артеріальна гіперемія, венозна гіперемія, ішемія, стаз, тромбоз, емболія.
13.2. Що таке артеріальна гіперемія?
Артеріальна гіперемія - це збільшення кровонаповнення органа або тканини за рахунок надмірного надходження крові по артеріальних судинах.
13.3. Які функціональні зміни й клінічні ознаки характеризують артеріальну гіперемію?
При артеріальній гіперемії спостерігають розширення дрібних артерій, артеріол, вен і капілярів; прискорення течії крові в них, пульсацію дрібних артерій і капілярів, збільшення числа видимих оком судин, збільшення тиску в артеріолах, капілярах і венах. У результаті зазначених змін виникає почервоніння, підвищується місцева температура, збільшується об'єм гіперемованої ділянки, підвищується тургор тканини, посилюються обмін речовин і функція органа.
73.4. Які фактори можуть бути причиною артеріально)' гіперемії? Що мають на увазі, коли кажуть про фізіологічну й патологічну артеріальну гіперемію?
Причиною артеріальної гіперемії може бути вплив фізичних, хімічних і біологічних факторів зовнішнього середовища; збільшення навантаження на орган або ділянку тканини; психогенні впливи.
ФЬіологічною називають артеріальну гіперемію, що виникає під дією звичайних фізіологічних подразників (збільшення навантаження на орган, психогенні впливи). Основними її різновидами є робоча й реактивна гіперемія.
Робоча гіперемія - це збільшення течії крові в органі під час посилення його функції (збільшення вінцевого кровообігу при посиленні роботи серця, гіперемія слинних залоз під час приймання їжі та ін.).
Реактивна гіперемія являє собою збільшення течії крові після його короткочасного обмеження. Розвивається зазвичай у нирках, головному мозку, шкірі, кишках, м'язах.
Патологічна артеріальна гіперемія виникає під дією незвичайних (патологічних) подразників або в результаті підвищення чутливості судин до звичайних впливів. Вона супроводжує розвиток таких патологічних процесів, як запалення, алергія, опіки, гарячка, її клінічними прикладами можуть бути інфекційний або алергічний висип, почервоніння обличчя при багатьох інфекційних хворобах (кір, скарлатина, висипний тиф), почервоніння половини обличчя при невралгії трійчастого нерва і т. д.
13.5. Назвіть основні механізми розвитку патологічної артеріальної гіперемії.
Розрізняють два механізми: нейрогенний і пов'язаний з дією місцевих хімічних (метаболічних) факторів.
Нейрогенна артеріальна гіперемія залежно від конкретних механізмів її розвитку може бути нейротонічного і нейропаралітичного типів.
Гіперемію, пов'язану з дією місцевих гуморальних факторів, іноді називаютьмі-опаралітичною, підкреслюючи тим самим первинність порушень скоротливих властивостей гладких м'язів судин під впливом хімічних агентів.
13.6. У чому сутність нейротонічного механізму розвитку артеріальної гіперемії?
Нейротонічний тип артеріальної гіперемії розвивається при збільшенні імпуль-сації по судинорозширювальних нервах (вазодилататорах). До останніх належать парасимпатичні нерви і симпатичні холінергічні нерви, медіатором яких є ацетилхолін.
В експерименті на тваринах цей тип артеріальної гіперемії відтворюють шляхом подразнення судинорозширювальних нервів. Так, подразнення chorda tympani (гілка n. facialis) викликає артеріальну гіперемію і посилення секреції піднижньощелепної слинної залози (дослід К. Бернара).
У клініці нейротонічна гіперемія виникає найчастіше рефлекторно у зв'язку з подразненням екстеро- та інтерорецепторів, а також при подразненні судинорозширювальних нервів та їх центрів. Цим, зокрема, пояснюється почервоніння обличчя і шиї при патологічних процесах у внутрішніх органах (яєчниках, серці, печінці).
13.7. Поясніть нейропаралітичний механізм розвитку артеріальної гіперемії.
Нейропаролітична артеріальна гіперемія розвивається при припиненні імпуль-сації по симпатичних адренергічних нервах, що мають судинозвужувальну дію. В експерименті на тваринах її моделюють за допомогою хірургічних втручань і фармакологічних способів. Часто застосовують перетинання симпатичних адренергічних волокон і нервів. Так, при перетинанні симпатичних волокон сідничного нерва спостерігають розширення судин лапки жаби (дослід А. Вальтера), а при видаленні шийного вузла симпатичного стовбура- почервоніння й підвищення температури вуха кроля збоку операційного втручання (дослід К. Бернара).
Серед фармакологічних способів відтворення артеріальної гіперемії нейропаралітичного типу — блокада передачі нервових імпульсів у симпатичних вузлах за допомогою гангліоблокаторів, порушення утворення, депонування й виділення катехоламінів закінченнями симпатичних нервів (застосування симпатолітиків); блокада а-адрено-рецепторів судинних гладких м'язів за допомогою відповідних адреноблокаторів.
13.8. Які гуморальні фактори можуть викликати розвиток артеріальної гіперемії?
Артеріальна гіперемія міопаралітичного типу може розвиватися за умов дії трьох груп гуморальних факторів:
1) неорганічних іонів (калію, водню) і дефіциту кисню;
2) метаболітів (молочної кислоти, органічних кислот циклу Кребса, АДФ, АМФ, аденозину);
3) біологічно активних речовин (гістаміну, серотоніну, кінінів, простагландинів).
Зазначені фактори спричинюють розширення судин, діючи або безпосередньо на гладкі м'язи судинної стінки, або опосередковано, через вплив на ендотелій судин.
13.9. Яка роль ендотелію кровоносних судин у розвитку артеріальної гіперемії?
Під впливом цілого ряду місцевих гуморальних факторів, зокрема, біологічно активних речовин, ендотеліальні клітини судин виділяють речовину, що отримала була назву фактора релаксації ендотеліального походження. Нині відомо, що цією речовиною є оксид азоту (II), який утворюється з амінокислоти аргініну під впливом ферменту NO-синтази. Оксид азоту діє на гладком'язові клітини судинної стінки й викликає їхню гіперполяризацію. Результатом цього є зменшення базального тонусу кровоносних судин та їх розширення під дією тиску крові.
13.10. Назвіть можливі наслідки артеріальної гіперемії.
У більшості випадків артеріальна гіперемія супроводжується збільшенням інтенсивності обміну речовин і посиленням діяльності органа, що є пристосуванням до дії підвищеного функціонального навантаження.
Однак можливі й несприятливі наслідки. При артеріосклерозі, наприклад, різке розширення судини може супроводжуватися розривом її стінки і крововиливом у тканину. Особливо часто подібне явище спостерігається в головному мозку.
13.11. Що таке венозна гіперемія?
Венозна гіперемія - це збільшення кровонаповнення органа або ділянки тканини в результаті утрудненого відтоку крові по венах.
13.12. Які фактори можуть бути причиною венозної гіперемії?
Порушення відтоку крові по венах може бути пов'язане з такими чинниками:
1) внутрішньосудинними (закупорка вен тромбом або емболом);
2) позасудинними (здавлювання вен пухлиною, рубцем, збільшеною маткою, набряковою рідиною);
3) факторами самої судинної стінки (конституціональна слабкість еластичного апарату вен, недостатній розвиток і знижений тонус гладком'язових елементів їхніх стінок);
4) порушеннями загальної гемодинаміки (ослаблення функції правого шлуночка серця, зменшення присмоктувальної дії грудної клітки, утруднення течії крові в малому колі кровообігу).
13.13. Якими ознаками виявляє себе венозна гіперемія?
Для венозної гіперемії характерне збільшення об'єму органа або ділянки тканини, ціаноз, місцеве зниження температури, набряк, підвищення тиску у венах і капіля-
pax застійної ділянки, уповільнення течії крові, вихід еритроцитів за межі судинного русла (діапедез). На завершальному етапі гіперемії можливий маятникоподібний рух крові і стаз. Тривале розширення вен призводить до розтягнення їхньої стінки, що може супроводжуватися гіпертрофією м'язової оболонки, явищами флебосклерозу і варикозного розширення вен.
13.14. Які місцеві й загальні порушення можуть бути наслідком венозної гіперемії?
Місцеві зміни при венозній гіперемії пов'язані в основному з кисневим голодуванням (гіпоксією) тканини. Гіпоксія при цьому спочатку обумовлена обмеженням припливу артеріальної крові, а потім дією на тканинні ферментні системи продуктів порушеного обміну, наслідком чого є порушення утилізації кисню.
Кисневе голодування при венозній гіперемії обумовлює розлади тканинного метаболізму, викликає атрофічні і дистрофічні зміни, надмірне розростання сполучної тканини (наприклад, цироз печінки при венозному застої, викликаному недостатністю функції серця).
Якщо венозна гіперемія має генералізований характер, то можливим є ряд загальних гемодинамічних порушень з важкими наслідками. Найчастіше вони виникають при закупорці великих венозних судин - ворітної, нижньої порожнистої вен. Скупчення крові в зазначених судинних резервуарах (до 90 % всієї крові) супроводжується різким зниженням артеріального тиску, порушенням живлення життєво важливих органів (серця, мозку), що може призвести до смерті.
13.15. Що таке ішемія?
Ішемія - це зменшення кровонаповнення органа або ділянки тканини в результаті обмеження або повного припинення припливу артеріальної крові. Ішемію називають ще місцевим недокрів'ям.
13.16. Які ознаки характерні для ішемії?
Ішемія характеризується зблідненням ділянки органа, зниженням його температури, порушенням чутливості (відчуття оніміння, поколювання, "повзання мурашок"), больовим синдромом, зменшенням швидкості течії крові і об'єму органа, зниженням артеріального тиску на ділянці артерії, розташованій нижче перешкоди; зниженням напруги кисню в ішемізованій ділянці органа або тканини, зменшенням утворення тканинної рідини і зниженням тургору тканини, порушенням функції органа або тканини, дистрофічними змінами.
13.17. Назвіть основні типи ішемії залежно від причини й механізмів її виникнення.
Основними типами ішемії є компресійна, обтураційна і ангіоспастична.
Компресійна ішемія виникає в результаті здавлювання артерій ззовні лігатурою, рубцем, пухлиною, стороннім предметом та ін.
Обтураційна ішемія є наслідком часткового звуження або повного закриття просвіту артерій атеросклеротичною бляшкою, тромбом або емболом.
Ангіоспастична ішемія виникає внаслідок спазму артерій, викликаного емоційним впливом (страх, хвилювання, гнів), фізичними факторами (холод, травма, механічне подразнення), хімічними агентами, біологічними подразниками (токсини бактерій) і т. д. В основі спазму можуть лежати нервові рефлекторні механізми або безпосередня дія подразників на гладкі м'язи судин (вплив вазопресину, ангіотензи-ну II, ендотеліну).
13.18. Чим визначається характер обмінних, функціональних і структурних порушень у тканині при її ішемії?
Характер таких порушень визначається ступенем кисневого голодування. Важкість гіпоксії, у свою чергу, залежить від швидкості розвитку й типу ішемії, її тривалості, локалізації, характеру колатерального кровообігу, функціонального стану органа або тканини.
Ішемія, що виникає на ділянці повної обтурації або компресії артерій, за інших рівних умов викликає важчі зміни, ніж при спазмі. Ішемія, що швидко розвивається, як і тривала, протікає важче порівняно з ішемією, що розвивається повільно, або нетривалою.
Ішемія життєво важливих органів (мозок, серце) має важчі наслідки, ніж ішемія нирок, легень, селезінки, а ішемія останніх - важчі, якщо порівнювати з ішемією скелетної, м'язової, кісткової або хрящової тканини. Мозок і серце характеризуються високим рівнем енергетичного обміну, але, незважаючи на це, їх колатеральні судини функціонально не здатні компенсувати порушення кровообігу. Навпаки, скелетні м'язи й особливо сполучна тканина, завдяки низькому рівню енергетичного обміну в них, більш стійкі в умовах ішемії.
Утруднення припливу артеріальної крові при підвищеній функціональній активності органа або тканини небезпечніше, ніж у стані спокою.
13.19. Якими послідовними стадіями характеризується патогенез порушень в ішемізованій тканині?
Виділяють такі стадії патогенезу
I. Порушення енергетичного обміну. Вони виявляють себе зниженням ефективності циклу Кребса і тканинного дихання, активацією гліколізу, а в кінцевому підсумку - зменшенням вмісту в клітинах макроергічних сполук — креатинфосфату і АТФ. Порушення утворення енергії на ділянці ішемії патогенетично пов'язане з недостатньою доставкою кисню й необхідних для окиснення субстратів, зниженням активності й синтезу ферментів, виходом ферментів з ушкоджених клітин, роз'єднанням окиснення й фосфорування.
II. Порушення енергозалежних процесів у клітинах, викликане зменшенням утворення енергії. При цьому порушуються специфічні функції клітин (скоротлива, секреторна та ін.), механізми активного транспорту речовин, зокрема, робота іонних насосів; знижується біосинтез білків неколагенового типу, що беруть участь у структурній організації клітин і тканин. В остаточному підсумку розвиваються ушкодження клітин і некробіотичні зміни, які в найважчих випадках закінчуються утворенням осередку некрозу - інфаркту.
III. Посилення біосинтезу компонентів сполучної тканини - колагену, глікозамі-ногліканів, глікопротеїнів, що є основою для наступного склерозування ішемізо-ваної ділянки тканини або органа.
13.20. Що таке стаз?
Стаз - це уповільнення й зупинка течії крові в капілярах, дрібних артеріях і венах.
13.21. Назвіть основні варіанти стазу та їхні причини.
Розрізняють ішемічний, венозний та істинний (капілярний) стаз.
Ішемічний і венозний стаз розвивається як наслідок ішемії та венозної гіперемії, а тому має ті ж причини, що й зазначені місцеві розлади кровообігу.
Причиною істинного стазу можуть бути фізичні (холод, тепло), хімічні (отрути, концентрований розчин натрію хлориду й інших солей, скипидар) і біологічні фактори (токсини мікроорганізмів).
У патогенезі істинного стазу велике значення надають двом факторам:
1) внутрішньокапілярній агрегації еритроцитів, тобто їх склеюванню й утворенню конгломератів, що утрудняють течію крові;
2) уповільненню течії крові в капілярах унаслідок згущення крові. В останньому випадку провідна роль належить підвищенню проникності стінок судин, розташованих у зоні стазу.
13.22. Що таке тромбоз?
Тромбоз -це процес прижиттєвого утворення на внутрішній поверхні стінки судин згустків крові, що складаються з її елементів. Ці згустки отримали назву тромбів.
Тромби бувають пристінковими (частково зменшують просвіт судини) і закупорювальними.
Залежно від будови розрізняють білі, червоні й змішані тромби. У першому випадку тромб утворюють тромбоцити, лейкоцити, а також невелика кількість білків плазми; у другому - еритроцити, скріплені нитками фібрину; змішані тромби складаються з білих та червоних шарів, що чергуються між собою.
13.23. Назвіть три основні фактори, що сприяють тромбоутворенню (тріада Вірхова).
1. Ушкодження судинної стінки. Воно може виникати під дією фізичних факторів (механічна травма, електричний струм), хімічних, біологічних (ендотоксини мікроорганізмів), а також у результаті порушення живлення й метаболізму судинної стінки.
2. Порушення активності систем зсідання і протизсідання у крові та судинній стінці. Для утворення тромбів велике значення має як підвищення активності системи зсідання крові за рахунок збільшення в ній концентрації прокоагулянтів, так і зниження активності антикоагулянтної і фібринолітичної систем.
3. Уповільнення течії крові. Цей чинник дає можливість пояснити, чому у венах тромби утворюються частіше, ніж в артеріях, у венах нижніх кінцівок - частіше, ніж у венах верхніх кінцівок; а також високу частоту тромбоутворення при декомпенсації кровообігу, тривалому перебуванні хворої людини в ліжку.
13.24. З яких фаз складається процес утворення тромбу? У чому їх сутність?
Процес тромбоутворення має дві фази: клітинну і плазматичну.
Сутність клітинної фази полягає в адгезії, агрегації й аглютинації тромбоцитів (докладно див. розд. 26).
Плазматична фаза (фаза коагуляції крові) являє собою ланцюг послідовних біохімічних реакцій зсідання крові, кінцевим результатом яких є утворення фібрину -важливого компонента тромбу.
13.25. Які негативні наслідки може мати тромбоутворення в умовах патології?
"При різних захворюваннях утворення тромбів може супроводжуватися важкими наслідками, зумовленими гострим порушенням кровообігу в зоні судини, в якій виник тромб (ішемія при тромбозі артерій і застій крові при тромбозі вен). Кінцевим етапом може бути розвиток некрозу (інфаркту) у басейні тромбованої, позбавленої колатералей судини. Особливо велика роль тромбозу вінцевих артерій у розвитку інфаркту міокарда. Тромбоз артерій може призводити до трофічних порушень із наступним розвитком гангрени кінцівок при атеросклерозі, облітеративному ендартеріїті, цукровому діабеті.
13.26. Що таке емболія?
Емболія — це закупорка судин тілами, принесеними течією крові або лімфи. Ці тіла називаються емболами.
13.27. Які виділяють види емболії?
Залежно від характеру емболів та їхнього походження розрізняють емболію екзогенну й ендогенну.
За локалізацією виділяють емболію великого і малого кола кровообігу, а також системи ворітної вени.
Дуже рідко буває так звана ретроградна емболія, коли рух ембола відбувається не за гемодинамічними законами, а відповідно до сили тяжіння самого ембола, і парадоксальна емболія, що спостерігається при незарощенні міжпередсердної або між-шлуночкової перегородки, у результаті чого емболи з вен великого кола кровообігу й правої половини серця переходять у ліву, обминаючи мале коло.
13.28. Назвіть основні причини емболії екзогенного походження.
Залежно від природи й характеру емболів, що надходять ззовні, розрізняють такі види екзогенної емболії: повітряну, газову, бактеріальну, паразитарну, емболію твердими сторонніми тілами.
Повітряна емболія виникає при пораненні великих вен голови й шиї, які слабко спадаються й тиск у яких близький до нуля або негативний. У результаті в ушкоджені вени засмоктується повітря, особливо на висоті вдиху, з наступною емболією судин малого кола кровообігу.
Газова емболія розвивається при різкому перепаді атмосферного тиску від підвищеного до нормального (у робочих кесонів і водолазів) або від нормального до зниженого (при швидкому піднятті на висоту або під час розгерметизації кабіни висотного літального апарата). При цьому зменшується розчинність газів у тканинах і крові, відбувається десатурація, тобто перехід газів з розчиненого стану в газоподібний, і закупорка бульбашками цих газів (у першу чергу азоту) капілярів, розташованих головним чином у системі великого кола кровообігу.
13.29. Назвіть основні причини емболії ендогенного походження.
До ендогенної емболії відносять емболію тромбом (тромбоемболію), жирову емболію, тканинну емболію, емболію навколоплідними водами.
Джерелом тромбоемболії є тромб, що відірвався, найчастіше при асептичному або гнійному його розплавленні.
Жирова емболія виникає при потраплянні в кровоносні судини крапель жиру. Причиною цього найчастіше є ушкодження (роздроблення, сильний струс) кісткового мозку, підшкірної або тазової клітковини.
Тканинна емболія може бути обумовлена занесенням у кровоносне русло частинок різних тканин організму при їх ушкодженні. Особливе значення має емболія судин клітинами злоякісних пухлин, оскільки вона є основним механізмом утворення метастазів.
Емболія навколоплідними водами виникає в результаті потрапляння навколоплідних вод під час пологів в ушкоджені судини матки на ділянці плаценти, що відокремилася.
13.30. Що розуміють під мікроциркуляцією? Назвіть основні типи порушень мікроциркуляції.
Мікроциркуляція — це рух крові й лімфи по мікроциркуляторних кровоносному і лімфоносному руслах.
Мікроциркуляторне кровоносне русло складається з судин, діаметр яких не перевищує 100 мкм, тобто артеріол, метартеріол, капілярних судин, венул і артеріоло-ве-нулярних анастомозів (рис. 38).
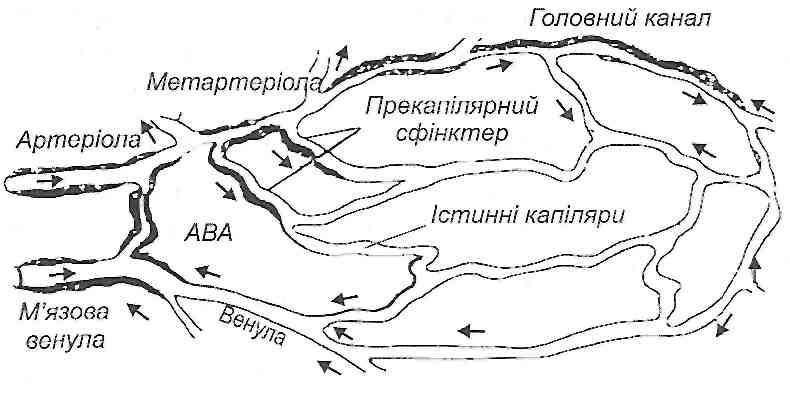
Рис. 38. Схема будови мікроциркупяторного русла: ABA - артеріовенозний анастомоз
Мікроциркуляторне лімфоносне русло представлене початковим відділом лімфатичної системи, у якому відбувається утворення лімфи і надходження її в лімфатичні капіляри.
Порушення мікроциркуляції поділяють на три типи: внутрішньосудиннї, порушення, пов 'язані зі змінами самих судин; позасудинні.
- Великі успіхи у вивченні закономірностей мікроциркуляції в нормі і при патології пов'язані з іменем О. М. Чернуха.
13.31. У чому сутність феномена під назвою "сладж"?
Сладж є внутрішньо судинним порушенням мікроциркуляції, пов'язаним зі зміною реологічних властивостей крові. Основні фактори таких змін — це порушення суспензійної стабільності крові, а також підвищення її в'язкості.
Головними особливостями крові при сладжі є прилипання один до одного еритроцитів, лейкоцитів і тромбоцитів, збільшення в'язкості крові, що утруднює її рух по мі-кросуцинах. При цьому течія крові різко уповільнюється й нагадує переміщення мулу по дну ріки (назва "сладж" походить від англ. sludge - густа грязь, баговиння, мул).
Залежно від розмірів агрегатів клітин крові, характеру їхніх контурів і щільності впакування еритроцитів розрізняють такі типи сладжу: класичний (великі розміри агрегатів, нерівні обриси контурів і щільне впакування еритроцитів), декстриновий (різна величина агрегатів, округлі обриси, щільне впакування еритроцитів) і аморфний гранулоподібний (величезна кількість дрібних агрегатів у вигляді гранул, що складаються всього з декількох еритроцитів).
13.32. Як здійснюється обмін води між плазмою крові й інтерстиціальною рідиною?
В основі обміну води між плазмою крові й інтерстиціальною рідиною лежать три механізми (рис. 39).

Рис. 39. Обмін рідини між кровоносними капілярами і міоісклітинним простором
1. Двостороння дифузія. Має найбільше значення. її швидкість настільки велика, що при проходженні крові через капіляри рідина плазми встигає 40 разів повністю обмінятися з рідиною міжклітинного простору.
Швидкість дифузії води через загальну обмінну поверхню капілярів становить 60 л за 1 хв, або 85 000 л за добу.
2. Фільтрація-реабсорбція. Це механізм перерозподілу води, що визначається двома факторами: а) гідростатичним тиском крові і міжклітинної рідини; б) онкотичним тиском плазми крові і рідини інтерстиціального простору. Співвідношення між цими факторами таке, що в артеріальній частині капіляра відбувається фільтрація води, а у венозній частині ~Ji реабсорбція.
Швидкість фільтрації через загальну обмінну поверхню капілярів організму становить 14 мл/хв., або 20 л за добу, а швидкість реабсорбції- 12,5 мл/хв., або 18 л за добу.
3. Мікр о везикулярний транспорт. Це механізм активного транспорту через ендотелій капілярів. Його основу становить явище ендоцитозу (піноцитоз, мікропіноцитоз).
13.33. Як впливають зміни гідростатичного і онкотичного тиску крові та міжклітинної рідини на інтенсивність процесів фільтрації-реабсорбції води в капілярах?
Напрямок руху води й інтенсивність процесів фільтрації-реабсорбції визначаються величиною ефективного фільтраційного тиску (Реф).
![]()
де Рг й Рок - гідростатичний і онкотичний тиск крові; Р^ і Рот - гідростатичний і онкотичний тиск тканинної рідини.
За умов норми в артеріальному кінці капілярів Р = 9 мм рт. ст. і рідина переходить із просвіту судин у тканину (фільтрація), а на венозній ділянці Р = -6 мм рт. ст, тому рідина переходить у зворотному напрямку — з тканин у капіляри (реабсорбція).
Фільтрація води збільшується, а реабсорбція зменшується при збільшенні гідростатичного тиску крові й онкотичного тиску інтерстиціальної рідини, а також при зменшенні онкотичного тиску плазми крові й тканинного гідростатичного тиску.
Фільтрація води зменшується, а реабсорбція зростає при зменшенні гідростатичного тиску крові й онкотичного тиску міжклітинної рідини, а також при збільшенні онкотичного тиску плазми крові й гідростатичного тиску рідини інтерстиціального простору.
13.34. Що таке недостатність лімфообігу? Назвіть основні її форми.
Недостатність лімфообігу - це стан, при якому лімфатичні судини не виконують свою основну функцію - здійснення постійного й ефективного дренажу інтерстиціального простору.
Розрізняють такі форми недостатності лімфообігу. 1. Механічна недостатність. Виявляє себе утрудненням відтоку лімфи у зв'язку з наявністю органічних (здавлювання пухлиною, рубцем, облітерація лімфатичних
судин при їх запаленні, тромбозі та ін.) або функціональних причин (підвищення тиску в магістральних венозних судинах, спазм лімфатичних судин, припинення м'язових скорочень та ін.).
2. Динамічна недостатність. Виникає тоді, коли об'єм транссудації міжклітинної рідини перевищує можливості лімфатичної системи забезпечувати ефективний дренаж інтерстиціальної тканини,
3. Резорбційна недостатність. Обумовлена структурними змінами інтерстиціальної тканини, накопиченням білків і осадженням їхніх патологічних видів в інтерстиції.
Основними проявами недостатності лімфообігу в гострій стадії є набряк, накопичення білків і продуктів їхнього розпаду в інтерстиціальній тканині, а в хронічній стадії - розвиток фіброзу й склерозу.
14. Запалення
74.7. Дайте визначення поняття "запалення".
Запалення - це типовий патологічний процес, що виникає в результаті ушкодження тканини й виявляє себе комплексом структурних, функціональних і метаболічних порушень, а також розладами мікроциркуляції.
74.2. Чому запалення називають типовим патологічним процесом?
Загальні закономірності розвитку запалення виявляють себе завжди, незалежно від його причини, локалізації, виду організму та його індивідуальних особливостей.
Запалення може виникати в різних органах і тканинах (ангіна, пневмонія, апендицит), його причиною можуть бути механічна травма, вплив температури, віруси, бактерії та ін.; воно може розвиватися у тварин і в людини. У кожному конкретному випадку запалення має свої особливості. Однак є щось загальне, яке виявляє себе завжди. Це загальне й становить сутність запалення як типового патологічного процесу.
14.3. Назвіть зовнішні ознаки запалення.
Припухлість (tumor), почервоніння (rubor), жар (color), біль (dolor) і порушення функції (functio laesd). Ці ознаки відомі як пеншада Цельса—Голена.
14.4. Що може бути причиною запалення?
Фактори, здатні викликати розвиток запалення, називають флогогенними. Та-кими є:
1) фактори фізичного походження (механічні, термічні, іонізуюча радіація, ультрафі- \ олетове випромінювання та ін.);
2) хімічні фактори (кислоти, луги, солі важких металів, феноли, альдегіди та ін.);
3) біологічні агенти (віруси, бактерії, найпростіші).
Стосовно організму флогогенні агенти можуть бути екзогенними й ендогенними. Екзогенні надходять в організм або діють із зовнішнього середовища. Ендогенні утворюються в самому організмі (токсичні продукти обміну, жовчні кислоти та ін.).
74.5. Які методи використовують при вивченні запалення?
Конгейм уперше запропонував вивчати зміни місцевого кровообігу при запаленні на брижі жаби (дослід Конгейма).
Подружжя Кларків розробило таку методику. На двох протилежних ділянках шкіри вуха кроля видаляли епідерміс і на його місце вставляли диски зі слюди. У такому прозорому віконці можна було безперервно спостерігати кровообіг при запаленні в тонкому шарі тканини між дисками.
Пізніше Сельє запропонував вивчати кровообіг при запаленні в судинах защічних мішків хом'яка, роздутих повітрям.
Широко використовують також біохімічні методи дослідження (Менкін), що дозволяють вивчати біологічно активні речовини і порушення метаболізму у вогнищі запалення.
Порівняльно-еволюційний підхід до вивчення запалення був запропонований /. /. Мечтіковим.
14.6. З яких компонентів складається патогенез запалення?
У патогенезі запалення розрізняють:
1) альтерацію;
2) порушення мікроциркуляції'з явищами ексудації і еміграції;
3) проліферацію.
Ці компоненти іноді називають стадіями запалення (рис. 40). Однак варто пам'ятати, що зазначені процеси не є строго послідовними, оскільки вони перекриваються в часі.

Рис. 40. Стадії патогенезу запалення
14.7. У чому сутність стадії альтерації?
В основі альтерації лежать дві групи явищ:
1) ушкодження клітин і позаклітинних структур;
2) утворення медіаторів запалення.
14.8. Що таке первинна і вторинна альтерація?
Первинна альтерація — це ушкодження тканини, яке виникає внаслідок безпосередньої дії флогогенних агентів.
Вторинна альтерація — це ушкодження тканини, що виникає в результаті дії факторів, які утворилися внаслідок первинної альтерації.
14.9. Які фактори викликають розвиток вторинної альтерації у вогнищі запалення?
1. Медіатори запалення (лізосомні фактори, активований комплемент, лімфокіни-лімфотоксини).
2. Вільні радикали й пероксиди.
3. Гіпоксія, що виникає в результаті місцевих розладів кровообігу.
4. Місцевий ацидоз.
5. Підвищення осмотичного і онкотичного тиску у вогнищі запалення.
14.10. Назвіть причини розвитку місцевого ацидозу у вогнищі запалення.
Розрізняють первинний і вторинний ацидоз. Первинний ацидоз виникає в перші ЗО хв. унаслідок деполімеризації основної інтерстиціальної речовини і вивільнення карбоксильних і сульфатних груп.
Вторинний ацидоз розвивається пізніше й обумовлений порушеннями обміну речовин у вогнищі запалення. До його виникнення причетні накопичення молочної кислоти (активація гліколізу), вихід з ушкоджених клітин недоокиснених продуктів циклу Кребса (три- і дикарбонових кислот), вивільнення вільних жирових кислот, амінокислот і фосфорної кислоти в результаті гідролітичного розщеплення тригліце-ридів, фосфоліпідів, білків, АТФ.
14.11. Чому в осередку запалення розвиваються гіперосмія й гіперон кія?
Збільшення осмотичного тиску у вогнищі запалення (гіперосмія) зумовлене насамперед виходом іонів калію з ушкоджених клітин, а також вивільненням калію зі зв'язаного з внутрішньоклітинними білками стану. Останнє є результатом протеолізу, що відбувається в клітинах за умов їхнього ушкодження.
Збільшення онкотичного тиску (гіперонкія) обумовлене:
1) надходженням білків у тканину із крові в процесі ексудації (плазмове джерело);
2) розщепленням великих білкових молекул на дрібніші під дією лізосомних ферментів (тканинне джерело).
14.12. Які порушення обміну речовин закономірно виникають у вогнищі запалення?
Запалення завжди починається з посилення обміну речовин. У гострому періоді запалення переважають процеси розпаду, катаболізму. Відбувається збільшення
інтенсивності споживання кисню й активація процесів гліколізу. Під дією лізосомних гідролаз великі молекули розщеплюються на дрібні. Це все характеризують терміном "пожежа обміну". Аналогія полягає не тільки в тому, що обмін речовин у вогнищі запалення різко підвищений, але й у тому, що "горіння" іде не до кінця, а з утворенням недоокиснених продуктів.
Пізніше відбувається активація анаболічних процесів, що забезпечують явища відновлення (репарації). Збільшується синтез нуклеїнових кислот, різко зростає утворення глікозаміногліканів, глікопротеїнів, колагену й інших компонентів сполучної тканини.
Велике значення у вивченні біохімічних змін у вогнищі запалення мали роботи Менкіна і Альперна.
14.13. Що таке медіатори запалення? Назвіть основні їх класи.
Медіатори запалення — це біологічно активні сполуки, які утворюються у вогнищі запалення і визначають його патогенез.
Розрізняють медіатори клітинного (утворюються в клітинах) і плазмового (утворюються й надходять із плазми крові) походження.
До медіаторів клітинного походження відносять лізосомні фактори, продукти вільнорадикального окиснення, продукти тканинних базофілів, похідні арахідонової кислоти, цитокіни, фактори росту.
Медіаторами плазмового походження є кініни, продукти активації комплементу, продукти активації системи зсідання крові і фібринолітичної системи.
14.14. Яку роль відіграють лізосомні фактори в патогенезі запалення?
До лізосомних факторів відносять: лізосомні ферменти (кислі й нейтральні гід-ролази) і неферментні катіонні білки.
Роль лізосомних ферментів, основним джерелом яких є лейкоцити, полягає в ініціюванні таких змін.
1. Вони викликають вторинну альтерацію.
2. Беруть участь в утворенні і активації інших медіаторів запалення: стимулюють дегрануляцію тканинних базофілів, активують калікреїн-кінінову систему, систему комплементу; вивільнюють арахідонову кислоту з фосфоліпідів клітинних мембран.
3. Безпосередньо підвищують проникність капілярів завдяки дії еластази, колагена-зи і гіалуронідази на компоненти базальної мембрани судинної стінки.
4. Викликають розвиток фізико-хімічних і метаболічних змін у вогнищі запалення: активують гідролітичне розщеплення речовин, чим сприяють розвитку місцевого ацидозу й гіперонкії.
Неферментні катіонні білки лізосом викликають вторинну альтерацію, підвищують проникність судин, активують хемотаксис лейкоцитів.
14.15. Які фактори можуть викликати дегрануляцію тканинних базофілів у вогнищі запалення?
1. Безпосередня дія флогогенного агента на тканинні базофіли (механічне ушкодження, температура, продукти бактерій, хімічні речовини - лібератори гістаміну).
2. Комплекси антиген-антитіло.
3. Активні протеази, зокрема, лізосомні.
4. Побічні продукти активації комплементу - СЗа, С5а.
14.16. Які медіатори запалення вивільняються при дегрануляції тканинних базофілів ? Яку вони мають дію у вогнищі запалення?
1. Біогенні аміни — гістамін і в деяких видів тварин (зокрема щурів) - серотонін. Основні ефекти гістаміну, що мають важливе значення в патогенезі запалення: а) розширення артеріол, що веде до розвитку артеріальної гіперемії в осередку запалення;
б) підвищення проникності мікросуцин (венул) - одна з причин запального набряку;
в) подразнення нервових закінчень, що зумовлює розвиток болю;
г) спазм гладких м'язів бронхів, матки, кишок. Цим, зокрема, пояснюють порушення функції зазначених органів при їхньому запаленні.
2. Гепарин. Другий основний компонент гранул тканинних базофілів є глікозаміно-гліканом. Його вважають протизапальним медіатором, оскільки він (1) має антикоагулянту дію, (2) гальмує адгезію і агрегацію тромбоцитів, (3) зв'язує біогенні аміни, (4) пригнічує активацію комплементу та калікреїн-кінінової системи.
3. Фактори, що впливають на клітини крові. До них можна віднести поліпептиди: (1) фактор еміграції еозинофілів, (2) фактор еміграції нейтрофілів, а також сполуку фосфоліпідного походження — (3) фактор*агрегації тромбоцитів (ФАТ).
Останній відіграє особливо важливу роль у патогенезі запалення. Утворюючись одразу після стимуляції тканинних базофілів, ФАТ зумовлює такі ефекти у вогнищі запалення:
а) активує процеси агрегації тромбоцитів та вивільнення їхніх гранул. Як наслідок, з тромбоцитів в осередок запалення виходять серотонін адреналін, аденінові нуклеотиди (АТФ, АДФ, АМФ), арахідонова кислота та тромбок-сани, тромбоцитарний фактор росту та інші;
б) навіть у дуже низьких концентраціях зумовлює розширення артеріол (артеріальну гіперемію) і збільшення проникності венул. Кількісно ці ефекти ФАТ відповідно в 100 і 10000 разів сильніші за дію гістаміну;
в) значно посилює адгезію лейкоцитів до ендотелію судин (крайове стояння) і стимулює хемотаксис нейтрофілів та макрофагів у вогнищі запалення.
Крім наведених вище медіаторів запалення під час дегрануляції тканинних базофілів вивільнюються лейкотрієни (повільно реагуюча субстанція анафілаксії), гідролітичні ферменти, катіонні білки.
14.17. Як відбувається активація калікреїн-кінінової системи? Назвіть основні функціональні ефекти кінінів.
У плазмі крові є неактивний протеолітичний фермент колікреїноген. З появою в крові активних протеаз (лізосомні ферменти, фактор Хагемана, трипсин, тромбін, плазмін та ін.) відбувається відщеплення ділянки молекули калікреїногену, в результаті чого він перетворюється на активний фермент — калікреїн.
. Під дією калікреїну відбувається відщеплення від а2-глобуліну плазми крові (кі-ніногену) пептидів, які отримали назву кініни. Найважливішими кінінами є калідин і брадикінін, що складаються відповідно з 9 і 10 амінокислотних залишків (рис. 41).
У вогнищі запалення кініни викликають: 1) розширення артеріол (артеріальну гіперемію); 2) підвищення проникності судинної стінки; 3) подразнення нервових закінчень (біль).
14.18. Які медіатори запалення є похідними арахідонової кислоти? Як вони утворюються і як діють ?
Похідними арахідонової кислоти є простагландини, тромбоксани, простациклі-ни, лейкотрієни (рис. 42).

Рис. 41. Механізми активації калікреїн-кінінової системи
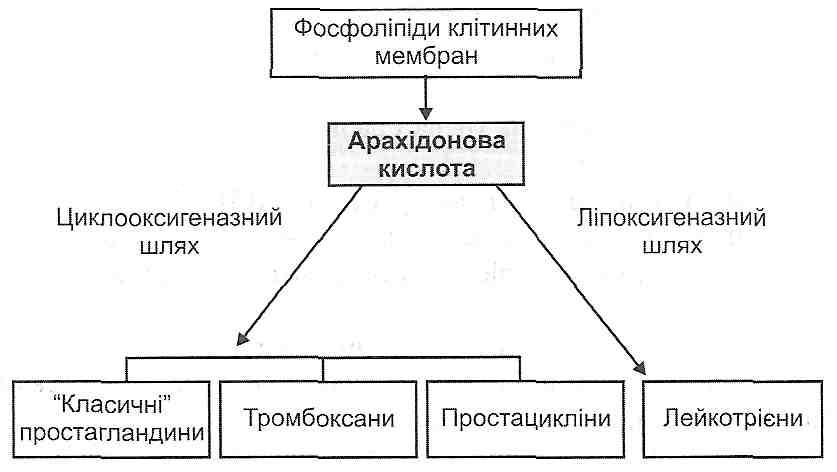
Рис. 42. Похідні арахідонової кислоти - медіатори запалення
Під дією ферменту фосфоліпази А2 (активується іонами кальцію) відбувається вивільнення арахідонової кислоти з фосфоліпідів клітинних мембран. Далі можливі два шляхи її перетворення: циклооксигеназний і ліпоксигеназний. У результаті активації першого утворюються "класичні" простагландини Е2, D2, F2 , тромбоксани й простацикліни, при активації другого - лейкотрієни С4, D4, E4.
Простагландини утворюються практично у всіх клітинах. Вони мають властивість розширювати артеріоли, звужувати венули, підвищувати проникність судинної стінки, зменшувати поріг больової чутливості нервових закінчень.
Тромбоксани утворюються в тромбоцитах. Вони викликають звуження артеріол і агрегацію тромбоцитів.
Простацикліни переважно вивільняються ендотеліальними клітинами судин і є антагоністами тромбоксанів. З їх дією пов'язано розширення артеріол і пригнічення агрегації тромбоцитів.
Місцем утворення лейкотрієнів є лейкоцити і тканинні базофіли. У вогнищі запалення вони стимулюють хемотаксис лейкоцитів і підвищують проникність кровоносних судин.
14.19. Що таке цитокіни? Яку роль вони відіграють у патогенезі запалення?
Цитокіни - це збірне поняття для позначення великої групи біологічно активних речовин білково-пептидної природи, що регулюють взаємодію між різними типами клітин.
Цитокіни синтезуються (1) активованими лімфоцитами (лшфокіни);2) моноцитами і макрофагами (монокіни), а також (3) багатьма іншими клітинами (нейтрофілами, фібробластами, ендотеліальними клітинами, тканинними базофілами, клітинами нейроглії та ін.).
На сьогодні описано понад 50 різних цитокінів. Залежно від функціональних ефектів їх поділяють на чотири групи.
I. Інтерлейкіни (ІЛ). Це сполуки, що регулюють взаємодію між різними видами лейкоцитів. Відомі нині 18 видів інтерлейкінів беруть участь у здійсненні імунних реакцій, у патогенезі алергії.
II. Інтерферони (ІНФ). Зазначена група білків здійснює природний неспецифічний противірусний захист.
III. Гемопоетичні колонієстимулятивні фактори (КСФ). Ці сполуки (гемопоети-ни) здійснюють регуляцію кровотворення в червоному кістковому мозку.
IV. Фактори, що пригнічують ріст пухлин, зокрема, фактор некрозу пухлин (ФНП)
За участю в патогенезі запалення цитокіни поділяють на (1) прозапсиїьні і (2) протизапальні. Спричинювані ними ефекти виявляють себе на місцевому рівні (в осередку запалення) і на рівні організму (системна дія).
Цитокіни є причетними до розвитку основних подій, що складають суть запального процесу, а саме:
а) вторинної альтерації. З-поміж інших цитокінів прямий стосунок до ушкодження клітин і позаклітинних компонентів має ФНП-р (лімфотоксин) — продукт активації макрофагів і Т-лімфоцитів. Високі його концентрації (1) спричинюють цитоліз (т.зв. кілінг-ефект), (2) посилюють генерацію вільних радикалів у вогнищі запалення; (3) індукують синтез колагеназ і, як наслідок, сприяють деградації колагену;
б) еміграції лейкоцитів. Ряд цитокінів (ІЛ-1, ФНП, ІНФ-у) індукують синтез адге-зивних білків в ендотеліальних клітинах, що сприяє розвиткові крайового стояння (прилипання до поверхні ендотелію) нейтрофілів, моноцитів і лімфоцитів. Крім того, деякі інтерлейкіни (ІЛ-6, ІЛ-8) значно посилюють хемотаксис лейкоцитів у вогнищі запалення;
в) проліферації. Однією з властивостей багатьох цитокінів є їхня мітогенна активність, що виявляє себе посиленням процесів проліферації в осередку запалення. Водночас, деякі цитокіни (ІЛ-1, ФНП) стимулюють синтез колагену і новоутворення кровоносних судин (ангіогенез);
г) загальних проявів запалення (див. запит. 14.37). У розвитку таких змін особливо велике значення має інтерлейкін-1 (ІЛ-1) (рис. 43).

Рис. 43. Деякі системні ефекти інтерлейкіну-1
Серед відомих сьогодні цитокінів є й протизапальні медіатори, зокрема ІЛ-10, який пригнічує синтез лейкоцитами багатьох біологічно активних сполук — активних учасників запального процесу.
14.20. Яке значення має комплемент і продукти його активації в патогенезі запалення?
Активований комплемент здатний викликати вторинну альтерацію у вогнищі імунного запалення.
Побічні продукти його активації- СЗа й С5а- викликають дегрануляцію тканинних базофілів і є сильними хемотаксинами для нейтрофілів.
Проміжні продукти, зокрема СЗЬ, мають властивості опсонінів, тобто полегшують фагоцитоз бактерій. Крім того, проміжні продукти, що виявляють протеазну активність, можуть активувати калікреїн-кінінову систему і систему зсідання крові.
14.21. Які продукти активації системи зсідання крові і фібринолітичної системи можуть впливати на патогенез запалення?
У розвитку запалення можуть мати значення:
1) фібршопептиди (відщеплюються від фібриногену при перетворенні його у фібрин) - збільшують проникність судин і активують хемотаксис лейкоцитів;
2) продукти деградації фібрину — збільшують проникність судин;
3) активні протеази (тромбін, плазмін) — активують калікреїн-кінінову систему й систему комплементу.
14.22. Назвіть стадії порушень місцевого кровообігу у вогнищі запалення. Хто їх уперше описав?
I. Короткочасна ішемія (тривалість від 10—20 с до кількох хвилин).
II. Артеріальна гіперемія (триває 20—30 хв, максимум до 1 год).
III. Венозна гіперемія.
IV. Стаз. Уперше зазначені зміни описав Ю. Конгейм (1867), вивчаючи кровообіг у брижі жаби під час запалення.
14.23. Який механізм лежить в основі короткочасної ішемії на початку запалення?
Короткочасну ішемію на початку запалення обумовлює рефлекторний спазм артеріол. Він пов'язаний зі збудженням судинозвужувальних адренергічних нервів і виділенням їхніми закінченнями катехоламінів. Останні, діючи на а-адренорецепто-ри, викликають скорочення гладких м'язів судинної стінки.
Ішемія, що виникає, є короткочасна, тому що швидко настає виснаження катехо-ламінових депо в нервових закінченнях і відбувається руйнування вивільнених медіаторів відповідними ферментами, зокрема, моноаміноксидазою. Крім того, вазокон-стрикція в деяких тканинах може перекриватися судинорозширювальним впливом холінергічних нервів, що реалізується за типом аксон-рефлексу.
14.24. Назвіть механізми розвитку артеріальної гіперемії у вогнищі запалення.
1. Нейрогенні механізми (нейротонічний і нейропаралітичний) (див. розд. 13). Вони мають значення в перші хвилини розвитку артеріальної гіперемії.
2. Вплив фізично-хімічних факторів: ацидозу, збільшення вмісту іонів калію в тканині, гіпоксії та ін.
3. Вплив продуктів метаболізму: молочної кислоти, АДФ, АМФ, аденозину.
4. Дія медіаторів запалення:
а) гістаміну і серотоніну;
б) кінінів (брадикініну і калідину);
в) простагландинів і простациклінів.
14.25. Які фактори викликають перехід артеріальної гіперемії у венозну в процесі розвитку запалення?
Можна виділити дві групи таких факторів.
І. Внутрішньосудинні фактори:
1) збільшення в'язкості крові;
2) мікротромбоутворення;
3) зсідання крові;
4) крайове стояння лейкоцитів;
5) агрегація еритроцитів;
6) набрякання ендотеліальних клітин. II. Позасудинні фактори:
1) здавлювання венозних судин набряковою рідиною;
2) втрата венулами еластичних властивостей внаслідок розщеплення колагену і еластину лізосомними ферментами (В. В. Воронін).
14.26. Що таке ексудація? Які механізми лежать в основі виходу рідкої частини крові з судин у запалену тканину?
Ексудація - це вихід рідини й розчинених у ній компонентів плазми крові із кровоносних судин у тканину. У широкому значенні слова це поняття включає й еміграцію лейкоцитів.
В основі ексудації лежать такі механізми:
1) підвищення проникності судинної стінки;
2) збільшення гідростатичного тиску в судинах;
3) збільшення осмотичного і онкотичного тиску в тканині.
14.27. Назвіть механізми підвищення проникності судинної стінки при запаленні.
1. Активація мікровезикулярного транспорту через ендотеліальні клітини.
2. Утворення наскрізних трансклітшних каналів в ендотеліоцитах (є наслідком значного посилення мікровезикулярного транспорту).
3. Збільшення просвіту міжендотеліальних щілин (відбувається в результаті скорочення й округлення ендотеліоцитів).
4. Десквамація (злущування) ендотелію. Є проявом первинної й вторинної альтерації.
5. Деполімеризація речовин, що з'єднують ендотеліальні клітини і є компонентами базальної мембрани судинної стінки.
14.28. Що є причиною підвищення проникності судинної стінки у вогнищі запалення?
До основних причин підвищення проникності судин відносять:
а) продукти дегрануляції тканинних базофілів (гістамін і серотонін);
б) кініни (брадикінін і калідин);
в) простагландини й деякі лейкотрієни;
г) лізосомні ферменти (еластаза, колагеназа, гіалуронідаза) і неферментні катіонні білки;
ґ) фібринопептиди й продукти деградації фібрину;
д) ацидоз.
14.29. Яка динаміка підвищення проникності судин при запаленні?
Виділяють дві фази підвищення проникності судин. Пік першої (ранньої) фази припадає на 10-15 хв від початку запалення. Основною причиною її розвитку є гістамін.
Друга (пізня) фаза починається через 1 год від початку запалення й триває кілька діб. До її розвитку причетні всі інші медіатори запалення, що підвищують проникність судин.
14.30. Що таке еміграція лейкоцитів? Які лейкоцити і в якій послідовності емігрують у вогнище запалення?
Еміграція — це перехід лейкоцитів крові із кровоносних судин у тканину.
Уперше послідовність еміграції лейкоцитів описав І. Мечніков. Спочатку в запалену тканину виходять полінуклеарні фагоцити, зокрема нейтрофіли. Вони знищують мікробів, що стали причиною ушкодження тканини. Потім у вогнище виходять мононуклеарні фагоцити - моноцити. Вони фагоцитують загиблі клітини, тканинний детрит, розчищаючи тим самим "поле бою". На кінцевих етапах, особливо при імунному запаленні, у тканину надходять лімфоцити.
14.31. Що таке крайове стояння лейкоцитів? Які його механізми?
Крайове стояння лейкоцитів (маргінація) — це перехід лейкоцитів із циркулюючого пулу в пристінковий (маргінальний). Воно триває від кількох хвилин до 1 години. В основі цього явища лежать такі механізми.
1. При уповільненні течії крові (венозна гіперемія) лейкоцити як найлегші формені елементи відкидаються за законами фізики на периферію.
2. Відбувається випадання ниток фібрину на поверхні ендотелію. Гладка в нормі поверхня ендотелію стає шорсткою. "Бахрома", що утворилася, затримує лейкоцити.
3. Має місце електростатична взаємодія лейкоцитів з ендотеліальними клітинами, її пояснюють втратою лейкоцитами поверхневого негативного заряду і утворенням "кальцієвих містків" між лейкоцитами й ендотеліоцитами.
4. На поверхні лейкоцитів і ендотеліальних клітин з'являються так звані "адгезивні білки ", які специфічно взаємодіють один з одним.
14.32. Що таке адгезивні білки лейкоцитів і ендотеліальних клітин? Що викликає їхню появу?
Адгезивні білки синтезуються в лейкоцитах та ендотеліальних клітинах і зберігаються у внутрішньоклітинних везикулах. При активації клітин відбувається злиття везикул з плазматичною мембраною, у результаті чого зазначені білки виявляються вмонтованими в цю мембрану. Специфічні ділянки молекул розташовуються зовні і можуть взаємодіяти з відповідними структурами адгезивних білків інших клітин.
Активаторами утворення і включення адгезивних білків у мембрану лейкоцитів є:
а) побічний продукт активації комплементу С5а;
б) лейкотрієни В4;
в) фактор активації тромбоцитів (ФАТ).
Аналогічні процеси в ендотеліальних клітинах викликають: а) ендотоксини бактерій;
б) інтерлейкін-1;
в) фактор некрозу пухлин.
14.33. Яким чином лейкоцити долають судинну стінку, емігруючи в запалену тканину?
Емігруючи в тканину, лейкоцити долають два бар'єри капілярної стінки: ендотелій і базальну мембрану. Нейтрофіли і макрофаги проходять крізь ендотелій через міжендотеліальні щілини. Вони випускають свої псевдоподії в простір між ендотелі-оцитами і "розсовують" клітини.
Подолання базальної мембрани може бути обумовлено двома механізмами. Перший з них полягає в явищі тиксотропії-при контакті нейтрофіла з базальною мембраною її колоїди переходять зі стану гелю в стан золю (відбувається розрідження мембрани). Нейтрофіл легко проходить через золь, після чого золь знову перетворюється на щільний гель. Другий механізм полягає у виділенні нейтрофілами нейтральних протеаз (еластази, колагенази), які розщеплюють волокнисті компоненти базальної мембрани.
14.34. У чому полягає сутність стадії проліферації в патогенезі запалення?
Стадія проліферації охоплює:
1) розмноження клітин, тобто власне проліферацію;
2) синтез позаклітинних компонентів сполучної тканини - колагену, еластину, про-теогліканів, глікопротеїнів. Ці події супроводжуються значним посиленням ана-болічних процесів.
14.35. Які фактори викликають активацію розмноження клітин у вогнищі запалення?
I. Зменшення концентрації в тканині кейлонів. Кейлоїш — це речовини білкової природи, які утворюються зрілими клітинами. Вони є інгібіторами клітинного поділу. При ушкодженні і загибелі клітин у вогнищі запалення концентрація кейлонів у тканині зменшується, а отже, знімається гальмівний вплив кейлонів на малодиференційовані (камбіальні) клітини. Вони починають ділитися. Поділ триває доти, доки концентрація кейлонів не збільшиться до рівня, що існував у неушкодженій тканині.
II. Збільшення концентрації в тканині стимуляторів проліферації— факторів росту. Фактори росту надходять у тканину з плазми крові або є продуктами клітин, що перебувають в осередку запалення. Прикладами можуть бути фактор росту епідермісу, фактор росту фібробластів, фактор росту тромбоцитарного походження, фактор росту нервів, фактор некрозу пухлин, інсуліноподібні фактори росту (соматомедини), лімфокіни (мітогенні фактори). Дія зазначених регуляторів здійснюється через активацію внутрішньоклітинних протеїнкіназ (протеїнкі-нази С і тирозинових протеїнкіназ).
14.36. Які механізми лежать в основі розвитку місцевих клінічних ознак запалення?
1. Почервоніння (rubor) пов'язано з розвитком артеріальної, а потім і венозної гіперемії.
2. Підвищення місцевої температури (color) обумовлено підвищенням інтенсивності катаболічних процесів у вогнищі запалення, а також артеріальною гіперемією, під час якої в тканину надходить багато теплої артеріальної крові.
3. Основу набряку (tumor) становлять механізми ексудації (див. запит. 14.26).
4. Біль (dolor) виникає в результаті подразнення рецепторів медіаторами запалення (гістамін, кініни), а також механічним тиском ексудату, ацидозом і гіперосмією.
5. Порушення функції (functio leasa) є наслідком ушкодження й загибелі клітин.
14.37. Які загальні прояви характерні для запалення?
1. Гарячка. Розвивається внаслідок виділення нейтрофілами і макрофагами так званих лейкоцитарних пірогенів (інтерлейкіну-1).
2. Лейкоцитоз. При гострому запаленні, спричиненому гноєтворними мікробами, він характеризується абсолютним збільшенням кількості нейтрофілів у периферичній крові (нейтрофільоз) і зміщенням лейкоцитарної формули вліво. В основі цієї реакції лежать вихід лейкоцитів з резервного пулу червоного кісткового мозку в кров (дія інтерлейкіну-1 і фактора некрозу пухлин), а також стимуляція лейкопо-езу колонієстимулятивним фактором.
3. Підвищення вмісту в крові "білків гострої фази запалення".
4. Збільшення швидкості осідання еритроцитів (ШОЕ). Пов'язано зі збільшенням вмісту в плазмі крові грубодисперсних білків (глобулінів, фібриногену), у результаті чого зменшується поверхневий негативний заряд еритроцитів і вони легко склеюються.
5. Інтоксикація. Обумовлена надходженням у кров продуктів альтерації із запаленої тканини.
14.38. Що таке "білки гострої фази запалення"? Що є причиною підвищення їхньої кількості при запаленні?
"Білки гострої фази запалення" ("реактанти гострої фази") - це білки, концентрація яких у плазмі крові при гострому запаленні збільшується більш як на 50 %. Вони утворюються в основному в печінці під впливом:
а) продуктів, що надходять у кров з вогнища запалення (продуктів альтерації);
б) інтерлейкіну-1 макрофагального походження.
Нині відомо більше 10 "білків гострої фази запалення". Всі вони в основному мають захисне значення. До них відносять:.
1) інгібітори протеаз (орозомукоїд, а-антитрипсин);
2) антиоксиданти (гаптоглобін, церулоплазмін);
3) імуноглобуліни й антитілоподібніречовини (антитіла, С-реактивний білок).
14.39. Як впливають гормони на перебіг запалення? Який механізм протизапальної дії глюкокортикоїдів ?
За механізмом впливу на запалення гормони поділяють на прозапальні й протизапальні. Прикладом прозапальних гормонів, тобто гормонів, що посилюють запалення, можуть бути мінералокортикоїдщ зокрема альдостерон- Під його впливом істотно підвищується проникність стінок судин, у результаті чого збільшується ексудація.
Найважливішими протизапальними гормонами є глюкокортикоїди. У високих (лікувальних) дозах вони викликають дерепресію гена, що кодує структуру особливого білка - ліпокортину. Ліпокортин є природним внутрішньоклітинним інгібітором фосфоліпази Аг Пригнічення цього ферменту ліпокортином має два важливих наслідки: 1) з одного боку, зменшується утворення лізофосфоліпідів, у результаті чого зменшуються явища альтерації (стабілізація мембрани) (див. розд. 11); 2) з другого боку, зменшується утворення арахідонової кислоти та її похідних (простагландинів, тромбоксанів, простациклінів, лейкотрієнів). Ця обставина пояснює інші протизапальні ефекти глюкокортикоїдів — зменшення ексудації і еміграції лейкоцитів, ослаблення порушень мікроциркуляції. У результаті пригнічення процесів клітинного поділу й біосинтезу білка зменшуються явища проліферації у вогнищі запалення.
14.40. Чому запалення слід вважати патологічним процесом, а не захисною компенсаторною реакцією організму?
Запалення, як і будь-який патологічний процес, являє собою єдність і боротьбу двох начал: власне патологічного і захисно-компенсаторного. У запаленні завжди наявні руйнівний і захисний компоненти.
Власне патологічними явищами при запаленні слід вважати первинну і вторинну альтерацію, набряк, фізично-хімічні зміни й порушення обміну речовин у вогнищі запалення, біль і порушення функції.
Захисне значення мають еміграція лейкоцитів, знищення флогогенних агентів, активація процесів репарації ушкодженої тканини, загальні реакції організму, спрямовані на збільшення його резистентності (гарячка, лейкоцитоз, збільшення вмісту "білків гострої фази запалення").
Іноді одна й та сама реакція має одночасно риси патологічної і захисної. Наприклад, розлади місцевого кровообігу, з одного боку, викликають ексудацію, призводять до кисневого голодування тканини (патологічний бік), з другого — сприяють еміграції лейкоцитів, перешкоджають поширенню збудника в організмі, локалізуючи його в запаленій тканині (захисний бік).
З огляду на такий характер запалення, лікар повинен спрямовувати свої зусилля на боротьбу з власне патологічними явищами і, в міру своїх можливостей, посилювати захисно-компенсаторні.
15. Гарячка
15.1. Що таке гарячка?
Гарячка - це типовий патологічний процес, що розвивається у вищих гомойотермних організмів у відповідь на пірогенні подразники і виявляє себе перебудовою терморегуляції, спрямованою на активне підвищення температури тіла.
75.2. Які речовини називають пірогенними (пірогенами)? Як їх класифікують ?
Шрогени — це речовини, які є причиною розвитку гарячки. їх поділяють на:
а) інфекційні й неінфекційні;
б) природні й штучні;
в) екзогенні й ендогенні;
г) первинні й вторинні.
15.3. Наведіть приклади інфекційних і неінфекційних пірогенів.
До інфекційних пірогенів відносять:
1) ендотоксини грамнегативних бактерій (пірогенну дію має фрагмент токсину — ліпоїд А);
2) екзотоксини грампозитивних бактерій (дифтерійний, правцевий);
3) продукти діяльності патогенних грибків;
4) рикетсії;
5) віруси.
Неінфекційними пірогенами є:
1) компоненти несумісної за групами перелитої крові (трансфузійна гарячка);
2) екзогенні білки (білки молока при парентеральному його введенні);
3) продукти розпаду тканин.
15.4. Що таке природні і штучні пірогени?
Природними називають пірогени, які існують у природі або утворюються природно з непірогенних речовин.
Штучні пірогени отримують шляхом обробки нативних бактеріальних токсинів і використовують з лікувальною метою (піротерапія). Найвідомішими є пірогенал, отриманий із Pseudomonas aeruginosa, і пірексаль, виділений із Salmonella abortus equi.
15.5. Що називають екзогенними й ендогенними пірогенами?
Екзогенні пірогени надходять або їх вводять ззовні. При введенні екзогенного пірогену парентерально гарячка виникає через 45-90 хв.
Ендогенні пірогени утворюються в самому організмі. До них відносять:
1) продукти первинної і вторинної альтерації, що утворилися у вогнищі запалення;
2) продукти, які надходять у кров з осередків некрозу (наприклад, при інфаркті міокарда);
3) метаболіти стероїдних гормонів;
4) комплекси антиген-антитіло;
5) лейкоцитарні пірогени - продукти діяльності нейтрофілів і макрофагів.
15.6. Що таке первинні і вторинні пірогени?
Первинними називають пірогени, які безпосередньо не впливають на центр терморегуляції, їх пірогенна дія опосередковується утворенням і вивільненням так званих лейкоцитарних пірогенів.
Вторинними називають лейкоцитарні пірогени, які утворюються і вивільнюються лейкоцитами під впливом первинних пірогенів. Вторинні пірогени мають здатність безпосередньо впливати на центр терморегуляції й викликати розвиток гарячки.
Сьогодні відомо, що одним із вторинних лейкоцитарних пірогенів є інтерлейкін-1. Ця речовина утворюється і вивільнюється лейкоцитами (нейтрофілами й макрофагами) у процесі активації фагоцитозу. Поряд з дією на центр терморегуляції інтерлейкін-1 виявляє цілу низку інших ефектів, що визначають клінічні прояви гарячки (див. розд. 14).
15.7. Які існують докази того, що дія первинних пірогенів пов'язана з утворенням вторинних?
1. Первинні пірогени мають досить високий латентний період дії (у людини 45 хв. і більше), у той час як латентний період дії вторинних пірогенів — 10 хв. і менше.
2. До дії первинних пірогенів розвивається толерантність (звикання), тобто для отримання гарячки треба збільшувати дозу пірогену з кожним наступним введенням. У той же час при повторних введеннях вторинних пірогенів толерантність не виникає.
3. Якщо фагоцитарна функція нейтрофілів і макрофагів порушена (наприклад, при лейкопенії, наповненні фагоцитів тушшю), то при введенні первинних пірогенів гарячка не виникає. ;
4. При безпосередньому введенні первинних пірогенів у терморегуляторні центри гіпоталамуса гарячка не розвивається, у той час як введення в ці центри вторинних лейкоцитарних пірогенів закономірно супроводжується підвищенням температури тіла.
15.8. Які послідовні процеси становлять сутність патогенезу гарячки?
У патогенезі гарячки можна виділити кілька етапів.
I. Індукція утворення й вивільнення вторинного лейкоцитарного пірогену (інтер-лейкіну-1) первинними пірогенами.
II. Вплив інтерлейкіну-1 на центр терморегуляції й перебудова його роботи.
III. Етап клінічних проявів гарячки (зміна температури тіла).
15.9. Де розташований і що являє собою з функціональної точки зору центр терморегуляції?
Нейрони центру терморегуляції містяться в передньому (преоптична ділянка) і задньому (дорсо- і вентромедіальні ядра) гіпоталамусі. Беручи до уваги функціональні характеристики, виділяють чотири групи нейронів (рис. 44).

1. Нейрони "термостата" - це група термочутливих нейронів, що безпосередньо сприймають температуру крові, яка протікає через гіпоталамус. Сюди ж надходить інформація від шкірних і внутрішніх периферичних терморецепторів. "Термостат" виводить середню температуру ядра тіла.
2. Нейрони "установочної точки" - це група термонечутливих нейронів, які за-1 дають рівень температури ядра тіла. Інформація від "термостата" надходить до нейронів "установочної точки", де відбувається порівняння наявної температури ядра із запрограмованим рівнем.
Якщо середня температура ядра виявиться вищою за температуру "установочну точки", то це породжує сигнали, які гальмують центр теплопродукції і збуджують центр тепловіддачі. І навпаки, зменшення температури ядра нижче температури "установочної точки" викликає активацію центру теплопродукції і гальмування центру тепловіддачі.
3. Центр теплопродукції. Його нейрони знаходяться у задньому гіпоталамусі. їх збудження викликає збільшення утворення теплоти.
4. Центр тепловіддачі міститься в преоптичній зоні переднього гіпоталамуса. При його збудженні зростає виділення теплоти організмом.
15.10. Який механізм дії інтерлейкіну-1 на центр терморегуляції?
Інтерлейкін-1 взаємодіє зі специфічними рецепторами на мембрані нейронів, які входять у групу клітин "установочної точки". Унаслідок активації рецепторів збільшується активність зв'язаного з ними ферменту - фосфоліпази А,. Цей фермент вивільнює з фосфоліпідів плазматичної мембрани арахідонову кислоту, з якої утворюються простагландини групи Е (рис. 45).

Рис. 45. Вплив інтерлейкіну-1 на центр терморегуляції
Простагландини зменшують чутливість нейронів "установочної точки" до імпульсів, що надходять від нейронів "термостата". У результаті цього звичайні сигнали про нормальну температуру ядра починають сприйматися нейронами "установочної точки" як інформація про зменшення температури. Це, у свою чергу, викликає стандартну реакцію, спрямовану на підвищення температури, - активацію центру теплоутворення й гальмування центру тепловіддачі (рис. 46).

Рис. 46. Роль простагландинів у патогенезі гарячки: "+ " — активація; "—" — гальмування
15.11. Які існують докази ролі простагландинів Ев патогенезі гарячки?
1. Введення простагландинів Е мікроін'єкторами в центр терморегуляції (у ділянку "установочної точки" гіпоталамуса) викликає підвищення температури тіла.
2. Фармакологічні препарати, які інгібують циклооксигеназу (фермент синтезу простагландинів), мають жарознижувальний ефект при гарячці. До таких препаратів, зокрема, належать ацетилсаліцилова кислота, індометацин.
3. Ці ж самі препарати не впливають на рівень нормальної температури тіла. Звідси висновок, що простагландини Е не беруть участі в регуляції температурного гомеостазу в нормі, а утворюються тільки при гарячці.
4. Глюкокортикоїди, що пригнічують активність фосфоліпази А2 через ліпокортино-вий механізм (див. розд. 33), зменшують утворення простагландинів Е, завдяки чому гальмують розвиток гарячки.
15.12. Назвіть стадії гарячки.
Клінічно виділяють три стадії гарячки (рис. 47):

Рис. 47. Стадії гарячки
I — підвищення температури (st. incrementi);
II - стояння підвищеної температури (st. fastigii);
III - зниження температури (st. decre-menti).
15.13. Поясніть, як відбувається підвищення температури тіла на І стадії гарячки.
На самому початку різко зменшується тепловіддача. У результаті активації сим-патоадреналової системи звужуються кровоносні судини шкіри й кінцівок, скорочуються гладкі м'язи, що піднімають волосся (у тварин піднімається шерсть, у людини виникає ознака "гусячої шкіри").
Ці зміни мають два наслідки. З одного боку, різке обмеження тепловіддачі саме по собі веде до підвищення температури ядра. З другого боку, зменшується температура шкіри, що викликає збудження холодових терморецепторів. Інформація про зниження температури "оболонки" надходить у центр терморегуляції, а звідти в кору головного мозку — у людини виникає відчуття холоду. Крім того, відбувається збудження підкіркових рухових центрів, у результаті чого підвищується тонус скелетних м'язів, розвивається тремтіння (озноб). Збільшується скоротливий термогенез.
Поряд із цим відбувається активація нескоротливого термогенезу, пов'язаного з підвищенням швидкості окисних процесів. Велике значення при цьому має підвищення інтенсивності клітинного дихання в бурій жировій тканині під дією катехо-ламінів.
Таким чином, підвищення температури тіла спочатку обумовлене зменшенням тепловіддачі, а потім збільшенням теплопродукції.
15.14. Поясніть механізми зниження температури тіла при завершенні гарячки. Які існують варіанти такого падіння?
Як тільки припиняється дія інтерлейкіну-1 на центр терморегуляції, у нейронах "установочної точки" зменшується вміст простагландинів Е, що веде до відновлення чутливості клітин до сигналів, які надходять від "термостата". Температура ядра починає сприйматися як підвищена, у результаті чого активується центр тепловіддачі й пригнічується центр теплопродукції. Найбільше значення при цьому мають дві фізіологічні реакції: розширення кровоносних судин шкіри й кінцівок та збільшення потоутворення і потовиділення. Ці реакції ведуть до збільшення тепловіддачі і, як наслідок, до зменшення температури тіла.
Буває два варіанти падіння температури:
1) критичне падіння — різке зменшення температури протягом кількох годин;
2) літичне падіння - поступове зменшення температури протягом кількох діб.
Критичне падіння може бути небезпечним, особливо у літніх і у хворих на серцево-судинні недуги людей у зв'язку з можливим падінням артеріального тиску і розвитком колапсу.
15.15. Які типи температурних кривих можуть бути характерні для гарячки? Які фактори впливають на динаміку зміни температури тіла при гарячці?
До основних типів температурних кривих відносять:
1) febris intermittent- температура нормалізується один або кілька разів на добу
(гнійна інфекція, абсцеси, туберкульоз);
2) febris remittens — коливання температури становлять більше 1 °С на добу, однак вона не повертається до норми (більшість вірусних і багато бактеріальних інфекцій);
3) febris continua - добові коливання температури становлять менше 1 °С (черевний і висипний тиф);
4) febris recurrens — приступи підвищення температури чергуються з періодами її нормалізації, що тривають кілька діб (поворотний тиф, малярія).
Динаміка змін температури при гарячці визначається, з одного боку, властивостями й особливостями життєвого циклу збудника, з другого - добовими (циркадни-ми) біологічними ритмами організму.
15.16. Чому гарячку називають патологічним процесом?
Гарячка є патологічним процесом, тому що в ній сполучаються два типи протилежних явищ: власне патологічні й захисно-компенсаторні. їх співвідношення залежить від величини підвищення температури.
15.17. У чому полягає захисно-пристосувальне значення гарячки?
При гарячці в організмі створюються несприятливі умови для розвитку збудників інфекційних хвороб і підвищується активність механізмів неспецифічної й специфічної резистентності організму. Зокрема: а) пригнічується розмноження багатьох вірусів, посилюється утворення інтерферонів;
б) збільшується фагоцитарна активність макрофагів і нейтрофілів;
в) підвищується інтенсивність синтезу антитіл;
г) зростає чутливість багатьох інфекційних збудників до дії лікарських речовин.
15.18. Які власне патологічні зміни можуть виникати при гарячці?
При температурі тіла, що перевищує 39 °С, можуть розвиватися:
а) порушення загального стану - нездужання, головний біль, відчуття жару та ін.;
б) розлади обміну речовин;
в) підвищення навантаження на серце (тахікардія, збільшення серцевого виштовху) або зменшення артеріального тиску при критичному падінні температури;
г) розлади центральної нервової системи, які можуть виявлятися маренням, галюцинаціями, а в дітей від 5 міс. до 5 років розвитком фебрильних судом. Можуть провокуватися напади епілепсії;
ґ) якщо температура перевищує 40 °С, послаблюється фагоцитоз, порушується життєдіяльність і функціональна активність лімфоцитів, збільшується чутливість організму до дії деяких екзотоксинів;
д) у вагітних можливе порушення розвитку плода, тератогенні ефекти.
15.19. Чим виявляє себе вплив гарячки на обмін речовин?
Насамперед, збільшується основний обмін (на 10-12 % при збільшенні температури на 1°С). Це викликає збільшення споживання кисню і поживних речовин. Оскільки апетит у хворого відсутній, іде використання ендогенних джерел енергії, людина втрачає у вазі.
Зростає потреба організму у воді, оскільки збільшуються нечутливі втрати води через шкіру й дихальні шляхи. У зв'язку з цим у маленьких дітей і важкохворих може розвиватися зневоднення. З метою його попередження особам з гарячкою рекомендують багато пити.
При помірній гарячці (38-39 °С) частота дихання й альвеолярна вентиляція зростають у більшій мірі, ніж утворення вуглекислого газу. У зв'язку із цим може розвиватися гіпокапнія й, як наслідок, газовий алкалоз. З метою його попередження рекомендують пити підкислену рідину.
При високій гарячці (понад 39 °С) відбувається мобілізація вільних жирових кислот і посилюється утворення в печінці кетонових тіл. Кетонемія може вести до розвитку негазового ацидозу.
При гарячці розвивається негативний азотистий баланс, обумовлений переважанням катаболізму білків над їх синтезом.
15.20. У чому полягає принципова відмінність гарячки і гіпертермії?
При гарячці має місце не порушення, а перебудова терморегуляції. Організм сам підтримує високу температуру, оскільки "установочна точка" терморегуляторного центру налаштована на більш високий рівень. Якщо тварину з гарячкою охолоджувати, то її температура не зменшується, а продовжує зберігатися високою.
При гіпертермії терморегуляція порушена. Температура тіла підвищується всупереч прагненням організму підтримувати температурний гомеостаз. "Установочна
точка" терморегуляторного центру не міняється. Якщо тварину з гіпертермією охолоджувати, то в результаті різкого збільшення тепловіддачі температура тіла починає зменшуватися (рис. 48).
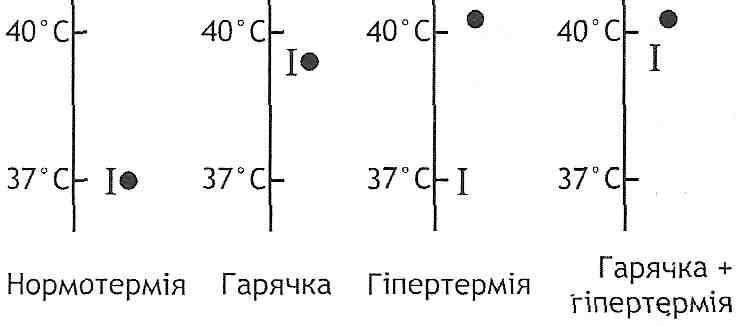
Рис. 48. "Установочна точка " і температура прирізних видах порушень терморегуляції
15.21. Що є основним патогенетичним принципом жарознижувальної терапії?
Основним патогенетичним принципом жарознижувальної терапії є зменшення "установочної точки" центру терморегуляції, що досягається пригніченням утворення простагландинів Е з допомогою інгібіторів циклооксигенази (ацетилсаліцилова кислота, індометацин, парацетамол) та інгібіторів фосфоліпази А2.
15.22. Наведіть приклади використання гарячки з лікувальною метою.
Нині з лікувальною метою застосовують високоочищені препарати пірогенів — пірогенал, пірексаль та ін. Піротерапію використовують для лікування пізніх стадій сифілісу, кістково-суглобного туберкульозу й інших інфекційних захворювань.
Застосування пірогенів при лікуванні сифілісу ефективне завдяки тому, що на пізніх стадіях хвороби збудник перебуває в головному мозку, куди утруднений доступ лікарських препаратів і антитіл через наявність гематоенцефалічного бар'єра. Проникність цього бар'єра збільшується при підвищенні температури тіла. Як наслідок, піднімається загальна реактивність і поліпшується перебіг хвороби.
16» Патологія клітинного росту. Пухлини
16.1. Назвіть основні види змін клітинного росту.
Розрізняють два види змін клітинного росту: гіпербіотичні і гіпобіотичпі процеси. До перших відносять:
а) гіпертрофію і гіперплазію;
б) регенерацію;
в) пухлини.
До других:
а) атрофію;
б) дистрофію і дегенерацію.
16.2. Що таке пухлинний процес? Які існують види пухлин?
Пухлинним називається типовий патологічний процес, сутність якого полягає в безмежному, нерегульованому розростанні тканини, не пов'язаному із загальною структурою ураженого органа та його функціями.
Виділяють два види пухлин: доброякісні і злоякісні.
16.3. Чому пухлинний процес вважають загальнобіолопчним
явищем?
Пухлинний процес носить загальнобіологічний характер, оскільки пухлини виникають як у тварин, так і у рослин. У всіх видів багатоклітинних живих організмів виявляють пухлини (у комах, риб, амфібій, рептилій, ссавців).
16.4. Чи існують особливості в характері пухлинного процесу у людини й у різних видів тварин?
У людини 90 % усіх злоякісних пухлин мають епітеліальне походження, тобто є раком. У той же час у великої рогатої худоби, коней, свиней 80 % злоякісних пухлин походять із клітин крові, тобто є гемобластозами, а у собак 50 % злоякісних новоутворень являють собою саркоми — пухлини із клітин сполучної тканини.
16.5. У чому полягають основні відмінності доброякісних і злоякісних пухлин?
1. Доброякісні пухлини складаються з добре диференційованих клітин. Ці пухлини зберігають типову структуру тканини, з якої утворилися. У той же час злоякісні пухлини характеризуються втратою диференціювання клітин, спрощенням і ати-повістю своєї будови.
2. Доброякісні пухлини часто ростуть повільно, їх ріст може зупинитися, а іноді спостерігається й зворотний розвиток (регресія). Для злоякісних пухлин, як правило, характерний швидкий ріст, що спонтанно не зупиняється. Мимовільна регресія таких пухлин невідома.
3. Доброякісні пухлини мають капсулу й ростуть експансивно, тобто не проростають у навколишні здорові тканини, а розсовують їх. Ріст злоякісних пухлин інвазивний (інфільтративний). Вони не мають капсули і проростають у навколишні тканини.
4. Доброякісні пухлини не метастазують, у той час як злоякісні зазвичай дають метастази.
5. Доброякісні пухлини добре лікуються хірургічними методами, летальних наслідків, як правило, не буває. Злоякісні пухлини при відсутності лікування призводять до смерті.
16.6. Які існують методи експериментального вивчення пухлин?
Методами експериментального моделювання пухлин є індукція, трансплантація і експлантація.
Метод індукції передбачає відтворення злоякісних пухлин шляхом введення в організм канцерогенних факторів. Найчастіше з цією метою використовують хімічні канцерогенні сполуки й безклітинні фільтрати пухлинної тканини, що містять онкогенні віруси. Крім того, з метою індукції пухлин іноді використовують фізичні впливи (рентгенівське випромінювання, радіонукліди, ультрафіолетове опромінення).
Метод трансплантації - це пересадження пухлини від однієї тварини іншій. Уперше здійснена М. Новинським у 1876 р. Для успішної трансплантації пухлини важливими є такі умови:
а) пересадження має здійснюватися в межах одного виду тварин;
б) пересаджувати треба живі життєздатні пухлинні клітини;
в) трансплантацію слід робити в стерильних умовах, щоб уникнути запального процесу в тканині.
Метод експлантації— це вирощування пухлини в культурі тканини поза організмом. Цей метод дає можливість вивчати вплив різних факторів на пухлинний ріст, здійснювати пошук засобів терапії злоякісних пухлин.
16.7. Назвіть основні причини виникнення злоякісних пухлин.
Існує три групи етіологічних факторів: хімічні (канцерогенні речовини), фізичні (іонізуюча радіація, ультрафіолетове випромінювання, висока температура, механічний вплив), біологічні (онкогенні віруси).
16.8. Хто і як уперше довів роль хімічних факторів у виникненні злоякісних пухлин?
У 1775 р. англійський лікар П. Ttomm уперше припустив, що хімічні сполуки можуть бути причиною раку. До такого висновку він дійшов на підставі своїх спостережень численних випадків раку шкіри мошонки у молодих людей, які багато років до виникнення хвороби, будучи дітьми, працювали сажотрусами. Було вперше встановлено зв'язок між виникненням раку сажотрусів і дією на шкіру сажі та смоли.
Однак тільки в 1915 p. японські вчені Ямагіва та Ішикава підтвердили цей висновок в експерименті. Вони вперше відтворили злоякісну пухлину (рак шкіри) шляхом тривалого, протягом 6-ти місяців утирання кам'яновугільної смоли в шкіру вуха кролів.
На початку 30-х років з кам'яновугільної смоли був виділений 3,4-бензпірен — речовина, з дією якої й був пов'язаний канцерогенний ефект продуктів неповного згоряння вугілля.
16.9. Як класифікують хімічні канцерогени?
Хімічні канцерогени — це речовини, здатні викликати розвиток злоякісних пухлин. ї. За походженням розрізняють канцерогени природні і штучні. її. За хімічною будовою канцерогени можуть бути представлені:
а) поліциклічними ароматичними вуглеводнями (ПАВ);
б) ароматичними амінами;
в) нітрозосполуками;
г) мікотоксинами;
ґ) гетероциклічними вуглеводнями;
д) аміноазосполуками;
є) простими сполуками (миш'як, азбест та ін.).
III. Відносно організму хімічні канцерогени можуть бути екзогенними й ендогенними.
IV. За механізмом канцерогенного впливу розрізняють канцерогени прямої дії й канцерогени непрямої дії.
16.10. Наведіть приклади канцерогенів природного і штучного походження.
До канцерогенів природного походження відносять продукти життєдіяльності деяких грибів (мікотоксини) і продукти вулканічної діяльності.
Джерелами канцерогенів штучного походження є:
1) викиди промислових підприємств;
2) вихлопні гази автомобілів;
3) тютюновий дим;
4) продукти неправильної кулінарної обробки їжі (використання пересмажених жирів, порушення технології копчення та ін.).
16.11. Охарактеризуйте канцерогенну дію поліциклічних ароматичних вуглеводнів (ПАВ).
ЛАВ - це сполуки, які мають у структурі своїх молекул кілька сполучених бензольних кілець. Найпоширенішими і найбільш вивченими є такі їхні представники, як 3,4-бензпірен, диме-
тилбензантрацен (рис. 50). їх можна виявити в продуктах вулканічної діяльності, викидах промислових підприємств, вихлопних газах автомобілів, тютюновому димі, харчових продуктах при неправильному їх копченні та ін.
Головна особливість канцерогенного впливу ПАВ полягає в їх місцевій дії. Це означає, що вони викликають розвиток пухлин у тих органах і тканинах, з якими контактують. Так, при втиранні в шкіру виникає рак шкіри, при підшкірному введенні - саркома, при вдихуванні - рак легень, при надходженні з їжею - рак стравоходу, шлунка і кишок, при виділенні з молоком - рак молочних залоз.

Рис. 50. Деякі канцерогенні ПАВ
Рис. 51. Канцерогенні ароматичні аміни

Рис. 52. Деякі канцерогенні сполуки
16.12. У чому полягає особливість канцерогенної дії ароматичних амінів?
Ароматичні аміни — це сполуки, що містять у своїй структурі бензольні кільця й аміногрупи. Канцерогенні властивості мають анілін та його похідні, зокрема, 2-на-фтиламін, диметиламіноазобензол (ДАБ) (рис. 51). Ці сполуки широко використовуються в промисловості як основа барвників, вихідні речовини для синтезу лікарських препаратів і виробництва вибухових речовин.
Характерною рисою канцерогенної дії ароматичних амінів є їх органотропність. Незалежно від шляху надходження або введення речовини пухлини виникають у певних органах. Так, при введенні 2-нафтиламіну розвивається рак сечового міхура, а при введенні ДАБ - рак печінки.
16.13. Чим характеризується канцерогенний вплив нітрозосполук?
До нітрозосполук належать нітрозаміни і нітрозаміди (рис. 52). У дослідах на тваринах показано, що 90 % всіх вивчених нітрозосполук мають канцерогенну дію. Багато речовин цього класу викликають утворення пухлин після одноразового вве-
дення в порівняно невеликих дозах. Не виявлено жодного виду тварин (вивчалося 40 видів, від риб до приматів), які були б стійкі до канцерогенної дії нітрозосполук. Дуже чутливим до їх впливу є й організм людини.
Нітрозаміни можуть утворюватися в шлунку людини з неканцерогенних попере-дників (нітритів, амінокислот, амідопірину) при наявності хлороводневої (соляної) кислоти.
Для канцерогенної дії нітрозосполук характерна органотропність. Є речовини, які вибірково викликають розвиток пухлин головного мозку, нирок, печінки, шлунка та ін.
16.14. Наведіть приклади канцерогенно)'дії продуктів життєдіяльності грибів.
Серед продуктів життєдіяльності грибів (цвілі), що мають канцерогенну дію, найбільш вивчено афлашоксин В. Цей мікотоксин є гетероциклічною сполукою і продукується грибом Aspergillus flavum (див. рис. 52). Канцерогенна дія афлатоксину виявляє себе в дуже малих дозах - 0,02 мг/кг маси. Для порівняння, ціанід калію спричиняє токсичну дію в дозах, що перевищують зазначену в кілька десятків разів.
Із впливом мікотоксинів пов'язують розвиток первинного раку печінки у представників племені Банту в Африці. Клімат території, на якій проживає це плем'я, дуже вологий, тому продукти харчування швидко покриваються цвіллю. За традицією, що існує в тих місцях, такі продукти придатні до використання. Аналізи показали, що у споживаній їжі міститься афлатоксин В.
16.15. Який зміст вкладають у поняття "ендогенні канцерогени"?
Ендогенними називають канцерогени, які утворюються в організмі з його нормальних компонентів.
Остаточно не доведено, однак є підстави думати, що в організмі при порушенні обміну речовин можуть утворюватися канцерогенні поліциклічні ароматичні вуглеводні, їхніми джерелами можуть бути холестерол, жовчні кислоти, стероїдні гормони. Зокрема, показано, що обробка in vitro жовчних кислот призводить до появи ме-тилхолантрену — представника ПАВ, що має сильну канцерогенну дію.
Крім того, ендогенні канцерогени можуть з'являтися при порушенні обміну деяких амінокислот, зокрема, триптофану.
16.16. Які досліди доводять можливу участь гормонів у виникненні злоякісного пухлинного росту?
При порушенні регуляції секреції тронних гормонів аденогіпофіза (при порушенні механізмів зворотного зв'язку) їхня кількість у крові може істотно зростати. Впливаючи на органи-мішені, вони можуть стимулювати проліферацію клітин і розвиток пухлини.
Подібну можливість демонструють у такому досліді. У тварини видаляють один яєчник, а другий пересаджують у селезінку. Кров від селезінки надходить у печінку, де естрогени, що утворилися в яєчнику, руйнуються. До гіпофіза надходить кров, у якій мало естрогенів. Це викликає стимуляцію утворення гонадотропних гормонів. Останні, діючи на яєчник, посилюють секрецію статевих гормонів, однак їх, як
і раніше, мало в крові, що надходить у гіпофіз, оскільки відбувається руйнування естрогенів у печінці. Постійна стимулятивна дія гонадотропних гормонів на яєчник викликає проліферацію його клітин і у великій кількості випадків - розвиток злоякісних пухлин.
16.17. Що таке хімічні канцерогени прямої і непрямої дії? Дайте їх порівняльну характеристику.
Канцерогени прямої дії— це високоактивні хімічні сполуки, зокрема лактони, хлоретиламіни, епоксиди. Вони здатні безпосередньо взаємодіяти зі структурами клітин і викликати розвиток пухлини. Ці сполуки не вимагають жодних перетворень в організмі для прояву своєї канцерогенної дії.
Маючи високу реакційну здатність, прямі канцерогени не можуть накопичуватися в навколишньому середовищі (при взаємодії з компонентами зовнішнього середовища вони руйнуються). Тому, з погляду гігієни, вони не являють великої небезпеки для людини як фактори канцерогенезу.
Канцерогени непрямої дії— це інертні за своїми хімічними властивостями сполуки. До них, зокрема, належать поліциклічні ароматичні вуглеводні, ароматичні аміни, нітрозосполуки, афлатоксини. Маючи низьку реакційну здатність, зазначені канцерогени можуть накопичуватися в навколишньому середовищі, а тому становлять велику небезпеку для людини.
Канцерогенними ці сполуки стають в організмі тільки після ряду хімічних ферментативних перетворень, у результаті яких утворюються їхні активні форми - власне канцерогени (рис. 53). Подібним чином з ПАВ утворюються епоксиди, з ароматичних амінів- гідроксиламіни, з нітрозамінів - алкильний радикал. Ці форми канцерогенів впливають на генетичний апарат клітини й викликають її перетворення на пухлинну.

Рис. 53. Перетворення канцерогенів непрямої дії в печінці
16.18. Які властивості хімічних речовин обумовлюють їхню канцерогенну дію ?
У 60-ті роки подружжя Міллерів показало, що канцерогенна дія хімічних сполук пов'язана з наявністю в їхній структурі позитивно зарядженої (електрофільної) групи. У молекулах канцерогенів прямої дії така група з'являється відразу ж при розчиненні речовини у воді. У випадку канцерогенів непрямої дії електрофільна група утворюється в процесі ферментативних перетворень речовини в організмі.
Так, продуктами перетворення ПАВ, що містять позитивно заряджену групу, є епоксиди. Подружжя Пульманів показало, що канцерогенні властивості мають епоксиди, у молекулі яких атом кисню приєднаний до так званої К-зони (від нім. слова
Krebs - рак). Пізніше було встановлено, що найбільш канцерогенними є епоксиди з атомом кисню в так званій бей-ділящі молекули ПАВ (від англ. bay - затока) (рис. 54).
Таким чином, знаючи хімічну будову молекули ПАВ, можна передбачити канцерогенні властивості речовини.

Рис. 54. Хімічні властивості канцерогенних ПАВ
16.19. Які стадії проходить хімічний канцерогенез? У чому їхня сутність ?
У хімічному канцерогенезі виділяють три стадії: ініціацію, промоцію і пухлинну прогресію.
Сутність ініціації полягає в тому, що під впливом хімічного канцерогену відбувається
трансформація клітини, тобто перетворення її з нормальної на пухлинну.
Під час стадії промоціїтрансформована клітина отримує стимул до розмноження, пухлина починає рости. Речовини, що стимулюють розмноження трансформованих клітин, отримали назву промоторів. Самі вони можуть бути й неканцерогенни-ми. Дуже сильними промоторами є форболові ефіри, які активують протеїнкіназу С, що бере участь у регуляції клітинного поділу.
Між ініціацією і промоцією може пройти багато часу (іноді роки). Більшість вивчених хімічних канцерогенів є повними, тобто виявляють властивості й ініціаторів, і промоторів.
Пухлинна прогресія — це якісні зміни властивостей пухлини в процесі її розвитку. Як правило, згодом пухлина набуває усе більш і більш злоякісних властивостей.
16.20. Чим пояснюється явище пухлинної прогресії?
Пухлинним клітинам притаманна висока мінливість, тому їхня популяція неоднорідна. Іде постійна боротьба клітин за виживання в несприятливих умовах існування (дефіцит субстратів, кисню і т. д.). Це є основою природного їх добору - виживають тільки ті, що найбільш пристосовані до існування в таких умовах. А найбільш пристосованими є найпростіше влаштовані пухлинні клітини, які втратили свої спеціалізовані функції й зберегли тільки властивість безмежного поділу. У такий спосіб іде подальше збільшення злоякісності пухлини (малігнізація) — головний напрям пухлинної прогресії.
16.21. Які фізичні фактори можуть мати значення у виникненні злоякісних пухлин?
Серед факторів фізичної природи до етіології пухлин можуть мати стосунок:
1) іонізуюча радіація;
2) ультрафіолетове випромінювання;
3) механічний вплив (тривалий тиск на тканини);
4) висока температура.
Роль іонізуючоїрадіації доводять в експериментах і численними клінічними спостереженнями. Радіаційний канцерогенез було виявлено вже через 7 років після відкриття рентгенівського випромінювання. Першою його жертвою став перший виробник рентгенівських трубок Фрікен, що перевіряв якість своєї продукції на власних руках. У нього виник рак шкіри.
При тривалому перебуванні білих щурів на сонці у них часто розвивається рак шкіри, що пов'язують із впливом ультрафіолетового випромінювання.
Розвиток пухлини в ділянці імплантації тваринам пластинок, виготовлених з хі-Вачно інертного матеріалу ("пластмасовий " канцерогенез), виникнення раку в місці тривалого тиску на шкіру кантрі (спеціальної сумки, у якій жителі Індії носять вугілля) - це приклади можливого значення механічних факторів у канцерогенезі.
Нарешті, часте виникнення пухлин порожнини рота у пастухів гірських районів, які п'ють дуже гарячий чай, наводить на думку про можливу роль високої температури в розвитку пухлин.
16.22. Назвіть основні закономірності канцерогенної дії іонізуючого випромінювання
Хоча для розвитку пухлин мають значення доза й вид випромінювання, немає лінійної залежності між частотою виникнення пухлинного росту і поглиненою дозою. Немає також і мінімальної порогової дози, так що будь-яке випромінювання в будь-якій дозі є потенційно небезпечним. За інших рівних умов тривалий і постійний вплив низьких доз, з погляду канцерогенезу, значно небезпечніший, ніж короткочас-ний вплив великих доз.
16.23. Що таке "пластмасовий" канцерогенез? У чому його особливості?
В експерименті було показано, що після імплантації пластмасових пластинок під шкіру в цій ділянці часто розвивається злоякісна пухлина. Таке явище отримало назву "пластмасового" канцерогенезу. Було встановлено такі його закономірності. 1. Для виникнення пухлини матеріал, з якого зроблено пластинки, не має особливого значення. Такий висновок зроблено на підставі результатів дослідження багатьох речовин, серед яких целофан, поліетилен, тефлон, скло, золото, платина та ін. | 2. Якщо з речовини зробити пластинку й імплантувати її - пухлина виникає, якщо пластинку подрібнити і ввести в тканину отриманий порошок - пухлина не розвивається.
3. Вирішальне значення має розмір пластинки. Пухлина виникає при імплантації пластинок розмірами не менше 0,5 х 0,5 см.
4. Пластинка має бути суцільною, тобто не мати отворів (перфорацій).
Відповідно до однієї з гіпотез, навколо пластинки утворюється сполучнотканинна капсула, серед колагенових волокон якої перебувають одиничні клітини. Вони є відірваними від інших клітин і сигналів, що регулюють інтенсивність проліфератив-них процесів. У зв'язку з цим створюються умови, які сприяють переродженню нормальних клітин у пухлинні.
16.24. Ким і в яких експериментах було доведено роль вірусів у виникненні пухлин?
Експериментальними доказами вірусного походження пухлин вважають їх виникнення після введення тваринам безклітинних фільтратів пухлинної тканини. Такі фільтрати готують із суспензії пухлинних клітин, пропускаючи її через порцелянові фільтри, що затримують бактерії і клітини тканини (рис. 55).
Уперше в 1908 р. В. Елерман і О. Банг у такий спосіб відтворили лейкоз у курей, уводячи безклітинні фільтрати лейкозних клітин.
У 1910 р. П. Раус викликав саркому у курей введенням безклітинного фільтрату саркоматозної тканини. За ці дослідження його в 1966 р. було удостоєно Нобелівської премії.
У 1932 p. Р. Шоуп повідомив про виділення вірусу з доброякісної пухлини кролів - фіброми, а трохи пізніше - з папіломи.
У 1934 р. Б. Люке виявив у ядрах ракових клітин нирок леопардової жаби тільця-включення, що нагадують такі при вірусних інфекціях. Потім він відтворив пухлину введенням тваринам висушеного екстракту пухлинних клітин.
У 1936 р.Дж. Біттнер відкрив "фактор молока" (фактор Біттнера), що викликав рак молочних залоз у мишей. Подальші дослідження показали, що цей фактор є ві- . русом, який передається від матері дитинчатам з молоком.
У 1951 p. JT. Гросс уперше відтворив лейкоз у мишей введенням безклітинних фільтратів пухлинних клітин новонародженим тваринам. Ці дослідження довели можливість вірусної етіології злоякісних пухлин і у представників ссавців.
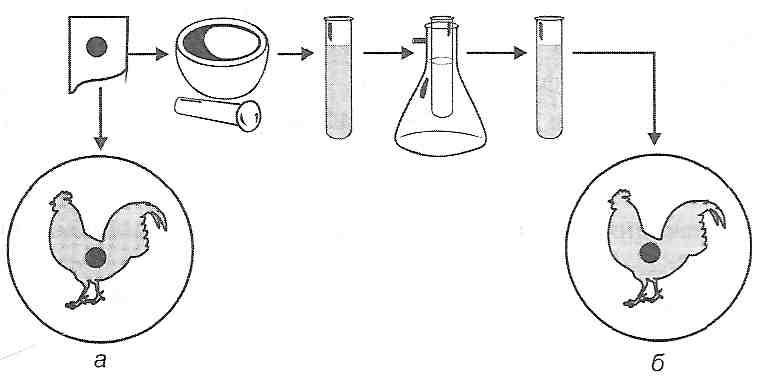
Рис. 55. Перевивання пухлини клітинним і безклітинним матеріалом: а — клітинне перевивання; б - перевивання фільтратом, що не містить клітин
16.25. Які ДНК-вмісні віруси є онкогенними для тварин і людини?
До онкогенних ДНКчвмісних вірусів відносять:
а) nanoea-eipycu. Вони викликають розвиток у тварин трьох видів пухлин: папіломи, поліоми і пухлини, що виникає під дією вакуолізуючого вірусу мавп SV-40;
б) аденовіруси. Онкогенними для тварин є аденовіруси 12,18 і 31-го типів;
в) герпес-віруси, зокрема, вірус Епшгпейна — Барр.
Що стосується людини, то в одних випадках доведено, а в інших є підстави думати, що причиною деяких пухлин є:
а) вірус Епштейна - Барр (викликає лімфому Беркіта, назофарингеальний рак);
б) вірус гепатиту В (може бути причиною раку печінки);
в) вірус папіломи людини (викликає доброякісні пухлини шкіри, жіночих геніталій, гортані).
16.26. Які РНК-вмісні віруси є онкогенними для тварин і людини?
Всі онкогенні РНК-вмісні віруси належать до сімейства pempoeipycie. Загальною їхньою властивістю є наявність у вірусному геномі гена, що кодує структуру ферменту ревертази, відомого ще як зворотна транскриптаза, або РНК-залежна ДНК-полімераза. Цей фермент забезпечує синтез двоспіральної ДНК на матриці односпіральноїРНК. Унаслідок цього утворюється ДНК-копія ретровірусу, що отримала назву ДНК-провірусу.
Залежно від онкогенності ретровіруси поділяють на дві групи.
I. Гостротрансформуючі ретровіруси. Дуже онкогенні, викликають розвиток пухлин після короткого латентного періоду. Ці віруси мають у своєму геномі онкоген, тому в основі трансформації клітин у пухлинні лежить епігеномнш механізм. До зазначеної групи, зокрема, відносять віруси гострих лейкозів у птахів, мишей і саркоми Рауса у курей.
II. Повільнотрансформуючі ретровіруси. Викликають розвиток пухлин після тривалого латентного періоду. Ці віруси не мають у своєму складі онкогена, тому основний механізм їх трансформуючої дії — мутаційний. До вірусів цієї групи відносять віруси лімфолейкозів.
Онкогенним ретровірусом людини є вірус Т-клітинноїлімфоми-лейкемії. Він передається від людини до людини при тривалих інтимних контактах, переливанні крові. Слід зазначити, що цей лімфотропний вірус дуже схожий на віруси імунодефіциту людини (ВІЛ), що викликають СНІД.
16.27. Назвіть етапи вірусного онкогенезу.
I. Рецепція вірусу. Відбувається взаємодія вірусної частки з певними структурами плазматичної мембрани клітини (рецепторами). Відсутністю відповідних рецепторів пояснюється видовий імунітет до вірусної інфекції.
II. Роздягання й проникнення вірусу в клітину (інтернолізація).
III. Об'єднання (інтеграція) вірусного геному з геномом клітини. Це центральний і обов'язковий етап вірусного онкогенезу. У випадку ДНК-вмісних онковірусів відбувається вбудовування вірусної ДНК у ДНК клітини; у випадку РНК-вмісних вірусів - вбудовується ДНК-провірус, який утворюється під впливом ферменту ревертази.
IV. Постійне перебування (персистенція) вірусу в геномі клітини. При цьому вірус розмножується разом з клітиною. Такий перебіг вірусної інфекції називається абортивним. Абортивний перебіг є неодмінною умовою перетворення клітини в пухлинну під впливом вірусу.
V. Трансформація клітини.
VI. Промоція.
VII. Пухлинна прогресія (див. запит. 16.19 і 16.20).
16.28. Назвіть фактори, від яких залежить трансформуюча дія вірусів на клітину.
I. Фактори, що їх визначають властивості вірусу. До них, зокрема, відносять так звану структурну дефектність вірусу. Структурно дефектними називаються віруси, які в процесі розмноження й формування вірусних часток втратили частину свого геному. Вони здатні проникати в клітину й об'єднуватися з її геномом, однак не здатні до репродукції. У цьому випадку єдино можливим варіантом вірусної інфекції є абортивний її перебіг. Це збільшує ймовірність трансформації клітини під впливом структурно дефектних вірусів.
Крім того, для механізмів онкогенної дії вірусів має значення наявність або відсутність у їхньому геномі вірусного онкогена.
II. Фактори, що їх визначають властивості клітин. До них відносять наявність віщіовіщтх. рецепторів на поверхні клітин, період клітинного циклу, під час якого вірус потрапляє в клітину. Інтеграція геному вірусу з геномом клітини можлива тільки в синтетичну фазу (фазу S) або в період, що безпосередньо передує їй (кінець фази G,). Цим, зокрема, пояснюється та обставина, що високодиференційова-ні клітини, які втратили здатність до поділу, є стійкими до дії онкогенних вірусів. Крім того, клітина стає чутливою до онкогенних вірусів, якщо в ній нема умов для синтезу всіх білків, необхідних для формування вірусних часток. За таких умов неможлива репродукція вірусу й вірусна інфекція має абортивний перебіг, при якому збільшується ймовірність трансформації клітини. Таке явище отримало назву функціональної дефектності вірусу.
16.29. Що таке вірусні онкогєни?
Вірусні онкогєни - це гени вірусу, з функціонуванням яких пов'язане перетворення нормальних клітин у пухлинні. Білки-продукти вірусних онкогенів порушують регуляцію процесів клітинного поділу і в такий спосіб викликають трансформацію клітини (епігеномний механізм канцерогенезу).
16.30. Що таке протоонкогени?
Про то онкогєни - це власні гени клітин, які несуть інформацію про структуру білків, що беруть участь у регуляції клітинного поділу. Протоонкогени є клітинними аналогами вірусних онкогенів.
Вважають, що вірусні онкогєни являють собою протоонкогени, які потрапили в геном вірусів у результаті тривалої еволюції останніх. Це пояснюється тим, що віруси, проходячи через клітини, можуть "красти", тобто прихоплювати із собою клітинні гени.
Протоонкогени є у всіх клітинах. Однак в одних клітинах вони все життя репресовані, тобто "мовчать", в інших вони "працюють" тільки в період ембріогенезу, а в інших - функціонують відповідно до регуляторних сигналів, що надходять.
16.31. Як класифікують вірусні онкогени і протоонкогени?
Залежно від продуктів, інформацію про які несуть онкогени вірусів і протоонкогени клітин, їх поділяють на такі групи (рис. 56):

Рис. 56. Продукти протоонкогенів і вірусних онкогенів
1. Онкогени, що кодують фактори росту або їхні аналоги. Наприклад, sis-онкоген вірусу саркоми мавп і аналогічний протоонкоген клітин кодують структуру фактора росту тромбоцитар-ного походження.
2. Онкогени, що кодують клітинні рецептори до факторіє росту.
Наприклад, онкоген вірусу лейкозу курей erb-B несе інформацію про видозмінений рецептор до епідермального фактору росту.
3. Онкогени, що кодують тирозинспецифічні про-теїнкінази. Прикладом може бути scr-онкоген вірусу саркоми Рауса та відповідний протоонкоген клітин.
4. Онкогени, що кодують структуру білків, які переносять інформацію від рецепторів плазматичної мембрани клітини до ядра. Прикладом є ras-онкоген вірусу саркоми щурів, який несе інформацію про цитоплазматичний білок, що зв'язує ГТФ.
5. Онкогени, що кодують структуру ядерних білків-регуляторів.
До них, зокрема, належить mic-онкоген вірусу мієлоцитозу курей. Продукти вірусних онкогенів є аналогами продуктів протоонкогенів, тобто власних білків клітин, що беруть участь у регуляції клітинного поділу. Однак є деякі, хоча й невеликі, відмінності, Вони стосуються певних структурних характеристик вірусних онкогенів і протоонкогенів. Саме ці відмінності і роблять продукти вірусних онкогенів власне онкогенними для клітини.
16.32. Що таке клітинні онкогени? Назвіть основні механізми перетворення протоонкогенів у клітинні онкогени.
Клітинні онкогени (трансформуючі гени) - це протоонкогени, які набули здатності трансформувати клітину, тобто перетворювати її в пухлинну. Перенесення таких генів в інші, здорові клітини викликає трансформацію останніх.
Нині доведено існування таких механізмів перетворення протоонкогенів у клітинні онкогени.
І. Дерепресія протоонкогена. Може відбуватися або в результаті порушення структури, а отже, і функції відповідного антионкогена, або внаслідок мутацій у генах-репресорах, що блокують діяльність (експресію) протоонкогена.
її. Підвищення експресії протоонкогена. Спостерігається тоді, коли білок-про-дукт протоонкогена утворюється і в нормі, однак його дуже мало. Під впливом певних генетичних факторів утворення такого продукту іноді істотно зростає. Зазначене явище може бути обумовлене такими конкретними механізмами:
а) ампліфікація генів (збільшення кількості їхніх копій);
б) хромосомні мутації — транслокація;
в) вплив вірусних промоторів і підсилювачів (так діють ретровіруси, що не мають у своєму складі онкогена);
г) вплив мігруючих генів самої клітини (транспозонів).
Ш. Якісні зміни протоонкогена, що викликають утворення видозміненого продукту. Ці зміни, як правило, обумовлені точковими мутаціями протоонкогена.
16.33. Що таке антионкогени?
AnmuoHKOzenu — це клітинні гени, продукти яких викликають репресію прото-онкогенів.
Втрата антионкогенів (делеція) або мутації в них, що призводять до утворення неактивних продуктів, можуть мати своїм наслідком дерепресію протоонкогенів і трансформацію клітини, тобто утворення злоякісної пухлини.
16.34. Які молекулярні механізми можуть лежати в основі вірусного онкогенезу?
I. Продукти вірусного онкогена порушують регуляцію клітинного поділу й у такий спосіб викликають трансформацію клітини. Цей механізм отримав назву епігеном-ного. Він реалізує себе у випадку дії вірусів, що містять у своєму геномі онкогени. Із цим механізмом, зокрема, пов'язаний вплив на клітини гостротрансформуючих ретровірусів.
II. Під дією промоторів і підсилювачів вірусів, що потрапили в геном клітини, відбувається активація власних протоонкогенів, і вони перетворюються на клітинні онкогени, що трансформують клітину. Це так звання мутаційний механізм вірусного канцерогенезу. Він виявляє себе при дії вірусів, позбавлених онкогенів, зокрема, повільнотрансформуючих ретровірусів (рис. 57).
16.35. З якими молекулярними механізмами може бути пов'язаний канцерогенез, що його викликають хімічні і фізичні фактори?
При дії хімічних і фізичних канцерогенних факторів можливими є такі молекулярні зміни, що призводять до перетворення клітини в пухлинну.
1. Точкові мутації протоонкогенів.
2. Мутації антионкогенів, що регулюють експресію протоонкогенів.
3. Хромосомні аберації.
4. Утворення дефектних вірусів, унаслідок чого вони отримують онкогенні властивості.
5. Вплив на системи природної і специфічної протипухлинної резистентності, зокрема, розвиток стану імунодепресії.

Рис. 57. Механізми канцерогенезу
Таким чином, значення хімічних і фізичних факторів як чинників канцерогенезу може полягати в тому, що вони впливають:
а) на клітини, викликаючи утворення клітинних онкогенів із протоонкогенів (мутаційний механізм канцерогенезу);
б) на віруси, змінюючи їхню структуру і властивості;
в) на організм у цілому, порушуючи механізми протипухлинного захисту.
16.36. Назвіть особливості росту злоякісних пухлинних клітин в умовах in vitro.
1. Відсутність контактного гальмування.
Нормальні клітини в культурі діляться доти, доки не утвориться моношар, що покриває дно судини. При цьому поділ припиняється (контактне гальмування). Пухлинні клітини розмножуються увесь час, утворюючи багатошарову структуру (контактного гальмування нема).
2. Здатність до поділу без прикріплення до якої-небудь поверхні. Пухлинні клітини, на відміну від нормальних, можуть ділитися, плаваючи в рідині і зберігаючи сферичну форму.
3. Для росту пухлинних клітин не обов'язкова наявність у середовищі сироватки крові.
Поділ нормальних клітин вимагає наявності в культуральному розчині не тільки поживних речовин і кисню, але й сироватки крові в концентрації від 10 до 30 %. Вважають, що сироватка містить білки, які є факторами росту для нормальних клітин.
4. Імортилізація (безсмертя) — безмежність у часі клітинного поділу. Нормальні клітини в культурі після певного числа пересаджень із судини в судину поступово втрачають здатність до поділу, культура старіє і клітини зрештою гинуть. Існує так званий ліміт Хейфліка — генетично запрограмована максимальна кількість поділів, яку може здійснити клітина.
У пухлинних клітинах ліміту Хейфліка нема, їхній поділ при створенні відповідних умов не має межі.
16.37. Назвіть основні особливості росту злоякісних пухлин in vivo.
1. Моноклональнісшь походження. Пухлина росте "сама із себе", тобто походить із однієї первинно трансформованої клітини. Інші, розташовані поруч, клітини в процес пухлинного переродження не втягуються:.
2. Автономність, росту — незалежність росту пухлини від регуляторних впливів організму (нервової системи, гормонів, факторів росту, інгібіторів проліферації). Для деяких пухлин така автономність ле абсолютна, а відносна.
3. Анаплазія- набуття пухлинними клітинами властивостей, характерних для ембріонального етапу розвитку організму. Інакше кажучи, пухлинні клітини своїми структурними, функціональними, біохімічними, імунологічними властивостями нагадують ембріональні клітини.
4. Поява в пухлинних клітинах великої кількості хромосомних аберацій. У клітинах злоякісної пухлини закономірно виявляють такі види хромосомних порушень, як транслокація, делеція, інверсія, дуплікація (докладно див. розд. 6).
5. Пухлинна прогресія (див. запит. 16.19 і 16.20).
6. Інвазивність.
7. Метастазування.
16.38. З якою швидкістю ростуть злоякісні пухлини? Якими чинниками вона визначається?
Теоретичні розрахунки показали, що за умови, коли всі пухлинні клітини постійно діляться, можна виділити два періоди розвитку пухлини.
Перший — це період від появи однієї пухлинної клітини до утворення пухлини, що містить 109 клітин. Для цього необхідно ЗО подвоєнь, тобто 90 діб. Маса такої пухлини становить приблизно 1 г - це мінімальна за величиною пухлина, яку можна виявити в організмі за допомогою сучасних методів дослідження.
Другий період — це період, під час якого кількість клітин у пухлині зростає від 109 до 1012. Для цього необхідно тільки 10 подвоєнь, тобто 30 діб. Маса пухлини наприкінці другого періоду має становити близько 1 кг — це максимально можлива за величиною злоякісна пухлина, ще сумісна з життям.
Однак у природних умовах швидкість росту пухлини значно менша, тому що не всі клітини діляться, а багато з них гине. На швидкість росту злоякісної пухлини впливають такі чинники.
1. Тривалість мітотичного циклу пухлинних клітин. Для більшості з них вона становить від 20 до 60 год.
2. Величина проліферативного пулу (ростової фракції) - показника, що відображає відсоток клітин пухлини, які перебувають у стані поділу. У деяких пухлинах він досягає 30 %.
3. Швидкість загибелі пухлинних клітин. Вона досить велика. Є пухлини, у яких на 100 щойно утворених клітин припадає 80-90 таких, що гинуть.
Причинами загибелі клітин у пухлині є:
а) дефіцит поживних речовин;
б) висока чутливість до дії ушкоджувальних факторів;
в) знищення захисними протипухлинними системами організму.
16.39. Якими порушеннями обміну речовин характеризуються злоякісні пухлини?
I. Порушення білкового обміну. У клітинах злоякісної пухлини спотворюється біосинтез білків: зникає багато власних білків, зокрема, деякі поверхневі антигени, у той же час з'являються невластиві клітинам білки вірусного і ембріонального походження, ферменти ектопічного синтезу гормонів. У пухлинній тканині зменшується інтенсивність катаболізму білків, порушується утворення деяких необхідних пухлині амінокислот, зокрема L-аспарагіну. Оскільки пухлина інтенсивно поглинає з крові величезну кількість амінокислот, її називають "пасткою " азоту.
II. Порушення вуглеводного обміну. Для злоякісної пухлини характерна низька інтенсивність клітинного дихання, висока активність гліколізу, ослаблений ефект Пастера. У зв'язку з цим пухлина має потребу в дуже великих кількостях глюкози. Поглинаючи її з крові, вона "обкрадає" організм, що може бути причиною розвитку гіпоглікемії. У зв'язку з цим злоякісну пухлину називають "пасткою " глюкози.
III. Порушення жирового обміну. У пухлинній тканині зменшується синтез жирових кислот із глюкози й ацетату. Всі необхідні ліпіди пухлина отримує з крові, поглинаючи ліпопротсїни дуже низької густини і комплекси альбумінів з жировими кислотами.
16.40. Що таке інвазивність пухлини? Як злоякісні клітини проростають у навколишню тканину?
Інвазивність - це здатність злоякісної пухлини проростати у навколишні тканини. Основу інвазії становлять три процеси.
1. Прикріплення пухлинних клітин до колагенових волокон інтерстиціальної тканини. Це відбувається завдяки наявності на поверхні пухлинних клітин рецепторів до фібронектину, що сприяє утворенню "фібронектинових містків" між клітинами пухлини і колагеном І і III типів.
2. Деградація інтерстиціальної сполучної тканини. Після прикріплення до колагену пухлинні клітини активуються й починають виділяти ферменти: колагенази І і III типів, еластазу, катепсини, плазмін. Усі вони спричиняються до гідролітичного розщеплення волокнистих структур сполучної тканини і компонентів основної інтерстиціальної речовини. Цим створюється шлях для міграції клітин, для просування їх у здорову тканину.
3. Власне міграція пухлинних клітин. Тиск, що створюється в процесі поділу, направляє пухлинні клітини в інтерстиціальну тканину, що зазнала змін. Крім того, частина клітин пухлини має власну рухливість і має властивість хемотаксису. їхній хемотаксис стимулюється продуктами деградації сполучної тканини.
16.41. Що таке метастазування? Як воно здійснюється?
Метастазування — це здатність злоякісної пухлини давати вторинні пухлинні вузли (метастази) у віддалених від первинної пухлини частинах організму.
Процес метастазування складається з трьох етапів. І. Вихід пухлинних клітин із тканини в лімфатичні або кровоносні судини - інтра-
вазація. Цьому передує прикріплення пухлинних клітин до компонентів базаль-
ної мембрани судин. В основі такого прикріплення лежить утворення "ламініно-вих містків" між поверхнею клітин пухлини і колагеном IV типу базальної мембрани. Глікопротеїд ламінін є компонентом інтерстиціальної речовини базальної мембрани. Деякі найбільш злоякісні клітини самі здатні продукувати цю речовину. Ламінін, з одного боку, взаємодіє з так званими ламініновими рецепторами пухлинних клітин, а з другого - з хімічними групами колагену IV типу.
II. Транспорт пухлинних клітин лімфою й кров'ю - дисемінація. Із клітин пухлини, що проникли в судини, утворюються пухлинні емболи. їх утворення пов'язане з агрегацією пухлинних клітин. У цьому процесі обов'язково беруть участь тромбоцити.
III. Вихід пухлинних клітин з судин у тканини й утворення вторинних вогнищ (метастазів)— екстравазація. Для локалізації метастазів мають значення місцезнаходження первинної пухлини, шлях метастазування (лімфогенний чи гематогенний), рецепторна взаємодія пухлинних клітин з ендотелієм судин. Останнім, зокрема, пояснюється факт специфічної локалізації метастазів деяких пухлин (раку простати в кістки, бронхокарциноми в головний мозок і надниркові залози, не-йробластоми в печінку і т. д.).
16.42. Як впливає пухлина на організм у цілому? Чому розвивається ракова кахексія?
Розвиток злоякісної пухлини може виявляти себе трьома групами загальних порушень в організмі.
ї. Ракова кахексія - загальне виснаження. Характеризується різким зменшенням маси тіла, слабкістю, втратою апетиту, анемією. Виникнення ракової кахексії пояснюють такими явищами:
а) пухлина захоплює із крові великі кількості глюкози ( "пастка глюкози"), у результаті чого розвивається гіпоглікемія і відбувається "енергетичне обкрадання" організму;
б) пухлина захоплює із крові великі кількості амінокислот ("пастка азоту"). Відбувається "пластичне обкрадання" організму;
в) з пухлинних клітин, що гинуть, у кров надходять токсичні продукти — ток-согормони. Вони обумовлюють явища загальної інтоксикації;
г) з пухлинних клітин виходить багато недоокиснених продуктів - розвивається негазовий ацидоз;
ґ) у результаті виходу ферментів із загиблих пухлинних клітин у кров розвивається ферментемія;
д) при локалізації пухлини у травному каналі порушуються функції травної системи.
II. Загальні прояви, пов'язані з місцевими змінами тканин. До цієї групи відносять утворення виразок, вторинні інфекції, кровотечі, больовий синдром.
III. Паранеонластичні синдроми. Вони часто супроводжують розвиток пухлин, однак їх патогенез і зв'язок зі злоякісним пухлинним ростом залишаються нез'ясованими.
До цієї групи відносять:
а) ендокринопатії;
б) гіперкальціємію;
в) нервово-м'язовий синдром (міастенію, порушення центральної й периферичної нервової системи);
г) дерматологічні порушення; ґ) ураження кісток і суглобів;
д) судинні й гематологічні порушення (тромбози, анемію, лейкемоїдну реакцію).
Великий внесок у вивчення складних механізмів впливу пухлини на організм зробив Р. Є. Кавецький- учень
0. О. Богомольця.
16.43. Які фактори організму впливають на розвиток злоякісних пухлин?
Розвиток пухлини визначається не тільки властивостями самих пухлинних клітин, але й впливом організму на цей процес. Найбільше значення мають:
а) васкулярілзація пухлини. Показано, що максимальна віддаленість пухлинних клітин від просвіту кровоносних судин не може бути більше 1—2 мм. Якщо відстань перевищує цю величину, клітини пухлини гинуть.
У злоякісну пухлину, як правило, інтенсивно проростають кровоносні судини. Це пов'язане з тим, що пухлинні клітини вивільнюють так званий ангіогенетичний фактор (ангіогенін), що стимулює ріст капілярів і розмноження ендотеліальних клітин;
б) гормони. Хоча пухлинний процес є автономним, існують, однак, пухлини, які виявляють високу чутливість до гормонів. Це, зокрема, рак молочної залози, матки, яєчників, передміхурової залози. Одні гормони посилюють ріст зазначених пухлин, інші, навпаки, гальмують;
в) стан механізмів протипухлинного захисту організму.
16.44. Які механізми протипухлинного захисту існують в організмі?
1. Механізми природної неспецифічної резистентності організму до пухлин. Не мають імунологічної специфічності і не вимагають попередньої імунізації. Вони здійснюються такими клітинами:
а) NK-wiimuHOMU (природними кілерами). Це великі гранулярні лімфоцити, що є різновидом О-лімфоцитів. Вони розпізнають пухлинні клітини і знищують їх;
б) LAK-wiimuHaMU (лімфокін-активованими кілерами). Вони, як і NK-клітини, здійснюють цитоліз пухлинних клітин;
в) макрофагами. Знищення клітин пухлини макрофагами здійснюється за допомогою фагоцитозу й механізмів позаклітинної цитотоксичності. Механізми природного неспецифічного протипухлинного захисту ефективні, якщо кількість пухлинних клітин в організмі не перевищує 103.
II. Реакції набутого (специфічного) протипухлинного імунітету. Обумовлені специфічними пухлинними антигенами і складаються як з клітинних, пов'язаних з функцією Т-лімфоцитів, так і гуморальних, пов'язаних з утворенням антитіл, імунних реакцій.
Зазначені реакції ефективні, якщо кількість клітин у пухлині становить від 103 до 10б. Якщо ж їхня кількість перевищує 106, то розвивається стан імунологічної депресії й описані вище механізми протипухлинного захисту пригнічуються.
16.45. Назвіть основні патогенетичні підходи до лікування пухлин.
1. Хірургічне видалення.
2. Променева терапія (використання радіоактивного опромінення).
3. Хіміотерапія.
4. Імунотерапія.
5. Підвищення неспецифічної резистентності (наприклад, введення БЦЖ).
17. Порушення енергетичного обміну
17.1. Що таке позаклітинні і внутрішньоклітинні порушення енергетичного обміну?
Залежно від причин розвитку розрізняють поза- і внутрішньоклітинні розлади енергетичного обміну.
Позаклітинними називають розлади енергетичного обміну, пов'язані з первинними порушеннями забезпечення клітин поживними речовинами і киснем. Це голодування і більшість видів гіпоксії.
При внутрішньоклітинних розладах енергетичного обміну доставка поживних речовин і кисню не страждає, а порушується їх використання клітинами.
7 7.2. Назвіть основні причини порушення постачання клітин поживними речовинами.
1. Повна відсутність їжі або дефіцит поживних речовин у ній.
2. Порушення процесів травлення і всмоктування.
3. Порушення мобілізації поживних речовин з депо (наприклад, ураження печінки, розлади нервово-гуморальної регуляції жирового обміну).
4. Порушення транспорту поживних речовин кров'ю (загальні й місцеві розлади кровообігу).
5. Порушення дифузії поживних речовин у тканинах.
6. Втрата поживних речовин або їх використання не за призначенням (протеїнурія, глюкозурія, опікова хвороба, злоякісні пухлини).
17.3. Які порушення хімічного складу крові свідчать про порушення постачання клітин поживними речовинами?
1. Гіпоглікемія - зменшення концентрації глюкози в крові.
2. Гіполіпацидемія й гіполіпопротеїнемія — зменшення вмісту в крові вільних жирових кислот і ліпопротеїнів.
3. Гіпопротеїнемія й гіпоаміноацидемія - зменшення вмісту білків і вільних амінокислот у крові.
17.4. Назвіть причини внутрішньоклітинних порушень енергетичного обміну.
1. Порушення транспорту поживних речовин через клітинну мембрану (наприклад, глюкози при цукровому діабеті).
2. Порушення центральних внутрішньоклітинних катаболічних шляхів.
3. Розлади процесів біологічного окиснення в мітохондріях.
4. Роз'єднання процесів окиснення й фосфорування.
5. Порушення транспорту АТФ із мітохондрій до місць використання.
6. Порушення використання енергії АТФ.
17.5. Порушення яких центральних внутрішньоклітинних катаболічних шляхів можуть призводити до розладів енергозабезпечення клітин?
1. Пригнічення гліколізу.
2. Порушення циклу Кребса.
3. Розлади пентозного циклу.
4. Пригнічення окиснення жирових кислот.
5. Пригнічення процесів дезамінування і окиснення амінокислот.
17.6. Назвіть основні причини порушень центральних катаболічних шляхів у клітинах.
I. Зменшення вмісту вітамінів і вітаміноподібних речовин у клітинах (вітамінна недостатність).
II. Набуте зменшення активності ферментів:
а) зменшення активності окремих молекул ферментів (дія метаболічних отрут);
б) зменшення кількості молекул ферментів (розлади білоксинтетичної функції клітин).
III. Спадково обумовлені ензимопатії. Описано численні генетичні дефекти ферментів гліколізу, пентозного циклу, катаболічних перетворень амінокислот. Нині не відомі які-небудь ензимопатії, безпосередньо пов'язані з циклом Кребса й (3-окис-ненням жирових кислот.
IV. Дефіцит АТФ. АТФ використовується клітиною для активації субстратів, які надходять у центральні катаболічні шляхи (наприклад, фосфорування глюкози й фрук-тозо-6-фосфату, активація жирових кислот). Дефіцит АТФ створює "зачароване коло" — він порушує катаболічні перетворення поживних речовин, що веде до порушення ресинтезу АТФ. Це, у свою чергу, збільшує дефіцит макроергічних сполук.
17.7. Які причини можуть викликати розвиток вітамінної недостатності у клітинах?
Розвиток вітамінної недостатності в клітинах викликають:
а) гіпо- і авітамінози;
б) порушення транспорту вітамінів у клітину;
в) порушення перетворення вітамінів у коферменти;
г) порушення утворення холоферментів — комплексів коферментів з апоферментами.
17.8. Назвіть основні причини порушення біологічного окиснення в мітохондріях клітин.
1. Дефіцит коферментів: НАД, ФМН, убіхінону.
2. Дефіцит мікроелементів: Fe (входить до складу залізо-сірчаних центрів НАДН-дегі-дрогеназного комплексу і цитохромів) і Си (входить до складу цитохромоксидази).
3. Блокада транспорту електронів по дихальному ланцюгу (дія отрут— ротенону, антиміцину А, аміталу, ціанідів, оксиду вуглецю (II), сірководню; рис. 58).

Рис. 58. Блокада транспорту електронів по дихальному ланцюгу
4. Порушення акцепторного контролю дихання (АДФ не контролює швидкість транспорту електронів по дихальному ланцюгу).
17.9. Що таке роз 'єднання окиснення й фосфорування? Які його механізми?
Роз'єднання окиснення й фосфорування — це стан, при якому енергія, що вивільняється в процесі транспорту електронів по дихальному ланцюгу, не здатна акумулюватися в макроергічних зв'язках АТФ і тому виділяється у вигляді теплоти.
Для цього стану характерне зменшення ресинтезу АТФ і збільшення споживання кисню клітинами.
В основі роз'єднання окиснення й фосфорування можуть лежати такі механізми:
а) зменшення градієнта концентрацій іонів водню між матриксом мітохондрій і цитоплазмою;
б) зменшення трансмембранного електричного потенціалу на внутрішній мітохон-дріальній мембрані;
в) порушення АТФ-синтетазного ферментного комплексу;
г) використання енергії градієнта концентрацій іонів водню не на синтез АТФ, а на інші цілі (транспорт іонів кальцію із цитоплазми в мітохондрії, транспорт фосфату, АДФ, АТФ та ін.).
17.10. При порушенні яких біохімічних реакцій зменшується ресинтез АТФ у клітинах?
Утворення АТФ у клітинах зменшується за умов пригнічення: а) гліколітичного (субстратного) фосфорування:
![]()
б) окисного фосфорування в мітохондріях:
![]()
в) креатинкіназної реакції:
![]()
г) аденілаткіназної реакції:
![]()
ґ) нуклеозиддифосфокіназної реакції:
![]()
17.11. Які наслідки для клітини має дефіцит АТФ?
Дефіцит АТФ у клітині призводить до:
1. Порушення механічної роботи - скорочення контрактильних структур клітин. Це виявляє себе розладами елементарних клітинних функцій: скорочення, міграції, екзо- і ендоцитозу, клітинного поділу, руху війок, джгутиків (рис. 59).
2. Порушення осмотичної роботи — процесів активного транспорту іонів. При дефіциті АТФ страждають механізми як первинного, так і вторинного активного транспорту: натрій-калієвий і кальцієвий насоси, натрій-кальцієвий і натрій-водневий обмінні механізми. Це викликає порушення внутрішньоклітинного гомеостазу й ушкодження клітин.
3. Порушення хімічної роботи — біосинтезу речовин. Наслідком цього є порушення самовідновлення й самовідтворення клітин, механізмів їх довгострокової адаптації до дії факторів навколишнього середовища. В остаточному підсумку відбувається повільна загибель клітин.
4. Порушення реакцій клітинного метаболізму.

Рис. 59. Шляхи використання АТФ у клітинах
17.12. Які порушення метаболізму в клітинах можуть бути пов'язані з первинним дефіцитом АТФ?
В умовах дефіциту АТФ порушуються не тільки реакції біосинтезу речовин (анаболізм), але й реакції їх розщеплення (катаболізм).
Це пов'язано з тим, що при дефіциті АТФ безпосередньо порушуються:
а) активація субстратів (фосфорування) і залучення їх у катаболічні шляхи (гліколіз, Р-окиснення);
б) активація багатьох ферментів, здійснювана протешкіназами;
в) утворення циклічного АМФ.
17.13. Наведіть приклади "зачарованих кіл" у розвитку енергодефіцитного стану клітин.
Зменшення вмісту АТФ у клітині призводить до пригнічення функції Са-насосів, внаслідок чого збільшується концентрація іонів кальцію в цитоплазмі. Це викликає роз'єднання окиснення й фосфорування - у результаті дефіцит АТФ зростає (див. розд. 11).
Недостатність АТФ у клітині є причиною порушень її білоксинтетичних функцій. Страждає синтез усіх білків, у тому числі й білків-ферментів. Це веде до порушення катаболічних перетворень поживних речовин у клітині й процесів біологічного окиснення - дефіцит АТФ збільшується (рис. 60).

Рис. 60. Одне з "зачарованих кіл" у розвитку енергодефіцитного стану клітини
17.14. Що таке основний обмін?
Основний обмін — це мінімальні енергетичні витрати організму, визначені ранком у стані повного спокою, натще (через 12-14 год. після останнього прийому їжі), в умовах температурного комфорту (t = 18-20 °С, вологість повітря - 60-80 %, швидкість його руху - 0,1-0,2 м/с).
17.15. Які зовнішні і внутрішні фактори впливають на величину основного обміну?
Зовнішні фактори:
а) кліматичні умови;
б) час доби;
в) висота над рівнем моря;
г) характер харчування; ґ) характер виробничої діяльності.
Внутрішні фактори:
а) ріст і маса тіла;
б) площа поверхні тіла;
в) вік;
г) стать.
17.16. Наведіть приклади збільшення і зменшення основного обміну в умовах патології.
Збільшення основного обміну характерне для гіперфункції щитоподібної залози, аденогіпофіза, статевих залоз.
Зменшення основного обміну реєструють при гіпофункції щитоподібної залози, аденогіпофіза, статевих залоз; при хронічній недостатності кори надниркових залоз, при голодуванні.
18с Голодування
18.1. Дайте визначення поняття "голодування".
Голодування - це типовий патологічний процес, що виникає внаслідок повної відсутності їжі або недостатнього надходження в організм поживних речовин, а також в умовах різкого порушення складу їжі та її засвоєння.
-J v- , •'
18.2. Як класифікують голодування?
За походженням виділяють фізіологічне, патологічне і лікувальне голодування. Фізіологічне голодування характерне для деяких видів тварин під час зимової (бабаки, ховрашки) або літньої сплячки (плазуни).
Залежно від змісту виділяють такі види голодування.
1. Повне голодування:
а) із уживанням води;
б) без уживання води (абсолютне).
2. Неповне голодування (недоїдання).
3. Часткове голодування (якісне).
18.3. На які періоди поділяють патогенез повного голодування із уживанням води?
I. Період неекономного витрачання енергії.
II. Період максимального пристосування.
III. Термінальний період.
18.4. Чим характеризується період неекономного витрачання енергії?
Його тривалість— 2-4 доби. Характерне сильне відчуття голоду, обумовлене збудженням харчового центру. При повному голодуванні воно триває до 5-ти діб, а потім зникає. Відбувається швидке падіння маси тіла (схуднення). Основним джерелом енергії у цей період є вуглеводи, про що свідчить дихальний коефіцієнт, який дорівнює 1,0. Виникає гіпоглікемія, яка збільшує секрецію глюкокортикоїдів корою надниркових залоз. Наслідком цього є посилення катаболізму білків у периферичних тканинах, зокрема м'язовій, і активація глюконеогенезу в печінці.
Основний обмін спочатку трохи збільшується, а потім поступово зменшується і стає на 10—20 % менше вихідного. Розвивається негативний азотистий баланс.
18.5. Що характерно для другого періоду голодування - періоду максимального пристосування?
Середня його тривалість — 40-50 діб. Темпи зменшення маси тіла уповільнюються і становлять 0,5-1 % на добу. Відчуття голоду зникає. Основним джерелом енергії є жири, про що свідчить дихальний коефіцієнт, який дорівнює 0,7.
Гіпоглікемія збільшує надходження в кров ліполітичних гормонів (адреналіну, глюкокортикоїдів, глюкагону). Унаслідок цього відбувається мобілізація жиру з депо — розвивається гіперліпацидемія. Вона, у свою чергу, є причиною посиленого утворення кетонових тіл у печінці. Кетонемія, що виникає, може призводити до не-газового ацидозу.
Основний обмін у цей період на 10-20 % нижче вихідного рівня. Азотистий баланс негативний.
18.6. Як втрачають масу різні органи і тканини в другому періоді голодування?
Втрата маси в другому періоді голодування становить: жирова тканина — 97 %,' селезінка — 60 %, печінка — 54 %, сім'яники — 40 %, м'язи - 31 %, кров - 26 %, нирки - 26 %, нервова система - 4 %, серце - 3,6 %.
18.7. Дайте характеристику третього періоду голодування.
Цей період називають термінальним, тому що він передує смерті. Його тривалість 2—3 доби. Відбувається інтенсивний розпад тканин, розвивається інтоксикація. Основним джерелом енергії є білки, про що свідчить дихальний коефіцієнт, який дорівнює 0,8. Збільшується виділення із сечею азоту, калію, фосфатів (ознаки деструкції клітин і тканинних білків).
Смерть настає при зменшенні маси тіла до 50 % від вихідної.
18.8. Які фактори визначають максимально можливу тривалість повного голодування із уживанням води?
І. Ендогенні фактори:
а) вид тварини-
б) вік;
в) стать;
г) кількість і якість жирових та білкових резервів організму; ґ) загальний функціональний стан організму;
д) м'язова робота.
Усі зазначені чинники впливають на тривалість голодування, змінюючи величину основного обміну. Що вищий рівень основного обміну, то менша тривалість голодування, і навпаки. її. Екзогенні фактори. Це чинники зовнішнього середовища, які збільшують енер-говитрати організму. Такими є:
а) низька температура навколишнього середовища;
б) висока вологість повітря;
в) велика швидкість руху повітря.
18.9. Як розрахувати максимально можливу тривалість повного голодування із вживанням води?
Для такого розрахунку слід пам'ятати, що, по-перше, дорослий організм гине при втраті 50 % вихідної маси тіла й, по-друге, втрата маси в другому, самому тривалому періоді голодування становить 0,5—1 % на добу.
Так, якщо вихідна маса тіла дорівнює 70 кг, то смерть настає при втраті 35 кг. За умови, що кожної доби втрачається 0,5 % вихідної маси (0,35 кг), максимально можлива тривалість другого періоду, а отже й голодування в цілому, становить 100 днів.
18.10. Що таке абсолютне голодування? У чому його особливість?
Абсолютним називають повне голодування без уживання води. Його тривалість у 2-3 рази менша, ніж тривалість повного голодування з водою.
При абсолютному голодуванні відбувається посилене розщеплення жирів для утворення ендогенної (оксидаційної) води, у результаті чого швидко розвивається кетонемія і негазовш ацидоз. Важкість протікання абсолютного голодування обумовлена також накопиченням великої кількості кінцевих продуктів обміну й інших токсичних продуктів, для виведення яких з організму потрібна вода.
18.11. Назвіть особливості неповного голодування.
Неповне голодування (енергетична недостатність) розвивається, коли енергетична цінність їжі не задовольняє енергетичні потреби організму.
Неповне голодування від повного відрізняється такими особливостями:
1) тривалістю (неповне голодування може тривати місяці, роки);
2) більш вираженими деструктивними змінами в тканинах;
3) значно більшим зменшення основного обміну (на 30—40 %);
4) розвитком виражених набряків унаслідок зменшення вмісту білків у плазмі крові;
5) великого падіння маси тіла не відбувається через затримку рідини в організмі;
6) відновити життєдіяльність систем організму після неповного голодування набагато складніше.
18.12. Що таке білково-енергетична недостатність? Наведіть приклади.
Білково-енергетична недостатність — це стан, що виникає як результат поєднання неповного і якісного білкового голодування. Прикладами є:
а) аліментарна дистрофія. Описана в Ленінграді під час облоги в роки другої світової війни. У її патогенезі, крім білкової й енергетичної недостатності, мають значення й додаткові чинники: холод, фізичне стомлення, нервово-психічна напруга;
б) аліментарний маразм. Розвивається в дітей віком до одного року. На перше місце виступає енергетична недостатність;
в) квашіоркор. Розвивається в дітей віком 3-6 років. Головним у патогенезі є білкова недостатність. Енергетичний дефіцит компенсується надлишковим споживанням вуглеводів.
18.13. Якими клінічними синдромами виявляє себе білково-енергетична недостатність?
І. Недостатнє надходження в організм білків призводить до порушення білоксин-тетичної функції печінки. Це є причиною гіпопротеїнемії, що, у свою чергу, обумовлює розвиток онкотичних набряків.
II. Енергетична недостатність є причиною зменшення основного обміну. Це виявляється зниженням температури тіла (гіпотермією).
III. Атрофічні синдроми. їх розвиток пов'язаний з порушеннями пластичного й енергетичного забезпечення клітин.
18.14. Якими порушеннями фізіологічних функцій виявляють себе атрофічні зміни в органах і тканинах при білково-енергетичній недостатності?
Атрофічні зміни розвиваються у всіх тканинах, органах і системах організму.
Проявом атрофічних змін у ЦНС є уповільнення розумового розвитку, у травній системі - розлади всмоктування і діарея, у серцево-судинній системі — гіпотензія, в імунній системі — зменшення синтезу антитіл і підвищення чутливості до інфекцій, у червоному кістковому мозку — розвиток анемії, у скелетних м'язах — гіподинамія та м'язова слабкість, у кістках — затримка росту скелета.
18.15. Що таке часткове (якісне) голодування? Назвіть його види.
Частковим (якісним) голодуванням називають недостатнє надходження з їжею одної або кількох поживних речовин при нормальній енергетичній цінності їжі.
Видами часткового голодування є білкове, жирове, вуглеводне, вітамінне, мінеральне, водне голодування.
19о Гіпоксія
19.1. Дайте визначення поняття "гіпоксія".
Гіпоксія (кисневе голодування) — це типовий патологічний процес, що виникає внаслідок недостатнього постачання тканин киснем або в результаті порушення його використання клітинами.'
19.2. Як класифікують кисневе голодування?
I. Етіологічна класифікація:
а) гіпоксична (екзогенна);
б) дихальна (респіраторна);
в) серцево-судинна (циркуляторна);
г) кров'яна (гемічна); ґ) тканинна (гістотоксична) гіпоксія.
II. За темпами розвитку і тривалістю виділяють:
а) блискавичну;
б) гостру;
в) підгостру;
г) хронічну гіпоксію Ні. Залежно від поширеності процесу гіпоксія може бути загальною і місцевою.
19.3. У яких біохімічних процесах, що відбуваються в організмі, використовується кисень?
I. Тканинне (клітинне) дихання. Здійснюється в мітохондріях клітин за участю дегідрогеназ та інших компонентів дихального ланцюга, що забезпечують транспорт електронів від субстрату на кисень. Основна функція клітинного дихання - вивільнення енергії поживних речовин і акумулювання її в макроергічних зв'язках АТФ (окисне фосфорування).
На ці процеси клітинами використовується не менше 90 % кисню, що поглинається.
II. Мікросомне окиснення. Здійснюється в ендоплазматичному ретикулумі клітин. Особливо інтенсивно проходить у печінці та деяких ендокринних залозах (надниркових, статевих).
Каталізаторами мікросомного окиснення є ферменти оксигенази, які приєднують кисень безпосередньо до субстрату. Залежно від кількості атомів кисню, який приєднується, розрізняють монооксигенази і діоксигенази. Перші забезпечують реакції гідроксилювання (утворення стероїдних гормонів, перетворення проліну в оксипролін), другі - реакції детоксикації в печінці.
III. Пероксидгенеруючі реакції. Здійснюються в пероксисомах, а також у гранулах нейтрофілів і макрофагів. їхніми каталізаторами є ферменти оксидази, що забез-
печують утворення пдропероксидш цілого ряду сполук і пероксиду водню. Зазначені процеси мають значення в катаболізмі деяких сполук (амінокислот, пуринів), а в лейкоцитах є одним з механізмів бактерицидності. IV. Пероксидне окиснсння ліпідів (див. розд. 11). У нормі інтенсивність цього процесу незначна. Він істотно активується при ушкодженні клітин.
19.4. Які механізми можуть лежати в основі зменшення напруги кисню в тканинах?
1. Зменшення доставки кисню кров'ю.
2. Порушення дифузії кисню від кровоносних капілярів до клітин.
3. Посилене використання кисню клітинами.
19.5. Назвіть причини зменшення доставки кисню кров'ю.
![]()
де С. — вміст кисню в артеріальній крові; Q — об'ємна швидкість течії крові. Причинами порушення доставки кисню кров'ю можуть бути:
а) зменшення вмісту кисню в артеріальній крові;
б) зменшення об'ємної швидкості течії крові в тканині (порушення кровопостачання);
в) зменшення віддачі кисню гемоглобіном (зменшення дисоціації оксигемоглобіну).
19.6. Чим може бути обумовлене зменшення вмісту кисню в артеріальній крові?
![]()
де - Ск - вміст кисню в артеріальній крові; [НЬ] - концентрація гемоглобіну в крові; S — насичення гемоглобіну киснем; 1,34 - число Хюфнера.
Причиною зменшення вмісту кисню в артеріальній крові можуть бути:
а) зменшення концентрації гемоглобіну, здатного зв'язувати кисень (зменшення кисневої ємності крові). Це може бути обумовлено або анемією (зменшується загальний вміст гемоглобіну), або інактивацією гемоглобіну;
б) зменшення насичення гемоглобіну киснем. Закономірно виникає при зменшенні напруги кисню в артеріальній крові нижче 60 мм рт. ст.
19.7. Які зміни можуть зменшувати об'ємну швидкість течії крові в тканинах і призводити до гіпоксії?
Оскільки
![]()
де Q — об'ємна швидкість течії крові; Ра — артеріальний тиск на початку, а Рвсн — венозний тиск наприкінці перфузованої ділянки; (Р т — Р ) перфузійний тиск; R — гемодинамічний опір, то зменшення кровопостачання тканин може бути обумовлене такими групами причин.
І. Зменшення перфузійного тиску в судинах органа або тканини:
а) зменшення артеріального тиску;
б) збільшення венозного тиску.
IJ. Збільшення гемодинамічного опору судин даної ділянки:
а) звуження судин;
б) підвищення в'язкості крові.
19.8. Які фактори викликають зміщення кривої дисоціації оксигемоглобіну?
Крива дисоціації оксигемоглобіну відображує залежність між напругою кисню в артеріальній крові і насиченням гемоглобіну киснем (рис. 61).
Рис. 61. Крива дисоціації оксигемоглобіну
Зміщення цієї кривої вліво відбувається при:
а) зниженні температури;
б) алкалозі;
в) гіпокапнії;
г) зменшенні в еритроцитах вмісту 2,3-дифос- -фогліцерату;
ґ) отруєннях оксидом вуглецю (II);
д) появі спадково обумовлених патологічних форм гемоглобіну, які не віддають кисень тканинам.
При зміщенні кривої вліво гемоглобін легше приєднує кисень у капілярах легень, але гірше віддає його тканинам.
Причиною зміщення кривої дисоціації оксигемоглобіну вправо можуть бути:
а) підвищення температури;
б) ацидоз;
в) гіперкапнія;
г) збільшення вмісту в еритроцитах 2,3-дифосфогліцерату.
Вплив ацидозу і гіперкапнії на дисоціацію оксигемоглобіну відомий як ефект Бора.
При зміщенні кривої вправо гемоглобін гірше приєднує кисень у капілярах легень, але краще віддає його тканинам. З цим, зокрема, пов'язане захисно-компенсаторне значення ефекту Бора при кисневому голодуванні.
19.9. Які фактори зумовлюють порушення дифузії кисню в тканинах? Відповідно до закону Фіка
![]()
де m — кількість газу, що дифундує (дифузійний потік); k — коефіцієнт дифузії; S - загальна площа поверхні, через яку здійснюється дифузія; 1 - відстань дифузії; (Pj —Р2) — різниця між напругою О, у капілярах і клітинах.
Звідси випливає, що причинами порушення дифузії кисню в тканинах можуть бути:
1) зменшення коефіцієнта дифузії кисню (наприклад, при відкладеннях у тканині ліпідів, гіаліну, амілоїду, солей кальцію);
2) зменшення загальної площі поверхні кровоносних капілярів при зменшенні їхньої кількості;
3) збільшення дифузійної відстані (наприклад, при набряку);
4) зменшення напруги кисню в капілярах;
5) збільшення напруги кисню в клітинах.
19.10. Що таке гіпоксія навантаження?
Гіпоксія навантаження — це кисневе голодування, що виникає при збільшенні функціонального навантаження. Воно пов'язане з посиленим використанням кисню клітинами. При цьому доставка кисню тканинам може навіть зростати.
Якщо все-таки доставка кисню не покриває його посиленого використання клітинами, напруга кисню в тканинах падає й розвивається гіпоксія.
19.11. Що таке гіпоксична гіпоксія? Коли вона виникає?
Тіпоксичною (екзогенною) називають гіпоксію, причиною якої є зменшення парціального тиску кисню у вдихуваному повітрі.
Гіпоксична гіпоксія може наставати при: а) зниженні атмосферного тиску (при підніманні на висоту в гори);
6) зменшенні вмісту кисню у вдихуваному повітрі (робота в шахтах, несправність систем кисневого забезпечення в літальних апаратах, на підводних човнах, у скафандрах).
19.12. Назвіть патогенетичні фактори розвитку гірської хвороби.
Гірська хвороба виникає при підніманні неадаптованого організму в гори. Вона являє приклад підгострої і хронічної гіпоксії.
Провідне значення в патогенезі гірської хвороби має зменшення парціального тиску кисню у вдихуваному повітрі (гіпоксична гіпоксія).
Крім того, при підніманні в гори патогенну дію чинять й інші фактори, зокрема, зменшення власне атмосферного тиску (синдром декомпресії), сонячна радіація, зниження температури зовнішнього середовища, сухість вдихуваного повітря, збільшення фізичного навантаження.
19.13. Які зони виділяють при підніманні в гори з урахуванням ознак гіпоксії, що розвивається?
I. Нейтральна зона (висота від 0 до 2000 м над рівнем моря). Функції організму не страждають.
II. Зона повної компенсації (висота від 2000 до 4000 м над рівнем моря). Відзначається збільшення частоти пульсу, дихання, підвищення артеріального тиску. У той же час зменшується фізична й розумова працездатність, розвивається ейфорія, порушується тонка координація рухів, послаблюється увага.
III. Зона неповної компенсації (висота від 4000 до 6000 м над рівнем моря). Розвиваються важкі, але оборотні зміни. Тахікардія змінюється брадикардією, падає артеріальний тиск, дихання стає частим і поверхневим, іноді розвивається дихання Чейна-Стокса, характерні сонливість, млявість, нудота.
IV. Критична зона (понад 7000 м над рівнем моря). Розвиваються необоротні зміни. Артеріальний тиск падає до 0, пульс стає ниткоподібним, з'являється термінальне дихання, людина непритомніє, розвиваються судоми й настає смерть.
19.14. Що таке висотна хвороба?
Висотна хвороба - це гостра або блискавична форма гіпоксичної гіпоксії, що виникає під час висотних польотів у літальних апаратах з кабінами відкритого типу або при порушенні герметичності кабін закритого типу.
19.15. Які зміни показників газового стану крові характерні для гіпоксичної гіпоксії?
Зменшення р02 і рС02 артеріальної крові, розвиток газового алкалозу.
19.16. Що таке дихальна гіпоксія?
Дихальна гіпоксія - це кисневе голодування, причиною якого є недостатність зовнішнього дихання. Причини її розвитку див. розд. 29.
19.17. Які зміни показників газового стану крові характерні для дихальної гіпоксії?
Зменшення р02 і збільшення рС02 артеріальної крові, розвиток газового ацидозу.:
19.18. Що таке циркуляторна гіпоксія?
Циркуляторна гіпоксія — це кисневе голодування, причиною якого є розлади загальної гемодинаміки або порушення місцевого кровообігу.
В основі порушень системного кровообігу можуть лежати недостатність серця й недостатність судин (шок, колапс).
До місцевої гіпоксії призводять ішемія, тромбоз, емболія, венозна гіперемія.
Залежно від механізмів розвитку деякі автори виділяють дві форми циркулятор-ної гіпоксії: ішемічну і застійну.
19.19. Які зміни показників газового стану крові характерні для циркуляторної гіпоксії?
Збільшення артеріовенозної різниці за киснем за рахунок повнішого вилучення його з артеріальної крові.
19.20. Що таке кров'яна (гемічна) гіпоксія? Назвіть її види.
Кров 'яна (гемічна) гіпоксія — це кисневе голодування, що виникає внаслідок зменшення кисневої ємності крові.
Виділяють дві форми кров'яної гіпоксії:
а) анемічну — виникає як наслідок анемії (див. розд. 26);
б) гіпоксію, пов'язану з інактивацією гемоглобіну.
19.21. Назвіть форми інактивованого гемоглобіну.
1. Карбоксигемоглобін - продукт взаємодії гемоглобіну з оксидом вуглецю (II) (чадним газом, CO).
2. Метгемоглобін — гемоглобін, у якому залізо перебуває в окисненому, тривалентному стані.
3. Сульфгемоглобін — сполука гемоглобіну із сірководнем.
19.22. Які механізми обумовлюють розвиток порушень в організмі при отруєнні оксидом вуглецю (II)?
У патогенезі порушень, спричинюваних оксидом вуглецю (II), мають значення такі фактори: |< -*•
а) інактивація гемоглобіну, що зменшує кисневу ємність крові, — розвивається кров 'яна гіпоксія;
б) зміщення кривої дисоціації оксигемоглобіну вліво - навіть той гемоглобін, що не зазнав інактивації, погано віддає кисень тканинам;
в) зв'язування оксиду вуглецю (II) із залізом інших білків, що містять у собі гем, зокрема цитохромів — розвивається тканинна гіпоксія.
19.23. Які фактори можуть бути причиною утворення метгемоглобіну, а отже й розвитку кров'яної гіпоксії?
Причини утворення метгемоглобіну:
1) екзогенніречовши-окислювачі (метгемоглобіноутворювачі). До них відносять:
а) нітросполуки (оксид азоту (II), нітрити, нітрати);
б) аміносполуки (анілін, фенілгідразин);
в) окислювачі (хлорати, перманганати, хінони);
г) окисно-відновні барвники (метиленовий синій у високих концентраціях); ґ) лікарські препарати (нітрогліцерин, амілнітрит, сульфаніламіди, барбітурати);
2) недостатність антиоксидантних систем еритроцитів, що відновлюють метгемоглобін. Це спостерігається при порушеннях пентозного циклу і глютатіон-редуктази. Описано генетично обумовлений дефект ферменту - НАДФ-залежної метгемоглобінредуктази.
19.24. Які зміни показників газового стану крові характерні для кров 'яної гіпоксії?
Зменшення кисневої ємності крові.
19.25. Що таке тканинна гіпоксія?
Тканинна гіпоксія — це кисневе голодування, що виникає в результаті порушення утилізації кисню клітинами.
В її основі лежать два типи порушень:
а) пригнічення біологічного окиснення;
б) роз'єднання окиснення й фосфорування (див. розд. 17).
19.26. Які зміни показників газового стану крові характерні для тканинної гіпоксії?
Зменшення артеріовенозної різниці за киснем і збільшення рО, венозної крові.
19.27. Дайте порівняльну характеристику основних показників газового стану крові при різних видах гіпоксії.

р02 — напруга кисню в артеріальній крові; рС02 — напруга вуглекислого газу в артеріальній крові; AV-різниця — артеріовенозна різниця за киснем; КЄК — киснева ємність крові; КОС — кислотно-основний стан.
19.28. На які групи можна поділити всі захисно-компенсаторні реакції, що виникають при гіпоксії?
I. Реакції, спрямовані на збільшення доставки кисню кров 'ю.
II. Місцеві (тканинні) реакції, спрямовані на поліпшення забезпечення клітин киснем.
III. Реакції в системах утилізації кисню.
19.29. Назвіть захисно-компенсаторні реакції організму, спрямовані на збільшення доставки кисню тканинам.
1. Реакції зовнішнього дихання. Спрямовані на збільшення р02 артеріальної крові, тому можуть бути ефективними тільки при гіпоксичній і дихальній гіпоксії. Вони виявляють себе:
а) збільшенням глибини дихання;
б) збільшенням частоти дихання;
в) мобілізацією резервних альвеол.
Комплекс зазначених змін отримав назву гіпервенпгиляції.
2. Реакції системи кровообігу. Спрямовані на збільшення кровопостачання тканин і є ефективними при всіх видах гіпоксії, крім тканинної. До цих реакцій відносять:
а) збільшення хвилинного об'єму крові за рахунок збільшення сили й частоти серцевих скорочень;
б) підвищення артеріального тиску;
в) перерозподіл течії крові - зменшення кровообігу в шкірі, скелетних м'язах, органах черевної порожнини і збільшення — у серці й головному мозку.
3. Реакції системи крові. Спрямовані на збільшення кисневої ємності крові і виявляють себе збільшенням кількості еритроцитів та концентрації гемоглобіну в периферичній крові. Це досягається за рахунок:
а) виходу додаткової кількості еритроцитів з депо;
б) активації еритропоезу (при гіпоксії посилюється утворення ниркових ери-тропоетинів).
Крім того, захисне значення має зміщення кривої дисоціації оксигемоглобіну вправо — ефект Бора (див. запит. 19.8).
19.30. Які небажані наслідки може мати гіпервентиляція при гіпоксичній гіпоксії?
Гіпервентиляція, що виникає, веде до зменшення рС02 артеріальної крові - гіпо-капнії. Це має ряд негативних наслідків:
а) відбувається пригнічення дихального центру;
б) розвивається газовий алкалоз;
в) настає спазм мозкових і вінцевих судин;
г) крива дисоціації оксигемоглобіну зміщується вліво - кров погано віддає кисень тканинам.
19.31. Назвіть місцеві (тканинні) реакції, спрямовані на поліпшення забезпечення клітин киснем в умовах гіпоксії.
1. Посилення місцевого кровообігу — артеріальна гіперемія. Розвивається як наслідок безпосереднього впливу зменшення р02 на гладкі м'язи судин і дії на судини вазо-активних метаболітів (аденозину, молочної кислоти, іонів калію й водню та ін.)
2. Збільшення кількості капілярів, що функціонують. У результаті зменшується відстань дифузії кисню і збільшується загальна площа дифузійної поверхні.
3. Підвищення вмісту в клітинах міоглобіну, який у м'язах є внутрішньоклітинним депо кисню.
19.32. Назвіть захисно-компенсаторні реакції в системах утилізації кисню при гіпоксії.
1. Зниження функціональної активності клітин, унаслідок чого зменшується їхня потреба в кисні.
2. Збільшення кількості дихальних ферментів і мітохондрій у клітинах.
3. Збільшення спорідненості цитохромоксидази з киснем.
4. Підвищення ступеня спряженості окиснення й фосфорування до максимально можливої величини, що дорівнює 3.
5. Активація гліколізу.
19.33. При яких значеннях напруги кисню в тканинах починає зменшуватися утворення АТФ у клітинах?
При зменшенні р02 у тканинах нижче ЗО мм рт. ст. знижується інтенсивність споживання кисню клітинами, а отже, падає інтенсивність утворення АТФ.
"Критична" напруга 02 в мітохондріях - 0,1—1 мм рт. ст. При зменшенні рО, нижче цієї величини цитохромоксидаза не здатна передавати електрони на кисень — тканинне дихання повністю припиняється.
19.34. Які механізми складають основу гіпоксичного ушкодження клітин?
І. Гіпоксія, викликаючи дефіцит АТФ у клітинах, призводить до порушення роботи іонних насосів. Наслідком цього є збільшення концентрації іонів кальцію й на-
трію в цитоплазмі, що започатковує кальцієві й електролітно-осмотичні механізми ушкодження клітини (див. розд. 11).
II. При гіпоксії відбувається активація анаеробного гліколізу. Це призводить до накопичення молочної кислоти й розвитку внутрішньоклітинного ацидозу. Як наслідок, вмикаються ацидотичні механізми ушкодження клітини (див. розд. 11).
III. При значному дефіциті кисню компоненти дихального ланцюга перебувають у відновленому стані. Вони "скидають" свої електрони безпосередньо на молекули кисню, що залишився, обминаючи дихальний ланцюг. Це веде до одноелектронно-го відновлення кисню й утворення супероксидних радикалів - активуються реакції вільнорадикального окиснення. Результатом є ініціація пероксидного окиснення ліпідів (ПОЛ) і реалізація "ліпідноїтріади" ушкодження клітин (див. розд. 11).
19.35. Від яких факторів залежить чутливість клітин до гіпоксії?
Існує закономірність: що вища інтенсивність споживання кисню клітинами, то вища їхня чутливість до кисневого голодування.
Оскільки споживання кисню визначається енергетичними потребами, а останні — функціональною активністю клітин, стає зрозумілим, чому головний мозок, серце, печінка, нирки дуже чутливі, а кістки, хрящі, сухожилля резистентні до гіпоксії.
Крім того, чутливість до гіпоксії залежить від швидкості окисних процесів в організмі й від температури тіла. При зменшенні температури чутливість тканин до кисневого голодування падає. Цю обставину використовують у медицині при проведенні тривалих операцій на серці (штучна гіпотермія).
7 9.36. Які періоди характерні для гострої гіпоксії клітин?
I. Латентний період. Триває кілька секунд. Клітини функціонують нормально.
II. Період порушення функцій. Триває до повного припинення функцій органа, тканини.
III. Період оживлення. Охоплює час від моменту повного припинення функції до початку розвитку необоротних структурних змін.
IV. Період необоротного ушкодження клітин. Триває до загибелі клітин.
і9.37. Яка динаміка змін у ЦНС при гострій гіпоксії?
Головний мозок є "критичним органом" при гострій гіпоксії. Це означає, що гі-поксичне ушкодження структур ЦНС, розвиваючись дуже швидко, призводить до смерті організму, незважаючи на те, що інші органи й тканини ще якийсь час зберігають свою життєздатність.
Латентний період гострої гіпоксії для ЦНС становить 4 с. Через 8-12 с. після повного припинення постачання головного мозку киснем функції ЦНС припиняються і людина непритомніє. Через 20-30 с. зникає спонтанна електрична активність кори головного мозку (на електроенцефалограмі - ізоелектрична лінія). Межа оживлення головного мозку становить 8-10 хв. У той же час межа оживлення організму в цілому - 4-5 хв. після зупинки серця. Це пояснюється тим, що після відновлення роботи серця необхідно ще 4-5 хв., щоб створити артеріальний тиск, достатній для кровопостачання мозку.
20o Порушення вуглеводного обміну
20.1. Назвіть основні причини порушень вуглеводного обміну.
1. Порушення перетравлювання вуглеводів та їх усмоктування в кишках (див. розд. ЗО).
2. Порушення вуглеводної функції печінки (див. розд. 31).
3. Порушення катаболізму глюкози в периферичних клітинах (див. розд. 17).
4. Порушення нейрогормональної регуляції вуглеводного обміну.
20.2. Які гормони беруть участь у регуляції вуглеводного обміну?
Гормони, що беруть участь у регуляції вуглеводного обміну, поділяють на дві групи: інсулін і контрінсулярні гормони.
Контрінсулярними називають гормони, які за своїми біологічними ефектами є антагоністами інсуліну. До них належать адреналін, глюкагон, глюкокортикоїди, соматотропний гормон.
20.3. На які органи і тканини діє інсулін?
Залежно від чутливості до інсуліну всі структури організму поділяють на три групи.
I. Абсолютно залежні від інсуліну. Такими є печінка, м'язи (скелетні, міокард), жирова тканина.
II. Абсолютно нечутливі. Це головний мозок, мозкова речовина надниркових залоз, еритроцити, сім'яники.
III. Відносно чутливі (всі інші органи й тканини).
20.4. Назвіть основні біологічні ефекти інсуліну.
1. Гіпоглікемична дія. Інсулін зменшує вміст глюкози в крові за рахунок:
а) пригнічення процесів, що забезпечують вихід глюкози з печінки в кров (глі-когенолізу і глюконеогенезу);
б) посиленого використання глюкози інсулінозалежними тканинами (м'язовою, жировою).
2. Анаболічна дія. Інсулін стимулює ліпогенез у жировій тканині, глікогенез у печінці і біосинтез білків у м'язах.
3. Мітогенна дія. У великих дозах інсулін стимулює проліферацію клітин in vitro та in vivo.
Залежно від швидкості виникнення ефекти інсуліну поділяють на:
а) дуже швидкі (виникають протягом секунд) - зміна мембранного транспорту глюкози, іонів;
б) швидкі (тривають хвилини) — алостерична активація анаболічних ферментів і пригнічення ферментів катаболізму;
0:#:«
в) повільні (тривають від кількох хвилин до кількох годин) - індукція синтезу анаболічних ферментів і репресія синтезу ферментів катаболізму;
г) дуже повільні (від кількох годин до кількох діб) — мітогенна дія.
20,5. Які зміни вуглеводного обміну викликає адреналін?
Під впливом адреналіну збільшується вміст глюкози в крові. В основі цього ефекту лежать такі механізми:
а) активація глікогенолізу в печінці. Вона пов'язана з активацією аденілатциклазної системи гепатоцитів і утворенням, в кінцевому підсумку, активної форми фосфорилази;
б) активація глікогенолізу в м'язах з наступною активацією глюконеогенезу в печінці. При цьому молочна кислота, що вивільняється з* м'язової тканини в кров, іде на утворення глюкози в гепатоцитах (рис. 62);
в) пригнічення поглинання глюкози інсулінозалежними тканинами з одночасною активацією ліпрлізу в жировій тканині;
г) пригнічення секреції інсуліну β-клітинами і стимуляція секреції глюкагону а-клі-тинами острівців підшлункової залози.

Рис. 62. Один з механізмів гіперглікемічної дії адреналіну
20.6. Які механізми лежать в основі гіперглікемічної дії глюкагону?
1. Активація глікогенолізу в печінці.
2. Активація глюконеогенезу в гепатоцитах.
Обидва механізми є цАМФ-опосередкованими.
20.7. Яким чином глюкокортикоїди підвищують рівень глюкози в крові?
Глюкокортикоїди активують процеси глюконеогенезу в печінці, збільшуючи:
а) синтез відповідних ферментів (вплив на транскрипцію);
б) вміст у крові субстратів глюконеогенезу — амінокислот — за рахунок посилення протеолізу в м'язах.
Крім того, глюкокортикоїди зменшують поглинання глюкози інсулінозалежними тканинами.
20.8. Чому при дії великих доз соматотропного гормону підвищується вміст глюкози в крові?
Тривалий вплив великих доз соматотропного гормону супроводжується розвитком інсулінорезистентності м'язів і жирової тканини — вони стають нечутливими до дії інсуліну. Результат цього — гіперглікемія.
20.9. Яка тривалість гіперглікемічного ефекту контрінсулярних гормонів?
Гіперглікемічна дія адреналіну триває до 10 хв, глюкагону—3 0-60 хв, глюкокортико-ї'дів — від кількох годин до кількох діб, соматотропного гормону—тижні, місяці, роки.
20.10. Як змінюється вміст глюкози в крові при порушенні балансу між інсуліном і контрінсулярними гормонами?
При збільшенні вмісту інсуліну розвивається гіпоглікемія, а при зменшенні його концентрації - гіперглікемія.
При збільшенні вмісту контрінсулярних гормонів розвивається гіперглікемія, а . при зменшенні їх концентрації - гіпоглікемія.
20.11. Як здійснюється нервова регуляція вуглеводного обміну?
Існує ряд доказів того, що нервова система бере участь у регуляції вмісту глюкози в крові.
Так, Клод Бернар уперше показав, що укол у дно IV шлуночка спричиняється до гіперглікемії ("іскровийукол"). Збільшення концентрації глюкози крові може виникати внаслідок подразнення сірого горба гіпоталамуса, сочевицеподібного ядра і смугастого тіла базальних ядер великого мозку. Кеннон спостерігав, що психічне перенапруження, емоції можуть підвищувати рівень глюкози в крові. Гіперглікемія виникає також при больових відчуттях, під час нападів епілепсії і т. д.
Нині доведено, що вплив нервової системи на рівень глюкози крові опосередковується гормонами. Можливі такі варіанти:
1) ЦНС → симпатична нервова система → мозкова речовина надниркових залоз → адреналін → гіперглікемія (укол К. Бернара);
2) ЦНС →• парасимпатична нервова система → острівці підшлункової залози → інсулін і глюкагон;
3) ЦНС → симпатична нервова система → мозкова речовина надниркових залоз → адреналін → Β-клітини острівців підшлункової залози → пригнічення секреції інсуліну;
4) ЦНС щ гіпоталамус → аденогіпофіз кі АКТГ → глюкокортикоїди → гіперглікемія.
20.12. Дайте визначення поняття "гіпоглікемія".
Гіпоглікемія - це зменшення концентрації глюкози в плазмі крові до рівня, який обумовлює появу клінічних симптомів, що зникають після нормалізації вмісту цієї речовини.
Ознаки гіпоглікемії виникають, як правило, при зменшенні вмісту глюкози нижче 4 ммоль/л.
20.13. Які механізми можуть лежати в основі розвитку гіпоглікемії?
1. Зменшення надходження глюкози в кров. Це буває при голодуванні, порушеннях травлення (недостатність амілолітичних ферментів, розлади всмоктування), при спадкових і набутих порушеннях глікогенолізу і глюконеогенезу в печінці.
2. Посилене використання глюкози на енергетичні потреби організму (наприклад, важка фізична робота).
3. Втрата глюкози (глюкозурія) або використання її не за призначенням (злоякісні пухлини).
20.14. Якими клінічними ознаками виявляє себе гіпоглікемія? Що таке гіпоглікемічна кома?
Клінічні ознаки гіпоглікемії пов'язані з двома групами порушень в організмі.
I. Порушення постачання глюкозою тканин головного мозку. Залежно від ступеня гіпоглікемії розвиваються такі симптоми, як головний біль, неможливість зосередитися, стомлюваність, неадекватна поведінка, галюцинації, суцоми, гіпоглікемічна кома.
II. Активація симпатоадреналової системи. Цим обумовлені серцебиття, посилене потовиділення, тремтіння, почуття голоду.
Гіпоглікемічна кома є найтяжчим проявом гіпоглікемії, і якщо вчасно не надати допомогу (введення глюкози), призводить до смерті. Вона характеризується втратою свідомості, зникненням рефлексів, порушеннями життєво важливих функцій (див. розд. 12).
20.15. Що таке гіперглікемія?
Гіперглікемія — це збільшення вмісту глюкози в плазмі крові (понад 6,66 ммоль/л при визначенні методом Хагедорна - Йєнсена).
20.16. Які механізми можуть лежати в основі гіперглікемії?
1. Збільшення надходження глюкози в кров. Це буває після приймання їжі (аліментарна гіперглікемія), при посиленні глікогенолізу й глюконеогенезу в печінці (зменшення вмісту інсуліну або збільшення концентрації контрінсулярних гормонів).
2. Порушення використання глюкози периферичними тканинами.
Так, при зменшенні вмісту інсуліну порушується надходження й утилізація глюкози в інсулінозалежних тканинах (м'язах, жировій тканині, печінці).
20.17. Дайте визначення поняття "цукровий діабет".
Цукровий діабет - це хвороба, яка у нелікованому стані виявляє себе хронічним збільшенням вмісту глюкози в крові - гіперглікемією (визначення ВООЗ, 1987).
20.18. Які існують експериментальні моделі цукрового діабету?
1. Панкреатичний цукровий діабет- видалення в собак 9/10 підшлункової залози (Мерінг і Мінковський, 1889).
2. Алоксановий цукровий діабет: однократне введення тваринам алоксану — речовини, що вибірково ушкоджує Β-клітини острівців підшлункової залози.
3. Стрептозотоциновий цукровий діабет: введення тваринам антибіотика - стреп-тозотоцину, що вибірково ушкоджує )3-клітини острівців.
4. Дитизоновий цукровий діабет: введення тваринам дитизону — речовини, що зв'язує цинк і в такий спосіб порушує депонування й секрецію інсуліну.
5. Імунний цукровий діабет - введення тваринам антитіл проти інсуліну.
6. Метагіпофізарний цукровий діабет — тривале введення тваринам гормонів адено-гіпофіза - соматотропного гормону, АКТГ.
7. Метастероїдиий цукровий діабет — тривале введення тваринам глюкокортикоїдів.
8. Генетичні моделі цукрового діабету — виведення чистих ліній мишей та інших тварин зі спадково обумовленою формою хвороби.
,у' НА 10***111 V,.'!1'-'
20.19. Наведіть патогенетичну класифікацію цукрового діабету.
1. Спонтанний цукровий діабет (первинний) - являє собою самостійну нозологічну одиницю. На його частку припадає близько 90 % усіх випадків цукрового діабету. Виділяють два різновиди спонтанного діабету: тип І, або інсулінозалеоісний (юнацький), і тип II, або інсулінонезолежний (діабет дорослих).
2. Вторинний цукровий діабет — є тільки ознакою інших захворювань. Він, зокрема, розвивається при ураженнях підшлункової залози, ендокринних хворобах, що супроводжуються збільшенням секреції контрінсулярних гормонів, при складних спадково обумовлених синдромах (наприклад, атаксія-телеангіектазія).
20.20. Дайте порівняльну характеристику цукрового діабету і і II типів.
Цукровий діабет І типу — інсулінозалежшй. Він характеризується абсолютною інсуліновою недостатністю, що виникає в результаті загибелі β-клітин панкреатичних острівців. Розвивається в осіб молодого віку, зазвичай до 30 років. Тому його ще називають ювенільним, або юнацьким. Супроводжується кетозом — накопиченням кетонових тіл. Необхідне лікування інсуліном.
Цукровий діабет II типу — інсулінонезолежний. Він характеризується відносною недостатністю інсуліну або інсулінорезистентністю. Розвивається у дорослих, найчастіше після 40 років. Не супроводжується кетозом. У його лікуванні інсулін не застосовують.
20.21. Які причини розвитку цукрового діабету І типу?
Цукровий діабет І типу — захворювання з генетичною схильністю, у виникненні якого важливу роль відіграють фактори зовнішнього середовища (рис. 63).
Спадкова схильність до діабету І типу обумовлена антигенасоційованим характером цього захворювання. Так, доведений зв'язок між виникненням цукрового діабету І типу і наявністю певних HLA-генів (В8, Bwl5, Dw3, Dw4) у головному комплексі гістосумісності (МНС). Це наводить на думку про значення аутоімунних механізмів у розвитку цієї хвороби.
Серед факторів зовнішнього середовища, здатних ушкоджувати β-клітини панкреатичних острівців, велике значення мають р-цитотропні віруси (віруси Коксакі,
Рис. 63. Причини цукрового діабету І типу
епідемічного паротиту, кору) і fi-цитотропні хімічні агенти (наприклад, алоксан, стрептозотоцин).
20.22. Які механізми лежать в основі розвитку абсолютної інсулінової недостатності при цукровому діабеті і типу?
Генетична схильність, пов'язана з генами МНС, виявляє себе, з одного боку, утворенням аутоантитіл, здатних вибірково ушкоджувати Β-клітини острівців підшлункової залози, з другого - зменшенням резистентності клітин до дії екзогенних ушкоджувальних факторів (Р-цитотропних вірусів і хімічних агентів).
Усе це разом призводить до ушкодження інсулярного апарату й загибелі β-клітин (рис. 64). Утворення інсуліну припиняється.

Рис. 64. Механізми абсолютної інсулінової недостатності при цукровому діабеті І типу
20.23. Які причини розвитку цукрового діабету // типу?
1. Спадкова схильність. Вона, однак, на відміну від діабету І типу, не пов'язана з генами головного комплексу гістосумісності (МНС).
2. Ожиріння. Його відзначають у 80 % хворих. Тому виділяють дві форми цукрового діабету II типу:
а) з ожирінням;
б) без ожиріння.
На відміну від діабету І типу фактори зовнішнього середовища не мають особливого значення в етіології діабету II типу.
20.24. Опишіть патогенез цукрового діабету II типу з ожирінням.
Умовно виділяють два етапи патогенезу. І. Гіперінсулінемічний етап (рис. 65). Споживання великої кількості їжі особами з ожирінням викликає збільшення секреції інсуліну (гіперінсулінемія). Ця реакція спрямована на активацію процесів депонування поживних речовин у жировій тканині.

Рис. 65. Гіперінсулінемічний етап патогенезу цукрового діабету II типу з ожирінням
М'язи ж не мають потреби в дії інсуліну. Тому вони оберігають себе від надлишку цього гормону зменшенням кількості рецепторів на поверхні м'язових клітин. Розвивається явище інсулінорезистентності м'язової тканини — її чутливість до дії інсуліну падає. II. Гіпоїнсулінемічний етап (рис. 66). Підвищене навантаження на інсулярний апарат може призводити до функціонального виснаження β-клітин. Цьому сприяють генетично обумовлені їхні дефекти і надлишок в організмі контрінсулярних гормонів. Як наслідок, секреція інсуліну падає й розвивається його відносна недостатність. При цьому дія інсуліну на жирову тканину зберігається (на жирових клітинах багато рецепторів до інсуліну), а на м'язову тканину - зменшується внаслідок інсулінорезистентності.
Клінічно це виявляє себе розвитком гіперглікемії (немає дії інсуліну на м'язову тканину) і відсутністю кетозу (зберігається дія інсуліну на жирову тканину).
20.25. Назвіть можливі причини позапанкреатичної недостатності інсуліну.
Позапанкреатичну недостатність інсуліну можуть викликати такі причини:
а) порушення перетворення проінсуліну в інсулін;
б) утворення аномального інсуліну;
в) висока активність печінкових інсуліназ;
г) зв'язування інсуліну сироватковими білками;
ґ) утворення антитіл проти інсуліну;
д) аномалії інсулінових рецепторів на поверхні периферичних клітин.

Рис. 66. Гіпоінсулінемічний етап патогенезу цукрового діабету II типу з ожирінням
20.26. Які види обміну речовин порушуються при цукровому діабеті?
Цукровий діабет — це захворювання, при якому порушуються всі види обміну речовин: вуглеводний, жировий, білковий, водно-електролітний обмін, кислотно-основний стан.
20.27. Поясніть механізми розвитку гіперглікемії при цукровому діабеті.
Абсолютна або відносна недостатність інсуліну при цукровому діабеті викликає розвиток гіперглікемії, в основі якої лежать такі механізми.
I. Збільшення надходження глюкози в кров із печінки. Це пояснюється тим, що знімається гальмівний вплив інсуліну на ферменти глікогенолізу й глюконеогенезу, унаслідок чого збільшується інтенсивність цих процесів у печінці.
II. Зменшення використання глюкози інсулінозалежшми тканинами. Це пов'язане з тим, що при дефіциті інсуліну:
а) зменшується проникність клітинних мембран для глюкози у м'язовій (при обох типах цукрового діабету) і жировій (тільки при діабеті І типу) тканині;
б) зменшується утворення глікогену в печінці і м'язах;
в) падає активність пентозного циклу в печінці й жировій тканині;
г) зменшується активність гліколізу в усіх інсулінозалежних тканинах; ґ) відбувається пригнічення ферментів циклу Кребса в печінці і м'язах;
д) порушується перетворення глюкози в жири у печінці й жировій клітковині.
20.28. Які клінічні ознаки цукрового діабету обумовлені гіперглікемією ?
Можна виділити три групи таких ознак.
I. Гіперглікемія, глюкозурія, поліурія, полідипсія (спрага). Глюкозурія виникає тоді, коли концентрація глюкози в крові перевищує так званий "нирковий поріг", тобто 10 ммоль/л.
Унаслідок появи глюкози у вторинній сечі в ній збільшується осмотичний тиск.
Це викликає осмотичний діурез і поліурію.
Як результат поліурії розвивається зневоднення й спрага.
II. Висока гіперглікемія (понад ЗО ммоль/л) викликає збільшення осмотичного тиску крові, унаслідок чого розвивається дегідратація тканин, особливо мозку. Це є причиною так званої гіперосмолярної коми.
III. При гіперглікемії істотно зростає швидкість неферментпативного глікозіїлювання білків (хімічної взаємодії білків з глюкозою крові). Це спричиняється до структурних та функціональних порушень багатьох білків — як наслідок, виникають різні зміни в організмі, серед яких деформація й гемоліз еритроцитів, порушення зсідання крові, підвищення проникності судинної стінки, помутніння кришталика та ін.
20.29. Які порушення свідчать про розлади жирового обміну при цукровому діа б є ті?
1. Гіперліпацидемія — збільшення вмісту в крові вільних жирових кислот. Пов'язана з активацією ліполізу і пригніченням ліпогенезу в жировій тканині внаслідок порушення балансу між інсуліном і контрінсулярними гормонами (рис. 67).

Рис. 67. Перетворення жирових кислот (ЖК) у печінці при цукровому діабеті: ТГ — тригліцериди; ЛПДНГ - ліпопротеїди дуже низької густини
2. Кетоз (гіперкетонемія й кетонурія). Збільшення вмісту кетонових тіл у крові й поява їх у сечі пов'язані з гіперліпацидемією (див. розд. 21).
3. Гіперліпопротеїнемія. Характеризується збільшенням вмісту в крові ліпопротеї-дів дуже низької густини (ЛПДНГ) (див. розд. 21).
4. Жирова інфільтрація печінки. Як і гіперліпопротеїнемія, вона є наслідком надмірного надходження в печінку вільних жирових кислот. Останні виводяться з печінки, перетворюючись у тригліцериди, з наступним утягуванням у формування ЛПДНГ, — розвивається гіперліпопротеїнемія. Якщо можливості гепатоцитів утворювати міцели ЛПДНГ вичерпуються, надлишок тригліцеридів відкладається в печінкових клітинах.
5. Схуднення. При нелікованому цукровому діабеті порушується здатність жирової тканини перетворювати вільні жирові кислоти плазми крові в тригліцериди. Це пов'язано з гальмуванням ліпогенезу при відсутності інсуліну й пригніченням реакцій гліколізу, які необхідні для цього процесу (рис. 68).

Рис. 68. Порушення депонування жирових кислот (ЖК) у жировій тканині при цукровому діабеті: ТГ— тригліцериди; ХМ — хіломікрони; ЛПДНГ'—ліпопротеїди дуже низької
густини
Посилення ліполізу під дією контрінсулярних гормонів також сприяє зменшенню маси жирової клітковини. 6. Атеросклероз (див. запит. 20.33).
20.30. Чим виявляють себе порушення білкового обміну при цукровому діабеті?
1. Аміноацидемією — збільшенням вмісту амінокислот у плазмі крові (рис. 69).
В основі цього лежить зменшення транспорту амінокислот у м'язові клітини (при відсутності інсуліну зменшується проникність клітинних мембран для амінокислот) і посилення протеолізу в м'язах, унаслідок чого вивільнені амінокислоти надходять у кров.
Надлишок вільних амінокислот поглинається печінкою, де посилюються процеси їх перетворення в глюкозу (глюконеогенез). Це, в кінцевому підсумку, призводить до подальшого збільшення рівня гіперглікемії.
2. Порушеннями біосинтезу білків. Це прямо пов'язано з випадінням анаболічної дії

Рис. 69. Порушення обміну білків при цукровому діабеті: АК—амінокислоти
інсуліну.
Клінічно пригнічення білоксинтетичних процесів виявляє себе порушеннями фізичного й розумового розвитку дітей, уповільненням загоєння ран, порушеннями утворення антитіл, унаслідок чого збільшується чутливість до інфекцій, часто розвивається фурункульоз.
20.31. Які порушення водно-електролітного обміну характерні
для цукрового діабету? Який їх
патогенез?
1. Зневоднення (дегідратація). Є наслідком поліурії. Посилює дегідратацію блювота, яка часто супроводжує ацидоз, що розвивається у хворих на цукровий діабет (рис. 70).
Рис. 70. Механізми дегідратації при цукровому діабеті
2. Гіперкаліємія. Є наслідком активації внутрішньоклітинного протеолізу. Відбувається вивільнення зв'язаного з білками калію, і його іони виходять з клітин у тканинну рідину і кров.
3. Гіпонатріємія. Якщо процеси ацидогене-зу в дистальних звивистих канальцях ниркових нефронів не забезпечують повного відтитровування гідрокарбонатного буфера, то якась частина іонів натрію втрачається із сечею разом з аніонами органічних кислот (ацетооцтової, р-оксимасля-ної).
20.32. Які порушення кислотно-основного стану розвиваються при цукровому діабеті?
Для цукрового діабету характерний негазовий ацидоз. Залежно від механізмів
його розвитку виділяють:
а) кетонемічний метаболічний ацидоз - пов'язаний з накопиченням кетонових тіл;
б) лактацидемічний метаболічний ацидоз — пов'язаний з накопиченням молочної кислоти. Причиною утворення останньої є зневоднення, що призводить до гіпо-волемії, згущення крові (гемоконцентрації) і, як наслідок, — до гіпоксії (рис. 71).

Рис. 71. Механізми лактацидеміїпри цукровому діабеті
20.33. Які варіанти коматозних станів можуть розвиватися при цукровому діабеті?
1. Діабетична кетонемічна кома. В основі її розвитку лежать ацидоз та інтоксикація, обумовлені кетоновими тілами.
2. Гіперосмолярна кома. Розвивається внаслідок дегідратації головного мозку, обумовленої високим ступенем гіперглікемії (див. запит. 20.26).
3. Лактацидемічна кома. Обумовлена накопиченням молочної кислоти й пов'язаним із цим ацидозом.
4. Гіпоглікемічна кома. Може розвиватися в результаті передозування інсуліну при лікуванні цукрового діабету.
20.34. Які ускладнення характерні для цукрового діабету?
... . . . 'Лі
Макроангюпатії, мікроангюпатії, нейропатії.
20.35. Які механізми можуть лежати в основі розвитку макроангіопатій при цукровому діабеті?
Макроангіопшпії характеризуються прискореним розвитком атеросклерозу в артеріях хворих на цукровий діабет. Найчастіше вражаються вінцеві артерії серця, артерії головного мозку й нижніх кінцівок. Це може призводити до розвитку таких
ускладнень, як інфаркт міокарда, інсульт, гангрена пальців ніг і всієї стопи. Існують дві концепції, що пояснюють патогенез макроангіопатій.
I. Концепція порушеного гомеостазу (власне діабетична). Головне значення в розвитку атеросклерозу при цукровому діабеті надається загальним порушенням обміну речовин в організмі, а саме: гіперглікемії, гіперліпопротеїнемії й ацидозу. Патогенетичне значення гіперглікемії полягає в тому, що вона:
1) є причиною неферментативного глікозилювання ліпопротеїдів плазми крові, унаслідок чого істотно збільшується їхня атерогенність;
2) викликає неферментативне глікозилювання мембранних білків ендотеліаль-них клітин і, як наслідок, призводить до підвищення проникності судинної стінки;
3) активує сорбітоловий шлях перетворення глюкози в гладких м'язових клітинах судин. Останнє відбувається, якщо концентрація глюкози в крові перевищує 20 ммоль/л.
Результатом активації сорбітолоеого шляху є утворення в клітинах фруктози. , Оскільки плазматична мембрана непроникна для цієї речовини, вона накопичується в цитоплазмі, підвищуючи осмотичний тиск внутрішньоклітинної рідини, викликаючи набряк і ушкодження клітин.
Гіперліпопротеїнемія при цукровому діабеті характеризується збільшенням вмісту в крові ліпопротеїдів дуже низької густини (ЛПДНГ) і появою "модифікованих" ліпопротеїдів (ЛП): глікозильованих і ацетоацетильованих ЛІХ Про значення цих порушень у розвитку атеросклерозу див. розд. 28.
З виникненням ацидозу пов'язане підвищення проникності судинної стінки й ушкодження її гладком'язових і ендотеліальних клітин - фактори, що сприяють атеросклерозу.
II. Інсулінова концепція. її прихильники вважають, що провідною ланкою в патогенезі діабетичних макроангіопатій є гіперінсулінемія. Збільшення вмісту інсуліну в крові може бути ендогенним, як при цукровому діабеті II типу, і екзогенним, як результат передозувань інсуліну при лікуванні діабету І типу.
Інсулін у великих кількостях, маючи мітогенну дію, викликає проліферацію гладком'язових клітин артеріальної стінки, що призводить до формування фіброзних атеросклеротичних бляшок.
20.36. Як пояснюють розвиток мікроангіопатій при цукровому діабеті? Чим вони можуть виявляти себе?
Мікроангіопатїї— це ураження судин мікроциркуляторного русла (артеріол, капілярів), що виникають як ускладнення цукрового діабету. Сутність цих уражень полягає в значному збільшенні товщини базальної мембрани мікросудин, що утруднює обмін речовин між кров'ю й тканинами.
Серед механізмів розвитку мікроангіопатій велике значення мають збільшення синтезу глікопротеїнів базальної мембрани і неферментативне глікозилювання її компонентів.
Мікроангіопатії найчастіше виявляють себе ураженням судин нирок (діабетич-
на нефропатія) і сітківки очей (діабетичнаретинопатія). Як наслідок, можуть розвиватися хронічна ниркова недостатність, відшарування сітківки.
20.37. Який патогенез нейропатій при цукровому діабеті?
Heuponamu — це специфічні ураження нервових провідників у хворих на цукровий діабет. Вони виявляють себе розладами чутливості, вегетативних і рухових функцій, нервової трофіки.
В основі патогенезу діабетичних нейропатій лежать процеси демієлінізації нервів і порушення аксоплазматичного транспорту.
Суть демієлінізації полягає в руйнуванні мієлінової оболонки нервових волокон і порушенні утворення мієліну. Ці розлади пов'язують із:
а) активацією сорбітолового шляху перетворення глюкози у шваннівських клітинах, що спричиняє їхнє ушкодження й загибель;
б) пригніченням міоінозитолового шляху, внаслідок чого порушується утворення мі-оінозитолу - речовини, необхідної для побудови мієліну.
20.38. Назвіть основні патогенетичні принципи лікування цукрового діабету.
1. Уведення інсуліну при інсулінозалежному цукровому діабеті І типу. Перспективними в цьому плані є трансплантація (3-клітин острівців підшлункової залози й застосування автоматизованих систем дозування і введення інсуліну.
2. Уведення фармакологічних препаратів, що усувають гіперглікемію, - гіпоглікемічних засобів (бігуаніди, похідні сульфонілсечовини).
3. Дієтотерапія, що забороняє вживати харчові продукти з високим вмістом цукру, регулює енергетичну цінність їжі та режим її споживання.
4. Фізичні навантаження (тренування). Вони зменшують рівень гіперглікемії й збільшують чутливість м'язової тканини до інсуліну.
21. Порушення жирового обміну
21.1. Назвіть основні причини порушень жирового обміну в організмі.
Причинами розладів жирового обміну можуть бути порушення:
1) перетравлювання і всмоктування ліпідів у тонкій кишці;
2) транспорту ліпідів кров'ю;
3) депонування ліпідів у жировій тканині;
4) жирової функції печінки (див. розд. 31);
5) проміжного обміну ліпідів у периферичних тканинах;
6) нервової й гормональної регуляції жирового обміну.
27.2. Що може бути причиною порушень перетравлювання і всмоктування ліпідів у кишках?
1. Порушення емульгування жирів:
а) недостатнє надходження жовчі в кишки (механічна жовтяниця);
б) передчасне руйнування жовчних кислот бактеріальною флорою при порушенні моторної функції кишок.
2. Порушення гідролітичного розщеплення жирів:
а) недостатнє надходження панкреатичної ліпази у дванадцятипалу кишку;
б) порушення активації цього ферменту за умов недостатньої секреції жовчі.
3. Порушення утворення ліпідних міцел у порожнині тонкої кишки:
а) недостатнє надходження жовчі в тонку кишку;
б) зв'язування жовчних кислот деякими лікарськими препаратами (холестира-мін, неоміцин та ін.);
в) утворення кальцієвих солей жирових кислот при надмірному надходженні кальцію з їжею й водою.
4. Порушення всмоктування міцел:
а) швидка евакуація вмісту тонкої кишки (проноси);
б) ушкодження епітелію слизової оболонки тонкої кишки (ентерити, радіаційні ураження).
5. Порушення ресинтезу тригліцеридів і формування хіломікронів в епітеліальних клітинах кишок:
а) зменшення кількості або пригнічення активності відповідних ферментів;
б) дефіцит АТФ.
21.3. Які зміни складу крові можуть бути проявом порушень транспорту ліпідів в організмі?
Гіперліпопротеїнемія і гіполіпопротеїнемія — відповідно збільшення й зменшення вмісту ліпопротеїдів у плазмі крові; дисліпопротеїнемія — порушення співвідно-
шення між окремими класами ліпопротеїдів плазми крові; гіперліпацидемія — збільшення вмісту вільних жирових кислот у крові.
21.4. Які існують класи ліпопротеїдів плазми крові?
У плазмі крові містяться хіломікрони (ХМ), ліпопротеїди дуже низької густини (ЛПДНГ), ліпопротеїди проміжної густини (ЛППГ), ліпопротеїди низької густини (ЛПНГ), ліпопротеїди високої густини (ЛПВГ).
21.5. Дайте порівняльну характеристику різних класів ліпопротеїдів плазми крові.
|
Показник |
хм |
ЛПДНГ |
ЛПНГ |
ЛПВГ |
|
Діаметр міцел, нм |
Близько 500 |
Близько 50 |
15-20 |
6-9 |
|
Основний ліпідний компонент |
Тригліцериди |
Тригліцериди |
Холестерол |
Фосфоліпіди |
|
Місце утворення |
Епітелій тонкої кишки |
Печінка |
Кровоносні капіляри печінки |
Печінка, тонка кишка |
|
Функції |
Транспорт екзогенних тригліцеридів у/Ьмнтіітло .ж |
Транспорт ендогенних тригліцеридів Of'V |
Транспорт холестеролу до периферичних тканин |
Транспорт холестеролу від периферичних тканин до печінки |
21.6. Як класифікують гіперліпопротеїнемії?
За походженням гіперліпопротеїнемії бувають первинними (спадковими) і вторинними (набутими).
Класифікація ВООЗ передбачає поділ гіперліпопротеїнемій на типи залежно від того, вміст ліпопротеїдів якого класу збільшений у крові (див. запит. 21.9).
Залежно від механізмів розвитку гіперліпопротеїнемія може бути продукційною і ретенційною.
21.7. Які генетичні дефекти можуть бути причиною розвитку первинних (спадкових) гіперліпопротеїнемій?
1. Генетично обумовлені зміни структури апопротеїнів — білкової частини ліпопро-теїдних міцел, унаслідок чого ліпопротеїди плазми крові не можуть взаємодіяти з відповідними рецепторами або зазнавати ферментативних перетворень.
2. Спадкові дефекти ферментів, що беруть участь в обміні ліпопротеїдів, зокрема, дефіцит ліпопротеїнліпази, печінкової ліпази, лецитинхолестеролацилтрансфера-зи (ЛХАТ).
3. Аномалії клітинних рецепторів до ліпопротеїдів.
21.8. Назвіть можливі причини розвитку вторинних (набутих) . гіперліпопротеїнємій.
1. Ендокринні хвороби (цукровий діабет, гіпотиреоз).
2. Метаболічні розлади (ожиріння, подагра).
3. Хвороби нирок (нефротичний синдром).
4. Хвороби печінки (обтураційна жовтяниця).
5. Інтоксикації (алкоголізм).
21.9. Наведіть класифікацію гіперліпопротеїнємій, запропоновану експертами ВООЗ.

Умовні позначення див. запит. 21.4.
21.10. Наведіть приклади розвитку різних типів гіперліпопротеїнємій за класифікацією ВООЗ.
|
Тип гшерліпопротеїнемії |
Спадкові порушення |
Набуті порушення |
|
Типі |
Дефіцит ліпопротеїнліпази |
Системний червоний вовчак |
|
Тип Па |
Сімейна гіперхолестеролемія (дефіцит рецепторів до ЛПНГ) |
Гіпотиреоз |
|
Тип ПЬ |
Комбінована сімейна гіперхолестеролемія |
Нефротичний синдром |
|
Тип III |
Сімейна гіперліпопротеїнемія ПІ типу |
Ожиріння |
|
Тип IV |
Комбінована сімейна гіперліпідемія |
Цукровий діабет |
|
ТипУ |
Сімейна гшертриглщеридемія |
Алкогольна інтоксикація |
21.11. Що таке продукційна і ретенційна гіперліпопротеїнемія?
Продукційна гіперліпопротеїнемія розвивається внаслідок збільшення утворення ліпопротеїдів, а ретенційна — у результаті порушення їх утилізації.
21.12. У чому полягає патогенетичне значення гіперліпопротеїнемій ?
Гіперліпопротеїнемії сприяють розвитку атеросклерозу (див. розд. 28).
21.13. Наведіть приклади гіполіпопротеїнемій. Дайте коротку характеристику.
Зменшення вмісту в крові ліпопротеїдів (гіполіпопротеїнемія) спостерігається значно рідше, ніж гіперліпопротеїнемія. Причиною гіполіпопротеїнемій найчастіше є спадково обумовлені порушення. Серед них:
1) абеталіпопротеїнемїя. В організмі нема апопротеїну В, унаслідок чого не утворюються хіломікрони і ЛПНГ. Клінічно виявляє себе стеатореєю (поява жиру в калі) і авітамінозами жиророзчинних вітамінів. Успадковується аутосомно-рецесивно;
2) гіпобеталіпопротеїнемія. Зменшено вміст ЛПНГ. Вважають, що це доброякісний стан, який сприяє довголіттю, оскільки перешкоджає розвитку атеросклерозу й ішемічної хвороби серця. Успадковується аутосомно-домінантно;
3) танжерська хвороба (від назви острова Танжер на східному узбережжі США). Характеризується повною відсутністю ЛПВГ або наявністю їх аномальних форм. Порушується транспорт холестеролу від тканин у печінку, він накопичується в периферичних клітинах. Клінічно це виявляє себе гепатомегалією, спленомегалією, збільшенням лімфатичних вузлів.
21.14. Що таке "модифіковані" ліпопротеїди? Наведіть приклади. Яке їх патогенетичне значення?
"Модифікованими" називають якісно змінені ліпопротеїди (ЛП). До них, зокрема, відносять глікозильовані ЛП (зв'язані з глікозильними групами, утворюються при гіперглікемії), ацетоацетильовані ЛП (зв'язані з ацетооцтовою кислотою, утворюються при цукровому діабеті); ЛП, зв'язані з продуктами пероксидного окиснення ліпідів; ліпопротеїн X (з'являється при обтураційній жовтяниці); комплекси ліпопро-теїд-антитіло.
"Модифіковані" ЛП є атерогенними. їх накопичення сприяє розвитку атеросклерозу.
21.15. Що таке первинне і вторинне ожиріння?
Первинним називають ожиріння, що являє собою самостійний патологічний процес.
Вторинне ожиріння є ознакою тих чи тих захворювань. Найпоширенішими варіантами вторинного ожиріння є церебральне і гормональне ожиріння.
21.16. Назвіть основні причини первинного ожиріння.
1. Надмірне споживання їжі, що перевищує енергетичні витрати організму.
2. Гіподинамія — обмеження фізичної активності людини.
3. Генетична схильність. Може виявляти себе особливостями харчової поведінки людини або особливостями регуляції жирового обміну.
21.17. У яких випадках виникає церебральне ожиріння?
Церебральне ожиріння виникає при ураженнях гіпоталамуса, де зосереджені центри, що регулюють харчову поведінку. Такі ураження виникають при травмах, пухлинах, енцефаліті. Провідним механізмом ожиріння в цьому випадку є поліфагія (підвищення апетиту).
21.18. Які гормональні порушення можуть бути причиною вторинного ожиріння?
Гормональне ожиріння розвивається як одна з ознак ендокринних хвороб. Воно супроводжує розвиток:
а) гіпотиреозу;
б) аденоми острівців підшлункової залози (гіперінсул інізм);
в) синдрому Іценка—Кушинга;
г) гіпофункції статевих залоз.
21.19. Чим відрізняється гіперпластичний тип ожиріння від гіпертрофічного?
Гіперпластичне ожиріння пов'язане з гіперплазією жирових клітин, тобто зі збільшенням їхньої кількості. Для нього характерними є початок у ранньому дитячому віці і велика надлишкова вага.
В основі гіпертрофічного ожиріння лежить збільшення маси окремих жирових клітин, при цьому їхня кількість не міняється. Ожиріння цього типу має більш пізній початок і не настільки виражене, як у попередньому випадку.
21.20. Які існують експериментальні моделі ожиріння?
I. Експериментальні моделі первинного ожиріння. Отримано чисті лінії мишей і щурів з генетично обумовленим ожирінням, що є ознакою, яка передається від потомства до потомства.
II. Експериментальні моделі вторинного церебрального ожиріння:
а) руйнування вентромедіальних ядер гіпоталамуса, що утворюють "центр насичення";
б) електростимуляція латеральних ядер гіпоталамуса, що становлять "центр апетиту".
III. Експериментальні моделі вторинного гормонального ожиріння:
а) вимикання функції деяких ендокринних залоз (видалення щитоподібної залози, кастрація);
б) введення в організм великої кількості деяких гормонів (інсуліну, глюкокор-тикоїдів).
IV. Експериментальні моделі місцевого ожиріння — перетинання симпатичних нервів. При цьому в тканині з порушеною іннервацією збільшується маса жирової клітковини, оскільки припиняється ліполітична дія катехоламінів.
21.21. Які механізми лежать в основі збільшення маси жирової тканини при ожирінні?
I. Посилення ліпогенезу. Цей механізм є провідним при:
а) посиленому надходженні жирових кислот у жирові клітини з хіломікронів і ліпопротеїдів дуже низької густини (переїдання, церебральне ожиріння, гіперінсулінізм);
б) посиленому утворенні жирових кислот в адипоцитах із глюкози (надмірне споживання вуглеводів, гіперінсулінізм, гіперфункція кори надниркових залоз);
в) збільшенні активності ферментів ліпогенезу (гіперінсулінізм).
II. Пригнічення ліполізу. В основі цього механізму зменшення активності гормончут-ливої ліпази адипоцитів. Це буває при:
а) гіподинамії;
б) гіпотиреозі;
в) порушенні симпатичної іннервації.
21.22. У чому полягає патогенетичне значення ожиріння?
При ожирінні значно зростає ризик виникнення багатьох соматичних хвороб. Серед них — атеросклероз, ішемічна хвороба серця, інфаркт міокарда, цукровий діабет II типу.
21.23. Що таке гіперкетонемія? Які причини й механізми лежать в основі її розвитку?
Гіперкетонемія - це накопичення кетонових тіл у крові. До них відносять ацетооцтову кислоту, р-оксимасляну кислоту, ацетон.
Основною причиною гіперкетонемії є збільшення вмісту в крові вільних жирових кислот - гіперліпацидемія. Остання виникає при посиленні ліполізу в жировій тканині, наприклад, при цукровому діабеті І типу, гарячці, у другому періоді голодування.
Надлишок вільних жирових кислот надходить у печінку, де під дією ферментів р-окиснення" утворюється велика кількість ацетил-КоА. Якась його частина зазнає подальших перетворень у циклі Кребса (інтенсивність цього процесу залежить від енергетичних потреб гепатоцитів), а невикористана кількість, що залишилася, іде на
утворення кетонових тіл, які надходять у кров і можуть бути утилізовані як цінний ! енергетичний субстрат периферичними клітинами.
При деяких захворюваннях, наприклад, при цукровому діабеті І типу, використання кетонових тіл клітинами порушується. Це збільшує гіперкетонемію.
Гіперкетонемія завжди супроводжується кетонурією (ацетонурією) — появою кетонових тіл (ацетону) у сечі.
21.24. Які гормони посилюють ліполіз у жировій тканині і можуть викликати гіперліпацидемію з наступною гіперкетонемією?
Ліполітичну дію мають контрінсулярні гормони, зокрема, катехоламіни, глюкагон, глюкокортикоїди, тироксин. Вони через активацію аденілатциклазної системи підвищують активність гормончутливої ліпази клітин жирової тканини.
21.25. Які порушення в організмі обумовлює гіперкетонемія?
1. Метаболічний ацидоз. Пов'язаний з накопиченням кислих продуктів (ацетооцтової, Р-оксимасляної кислот).
2. Інтоксикація. Обумовлена головним чином ацетоном. Ця речовина легко проникає в багаті ліпідами тканини, зокрема, у структури ЦНС і, "розчиняючи" ліпіди мембран, порушує їх бар'єрну і транспортну функції.
3. Кома. Є найтяжчим для організму порушенням. Розвивається як наслідок декомпенсованого метаболічного ацидозу та інтоксикації.
22о Порушеним білкового обміну, обміну амінокислот і азотистих основ
22.1. Що таке позитивний і негативний азотистий баланс? Наведіть приклади.
У дорослої здорової людини кількість азотистих речовин, що виводяться з організму, дорівнює кількості, що він її отримує з їжею. Такий стан називається азопшс- \ тою рівновагою.
В організмі, що росте, при вагітності, при введенні або надмірному утворенні ! анаболічних гормонів, при посиленому годуванні після виснажливих хвороб азоту виводиться менше, ніж його надходить. У цьому випадку йдеться про позитивний азотистий баланс.
І навпаки, якщо азоту виводиться більше, ніж надходить, то розвивається негативний азотистий баланс. Це може бути при голодуванні, втраті білків через нирки (протеїнурія), шкіру (опіки), кишки (проноси); при тиреотоксикозі, інфекційній гарячці.
22.2. Назвіть основні причини аліментарної білкової недостатності.
Аліментарнії білкова недостатність розвивається внаслідок порушень надходження в організм білків, їх перетравлювання і всмоктування.
Основними її причинами є голодування, незбалансоване за амінокислотним і складом харчування, запальні й дистрофічні зміни різних відділів кишок, що супроводжуються порушеннями їх секреторної та моторної функцій.
22.3. Назвіть основні причини порушення біосинтезу білків у клітинах.
1. Порушення структури генів, що кодують інформацію про будову білків (мутації).
2. Отрути й специфічні інгібітори мультиферментних комплексів, що забезпечують ] процеси транскрипції, трансляції й посттрансляційної модифікації білків.
3. Дефіцит незамінних амінокислот.
4. Дефіцит АТФ.
5. Порушення утворення транспортних і рибосомної РНК, білків рибосом.
22.4. Порушення яких етапів можуть спричиняти розлади біосинтезу білків у клітинах?
I. Порушення транскрипції- утворення інформаційної РНК на матриці ДНК.
II. Порушення трансляції— синтезу поліпептидних ланцюгів з амінокислот.
III. Порушення посттрансляційної модифікації білків — формування їхньої третин- ; ної й четвертинної структур.
22.5. Які зміни білкового складу крові можуть виникати в умовах патології?
I. Гіпопротеїнемія - зменшення вмісту білків у плазмі крові. Виникає головним чином за рахунок зниження кількості альбумінів і може бути набутою і спадковою. До гіпопротеїнемії спричиняються голодування, аліментарна білкова недостатність, захворювання печінки, вихід білків із кровоносного русла (крововтрата, плазмовтрата, ексудація, транссудація) і втрата білків із сечею (протеїнурія). Гіпопротеїнемія веде до зменшення онкотичного тиску плазми крові, у результаті чого рідина виходить з кровоносних судин в інтерстиціальну тканину - розвиваються набряки.
II. Гіперпротеїнемія — збільшення вмісту білків у плазмі крові. Буває відносною (згущення крові) і абсолютною. Абсолютна гіперпротеїнемія найчастіше обумовлена збільшенням синтезу білків плазми крові і головним чином у-глобулінів (антитіл).
Клінічні прояви гіперпротеїнемії пов'язані зі збільшенням в'язкості крові, зміною її реологічних властивостей і, як наслідок, порушеннями мікроциркуляції.
III. Диспротеїнемія - зміна співвідношення між окремими білковими фракціями крові. Може бути спадковою і набутою. Часто пов'язана зі зміною спектру а- і у-глобулінів. Характерна для гострих запальних процесів ("білки гострої фази запалення"), дифузних захворювань сполучної тканини, аутоімунних захворювань. Іноді в крові з'являються якісно змінені білки, зокрема, парапротеїни і кріогло-буліни. Парапротеїни — це імуноглобуліни, що є продуктами одиничних клонів лімфоцитів. їх поява обумовлена проліферацією окремих антитілосинтезуючих клітин, що буває при патологічних процесах пухлинної природи (мієломна хвороба, макроглобулінемія Вальденстрема).
Кріоглобуліни — це різновид парапротеїнів. Вони являють собою патологічні білки із властивостями імуноглобулінів, що преципітують при охолодженні.
22.6. Що таке продукційна іретенційна гіперазотемія?
Пперазотемія — це збільшення залишкового (небілкового) азоту в крові. У нормі залишковий азот на 50 % складається з азоту сечовини, близько 25 % його припадає на частку амінокислот, інша частина — на інші азотисті продукти.
Продукційна (печінкова) гіперазотемія виникає внаслідок порушення утворення сечовини, детоксикації азотистих продуктів у печінці.
Ретенційна (ниркова) гіперазотемія є наслідком порушення видільної функції нирок.
22.7. Які фактори можуть викликати порушення утворення сечовини в печінці?
Порушення синтезу сечовини може спостерігатися на завершальних етапах розвитку недостатності печінки як одна з ознак порушення її детоксикаційної функції.
Можливі спадково обумовлені порушення сечовиноутворення. їх причиною може бути недостатній синтез цілого ряду ферментів: аргінінсукцинатліази (аргінін-
сукцинатурія), карбамоїлфосфатсинтетази і орнітинкарбамоїлтрансферази (амоніє-мія) і аргінінсукцинатсинтетази (цитрулінурія).
Наслідком порушення синтезу сечовини є накопичення аміаку в крові й цілий ряд пов'язаних з цим тяжких клінічних проявів (докладно див. розд. 31).
22.8. У чому сутність і чим виявляють себе спадково обумовлені порушення обміну фенілаланіну?
Спадково обумовленим порушенням обміну фенілаланіну є фенілкетонурія -за-хворювання з аутосомно-рецесивним типом спадкування. Його причиною є генетичний дефект ферменту фенілаланінгідроксилази, що в нормі перетворює фенілаланін на тирозин (рис. 73). За відсутності зазначеного ферменту окиснення фенілаланіну відбувається шляхом утворення фенілпіровиноградної і фенілмолочної кислот. Однак цей шлях має малу пропускну здатність, і тому фенілаланін накопичується у великій кількості в крові, тканинах і спинномозковій рідині, що в перші ж місяці життя веде до важкого ураження центральної нервової системи й невиліковного слабоумства.

Рис. 73. Блокада шляхів метаболізму фенілаланіну і тирозину: блок а - фенілкетонурія; б — тирозиноз; в — алкаптонурія; г - гіпотиреоз; д — альбінізм
22.9. У чому сутність і чим виявляють себе спадково обумовлені порушення обміну тирозину?
Залежно від рівня генетичних дефектів спадково обумовлені порушення обміну тирозину можуть виявлятися розвитком тирозинозу, алкаптонурії, альбінізму. Усі ці захворювання успадковуються аутосомно-рецесивно.
Тирозиноз виникає внаслідок генетичного дефекту ферменту - оксидази парагі-дроксифенілпіровиноградної кислоти. У результаті вона, будучи першим проміжним продуктом обміну тирозину, не перетворюється в гомогентизинову кислоту, накопичується в крові й разом з тирозином виводиться із сечею.
Алкаптонурія є наслідком порушення синтезу оксидази гомогентизинової кислоти, що перетворює останню в малеїлацетооцтову кислоту. У результаті в крові й сечі з'являється гомогентизинова кислота. Сеча при стоянні на повітрі, а також при додаванні до неї лугу стає чорною, що пояснюється окисненням гомогентизинової кислоти киснем повітря й утворенням алкаптону. Гомогентизинова кислота з крові проникає в тканини — хрящову, сухожилля, зв'язки, внутрішній шар стінки аорти, унаслідок чого з'являються темні плями в ділянці вух, носа, на склерах. Іноді розвиваються тяжкі зміни в суглобах.
Альбінізм обумовлений дефіцитом ферменту тирозинази. Унаслідок цього не утворюється пігмент шкіри й волосся — меланін. Організм, позбавлений пігменту, стає дуже чутливим до дії ультрафіолетового випромінювання.
22.10. Що таке подагра?
Подагра - це хвороба, в основі якої лежить накопичення в організмі сечової кислоти - кінцевого продукту обміну пуринових основ, що входять до структури нуклеїнових кислот.
Для хворих на подагру характерне збільшення рівня сечової кислоти в крові (гіперурикемія). Гіперурикемія може супроводжуватися відкладенням солей сечової кислоти в суглобах і хрящах, де через слабке кровопостачання завжди є тенденція до зменшення рН (кисле середовище сприяє випаданню солей в осад). Відкладення солей викликає гостре подагричне запалення, що супроводжується болем, гарячкою і завершується утворенням подагричних вузлів і деформацією суглобів.
22.11. Що є факторами ризику подагри?
Факторами ризику подагри можуть бути:
1) надмірне надходження пуринів в організм (уживання в їжу великої кількості м'яса, особливо з вином і пивом);
2) надмірне надходження в організм молібдену, що входить до складу ксантинокси-дази, яка перетворює ксантин у гіпоксантин. Останній потім перетворюється в сечову кислоту;
3) стать (частіше хворіють чоловіки);
4) літній вік, для якого характерна вікова гіперурикемія;
5) спадкова схильність. Можливими є домінантно успадковуване підвищення рівня сечової кислоти в крові і зміни факторів, що підтримують сечову кислоту в розчиненому стані.
23о Порушення водно-еольового обміну
23.1. Що таке позитивний і негативний водний баланс?
Якщо надходження води в організм перевищує її виведення, то розвивається позитивний водний баланс.
Негативний водний баланс розвивається тоді, коли виведення води з організму перевищує її надходження. Класифікацію порушень обміну води представлено на рис. 74.

Рис. 74. Класифікація порушень обміну води
23.2. Які гормони беруть участь у захисно-компенсаторних реакціях організму при порушеннях водно-сольового обміну?
Альдостерон, вазопресин (антидіуретичний гормон), передсердний натрійуре-тичний гормон (атріопептин), адреналін.
23.3. Які фактори активують і гальмують утворення й секрецію
альдостерону?
Основним фактором, що стимулює утворення й секрецію альдостерону, є продукти активації ренін-ангіотензинної системи — ангіотензин II і ангіотензин III (рис. 75).

Рис. 75. Фактори — стимулятори секреції альдостерону
їхній стимуляційний ефект максимально виявляє себе за умови нормальної секреції ^КТТ'аденогіпофізом. У цьому випадку АКТГ має так звану пермісивну дію.
Можлива також безпосередня стимуляція секреції альдостерону високими концентраціями іонів калію в плазмі крові.
Гальмують утворення і вивільнення альдостерону в кров передсердний натрійу-ретичний гормон і дофамін.
23.4. Назвіть основні функціональні ефекти альдостерону.
Основні функціональні ефекти альдостерону пов'язані з його впливом на нирки. Діючи на дистальні звивисті канальці нефронів, альдостерон викликає:
1) збільшення реабсорбції іонів натрію;
2) збільшення секреції іонів калію;
3) збільшення секреції іонів водню (посилює ацидогенез).
23.5. Що таке ренін-ангіотензинна система? Як вона активується? Назвіть основні функціональні ефекти ангіотензину II і ангіотензину III.
Ренін-ангіотензинна система пов'язана з функціонуванням юкстагломеруляр-ного апарату нирок (ЮГА). Цілий ряд факторів (порушення кровообігу в нирках, активація симпатоадреналової системи, зменшення концентрації іонів натрію в плазмі крові) викликає вивільнення клітинами ЮГА в кров протеолітичного ферменту — реніну (рис. 76). Ренін діє на а -глобулін плазми крові (ангіотензиноген) і відщеплює від нього пептид, що складається з десяти амінокислотних залишків. Ця речовина, яка ще не має будь-якої біологічної активності, отримала назву ангіотензин І. При проходженні через капіляри легень від ангіотензину І під впливом ферменту кон-вертази, що міститься на поверхні ендотеліальних клітин, відщеплюється дві амінокислоти, у результаті чого утворюється ангіотензин II. Далі під впливом ангіотен-зиназ утворюються ангіотензин III (складається з 7 амінокислотних залишків) та інші пептиди, що містять 6,5 і менше амінокислот і не мають біологічної активності (рис. 77).

Рис. 76. Фактори - стимулятори секреції реніну

Рис. 77. Ренін-ангіотензинна система

Рис. 78. Функціональні ефекти ангіотензинів II і III
Ангіотензин II має два ефекти:
1) викликає скорочення гладких м'язів артеріол, у результаті чого відбувається їх звуження й підвищується артеріальний тиск;
2) діючи на клубочкову зону кори надниркових залоз, він активує секрецію альдостерону.
Ангіотензин III має тільки одну з двох зазначених дій - збільшує секрецію альдостерону (рис. 78).
23.6. Які фактори стимулюють утворення й секрецію передсердного натрійуретичного гормону (атріопептину)? Яку дію виявляє цей гормон?
Основним фактором, що стимулює утворення й секрецію атріопептину, є збільшення надходження крові в передсердя серця й, зокрема, збільшення об'єму цирку-
люючої крові. При цьому відбувається розтягнення стінок передсердь, у результаті чого міоендо-кринні клітини вивільняють гормон у кров.
Сьогодні відомо два важливих функціональних ефекти атріопептину. Вони пов'язані з його впливом на клітини канальцевого епітелію нирок і гладкі м'язи судин (рис. 79). Діючи на ці структури, передсердний натрійуретичний гормон, з одного боку, зменшує реабсорбцію іонів натрію, у результаті чого збільшується натрійурез і діурез та зменшується об'єм циркулюючої крові, а з другого - викликає розширення артеріол, унаслідок чого зменшується загальний периферичний опір. У результаті відбувається падіння артеріального тиску.

Рис. 79. Функціональні
ефекти передсердного
натрійуретичного гормону
(ПНУГ)
23.7. Що стимулює секрецію вазопресину (антидіуретичного гормону)? Яку дію має цей гормон?
Відомо два механізми активації секреції вазопресину (рис. 80). Перший з них — осмотичний, пов'язаний зі збільшенням осмотичного тиску крові і збудженням центральних та периферичних осморецепторів. Другий механізм — гемодинамічний, починає здійснюватися при зменшенні об'єму циркулюючої крові на 7-15 %. При цьому відбувається збудження волюмо- і барорецепторів, інформація від яких надходить у паравентрикулярне і супраоптичне ядра гіпоталамуса, де відбувається утворення вазопресину. Цей гормон по відростках нейронів опускається в нейрогіпофіз, а звідти надходить у кров.

Рис. 80. Механізми активації вивільнення вазопресину (антидіуретичного гормону—АДГ): AT- артеріальний тиск; ОТ- осмотичний тиск; ОЦК—об'єм циркулюючої крові;
Hth - гіпоталамус
Найважливішими ефектами вазопресину є (рис. 81): 1) звуження артеріол і підвищення артеріального тиску;
2) збільшення реабсорбції води в дистальних звивистих канальцях і збірних трубках нирок, що веде до зменшення діурезу, збільшення об'єму циркулюючої крові.
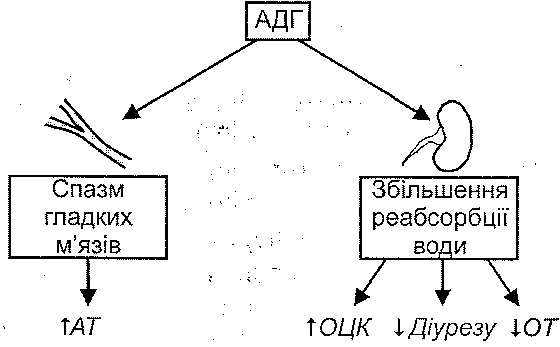
Рис. 81. Функціональні ефекти вазопресину (АДГ)
23.8. Які функціональні ефекти симпатоадреналової системи обумовлюють її участь у захисно-компенсаторних реакціях організму при зневодненні?
1. Активація ренін-ангіотензинної системи. Цей ефект пов'язаний з безпосередньою дією катехоламінів на )3-адренорецептори юкстагломерулярного апарату нирок і опосередкованим впливом на ЮГА через спазм приносних артеріол.
2. Внутрішньонирковий перерозподіл течії крові. При активації симпатоадреналової системи відбувається спазм судин кортикальних нефронів. Унаслідок цього основна частина крові йде через юкстамедулярні нефрони, де площа реабсорбції води й іонів натрію, а також інтенсивність цього процесу значно більша, ніж у кортикальних нефронах. Такий перерозподіл течії крові в нирках веде до значного збільшення реабсорбції натрію й води і сприяє їх збереженню в організмі.
3. Спазм артеріол периферичних тканин. При цьому відповідно до механізму Стар-лінга зменшується фільтрація води з капілярів у тканини, що сприяє підтриманню загального об'єму крові.
4. Зменшення потовиділення. Ця реакція спрямована на зменшення втрати води і солей організмом.
23.9. Що таке позаклітинне зневоднення? Назвіть основні його
причини.
Позаклітинне зневоднення (гіпогідрія, дегідратація, ексикоз) — це зменшення об'єму позаклітинної рідини. В основі його лежить негативний водний баланс.
Причинами позаклітинного зневоднення можуть бути: І. Недостатнє надходження води в організм:
а) екстремальні ситуації, у яких може опинитися людина під час землетрусу, у пустелі (повне водне голодування);
б) неможливість самостійно вгамувати спрагу (важкохворі люди, грудні діти);
в) порушення формування відчуття спраги при ураженнях питного центру в ЦНС. II. Втрата води організмом:
а) виділення великої кількості рідини нирками (поліурія), наприклад, при цукровому й нецукровому діабеті;
б) втрата рідини через травний канал (нестримна блювота, проноси, гіперсалі-вація);
в) посилене потовиділення, наприклад, при інтенсивній фізичній роботі, при дії високої температури;
г) збільшення виділення вологи з видихуваним повітрям при всіх видах задишки; ґ) втрата води з ексудатом при запаленні (набряки, запалення серозних оболонок та ін.);
д) крововтрата.
23.10. Що таке ізоосмолярне, гіпоосмолярне і гіперосмолярне зневоднення? Наведіть приклади.
Ізоосмолярним називають зневоднення, при якому осмотичний тиск плазми крові й міжклітинної рідини не міняється. Воно розвивається у випадках еквівалентної втрати води й електролітів. Це спостерігається іноді при поліурії, розладах діяльності кишок, а також зразу після гострої крововтрати.
Гіпоосмолярне зневоднення характеризується зменшенням осмотичного тиску позаклітинної рідини і виникає у випадках переважної втрати солей. Воно розвивається при втраті секретів шлунка й кишок (пронос, блювота), а також при підвищеному потовиділенні, якщо втрата води відшкодовується питвом без солі.
Гіперосмолярним називають зневоднення, при якому збільшується осмотичний тиск позаклітинної рідини. Це спостерігається в тих випадках, коли втрата води перевищує втрату електролітів (насамперед натрію), наприклад, при гіпервентиляції, профузному потовиділенні, втраті слини (піт і слина гіпотонічні стосовно крові), а також при проносі, блювоті й поліурії, коли відшкодування втрати води її надходженням в організм є недостатнім.
23.11. Які захисно-компенсаторні реакції розвиваються при позаклітинному зневодненні?
1. Відбувається перехід рідини з інтерстиціального сектора в судини. Це пов'язане з тим, що в умовах зневоднення зменшується гідростатичний тиск крові в капілярах, з одного боку, і збільшується онкотичний тиск крові внаслідок її згущення (гемоконцентрації), з другого.
2. Зменшення об'єму циркулюючої крові, пов'язане зі зневодненням, веде до збудження волюморецепторів і, в кінцевому підсумку, до збільшення секреції антиді-уретичного гормону. Останній збільшує реабсорбцію води в нирках, обмежуючи її втрату організмом.
3. Зменшення об'єму циркулюючої крові викликає активацію ренін-ангіотензинної системи і збільшення секреції альдостерону корою надниркових залоз. Це веде до збільшення реабсорбції іонів натрію в нирках і до нормалізації осмотичного тиску позаклітинної рідини.
4. У результаті зменшення артеріального тиску збуджуються барорецептори, що призводить до активації симпатоадреналової системи (див. запит. 23.8).
5. Зневоднення через центральні й периферичні механізми викликає відчуття спраги. У результаті формуються поведінкові реакції, спрямовані на пошук води й поповнення втраченої рідини.
23.12. Що таке синдром ангідремії? Які патогенетичні механізми відіграють провідну роль у його розвитку?
Ангідремія — це зменшення вмісту води в рідкій частині крові. Є крайнім проявом позаклітинного зневоднення й характеризується розвитком ангідремічного шоку (рис. 82). Основне значення в його розвитку мають:
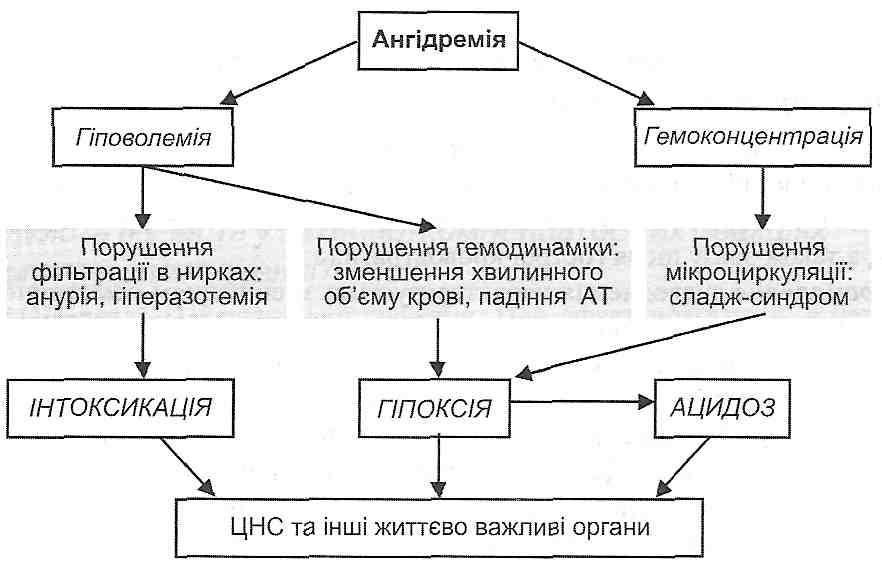
Рис. 82. Патогенез ангідремічного шоку
1) гіповолемія (зменшення об'єму циркулюючої крові). Вона є причиною порушення загальної гемодинаміки. Зменшується хвилинний об'єм крові й артеріальний тиск, що веде до розвитку циркуляторної гіпоксії й метаболічного ацидозу. У результаті гемодинамічних порушень розвивається гостра ниркова недостатність: зменшується фільтраційний тиск і, як наслідок, розвиваються оліго- і анурія, гіпе-разотемія і уремія (інтоксикація);
2) гемоконцентрація (згущення крові, збільшення її в'язкості). Викликає насамперед порушення мікроциркуляції, уповільнюється течія крові в капілярах, розвивається сладж-синдром, істинний капілярний стаз. Наслідком таких розладів є розвиток гіпоксії й ацидозу.
Гіпоксія, ацидоз та інтоксикація є основними факторами, що порушують функції ЦНС та інших життєво важливих органів і призводять до смерті. Ознаки важкої ангідремії й смерть настають у дорослих після втрати 1/3, у дітей — 1/5 об'єму позаклітинної рідини.
23.13. Що є причиною внутрішньоклітинного зневоднення? Які зміни в клітинах виникають при цьому?
Причиною внутрішньоклітинного зневоднення є збільшення осмотичного тиску міжклітинної рідини, пов'язане з розвитком гіпернатріємії (див. запит. 23.29). У цих умовах вода за законами осмосу виходить із клітин у міжклітинний простір.
У результаті зневоднення збільшується внутрішньоклітинна концентрація електролітів, що веде до порушення гідратних оболонок білкових молекул. Зменшується розчинність білків, вони осаджуються, що, в кінцевому підсумку, виявляється порушенням їх функцій.
Крім того, зменшення води в клітинах спричиняється до зменшення їхнього об'єму і, як наслідок, до зменшення активної поверхні клітинних мембран. Результатом цього є порушення функцій, пов'язаних із плазматичною мембраною, - міжклітинних взаємодій, сприйняття регуляторних сигналів, міграції та ін.
23.14. Якими порушеннями на рівні організму виявляє себе внутрішньоклітинне зневоднення?
Серед загальних порушень на перший план виходять розлади функції нейронів ЦНС. Це виявляється розвитком нестерпної спраги, потьмаренням свідомості, галюцинаціями, порушеннями ритму дихання. Підвищується температура тіла, розвивається "сольова гарячка ".
Зневоднення ендотеліальних клітин веде до збільшення проміжків між ними і, як наслідок, до збільшення проникності стінок судин. Це може бути причиною виходу з капілярів у тканини білків плазми крові та її формених елементів — розвиваються геморагії.
23.15. Що таке позаклітинна гіперп'дрія? Назвіть основні її причини.
Позаклітинна гіпергідрія — це збільшення об'єму рідини в позаклітинному секторі організму. Вона є результатом позитивного водного балансу. Причинами позаклітинної гіпергідрії можуть бути:
I. Надмірне надходження води в організм:
а) пиття солоної води, що не вгамовує спрагу;
б) внутрішньовенне введення великої кількості рідини хворим.
II. Затримка води в організмі внаслідок порушення її виведення нирками:
а) ниркова недостатність (оліго- і анурія);
б) порушення регуляції нирок (первинний і вторинний гіперальдостеронізм, гіперпродукція антидіуретичного гормону).
23.16. Що таке ізоосмолярна, гіпоосмолярна і гіперосмолярна гіпергідрія? Наведіть приклади.
При ізоосмолярній гіпергідрії осмотичний тиск позаклітинної рідини не змінюється. Цей вид порушень може спостерігатися протягом деякого часу після введення надлишкових кількостей ізотонічних розчинів.
Гіпоосмолярна гіпергідрія (водне отруєння) характеризується зменшенням осмотичного тиску позаклітинної рідини. Цей вид гіпергідрії в експерименті на тва-
ринах моделюють повторними введеннями води в шлунок, особливо на тлі введення вазопресину, альдостерону або видалення надниркових залоз. У клініці водне отруєння можливе при рефлекторній анурії, а також у другій стадії гострої ниркової недостатності.
Гіперосмолярна гіпергідрія, для якої характерне збільшення осмотичного тиску позаклітинної рідини, може розвиватися при вживанні для пиття солоної морської води.
23.17. Які захисно-компенсаторні реакції розвиваються при позаклітинній гіпергідрії?
1, Позаклітинна гіпергідрія супроводжується збільшенням об'єму циркулюючої крові. Це веде до механічного розтягнення клітин передсердь, які у відповідь на це вивільняють у кров передсердний натрійуретичний гормон (атріопептин). Останній збільшує натрійурез і діурез, унаслідок чого зменшується об'єм циркулюючої крові.
2. Збільшення об'єму циркулюючої крові є причиною зменшення імпульсації від волюморецепторів, у результаті чого зменшується секреція антидіуретичного гормону і зростає діурез.
23.18. Що таке набряки? Як їх класифікують?
Набряки — це накопичення рідини в тканинах організму і серозних порожнинах.
Розрізняють загальні й місцеві набряки. Загальні набряки є проявом позаклітинної гіпергідрії, місцеві — пов'язані з порушенням балансу рідини в обмеженій ділянці тканини або органа.
За етіологією виділяють набряки серцеві, ниркові, печінкові, кахектичні, запальні, алергічні, токсичні та ін.
Залежно від механізмів розвитку набряки можуть бути:
1) гідростатичними;
2) онкотичними;
3) мікседематозними.
Гідростатичні набряки виникають у результаті збільшення гідростатичного тиску в капілярах. Залежно від причин такого збільшення можна виділити:
а) гіперволемічні;
б) застійні;
в) мікроциркуляторні набряки.
Онкотичні набряки виникають унаслідок змін онкотичного тиску в капілярах або інтерстиціальній рідині. У цю групу входять:
а) гіпопротеїнемічні;
б) мембраногенні;
в) лімфогенні набряки.
23.19. У розвитку яких набряків провідна роль належить збільшенню гідростатичного тиску крові в капілярах?
Гідростатичні набряки можуть бути обумовлені такими механізмами: •
1) збільшенням об'єму крові (гіперволемічні набряки);
2) збільшенням венозного тиску (застійні набряки);
3) первинним порушенням мікроциркуляції - розширенням артеріол і спазмом ве-нул (мікроциркуляторні набряки). v^V-V
Гіперволемічнгши є набряки при позаклітинній гіпергідрії і набряки, пов'язані із затримкою в організмі іонів натрію, наприклад, при серцевій недостатності, вторинному гіперальдостеронізмі.
Причиною застійних набряків є порушення відтоку крові по венозних судинах (хронічна серцева недостатність, порушення венозних клапанів, тромбоз вен та ін.).
Розвиток набряків по мікроциркуляторному типу викликає гістамін, який одночасно розширює артеріоли і звужує вени.
23.20. У розвитку яких набряків провідна роль належить зменшенню онкотичного тиску крові?
Онкотичні набряки закономірно розвиваються при зменшенні вмісту білків (альбумінів) у плазмі крові. Це призводить до зменшення онкотичного тиску крові і переходу рідини з капілярів в інтерстиціальний простір.
За таким механізмом розвиваються, зокрема, набряки при голодуванні (кахек-тичні); нефротичні набряки, пов'язані із втратою білка (протеїнурією); печінкові набряки, що виникають унаслідок порушення синтезу альбумінів у печінці.
23.21. Які набряки відносять до мембраногенних?
Мембраногенні набряки виникають унаслідок підвищення проникності стінок судин (див. розд. 14). Збільшення проникності судин є причиною виходу білків плазми крові в міжклітинний простір, унаслідок цього зростає тканинний онкотичний тиск і вода переходить із кровоносних судин в інтерстицій.
Зазначений механізм є провідним у розвитку алергічних, запальних, токсичних набряків.
23.22. Що таке лімфогенні набряки?
Лімфогенні набряки виникають унаслідок порушень лімфоутворення і лімфо-відтоку. При цьому порушується виведення з лімфою білків, що в нормі фільтруються у тканину, і, як наслідок, збільшується тканинний онкотичний тиск.
Серед причин розвитку лімфогенних набряків варто виділити здавлення лімфатичних судин рубцем; збільшення центрального венозного тиску (недостатність серця), що перешкоджає припливу лімфи в систему кровообігу.
23.23. Що таке мікседематозні ("слизові") набряки?
Мікседематозні набряки - це особливий варіант набряків, в основі якого лежить збільшення гідрофільності тканинних колоїдів. При цьому в тканинах зростає кількість зв'язаної води.
Мікседематозні ("слизові") набряки характерні для гіпофункції щитоподібної залози.
23.24. Як відбувається накопичення води в тканинах при розвитку набряків?
У патогенезі набряків розрізняють дві стадії.
Перша стадія — накопичення зв'язаної води. Набрякова рідина зв'язується з тканинними колоїдами й накопичується в основному в гелеподібних структурах (колагенові волокна, основна речовина сполучної тканини). При цьому клінічні ознаки набряку незначні — трохи збільшується тургор тканини.
Друга стадія - накопичення вільної води. Коли маса зв'язаної води збільшується приблизно на ЗО %, а гідростатичний тиск у тканині досягає атмосферного, починає накопичуватися вільна незв'язана вода. Тоді з'являються виражені ознаки набряку: вільна вода переміщається відповідно до сили гравітації, з'являється симптом "ямки" при натискуванні на тканину.
23.25. Як впливає ацидоз на розвиток набряків?
Рис. 83. Вплив ацидозу на розвиток набряків
Ацидоз посилює розвиток набряків. Це пов'язане з тим, що при зміщенні рН у кислий бік зменшується гідрофільність структур сполучної тканини. Тому при надходженні води в тканину менша її кількість буде зв'язуватися з тканинними колоїдами і, отже, буде збільшуватися кількість вільної незв'язаної води. У зв'язку з цим за інших рівних умов клінічні ознаки набряку в кислому середовищі будуть більш вираженими (рис. 83).
23.26. У чому сутність дослідів Старлінга, присвячених вивченню патогенезу набряків?
Е. Старлінг (1896) у дослідах на жабах вивчав роль онкотичного тиску в розвитку набряків. Він показав, що при пер-фузії жаби фізіологічним розчином, що не містить білка, відбувається швидкий перехід рідини з суцин у тканину, внаслідок чого вода затримується в організмі й маса тварини зростає. Якщо потім перемкнути систему на перфузію сироваткою крові, то буде спостерігатися зворотний процес - рідина виходить із тканин у кровоносні судини й маса жаби поступово віднов-
люється до вихідного рівня. Дегідратація тканин відбувається значно повільніше, ніж розвиток набряків. Це пояснюється тим, що вода, яка надійшла в тканину, легко зв'язується із тканинними колоїдами й набагато важче переходить знову у вільний стан.
23.27. Що є причиною розвитку внутрішньоклітинної гіпергідрії? Чим вона виявляє себе на рівні організму?
Основною причиною внутрішньоклітинної гіпергідрії є зменшення осмотичного тиску позаклітинної рідини, пов'язане з розвитком гіпоштріємії (див. запит. 23.30). У цих умовах вода за законами осмосу переходить з міжклітинного простору в клітини - з'являються ознаки генералізованого набряку клітин.
Клінічно виникають явища водного отруєння, серед яких на перший план виступає набряк мозку, що виявляється сильним головним болем, нудотою, блювотою, судомами.
23.28. Які механізми можуть лежати в основі розвитку набряку клітини при її ушкодженні? Яке патогенетичне значення даного явища?
Серед механізмів розвитку набряку клітини основне значення мають:
1) розпад внутрішньоклітинних структур, білків, унаслідок чого вивільняються зв'язані з ними катіони (в основному іони калію) і збільшується внутрішньоклітинний осмотичний і онкотичний тиск;
2) порушення проникності клітинної мембрани, у результаті чого іони натрію й хлору надходять у клітину й збільшують осмотичний тиск цитоплазми;
3) порушення функціонування натрій-калієвих насосів, що призводить до накопичення іонів натрію в клітині.
Набряк клітини посилює процеси її ушкодження. Це пов'язане з тим, що:
а) збільшується проникність клітинних мембран унаслідок їх осмотичного розтягування;
б) можливе явище електричного "пробою" плазматичної мембрани збудливих клітин;
в) відбувається механічний розрив мембран при їх розтягуванні.
23.29. Назвіть причини гіпернатріємп, захисно-компенсаторні реакції, що виникають при цьому, і патогенетичне значення даного порушення.
Залежно від причин розвитку розрізняють первинну і вторинну гіпернатріємію.
Первинна гіпернатріємія (абсолютне збільшення іонів натрію в організмі) може виникати або в результаті збільшення надходження натрію в організм (приймання великої кількості хлориду натрію, введення його гіпертонічного розчину), або внаслідок зменшення виведення натрію з організму (первинний і вторинний гіпераль-достеронізм, ниркова недостатність).
Вторинна (відносна) гіпернатріємія — це збільшення вмісту іонів натрію в крові й міжклітинній рідині внаслідок втрати води організмом. При цьому загальний вміст натрію в організмі може не змінюватися, а іноді навіть зменшується. Такий стан виникає при гіпервентиляції, проносах, підвищеному потовиділенні, нецукро-вому діабеті.
У результаті гіпернатріємії підвищується осмотичний тиск позаклітинної рідини, збуджуються центральні й периферичні осморецептори, збільшується надходження в кров антидіуретичного гормону. Останній посилює реабсорбцію води в нирках, у результаті чого збільшується об'єм позаклітинної рідини і зменшується її осмотичний тиск.
Основним наслідком гіпернатріємії є розвиток внутрішньоклітинного зневоднення (див. запит. 23.13, 23.14).
23.30. Назвіть причини гіпонатріємії, захисно-компенсаторні реакції, що виникають при цьому, і патогенетичне значення даного порушення.
Первинна (абсолютна) гіпонатріємія розвивається в результаті зменшення надходження натрію в організм (безсольова дієта, анорексія) або внаслідок збільшення виведення натрію з організму нирками (гіпофункція кори надниркових залоз, ниркова недостатність).
Причиною вторинної (відносної) гіпонатріємії є. надмірне надходження в організм води або її затримка - гіпонатріємія внаслідок розведення.
Зменшення концентрації іонів натрію в позаклітинній рідині викликає, з одного боку, посилення секреції альдостерону через ренін-ангіотензинний механізм, з другого - зменшення надходження в кров антидіуретичного гормону, оскільки зменшується імпульсація від осморецепторів. Наслідком цього є посилення реабсорбції іонів натрію й пригнічення реабсорбції води в нирках — осмотичний тиск позаклітинної рідини відновлюється.
Патогенетичне значення гіпонатріємії полягає в розвитку генералізованого набряку клітин (див. запит. 23.27).
23.31. Назвіть причини гіперкаліємії, захисно-компенсаторні реакції, що виникають при цьому, і патогенетичне значення даного порушення.
Гіперкаліємією називають збільшення вмісту іонів калію в плазмі крові понад 5,5 ммоль/л.
Причинами її розвитку можуть бути:
1) надмірне надходження калію в організм;
2) перехід іонів калію із внутрішньоклітинного в позаклітинний простір при масивному ушкодженні клітин, при збільшенні інтенсивності катаболічних процесів і ацидозі;
3) порушення виведення калію з організму (оліго- і анурія, недостатність функції кори надниркових залоз).
Збільшення концентрації іонів калію в крові безпосередньо активує клітини клу-бочкової зони кори надниркових залоз і викликає посилення секреції альдостерону. Останній збільшує секрецію іонів калію в ниркових нефронах і в такий спосіб відновлює їх концентрацію в крові.
Наслідками гіперкаліємії є:
1) порушення діяльності збудливих тканин (нервової і м'язової), у результаті чого розвиваються розлади функції ЦНС, серцево-судинної системи, скелетної мускулатури, гладких м'язів травного каналу;
2) розвиток негазового ацидозу (див. розд. 25).
23.32. Назвіть причини гіпокаліємії, захисно-компенсаторні реакції, що виникають при цьому, і патогенетичне значення даного порушення.
Гіпокшііємія — це зменшення концентрації іонів калію в плазмі крові нижче 3,5 ммоль/л.
Причинами її розвитку можуть бути:
1) недостатнє надходження калію в організм з їжею (тривале використання дієти, що не містить продуктів рослинного походження);
2) посилений перехід іонів калію з позаклітинного простору в клітини, що буває при посиленні анаболічних процесів і алкалозі;
3) втрата калію організмом (поліурія, гіперальдостеронізм, тривале використання сечогінних засобів).
При гіпокаліємії розвивається гіперполяризація мембран секреторних клітин і у зв'язку з цим зменшується секреція альдостерону корою надниркових залоз. Це викликає зменшення секреції іонів калію клітинами ниркового епітелію.
Патогенетичне значення гіпокаліємії полягає в тому, що:
а) збільшується поріг збудливості клітин і, як наслідок, з'являються загальна слабкість, метеоризм, гіпотонія скелетних м'язів, зменшується шкірна чутливість;
б) розвивається гіпокаліємічний алкалоз (див. розд. 25).
23.33. Назвіть причини й основні прояви порушень обміну магнію в організмі.
Магній є одним з найважливіших внутрішньоклітинних катіонів. Його концентрація в клітинах у 3—10 разів перевищує його вміст у позаклітинному середовищі. Він є активатором багатьох ферментативних процесів (реакцій фосфорного обміну, гліколізу; ряду етапів синтезу білків і жирових кислот; розпаду нуклеїнових кислот та ін.). У більшості реакцій, у яких бере участь АТФ, обов'язковим є утворення комплексів АТФ з іонами магнію.
Причинами збільшення вмісту магнію в організмі можуть бути: ураження нирок з порушенням їх видільної функції (уремія), отруєння сполуками магнію. При цьому розвивається гіпермагніємія (збільшення концентрації магнію в плазмі крові понад 1 ммоль/л), що виявляє себе пригніченням центральної нервової системи: розвивається депресія і сон (магнезіальний наркоз), відбувається гальмування функцій дихального центру.
До зменшення вмісту магнію в організмі можуть спричинятися: порушення всмоктування цього елемента в кишках (нестримна блювота, проноси, панкреатит); парентеральне введення великих кількостей рідини, що не містить магнію; порушення функції ендокринних залоз (тиреотоксикоз, гіперпаратиреоз, первинний гіпераль-
достеронізм); ураження печінки (хронічний алкоголізм, цироз). Зазначені причини можуть викликати розвиток гіпомагніємії (зменшення концентрації магнію в плазмі крові нижче 0,75 ммоль/л), яка виявляє себе:
а) тетанією (нападами судом), перебіг якої значно важчий, ніж при гіпокальціємії;
б) появою трофічних виразок на шкірі;
в) погіршенням засвоєння їжі, що викликає порушення процесів росту;
г) зниженням температури тіла;
ґ) поширеним кальцинозом тканин, який у першу чергу розвивається в кровоносних судинах, нирках, хрящовій тканині. При цьому вміст кальцію в організмі не міняється.
24. Порушений фосфорно-кальцієвого обміну
24.1. Які гормони здійснюють регуляцію фосфорно-кальцієвого обміну в організмі?
Паратирин (паратгормон), кальцитонін, гормонально активна форма вітаміну D.
24.2. Як відбувається утворення гормонально активної форми вітаміну D?
В організмі існує два джерела вітаміну D:
1) утворення вітаміну D3 (холекальциферолу) у шкірі з 7-дегідрохолестеролу під дією ультрафіолетового випромінювання;
2) надходження в організм вітаміну D2 (ергокальциферолу) у складі харчових продуктів.
У печінці під впливом ферменту 25-гідроксилази утворюється транспортна форма вітаміну — 25-оксивітамін D. Ця форма спочатку в складі жовчі виділяється у дванадцятипалу кишку, а потім разом з жовчними кислотами знову всмоктується в кров у тонкій кишці.
У нирках під дією ферменту la-гідроксилази утворюється гормонально-активна форма вітаміну D - 1,25-(ОН)2-вітамін D. Крім того, можливе утворення і неактивної форми - 24,25-(ОН)2-вітаміну D.
Яка з цих форм утворюється переважно, залежить від концентрації іонів кальцію в плазмі крові. При гіпокальціємії з'являється в основному 1,25-(ОН)2-вітамін D і гальмується утворення 24,25-(ОН)2-вітаміну D; при гіперкальціємії - навпаки.
24.3. Назвіть основні біологічні ефекти гормонально активної форми вітаміну D.
Основний біологічний ефект 1,25-(ОН)2-вітаміну D- збільшення всмоктування кальцію її фосфатів у тонкій кишці. Діючи на епітеліальні клітини слизової кишки, 1,25-(ОН)2-вітамін D, як і інші стероїдні гормони, проникає через плазматичну мембрану в цитоплазму ентероцитів, а потім у комплексі з внутрішньоклітинним білком-рецептором у їхнє ядро. У ядрі відбувається активація транскрипції генів, що кодують структуру функціонально важливих білків: кальбідину (білка, що зв'язує Са) і білків кальцієвих насосів, зокрема, Са-АТФ-ази.
Кальбідин вмонтовується в плазматичну мембрану апікальної частини ентероцитів і забезпечує полегшену дифузію іонів кальцію із просвіту кишок у цитоплазму клітин кишкового епітелію. Кальцієві насоси здійснюють активний транспорт іонів кальцію із цитоплазми ентероцитів через плазматичну мембрану базальної частини клітин в інтерстицій і кров.
Другою "мішенню" для 1,25-(ОН)2-вітаміну D є кісткова тканина, де цей гормон, впливаючи на остеобласти, гальмує синтез колагену, а діючи на остеокласти, стимулює резорбцію кістки.
У кінцевому підсумку дія 1,25-(ОН)2-вітаміну D виявляється збільшенням концентрації іонів кальцію в плазмі крові.
Неактивна форма вітаміну D - 24,25-(ОН)2-вітамін D гальмує секрецію парати-рину прищитоподібними залозами й посилює інактивацію стероїдів у печінці, у тому числі й вітаміну D.
24.4. Які фактори стимулюють і гальмують секрецію паратирину прищитоподібними залозами?
Секрецію napamupuny стимулює зменшення концентрації іонів кальцію в плазмі крові, а гальмує - збільшення вмісту цих іонів у плазмі й 24,25-(ОН)2-вітамін D.
24.5. Назвіть основні біологічні ефекти паратирину.
1. Дія на кісткову тканину - активація функції остеокластів.
Під впливом паратирину відбувається вивільнення остеокластами лізосомних ферментів, які розщеплюють органічну матрицю кісткової тканини. Крім того, остеокласти починають продукувати великі кількості цитрату, що сприяє вимиванню кальцію з кристалів оксіапатиту.
Результатом зазначених ефектів є збільшення концентрації іонів кальцію в крові, з одного боку, і демінералізація, резорбція кісткової тканини, з другого.
2. Пригнічення реабсорбції фосфату в нирках.
3. Активація перетворення в нирках вітаміну D у гормонально активну форму — 1,25-(ОН)2-вітамінВ.
24.6. Які фактори стимулюють і гальмують секрецію кальцитоніну?
Кальцитонін синтезується в парафолікулярних (С-клітинах) щитоподібної залози. Крім того, виявлено клітини, здатні секретувати цей гормон, у вилочковій і при-щитоподібних залозах.
Секрецію кальцитоніну стимулює збільшення концентрації іонів кальцію в плазмі крові й деякі гастроінтестинальні гормони (особливо гастрин). Гальмування відбувається при зменшенні вмісту іонів кальцію в крові.
24.7. Назвіть основні біологічні ефекти кальцитоніну.
1. Кальцитонін перешкоджає резорбції кісткової тканини, пригнічуючи діяльність остеокластів. Це виявляється зменшенням концентрації іонів кальцію в плазмі крові.
2. Гальмує секрецію гастрину. Фізіологічне значення цього ефекту ще не встановлено.
24.8. Що може бути причиною розвитку гіпокальціємічних станів?
Причиною зменшення концентрації іонів кальцію в плазмі крові — гіпокальціємії можуть бути такі фактори (рис. 85).

Рис. 85. Причини розвитку гіпокальціємічних станів
1. Зменшення надходження кальцію з тонкої кишки в кров:
а) зменшення вмісту кальцію в продуктах харчування;
б) порушення співвідношення кальцій/фосфор у харчових продуктах;
в) утворення в кишках нерозчинних кальцієвих сполук (наприклад, з фітовою, інозитфосфорною кислотами, що містяться в продуктах зі злаків);
г) порушення всмоктування кальцію при ураженнях тонкої кишки (ентерити); ґ) гіповітаміноз D.
2. Втрата іонізованого кальцію організмом:
а) із сечею при порушеннях процесів реабсорбції;
б) при вагітності — втрати, пов'язані з формуванням скелета плода.
3. Порушення мобілізації кальцію з кісткової тканини:
а) гіпопаратиреоз;
б) пухлини С-клітин щитоподібної залози, що продукують кальцитонін.
4. Мінералізація м 'яких тканин:
а) гіперфосфатемія;
б) алкалоз.
5. Перехід кальцію плазми крові з іонізованої форми в неіонізовану — у комплекси з білками й органічними кислотами:
а) отруєння щавлевою кислотою, переливання цитратної крові; *б) збільшення концентрації сироваткових білків; в) алкалоз.
24.9. Які захисно-компенсаторні реакції і власне патологічні зміни виникають при гіпокальціємії?
Захисно-компенсаторні реакції в цих умовах спрямовані на збільшення концентрації іонів кальцію в плазмі крові. До них належать:
1) збільшення секреції паратирину;
2) збільшення утворення в нирках 1,25-(ОН)2-вітаміну D;
3) зменшення секреції кальцитоніну. Завдяки цим реакціям збільшується всмоктування кальцію й фосфору в кишках, зростає їхній перехід з костей у кров.
Власне патологічними змінами є:
1) порушення костей скелета - розвиток рахіту у дітей і остеомаляції у дорослих;
2) синдром підвищеної нервово-м'язової збудливості — тетанія.
24.10. Що таке тетанія? Коли вона виникає?
Tema/іія — це синдром підвищеної нервово-м'язової збудливості, що виявляється
розвитком тонічних судом. Виникає при гіпокальціємії.
При зменшенні концентрації іонів кальцію в крові критичний потенціал деполяризації збудливих клітин наближається до рівня потенціалу спокою, а отже, зменшується поріг збудливості. Тому ті подразники, які в нормі є підпорогови-ми, при гіпокальціємії викликають розвиток тонічних скорочень скелетних м'язів.
Особливо небезпечне скорочення дихальних м'язів і м'язів гортані, оскільки можлива периферична зупинка дихання.
24.11. Що таке рахіт? Які виділяють патогенетичні варіанти цього захворювання ?
Рахіт — це хвороба дитячого віку, основний прояв якої — порушення формування кісткового скелета внаслідок порушення утворення оксіа-патиту.
Оскільки основними складовими частинами оксіапатиту є кальцій і фосфат, то порушення утворення цього мінералу може бути пов'язане

Рис. 86. Причини кальципенічного рахіту. УФВ —ультрафіолетове випромінювання; ТК — травний канал
як з первинною недостатністю кальцію, так і з недостатністю фосфату. Тому виділяють два патогенетичних варіанти рахіту: кальципенічний і фосфопенічний.
24.12. Які чинники можуть бути причиною розвитку кальципенічного рахіту?
Основною причиною виникнення даного різновиду рахіту є порушення регуляції фосфорно-кальцієвого обміну вітаміном D.
До цього можуть спричинятися такі фактори (рис. 86).
1. Порушення утворення вітаміну D у шкірі:
а) недостатня інтенсивність ультрафіолетового випромінювання (осінньо-зимовий період, північні широти; забруднення повітря в індустріальних містах);
б) недостатнє перебування дітей на повітрі або перебування на повітрі в одязі, що затримує ультрафіолетове випромінювання;
в) пігментація шкіри.
2. Недостатнє надходження вітаміну D з їжею.
3. Порушення перетворення вітаміну D у печінці в його транспортну форму:
а) набуті порушення діяльності печінки;
б) спадково обумовлений дефіцит ферменту 25-гідроксилази.
4. Порушення зворотного надходження транспортної форми вітаміну D з тонкої кишки в кров.
5. Порушення утворення гормонально активної форми вітаміну D — 1,25-(ОН)2-ві-таміну D у нирках:
а) хронічна ниркова недостатність;
б) спадково обумовлений дефіцит ферменту Іа-гідроксилази.
6. Нечутливість клітин-мішеней до дії гормонально активної форми вітаміну D -генетично обумовлений дефіцит рецепторів до 1,25-(ОН) - вітаміну D.
24.13, Поясніть механізми розвитку основних проявів кальципенічного рахіту.
Порушення регуляції фосфорно-кальцієвого обміну вітаміном D первинно спричиняються до розладів усмоктування кальцію і фосфату у тонкій кишці. У результаті розвивається гіпокальціємія (рис. 87).
Зменшення концентрації іонів кальцію у плазмі крові стимулює секрецію пара-тирину. Останній, активуючи функцію остеобластів, зумовлює перехід іонів кальцію і фосфату із кісткової тканини в кров. Ця реакція, будучи по своїй суті захисно-компенсаторною, поновлює вміст кальцію в крові, однак організм розплачується за це демінералізацією кісток і порушенням окостеніння хрящової тканини. Кістки деформуються, і виникають характерні клінічні ознаки рахіту.
Гіпокальціємія, крім того, є причиною цілого ряду порушень центральної нервової системи: дитина стає лякливою, капризує; порушується сон, з'являється пітливість. Розвивається спазмофілія - напади рахітичної тетанії.
Рис. 87. Патогенез кальципенічного рахіту
і
24.14. Які фактори можуть бути причиною розвитку фосфопенічното рахіту?
Основна причина фосфопенічного рахіту - порушення реабсорбції фосфату в нирках. Найчастіше це спадково обумовлені захворювання:
1) гіпофосфатемічний вітамін D-резистентний рахіт - фосфат-діабет (хвороба зчеплена з Х-хромосомою, однак успадковується домінантно);
2) аутосомно-домінантний гіпофосфатемічний рахіт;
3) синдром Фанконі - складні порушення функції проксимальних звивистих каналь-ців ниркових нефронів.
Перелічені спадкові хвороби характеризуються порушенням реабсорбції фосфату в канальцях нирок.
24.15. Поясніть патогенез основних проявів фосфопенічного рахіту.
Генетично обумовлений дефект ферментів і транспортних білків призводить до порушення реабсорбції фосфату в ниркових канальцях, унаслідок чого розвивається гіпофосфатемія. Добуток концентрації іонів кальцію на концентрацію іонів фосфату в плазмі крові зменшується. Це має два наслідки: 1) вихід кальцію й фосфату з кісток у кров - демінералізація і 2) порушення утворення оксіапатиту в хрящовій тканині - порушення окостеніння хрящів. Усе це, в кінцевому підсумку, призводить до деформації кісток скелета — розвиваються клінічні ознаки рахіту.
24.16. Що може бути причиною розвитку п'перкальціємічних станів?
Збільшення концентрації іонів кальцію в плазмі крові — гіперкальціємія може бути обумовлена такими групами факторів (рис. 88).

Рис. 88. Причини розвитку гіперкальціємічних станів
I. Посилене надходження кальцію з тонкої кишки в кров:
а) надмірний вміст кальцію в продуктах харчування;
б) посилене всмоктування кальцію в кишках, що буває найчастіше при гіпервітамінозі D.
II. Зменшення виведення кальцію з організму:
а) набуті порушення — хронічна ниркова недостатність;
б) спадкові порушення - сімейна гіпокальціурична гіперкальціємія.
III. Посилене надходження кальцію в кров з кісткової тканини:
а) гіперпаратиреоз;
б) злоякісні пухлини з метастазами в кісткову тканину;
в) множинні переломи кісток.
IV. Порушення відкладення кальцію в кісткову тканину, що спостерігається при гі-пофосфатемії.
24.17. Які захисно-компенсаторні реакції і власне патологічні зміни виникають при гіперкальціємії?
Захисно-компенсаторні реакції в цих умовах спрямовані на зменшення вмісту іонів кальцію в крові. До них відносять:
1) зменшення секреції паратирину;
2) зменшення утворення в нирках 1,25-(ОН)2-вітаміну D і збільшення утворення 24,25-(ОН)2-вітаміну D;
3) збільшення секреції кальцитоніну.
Власне патологічні зміни:
1) кальцієве ушкодження клітин (див. розд. 11);
2) кальцифікація м'яких тканин — звапніння;
3) зменшення збудливості збудливих тканин;
4) утворення кальцієвих каменів у нирках;
5) посилення шлункової секреції з утворенням пептичних виразок у шлунку;
6) розвиток артеріальної гіпертензії.
24.18. Як відбувається кальцифікація м'яких тканин?
У цьому процесі виділяють дві фази.
Перша фаза — ініціація утворення кристалів оксіапатиту. В її основі лежать два фізико-хімічних механізми: осадження й епітаксія. Осадження відбувається при локальному збільшенні концентрації кальцію й фосфату вище певного критичного значення. Епітаксія - це механізм утворення оксіапатиту на органічній матриці, кристалічна структура якої подібна до такої оксіапатиту. Функцію органічної матриці у тканинах можуть виконувати колаген і еластин.
Друга фаза —ріст кристалів оксіапатиту. Цей процес підпорядкований фізико-хімічним закономірностям. На його інтенсивність впливає рН середовища. У кислому середовищі ріст кристалів уповільнюється, у лужному - прискорюється.
24.19. Які причини можуть викликати розвиток гіпо- і гіперфосфатемії? Які зміни в організмі виникають при цьому?
Зменшення концентрації фосфатів у крові — гіпофосфшпемія - може бути обумовлене двома групами причин:
а) зменшенням надходження неорганічного фосфору в організм (голодування, синдром мальабсорбції, гіповітаміноз D);
б) посиленим виведенням фосфатів нирками (гіперпаратиреоз, фосфат-діабет, синдром Фанконі).
Зменшення неорганічного фосфору в організмі призводить до численних порушень, в основі яких— розлади окисного фосфорування в клітинах, зменшення утворення 2,3-дифосфогліцерату в еритроцитах, у результаті чого відбувається зсув кривої дисоціації оксигемоглобіну вліво й розвивається гіпоксія. При цьому виникають порушення в системі травлення (диспепсичні явища, анорексія), системі крові (гемолітична анемія, лейко- і тромбоцитопенія), нервовій системі (парестезії, атаксія, сплутаність свідомості, у важких випадках — кома), опорно-руховому апараті (остеомаляція, міопатія, фосфопенічний рахіт у дітей).
Причинами збільшення вмісту фосфатів у плазмі крові — гіперфосфатемії— можуть бути такі фактори:
а) посилене надходження фосфатів із клітин і тканин організму в кров (важке фізичне навантаження, гемоліз еритроцитів, лейкози, метастази й первинні злоякісні пухлини кісток);
б) порушення виведення фосфатів нирками (гіпопаратиреоз, недостатність нирок).
При гіперфосфатемії створюються сприятливі фізико-хімічні умови для утворення оксіапатиту в м'яких тканинах - розвивається їх кальцифікація.
25. Порушення кислотно-основного стану
25.1. Які буферні системи беруть участь у підтриманні кислотно-основного гомеостазу?
1. Гідрокарбонашна буферна система. її компонентами є вугільна кислота Н2СО. і гідрокарбонат натрію NaHC03 у співвідношенні 1:20. Підтримує сталість рН у плазмі крові й міжклітинній рідині.
2. Фосфатна буферна система. Представлена кислою (NaH2P04) і основною (Na,HP04) натрієвими солями фосфорної кислоти у співвідношенні 1:4. Бере участь у регуляції кислотно-основного стану в нирках та інших тканинах.
3. Гемоглобіновий буфер. Він представлений відновленим гемоглобіном і калієвою сіллю окисненого гемоглобіну. Діє в еритроцитах, попереджаючи зміни рН унаслідок постійного надходження із тканин вуглекислого газу.
4. Білковий буфер. Забезпечує підтримку сталості внутрішньоклітинного рН.
25.2. Яку участь бере система зовнішнього дихання в регуляції кислотно-основного стану?
Система зовнішнього дихання забезпечує сталість напруги вуглекислого газу в артеріальній крові.
При збільшенні рСО,, (гіперкапнія) стимулюється дихальний центр, розвивається гіпервентиляція й надлишок С02 виводиться з організму з видихуваним повітрям.
При зменшенні рС02 (гіпокапнія), навпаки, відбувається пригнічення дихального центру, розвивається гіповентиляція й CO, затримується в організмі.
25.3. Які процеси в нирках беруть участь у регуляції кислотно-основного стану?
1. Ацидогенез — утворення і секреція у просвіт ниркових канальців іонів водню. Відбувається у проксимальних і дистальних звивистих канальцях нефронів (рис. 89).
2. Амоніогепез - утворення і секреція в просвіт канальців аміаку. Цей процес попереджає зменшення рН сечі нижче 4,5 і пов'язане з цим ушкодження клітин ка-нальцевого епітелію (рис. 90).
3. Реабсорбція гідрокарбонату. Здійснюється в проксимальних звивистих канальцях нефронів при участі процесів ацидогснезу (рис. 91).

Рис. 89. Схема ацидогенезу в нирках
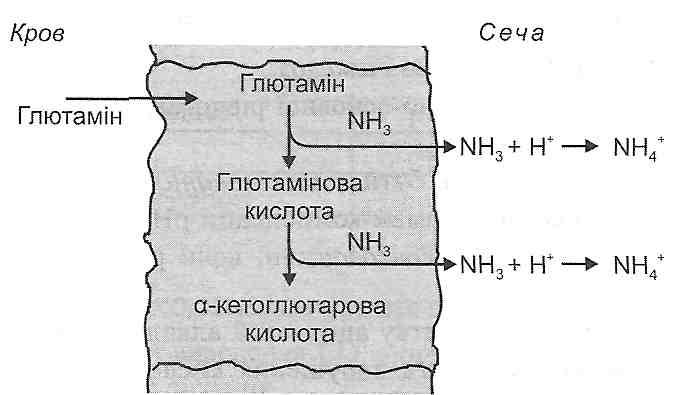
Рис. 90. Схема амоніогенезу в нирках

Рис. 91. Механізми реабсорбції гідрокарбонату в нирках
25.4. У чому полягає основна функціональна відмінність процесів ацидогенезу, що відбуваються в проксимальних і дистальних звивистих канальцях ниркових нефронів?
У проксимальних звивистих канальцях ацидогенез забезпечує реабсорбцію гідрокарбонату. Тут виявляється така залежність: що вищий рС02 артеріальної крові^ то вища інтенсивність ацидогенезу, то більша кількість гідрокарбонату може бути реабсорбована, і навпаки (рис. 92).

Рис. 92. Зв'язок міжрС02, ацидогенезом і реабсорбцією гідрокарбонату в нирках
Ацидогенез у дистальних звивистих канальцях забезпечує підкислення сечі, тобто її ацидифікацію. При цьому відбувається відтитровування гідрокарбонату плазми крові, завдяки чому зберігається її лужний резерв.
25.5. Назвіть основні форми порушень кислотно-основного стану.
Існує два типи порушень: ацидоз і алкалоз.
Ацидоз— це зміщення кислотно-основної рівноваги в кислий бік, алкалоз- у лужний.
Ацидози й алкалози можуть бути компенсованими, коли завдяки буферним системам і фізіологічним механізмам компенсації рН крові не виходить за межі фізіологічних коливань, і декомпенсованими, коли рН крові виходить за межі норми.
Залежно від механізмів розвитку ацидози й алкалози можуть бути газовими й негазовими. Газовими називають порушення кислотно-основного стану, обумовлені первинною зміною напруги вуглекислого газу в артеріальній крові. Не-газові порушення пов'язані з первинними змінами концентрації гідрокарбонату в крові.
25.6. Які показники використовують для характеристики порушень кислотно-основного стану?
Основні показники:
1) рН артеріальної крові (у нормі 7,37-7,43);
2) рС02 артеріальної крові (35-45 мм рт. ст.);
3) SB - стандартний гідрокарбонат (22-26 ммоль/л).
Додаткові показники:
1) ВВ - буферні основи (40-48 ммоль/л);
2) BE - зсув буферних основ (-2,5 - +2,5 ммоль/л).
25.7. Що таке газовий ацидоз?
Газовим називають ацидоз, основу якого становить збільшення напруги вуглекислого газу в крові (гіперкапнія).
25.8. Назвіть причини газового ацидозу.
1. Порушення виведення С02 з організму при всіх видах гіповентиляції (недостатність зовнішнього дихання) - ендогенний газовий ацидоз.
2. Вдихання повітря з високим вмістом CO, (тривале перебування в закритих приміщеннях з поганою вентиляцією, шахтах, підводних човнах) - екзогенний газовий ацидоз.
25.9. Які захисно-компенсаторні реакції розвиваються при газовому ацидозі?
Захисно-компенсаторні реакції при газовому ацидозі спрямовані на збільшення концентрації гідрокарбонату в плазмі крові і забезпечуються нирками. Тут посилюється ацидогенез у дистальних звивистих канальцях, що веде до утворення додаткової кількості гідрокарбонату. Посилення ацидогенезу в проксимальних звивистих канальцях забезпечує повну його реабсорбцію.
25.10. Які зміни показників кислотно-основного стану характерні для газового ацидозу?

25.11. Як здійснюють корекцію газового ацидозу?
Необхідно забезпечити виведення С02 з організму, для чого усувають причини недостатності зовнішнього дихання.
25.12. Що таке негазовий ацидоз?
Негазовий - це такий ацидоз, основу якого становить зменшення концентрації гідрокарбонату в плазмі крові.
25.13. Які види негазового ацидозу виділяють з урахуванням причин його виникнення?
1. Метаболічний ацидоз. 2. Екзогенний негазовий ацидоз. 3. Видільний ацидоз.
25.14. Що таке метаболічний негазовий ацидоз?
Метаболічний — це ацидоз, основу якого становить накопичення в організмі ендогенних кислот-метаболітів. Він розвивається при цукровому діабеті І типу (накопичуються кетонові тіла і молочна кислота), гіпоксії (молочна кислота), голодуванні (кетонові тіла), нирковій недостатності (фосфати, сульфати, сечова кислота), подагрі (сечова кислота).
25.15. Що таке екзогенний негазовий ацидоз?
Екзогенний негазовий - це ацидоз, що виникає внаслідок надходження або введення в організм екзогенних нелетких кислот. Може розвиватися при тривалому споживанні кислих продуктів, прийманні деяких ліків, зокрема, хлориду амонію; при отруєннях.
25.16. Що таке видільний ацидоз?
Видільний - це ацидоз, що виникає внаслідок втрати гідрокарбонату організмом при порушенні функціонування нирок і травної системи. Його різновидами є:
1) проксимальний нирковий канальцевий ацидоз. Розвивається в результаті первинних порушень реабсорбції гідрокарбонату в проксимальних звивистих канальцях;
2) дистальний нирковий канальцевий ацидоз. Розвивається внаслідок первинних порушень ацидогенезу в дистальних звивистих канальцях;
3) видільні ацидози, пов'язані з порушеннями діяльності травної системи:
а) втрата гідрокарбонату з підшлунковим соком при діареї;
б) гіперсалівація.
25.17. Які захисно-компенсаторні реакції розвиваються при негазовому ацидозі?
I. Дихальні механізми компенсації спрямовані на зменшення рС00. При збільшенні концентрації іонів водню збуджується дихальний центр, розвивається гіпервен-тиляція і збільшується виведення CO, з організму.
II. Ниркові механізми компенсації спрямовані на збереження гідрокарбонату в організмі. Зменшення рН крові викликає активацію ацидогенезу в дистальних звивистих канальцях. Завдяки цьому гідрокарбонат сечі відтитровується і зберігається в організмі, а рН сечі зменшується, тобто відбувається її ацидифікація.
25.18. Які зміни показників кислотно-основного стану характерні для негазового ацидозу?

25.19. Що таке негазові ацидози зі збільшеною й нормальною аніонною різницею?
Аніонною різницею називають різницю концентрації іонів натрію і суми концентрацій аніонів гідрокарбонату і хлору в плазмі крові. У нормі вона становить 8-16 мекв/л (рис. 93).
Якщо зменшення концентрації гідрокарбонату при ацидозі покривається збільшенням концентрації інших аніонів, крім хлору, то аніонна різниця зростає. До таких ацидозів відносять усі метаболічні і екзогенні ацидози, крім тих, що обумовлені введенням хлоридів або попередників НС1.
При негазових ацидозах з нормальною аніонною різницею зменшення концентрації гідрокарбонату в плазмі крові покривається збільшенням концентрації аніонів хлору, тобто розвивається гіперхлоремія. До таких ацидозів відносять усі видільні ацидози й ацидози, що виникають при введенні хлоридів або попередників НС1.

Рис. 93. Вміст катіонів і аніонів у плазмі крові
25.20. Як здійснюють корекцію негазового ацидозу?
Корекція цього порушення має бути спрямована на нормалізацію концентрації гідрокарбонату в плазмі крові. Для цього внутрішньовенно вводять розчини гідрокарбонату натрію NaHCOr
25.21. Які власне патологічні зміни виникають в організмі при декомпенсованих ацидозах?
1. Ацидотичне ушкодження клітин (див. розд. 11).
2. Ацидотична кома (див. розд. 12).
3. Пригнічення скоротливої функції серця. Розвивається внаслідок блокади іонами водню кальцієвих каналів плазматичної мембрани й тропонінових центрів зв'язування кальцію в кардіоміоцитах.
25.22. Що таке газовий алкалоз?
Газовим називають алкалоз, основу якого становить зменшення напруги вуглекислого газу в крові (гіпокапнія).
25.23. Назвіть причини газового алкалозу.
Причиною газового алкалозу є гіпервентиляція легень. Вона буває при:
а) безпосередньому збудженні дихального центру (пухлини головного мозку, енцефаліти);
б) рефлекторному його збудженні при подразненні периферичних хеморецепторів (гірська хвороба, гарячка);
в) неправильно здійснюваному керованому штучному диханні.
25.24. Які захисно-компенсаторні реакції виникають при газовому алкалозі?
Компенсаторні реакції при газовому алкалозі спрямовані на зменшення концентрації гідрокарбонату в плазмі крові й забезпечуються нирками.
При зменшенні рС02, крові зменшується інтенсивність ацидогенезу в проксимальних звивистих канальцях нефронів, що веде до зменшення реабсорбції гідрокарбонату. Наслідком цього є збільшення рН сечі, з одного боку, і зменшення концентрації гідрокарбонату в плазмі крові, з другого.
25.25. Як здійснюють корекцію газового алкалозу?
Корекція цього порушення спрямована на збільшення напруги вуглекислого газу в крові, тобто на боротьбу з гіпокапнією. З цією метою для дихання використовують газові суміші, багаті С09, наприклад карбоген, що складається із 02 (95 %) і С02
(5%). " V *' •"'" :"
25.26. Які зміни показників кислотно- основного стану характерні для газового алкалозу?

25.27. Що таке негазовий алкалоз?
Пегозовим називають алкалоз, основу якого становить збільшення концентрації гідрокарбонату в плазмі крові.
25.28. Які види негазового алкалозу виділяють з урахуванням причин його виникнення?
I. Видільний негазовий алкалоз:
а) гіпохлоремічний;
б) гіпокаліємічний.
II. Екзогенний негазовий алкалоз (гіпернатріємічний).
25.29. Що таке гіпохлоремічний алкалоз?
Гіпохлоремічним називають алкалоз, пов'язаний із втратою аніонів хлору, у результаті чого розвивається гіпохлоремія. При цьому втрата аніонів хлору поповнюється збільшенням концентрації аніонів гідрокарбонату.
Найчастішою причиною розвитку такого алкалозу є нестримна блювота.
25.30. Що таке гіпокаліємічний алкалоз?
Гіпокаліємічним називають алкалоз, який розвивається внаслідок втрати організмом іонів калію.
Найчастішою причиною його виникнення є гіперальдостероиізм, при якому збільшується секреція іонів калію в сечу й розвивається гіпокаліємія.
25.31. Що таке екзогенний (гіпернатріємічний) алкалоз?
Екзогенний- це алкалоз, пов'язаний з надходженням в організм екзогенних основ. Найчастіше буває при введенні великої кількості гідрокарбонату натрію NaHC03, наприклад, при неправильній корекції негазового ацидозу.
25.32. Які зміни показників кислотно- основного стану характерні для негазового алкалозу?

25.33. Які захисно-компенсаторні реакції розвиваються при негазовому алкалозі?
Компенсаторні реакції в цих умовах спрямовані на збільшення напруги вуглекислого газу в крові й забезпечуються системою зовнішнього дихання. При збільшенні рН зменшується збудливість і пригнічується дихальний центр, що призводить до гі-повентиляції легень. Як наслідок, зменшується виведення С02, і рС02 крові зростає.
25.34. Як здійснюють корекцію негазового алкалозу?
При гіпохяоремічному алкалозі для відновлення концентрації аніонів хлору в плазмі крові вводять розчини хлориду амонію NH4C1.
При гіпокаліємічному алкалозі введенням в організм хлориду калію КСІ відновлюють концентрацію іонів калію.
В умовах екзогенного (гіпернатріємічного) алкалозу вводять діуретики - інгібітори карбоангідрази з метою пригнічення ацидогенезу в проксимальних звивистих канальцях нефронів і зменшення реабсорбції гідрокарбонату.
25.35. Які власне патологічні зміни виникають в організмі при декомпенсованих алкалозах?
1. Клітинний алкалоз. Призводить до:
а) порушення конформації й властивостей структурних, функціональних білків і білків-ферментів;
б) збільшення гідрофільності клітинних колоїдів, унаслідок чого розвивається набряк клітини;
в) порушення окисного фосфорування в мітохондріях.
2. Гіпокальціємія (див. розд. 24).
25.36. Який зв'язок існує між порушеннями кислотно-основного стану і порушеннями електролітного обміну?
Первинні порушення кислотно-основного стану закономірно ведуть до вторинних порушень обміну електролітів, і навпаки, первинні порушення обміну електролітів викликають розвиток вторинних порушень кислотно-основного стану.
Найтісніший зв'язок існує між порушеннями кислотно-основного стану й обміном іонів калію.
При декомпенсованих ацидозах розвивається гіперкаліємія, а при гіперкаліємії— ацидоз. Це багато в чому пояснюється змінами процесів секреції іонів калію й водню в дистальних звивистих канальцях ниркових нефронів.
При ацидозі посилення ацидогенезу в нирках супроводжується зменшенням секреції калію, у результаті чого його концентрація в плазмі крові зростає. Якщо ж первинно розвивається гіперкаліємія, то вона викликає посилення процесів секреції іонів калію в ниркові канальці й пригнічення ацидогенезу. Наслідком цього є збільшення концентрації іонів водню в плазмі крові, тобто розвивається ацидоз.
В умовах декомпенсованого алкалозу закономірно виникає гіпокаліємія, а в результаті первинної гіпокалїємії — вторинно алкалоз. При алкалозі в результаті пригнічення процесів ацидогенезу в нирках посилюється секреція іонів калію — розвивається гіпокаліємія. При первинній гіпокаліємії внаслідок зменшення секреції калію в ниркові канальці значно зростає інтенсивність ацидогенезу. У результаті збільшення секреції іонів водню в сечу їхня концентрація в плазмі крові зменшується, тобто розвивається алкалоз.
Зміни вмісту іонів натрію в плазмі крові також можуть супроводжуватися порушеннями кислотно-основного стану, якщо при цьому змінюється концентрація іонів гідрокарбонату (а не хлору). Так, при гіпернатріємії зі збільшенням концентрації гідрокарбонату розвивається алкалоз, і навпаки, гіпонатріємія, пов'язана зі зменшенням вмісту гідрокарбонатних аніонів у плазмі крові, є причиною ацидозу.
Збільшення концентрації іонів хлору в плазмі крові (гіперхлоремія) при нормальному рівні іонів натрію супроводжується розвитком ацидозу й, відповідно, зменшення вмісту іонів хлору (гіпохлоремія), якщо воно не пов'язане з гіпонатріємією, є причиною алкалозу.
Частина II. ПАТОЛОГІЧНА ФІЗІОЛОГІЯ ОРГАНІВ І СИСТЕМ
26. Патологічна фізіологія системи крові
26.1. Які функціональні, морфологічні й регуляторні особливості системи крові впливають на характер, етіологію й патогенез патологічних процесів у цій системі?
1. Генетична детермінованість розмноження, диференціювання, обміну речовин і структури клітин усіх кров'яних паростків, з якою можуть бути пов'язані геномні порушення або зміни генетичної регуляції, що часто виступають причиною захворювань у системі крові (лейкоз, спадкова нейтропенія, гемолітична анемія та ін.).
2. Висока мітотична активність гемопоетичної тканини, що обумовлює її підвищену вразливість при дії мутагенних факторів (іонізуюча радіація, віруси, хімічні мутагени), цитостатиків, при дефіциті пластичних матеріалів (заліза, ціанокоба-ламіну й фолієвої кислоти, білків). Це призводить до розвитку лейкозу, дефіцитної анемії, лейко- і тромбоцитопенії, виникнення мутантних клонів лімфоцитів, що продукують антитіла проти власних клітин крові (аутоімунні анемії, лейко- і тромбоцитопенія).
3. Регуляція утворення клітин крові за допомогою еритро-, лейко- і тромбоцитопо-етинів, при дефіциті яких виникають патологічні зміни крові.
4. Патогенні агенти (бактерії, віруси, ендо- і екзогенні хімічні речовини), що потрапляють у кров, можуть викликати лізис кров 'яних клітин (наприклад, еритроцитів при гемолітичній анемії) і порушення їхньої антигенної структури. Це, у свою чергу, може зумовлювати вторинний цитоліз унаслідок аутоімунних реакцій.
5. Ушкодження судин викликає крововтрату, при якій зменшується загальний об'єм крові й порушуються її функції.
26.2. Які ознаки свідчать про порушення в системі крові?
Такими ознаками є зміни:
1) загального об'єму крові;
2) кількості, структури й функції клітин крові - еритроцитів, лейкоцитів, тромбоцитів - унаслідок порушень кровотворення або руйнування формених елементів крові;
3) гемостазу;
4) біохімічних і фізико-хімічних властивостей крові.
Ці зміни виникають:
а) при дії патогенних факторів безпосередньо на систему крові;
б) у результаті порушень її нейрогуморальної регуляції;
в) при ураженні інших органів і систем. У цьому випадку кров реагує вторинно.
Висока частота вторинних змін у системі крові обумовлена її функціональними особливостями. Так, збільшення утворення еритроцитів, що забезпечують дихальну функцію крові (транспорт 02 і С02), є компенсаторною реакцією системи крові на гіпоксію. При інфекційних хворобах часто посилюється лейкопоез, у крові збільшується кількість лейкоцитів, що беруть участь у захисних, у тому числі імунних, реакціях організму. У випадку ушкодження судин насамперед активується система зсідання крові і система фібринолізу, що забезпечує зупинку кровотечі (гемостаз).
Патологія системи крові може виявляти себе як самостійними захворюваннями (наприклад, гемофілія, анемія Аддісона-Бірмера, гострий мієлобластний лейкоз), так і гематологічними синдромами, що супроводжують хвороби інших органів і систем (наприклад, при деяких уроджених вадах серця, нейтрофільний лейкоцитоз при захворюваннях, спричинених гнійною інфекцією).
26.3. Назвіть види порушень загального об'єму крові. Наведіть приклади.
Порушення об'єму крові виявляють себе гіповолемієїо або гіперволемією — зменшенням або збільшенням об'єму крові, якщо порівнювати з нормою (нормоволемією).
Гіпо- і гіперволемію поділяють на просту (зберігається нормальне співвідношення плазми і клітин крові), поліцитемічну (переважають клітини крові) і олігоци-темічну (переважає плазма).
Крім того, до порушень об'єму крові відносять зміни об'ємного співвідношення між клітинними елементами і плазмою при нормальному загальному об'ємі крові — оліго- і поліцитемічну нормоволемію (гемодилюція і гемоконцентрація). Показником об'ємного співвідношення є гематокрит, що визначає вміст клітинних елементів (переважно еритроцитів) у загальному об'ємі крові (у нормі 0,36-0,48, або 36-48 %).
Гіповолемія проста — зменшення об'єму крові без зміни гематокриту. Виникає відразу після гострої крововтрати і зберігається доти, доки рідина не перейде із тканини в кров.
Гіповолемія олігоцитемічна — зменшення об'єму крові з переважним зменшенням у ній клітин - еритроцитів. Спостерігається при гострій крововтраті в тих випадках, коли надходження крові й тканинної рідини в кровоносне русло не компенсує об'єм і особливо склад крові.
Гіповолемія поліцитемічна—зменшення об'єму крові внаслідок зменшення об'єму плазми при відносному збільшенні вмісту еритроцитів. Розвивається при зневодненні організму (пронос, блювота, посилене потовиділення, гіпервентиляція), шоку (вихід рідини в тканини внаслідок підвищення проникності стінок судин).
Гіперволемія проста— збільшення об'єму крові при збереженні нормального співвідношення між еритроцитами і плазмою. Виникає відразу ж після переливання великої кількості крові. Однак незабаром рідина виходить з кровоносного русла, а еритроцити залишаються, що веде до згущення крові. Проста гіперволемія при посиленій фізичній роботі обумовлена надходженням у загальний кровообіг крові з депо.
Гіперволемія олігоцитемічна — збільшення об'єму крові за рахунок плазми. Розвивається при затримці води в організмі у зв'язку із захворюваннями нирок, при вве-
денні кровозамінників. її можна моделювати в експерименті шляхом внутрішньовенного введення тваринам ізотонічного розчину натрію хлориду.
Гіперволемія поліцитемічна — збільшення об'єму крові за рахунок наростання кількості еритроцитів. Спостерігається при зниженні атмосферного тиску, а також при різних захворюваннях, пов'язаних з кисневим голодуванням (вади серця, емфізема), її розглядають як компенсаторне явище.
Однак при еритремії поліцитемічна гіперволемія є наслідком пухлинного розростання клітин еритроцитарного ряду кісткового мозку.
Олігоцитемічна нормоволемія виникає при анемії внаслідок крововтрати (об'єм крові нормалізувався за рахунок тканинної рідини, а кількість еритроцитів ще не відновилася), при гемолізі еритроцитів, порушеннях гемопоезу.
Поліцитемічна нормоволемія спостерігається при переливанні невеликих кількостей еритроцитарної маси.
26.4. Чим обумовлене патогенетичне значення гіпо- і гіперволемії?
Гіповолемія супроводжується порушенням дихальної й транспортної функцій еритроцитів; трофічної, екскреторної, захисної, регуляторної функцій крові. Це так чи інакше відбивається на сталості внутрішнього середовища організму (гомеостазі).
Гіперволемія обумовлює збільшення навантаження на серце. У випадку одночасного збільшення гематокриту (поліцитемічна гіперволемія) збільшується в'язкість крові, що може бути причиною порушень мікроциркуляції й провокувати утворення тромбів.
26.5. Що таке крововтрата? Які причини викликають крововтрату? Від чого залежать її перебіг і завершення?
Крововтрата - це патологічний процес, що виникає внаслідок кровотечі і характеризується складним комплексом патологічних порушень і компенсаторних реакцій, спрямованих проти зменшення об'єму циркулюючої крові й гіпоксії, обумовленої зниженням дихальної функції крові.
До етіологічних факторів, що викликають кровотечу, відносять:
1) порушення цілісності судин при пораненні або ураженні патологічним процесом (атеросклероз, пухлина, туберкульоз);
2) підвищення проникності судинної стінки (гостра променева хвороба);
3) зниження зсідання крові (геморагічний діатез).
Перебіг і результат крововтрати залежать від особливостей самої кровотечі (швидкості, величини, виду ушкодженої судини, механізму ушкодження); швидкості включення й вираженості компенсаторних реакцій організму; статі, віку, станів, що передують і супроводжують крововтрату (охолодження, травма, захворювання серця, глибокий наркоз). Серйозну небезпеку для життя людини являє втрата 50 % об'єму циркулюючої крові, смертельною є втрата крові понад 60 %.
26.6. Які стадії умовно виділяють у патогенезі гострої крововтрати?
І. Початкова стадія. Характеризується зменшенням об'єму циркулюючої крові -простою гіповолемією, зниженням артеріального тиску, гіпоксією переважно циркуляторного типу.
II. Компенсаторна стадія. Обумовлена здійсненням комплексу захисно-компенсаторних реакцій, спрямованих на ліквідацію наслідків втрати крові.
III. Термінальна стадія. Характеризується наростанням патологічних змін в організмі аж до настання смерті. Розвивається при недостатності компенсаторних реакцій, а також при інтенсивній і швидкій крововтраті, на тлі дії несприятливих факторів (охолодження, велика травма, серцево-судинні захворювання) і при відсутності лікувальних заходів.
26.7. Що є головною ланкою патогенезу гострої крововтрати?
У патогенезі гострої крововтрати центральне місце посідають порушення загальної гемодинаміки — зменшення об 'єму циркулюючої крові (гіповолемія) і обумовлене цим падіння артеріального тиску (гіпотензія) (рис. 94).
Зазначені порушення, з одного боку, є причиною розвитку власне патологічних змін в організмі (анемії, гіпоксії, ацидозу, інтоксикації), з другого- вмикають складний комплекс рефлекторних і гуморальних захисно-компенсаторних реакцій, спрямованих на відновлення й збереження гомеостазу.

Рис. 94. Головна ланка патогенезу гострої крововтрати
26.8. Які захисно-компенсаторні реакції закономірно розвиваються при крововтраті?
Залежно від строків виникнення захисні реакції організму поділяють на термінові і нетермінові.
Залежно від спрямованості виділяють такі групи механізмів компенсації: Іо4 спрямовані на зменшення об'єму судинного русла;
2) спрямовані на збільшення об'єму циркулюючої крові;
3) спрямовані на відновлення складу крові;
4) спрямовані на захист від гіпоксії-(див. розд. 19).
26.9. Які компенсаторні реакції організму спрямовані на зменшення об'єму судинного русла в початковій стадії крововтрати?
Мета цієї групи реакцій — привести у відповідність об'єм судинного русла зменшеному об'єму циркулюючої крові (централізація кровообігу). Це дає можливість на деякий час підтримати необхідний тиск крові й забезпечити кровопостачання життєво важливих органів.
Зазначені реакції- термінові, у їхньому розвитку провідне значення мають рефлекси.
Зменшення об'єму судинного русла при крововтраті обумовлюється такими змінами (рис. 95):
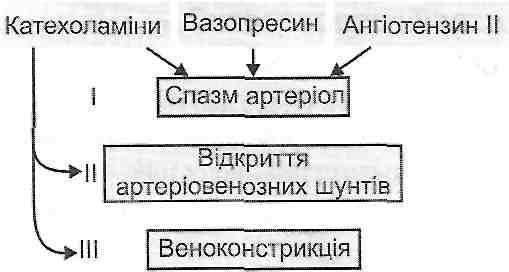
Рис. 95. Механізми централізації кровообігу при гострій крововтраті
1) спазм артеріол шкіри, м'язів, органів травної системи;
2) відкриття артеріовенозних анастомозів зазначених органів і тканин у результаті спазму прекапілярних сфінктерів;
3) веноконстрикція (скорочення гладких м'язів вен), що збільшує надходження крові до серця і зменшує ємність венозного відділу кровообігу.
В основі цих змін лежать такі механізми:
а) зниження артеріального тиску → збудження барорецепторів → активація симпа-тоадреналової системи → дія катехоламінів на а-адренорецептори гладких м'язів артерій, артеріол, прекапілярних сфінктерів і вен;
б) зменшення об'єму циркулюючої крові й артеріального тиску → збудження волю-мо- і барорецепторів → активація нейросекрсторних клітин гіпоталамуса, що продукують вазопресин → дія цього гормону на Vj-рецептори гладких м'язів судин з наступною вазоконстрикцією;
в) зменшення об'єму циркулюючої крові й активація симпатоадреналової системи → вивільнення клітинами юкстагломерулярного апарату нирок реніну → активація ренін-ангіотензинної системи з утворенням ангіотензину II → спазм гладких м'язів кровоносних судин.
26.10. У чому сутність компенсаторних реакцій організму, спрямованих на збільшення об'єму циркулюючої крові при крововтраті?
Реакції цієї групи здійснюються в період часу від кількох годин до кількох діб після кровотечі.
Збільшення об'єму циркулюючої крові в зазначений проміжок часу досягається за допомогою таких механізмів.
1. Перехід тканинної рідини в кровоносні судини. Основу цього процесу становить механізм, описаний Старлінгом. У результаті зменшення об'єму циркулюючої крові зменшується гідростатичний тиск у капілярах, що призводить до зменшення фільтрації води в артеріальній частині капілярів і збільшенню реабсорбції рідини у венозній. До зменшення гідростатичного тиску в капілярах призводить також розвиток спазму артеріол.
2. Посилення реабсорбції води та іонів натрію в нирках. Ця реакція, що запобігає втраті рідини із сечею, обумовлена такими механізмами:
а) дія вазопресину (антидіуретичного гормону) на У,-рецептори епітелію дистальних звивистих канальців і збірних трубок нирок, у результаті чого збільшується факультативна реабсорбція води;
б) активація ренін-ангіотензинної системи з наступним вивільненням альдостерону, що посилює реабсорбцію натрію в дистальних звивистих ка-нальцях нефронів;
в) активація симпатоадреналової системи, що призводить до перерозподілу течії крові між судинами кортикальних і юкстамедулярних нефронів, у результаті чого зростає площа й інтенсивність канальцевої реабсорбції води й натрію. 3. Вихід крові з депо в кровоносне русло. Основу цієї реакції становить активація симпатоадреналової системи й дія катехоламінів на судини печінки, селезінки, підшкірної жирової клітковини.
26.11. Які компенсаторні реакції забезпечують відновлення складу периферичної крові при крововтраті?
Відновлення складу периферичної крові забезпечується довгостроковими реакціями, які здійснюються в період часу від кількох діб до 1—2 тижнів після кровотечі. Вони виникають у відповідь на циркуляторну (зменшення об'єму циркулюючої крові) і гемічну (анемічну) гіпоксію. Основне значення надають кисневому голодуванню нирок, наслідком якого є утворення і надходження в кров великої кількості ниркових еритропоетинів. Останні діють на кровотворні клітини червоного кісткового мозку (еритропоетинчутливі клітини III класу) і стимулюють еритропоез - збільшується надходження молодих регенераторних форм еритроцитів у периферичну кров.
26.12. Які власне патологічні зміни можуть розвиватися при крововтраті?
1. Порушення системної' гемодинаміки (зменшення об 'єму циркулюючої крові, падіння артеріального тиску) і місцевого кровообігу (мікроциркуляції) аж до розвитку шоку.
2. Гостра постгеморагічна анемія (див. запит. 26.1.11).
3. Гіпоксія. Спочатку є циркуляторною, а потім гемічною (анемічною).
4. Негазовий ацидоз. Обумовлений гіпоксією й надходженням у кров молочної кислоти.
5. Порушення екскреторної функції нирок. При падінні артеріального тиску зменшується інтенсивність клубочкової фільтрації й розвиваються явища гострої ниркової недостатності: оліго- і анурія, інтоксикація (азотемія).
26.13. Що таке геморагічний шок? Назвіть головні патогенетичні ланки його розвитку.
Геморагічний шок — це шок, що виникає в результаті інтенсивної гострої крововтрати (рис. 96).
Провідним механізмом його розвитку є зменшення об 'єму циркулюючої крові, що викликає падіння

Рис. 96. Схема патогенеза геморагічного шоку
артеріального тиску, порушення мікроциркуляції, розлади кровопостачання життєво важливих органів (головного мозку, серця, нирок). Наслідком цього є розвиток гіпоксії, ацидозу й інтоксикації, що погіршує перебіг шоку, створює "зачаровані кола" у його патогенезі і в кінцевому підсумку веде до смерті.
26.1. Порушення системи еритроцитів
26.1.1. Якими кількісними змінами можуть виявляти себе патологічні процеси, пов 'язані з червоним паростком крові? Чим вони можуть бути обумовлені?
У нормі кількість еритроцитів у чоловіків дорівнює 4 -10і2-5 -1012, у жінок -3,5 -1012 — 4,5 -1012 в 1 л крові. Концентрація гемоглобіну у чоловіків становить 130-160, у жінок- 120-140 г/л.
В умовах патології можливі два види змін кількості еритроцитів і гемоглобіну в периферичній крові:
1) еритроцитоз - збільшення вмісту еритроцитів і гемоглобіну;
2) анемія — зменшення їх кількості.
Кількісні зміни еритроцитів можуть бути обумовлені:
а) порушенням співвідношення між їх утворенням (еритропоезом) і руйнуванням (еритродієрезом);
б) втратою еритроцитів при порушенні цілісності судин (крововтрата);
в) перерозподілом еритроцитів.
26.1.2. Які якісні зміни еритроцитів характерні для порушень червоного паростка крові? Чим вони можуть бути обумовлені?
До якісних змін еритроцитів відносять:
1) їхні регенераторні форми;
2) дегенеративні зміни еритроцитів;
3) клітини патологічної регенерації.
Причинами якісних змін еритроцитів можуть бути:
а) порушення дозрівання еритроцитів у червоному кістковому мозку або збільшення проникності кістковомозкового бар'єра, у результаті чого збільшується надходження в кров незрілих клітин з низьким вмістом гемоглобіну (регенераторні форми еритроцитів);
б) зміна типу кровотворення з еритробластичного на мегалобластичний, коли в кістковому мозку й крові з'являються мегалобласти і мегалоцити (клітини патологічної регенерації);
в) набуті і спадкові порушення обміну речовин, складу й структури еритроцитів, у тому числі синтезу гемоглобіну (зменшення утворення або синтез аномальних гемоглобінів), що веде до появи в крові дегенеративних форм еритроцитів.
26.1.3. Які клітини належать до регенераторних форм еритроцитів? Дайте їх коротку характеристику.
Регенераторні форми еритроцитів (клітини фізіологічної регенерації) — це молоді незрілі клітини червоного паростка крові, надходження яких у периферичну кров свідчить про посилення регенерації клітин еритроїдного ряду в червоному кістковому мозку або збільшення проникності кістковомозкового бар'єра.
До регенераторних форм відносять:
а) ретикулоцити (рис. 97; див. форзац). їх виявляють у мазку крові при суправі-тальному фарбуванні (барвник— бриліанткрезилблау). Являють собою без'ядерні клітини брудно-зеленого забарвлення (кольори "болотної зелені") із чорними включеннями у вигляді гранул (substantia granulofilamentosa). У нормі їхній вміст у крові становить 0,2-2 %. При посиленій регенерації клітин червоного паростка крові їх кількість може зростати до 50 %;
б) поліхроматофіли (рис. 98; див. форзац). їх виявляють у мазку крові при фарбуванні за Романовським-Гімза. Є без'ядерними клітинами, цитоплазма яких виявляє властивість поліхроматофілії, тобто сприймає як кислотні, так і основні барвники. Тому поліхроматофіли відрізняються від зрілих еритроцитів ціанотичним відтінком свого забарвлення. Власне кажучи, ретикулоцити і поліхроматофіли є клітинами однакового ступеня зрілості - безпосередніми попередниками еритроцитів. Різні назви пов'язані з різними їхніми властивостями, які виявляються при різних способах фарбування;
в) нормобласти (ацидофільні, поліхроматофільні, базофільні). Це ядерні попередники еритроцитів. У нормі в периферичній крові їх нема, вони містяться тільки в червоному кістковому мозку. При посиленій регенерації клітин еритроїдного ряду можуть з'являтися в крові ацидофільні і поліхроматофільні, рідше базофільні нормобласти. Іноді, при гіперрегенеративних анеміях, у крові можна виявити еритробласти (попередники нормобластів).
26.1.4. Які дегенеративні зміни можуть бути характерні для еритроцитів в умовах патологічних процесів, пов'язаних з червоним паростком крові?
Дегенеративними називають якісні зміни еритроцитів, що свідчать про неповноцінність цих клітин.
Такі зміни характеризуються такими явищами (рис. 99, 100; див. форзац):
а) анізоцитоз — зміна величини еритроцитів. Можлива поява макроцитів — еритроцитів з діаметром понад 8 мкм і мікроцитів — клітин, діаметр яких менший 6,5 мкм (середній діаметр нормального еритроцита близько 7,2 мкм);
б) пойкілоцитоз — зміна форми еритроцитів. У нормі еритроцити мають форму дисків, увігнутих всередину з обох боків. В умовах патології можуть з'являтися грушоподібні, витягнуті, серпоподібні, овальні еритроцити, а також еритроцити сферичної форми (сфероцити);
в) зміна забарвлення еритроцитів, що залежить від вмісту в них гемоглобіну. Еритроцити, інтенсивно забарвлені, називають гіперхромними, із блідим забарвлен-
ням - гіпохромними. Еритроцити, у яких забарвлена у вигляді кільця тільки периферична частина, де міститься гемоглобін, а в центрі - просвітління, мають назву анупоцитів. У випадку, коли еритроцити виявляють різну інтенсивність забарвлення ведуть мову про анізохромію; г) наявність патологічних включень. До них, зокрема, відносять тільця Жоллі-утворення розміром 1-2 мкм, які є залишками ядерної субстанції; кільгія Кебо-та - залишки ядерної оболонки, що мають форму кільця або вісімки; базофільна зернистість — залишки базофільної речовини цитоплазми, що свідчать про токсичне ураження червоного кісткового мозку.
26.1.5. Які клітини еритроцитарного ряду відносять до клітин патологічної регенерації?
При зміні типу кровотворення з еритробластичного на мегалобластичний у крові з'являються так звані клітини патологічної регенерації (рис. 101; див. форзац):
а) мегалобласти - дуже великі клітини (діаметром 12-15 мкм) з базофільною, по-ліхроматофільною або ацидофільною цитоплазмою, що містять велике, зазвичай ексцентрично розташоване ядро з ніжною хроматиновою ґраткою;
б) мегалоцити — без'ядерні клітини, які утворюються при дозріванні мегалобластів. Мають діаметр 10-12 мкм і більше, зазвичай інтенсивно забарвлені, злегка овальної форми, без властивого еритроцитам просвітління в центральній частині.
Поява зазначених клітин у червоному кістковому мозку й крові характерна для так званих мегалобластичних анемій, зокрема, Вр-фолієводефіцитної анемії.
26.1.6. Що таке єритроцитоз? Які причини й механізми його розвитку?
Еритроцитоз — це збільшення в крові кількості еритроцитів понад б • 1012 віл і концентрації гемоглобіну понад 170 г/л.
Еритроцитоз поділяють на абсолютний і відносний.
Абсолютний еритроцитоз - це підвищення вмісту еритроцитів і гемоглобіну в одиниці об'єму крові внаслідок посилення еритропоезу. За етіологією виділяють набутий і спадковий абсолютний еритроцитоз.
Набутий абсолютний еритроцитоз виникає в результаті збільшення продукції еритропоетину переважно в нирках. Це може бути викликано такими причинами:
1) порушеннями нейрогуморальної регуляції- збудженням симпатичної частини нервової системи, гіперфункцією деяких ендокринних залоз. Катехоламіни, АКТГ, тиреоїдні гормони, глюкокортикоїди посилюють утилізацію кисню, що сприяє розвитку гіпоксії й утворенню еритропоетинів у нирках;
2) гіпоксичною, дихальною, циркуляторною гіпоксією - у випадку гірської хвороби, недостатності зовнішнього дихання й кровообігу (див. розд. 19);
3) місцевою гіпоксією нирок унаслідок їх ішемії (гідронефроз, стеноз ниркових артерій);
4) гіперпродукцією еритропоетинів деякими пухлинами (гіпернефрома, рак печінки та ін.).
Крім того, абсолютний еритроцитоз розвивається при істинній поліцитемії (еритремія, або хвороба Вакеза), що є різновидом хронічного лейкозу.
Причиною виникнення спадкового абсолютного еритроцитозу може бути генетично обумовлений дефект глобіну в молекулі гемоглобіну або дефіцит в еритроцитах 2,3-Дифосфогліцерату, що є регулятором оксигенації й дезоксигенації гемоглобіну. При цьому підвищується спорідненість гемоглобіну до кисню і зменшується віддача останнього тканинам (крива дисоціації оксигемоглобіну зміщена вліво). Розвивається гіпоксія, стимулюється продукція еритропоетинів, під впливом яких посилюється еритропоез.
Гіпоксичне, або дисрегуляторне посилення утворення еритропоетинів супроводжується підвищенням функціональної активності еритроцитарного паростка кісткового мозку, що виявляється збільшенням у крові вмісту еритроцитів, гемоглобіну, гематокриту. При цьому може збільшитися об'єм циркулюючої крові (поліцитемічна гіперволемія), її в'язкість, сповільнюється швидкість течії крові, порушується серцева діяльність. Артеріальний тиск підвищується, відзначається повнокрів'я внутрішніх органів, гіперемія шкіри й слизових оболонок, спочатку посилюється тромбоутворення, а потім виникають кровотечі (розвивається ДВЗ-синдром, див. розд. 26.3).
Зміни в крові при набутих абсолютних еритроцитозах часто носять компенсаторний характер, сприяють поліпшенню кисневого постачання тканин в умовах гіпоксії. Із припиненням дії етіологічного фактора відбувається нормалізація кількості еритроцитів і гемоглобіну. Саме в цьому полягає корінна відмінність абсолютного еритроцитозу, що характеризується підвищенням фізіологічної регенерації еритроцитарного паростка кісткового мозку, від еритремії (хвороба Вакеза),- при якій первинне й необоротне зростання кількості еритроцитів обумовлене гіперплазією еритроцитарного паростка пухлинної природи.
Відносний еритроцитоз — це збільшення вмісту еритроцитів і гемоглобіну в одиниці об'єму крові внаслідок зменшення об'єму плазми. Його розвиток пов'язаний з дією факторів, які обумовлюють зневоднення організму (див. розд. 23) або перерозподіл крові, що викликає поліцитемічну гіповолемію (наприклад, шок, опіки).
26.1.7. Дайте визначення поняття "анемія".
Анемія — це гематологічний синдром або самостійне захворювання, що характеризується зменшенням кількості еритроцитів і (або) вмісту гемоглобіну в одиниці об'єму крові, а також якісними змінами еритроцитів.
26.1.8. Якими гематологічними й загальними клінічними ознаками може виявляти себе анемія?
Гематологічні ознаки анемій поділяють на кількісні і якісні. До кількісних відносять:
1) зменшення вмісту еритроцитів в одиниці об'єму крові (у чоловіків нижче 4 • 1012, у жінок нижче 3,5 -1012 в 1 л крові);
2) зменшення концентрації гемоглобіну (у чоловіків нижче 130 г/л, у жінок нижче 120 г/л);
3) зменшення гематокриту (у чоловіків нижче 43 %, у жінок нижче 40 %);
4) зміни колірного показника (норма 0,85-1).
Якісними ознаками анемій є поява:
1) регенераторних форм еритроцитів (див. запит. 26.1.3);
2) дегенеративних змін у клітинах еритроцитарного ряду (див. запит. 26.1.4);
3) клітин патологічноїрегенерації(див. запит. 26.1.5).
Загальні клінічні прояви анемій:
1) гіпоксія - синдром, що виникає при будь-якому виді анемії (див. розд. 19);
2) синдроми, обумовлені особливістю патогенезу кожного окремого виду анемії (наприклад, при В12-фолієводефіцитній анемії- неврологічні розлади й ураження травної системи, при гемолітичній анемії- жовтяниця).
26.1.9. Як класифікують анемії? Наведіть приклади кожного виду анемій.
