
- •Реферат на тему: синтез нових 5-піразолінзаміщених 4-тіазолідонів
- •4 Групи
- •Розділ 1 синтез похідних 4-тіазолідону за реакціями в положенні 5 тіазолідинового циклу
- •Розділ 2 синтез нових похідних 2,4-тіазолідиндіоНу з піразоліновим фрагментОм у 5 положенні
- •Розділ 3 спектральні характеристики синтезованих сполук
- •Розділ 4 Вивчення біологічної активності синтезованих сполук
- •Висновки
- •Список використаної літератури
Розділ 1 синтез похідних 4-тіазолідону за реакціями в положенні 5 тіазолідинового циклу
В положенні 5 молекул 4-тіазолідонів знаходиться достатньо активна метиленова група, яка проявляє СН-кислотні властивості, тому логічно, що найбільш вивченими для модифікації названих гетероциклів є реакції за зазначеним положенням.
Слід відзначити, що для пошуку нових біологічно активних сполук серед 4-тіазолідонів досить популярною і ефективною є реакція Кньовенагеля з карбонільними сполуками в умовах основного каталізу з утворенням 5-ариліденпохідних, що проявляють різнопланову фармакологічну активність.

Villemin Didier і співавт. синтезували 5-ариліденпохідні реакцією 3-метилроданіну з ароматичними альдегідами на поверхні KF/Al2O3 в середовищі CH2Cl2 при опроміненні МХ-променями потужністю 350 ВТ протягом 4 хв. В аналогічних умовах автори одержали оригінальні фосфонотіазолідони за схемою:

У реакції Кньовенагеля апробовано велику кількість ароматичних альдегідів, причому згідно спектрів ПМР (1 сигнал СН= при ~7.6 м.ч.) практично у всіх відомих випадках незалежно від природи альдегіду утворюється один ізомер з транс-розташуванням арилметиліденового водню і атому сірки гетероциклу.
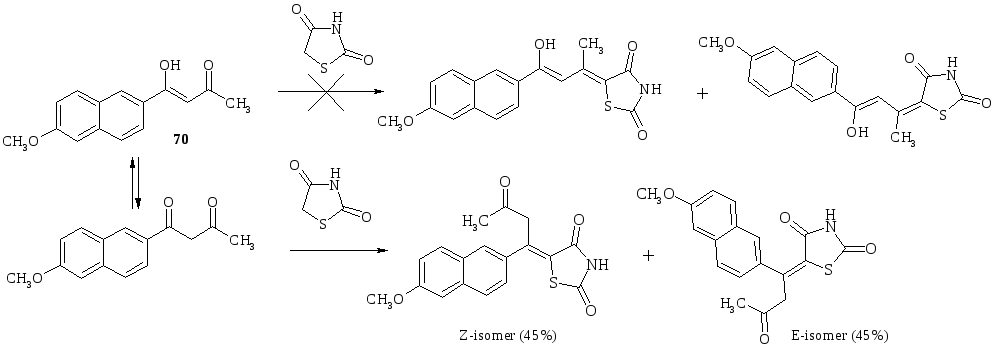
Конденсація Кньовенагеля 2,4-тіазолідиндіону з несиметричними кетонами приводить, в основному, до суміші Z- та Е-ізомерів. Встановлено, що єнолокетон (похідне нестероїдного протизапального засобу набуметону) в зазначеній реакції реагує в таутомерній оксоформі з утворенням суміші неочікуваних ізомерів. Прогнозовані ізомерні 5-іліденпохідні в зазначеній реакції не утворювалися:
Для відновлення подвійного зв’язку 5-іліден-3-карбоксиметилроданінів Ohishi Yoshitaka і співавт. використовували NaBH4 в середовищі ДМФА, а Ogawa i Honna проводили гідрування у водному середовищі в присутності 10% Pd/C i NaHCO3, під тиском водню 3 атм, з наступним виділенням відновленого аналогу дією кислоти:

Ефективне і регіоселективне відновлення 5-ариліден-2,4-тіазолідиндіонів у відповідні 5-бензилпохідні здійснено за допомогою дигідропіридину Ганча (3,5-дикарбетокси-2,6-диметил-1,4-дигідропіридину) з використанням силікагелю як кислотного каталізатора:
 Для
одержання 3,5-дизаміщених похідних
роданіну Ohishi
Yoshitaka і
співав. вводили в реакцію конденсації
етиловий естeр 3-карбоксиметилроданіну
і ClCH2CHO
в суміші ефір-вода в присутності NaHCO3
і утворену проміжну сполуку обробляли
толуолсульфокислотою в бензолі з
утворенням етилового естеру
5-(β-хлоретиліден)-3-карбоксиметилроданіну
за схемою:
Для
одержання 3,5-дизаміщених похідних
роданіну Ohishi
Yoshitaka і
співав. вводили в реакцію конденсації
етиловий естeр 3-карбоксиметилроданіну
і ClCH2CHO
в суміші ефір-вода в присутності NaHCO3
і утворену проміжну сполуку обробляли
толуолсульфокислотою в бензолі з
утворенням етилового естеру
5-(β-хлоретиліден)-3-карбоксиметилроданіну
за схемою:

При конденсації тіазолідиндіону або роданіну і діетилоксалату в спиртовому розчині в присутності алкоголяту натрію в реакцію вступає одна етоксильна група з утворенням похідного, що вміщує в положенні 5 фрагмент гліоксалевої кислоти. При проведенні зазначеної реакції в метанолі в присутності метилату натрію проходить переестерифікація:

Взаємодія 4-тіазолідон-5-гліоксалевих кислот і їх похідних з ароматичними альдегідами, нітрозосполуками і солями діазонію приводить до витіснення гліоксалевого залишку і утворення класичних 5-ариліден-, 5-ариліміно- і 5-арилазозаміщених.
Досить часто об’єктом можливих перетворень є подвійний зв’язок в положенні 5 5-іліден-4-тіазолідонів. Взаємодія 5-ариліден-3-арил-2,4-тіазолідиндіонів з реактивами Гріньяра проходить з алкілюванням подвійного зв’язку в положення 5 тіазолідинового циклу. 5-Ариліден-3-феніл-2,4-тіазолідиндіони приєднують тіокрезол або піперидин з утворенням сполук, які розкладаються на вихідні при температурі вищій ніж температура топлення. По іншому проходить взаємодія з діазометаном. Діазометан атакує електрофільний вуглець 5-ариліден-3-феніл-2,4-тіазолідиндіон і метилює подвійний зв’язок .

Abdel-Rahman Mahmoud реакцією 3-(3-метилфеніл)-5-ариліденроданінів з 1-піперидиноциклогексеном або з Et2NCH=CH-(CH2)4-CH3 в присутності гідрохінону в середовищі ацетонітрилу одержав 3,5-дизаміщені роданіни, а при взаємодії з 1-піридиноциклогексеном в присутності тетраціаноетилену оригінальну спіросистему роданінового ряду:

Лабільність атомів в положенні 5 молекули роданіну обумовлює взаємодію останнього з ортоефірами карбонових кислот. Так, 3-карбоксиметилроданін реагує з ортоформіатним ефіром в середовищі ацетангідриду з утворенням 3-карбоксиметил-5-етоксиметиліденроданіну. Останній легко взаємодіє з первинними і вторинними амінами в спирті з утворенням 5-заміщених амінометиліденпохідних 3-карбоксиметилроданіну за схемою:

Лабільність атомів водню в положенні 5 тіазолідинового циклу зумовлює утворення 5-карбамоїлроданінів при дії заміщених ізотіоціанатів та ізоціанатів у середовищі безводного тетрагідрофурану:

3-Етилроданін та 5-метил-3-етилроданін взаємодією з хлорангідридами ароматичних карбонових кислот в присутності гідроксиду кальцію з високими виходами утворюють 5-ароїлзаміщені, що, очевидно, зумовлено лабільністю атомів водню в положенні 5 :

4-Тіазолідони легко бромуються в положення 5 тіазолідинового циклу, що має важливе препаративне значення. При бромуванні 3-феніл-2,4-тіазолидіндіону з високими виходами одержані 5-бром і 5,5-дибромпохідні:

5-Бром-2,4-тіазолідиндіони виявились ефективними реагентами в органічному синтезі, на основі яких одержані різноманітні 5-ариламінопохідні, в тому числі амінокислоти тіазолідиндіонового ряду, тіоуронієві солі, біциклічні тіазолідиндіони, гідробромід бетаїну тіазолідинового ряду:

Бромування тіазолідиндіонів, як і реакції Меєрвейна та Кньовенагеля, мають важливе значення для синтезу гіпоглікемічних засобів. На основі 5-бром-2,4-тіазолідиндіону синтезують AY-31637, який знаходиться на стадії клінічних досліджень. Існує альтернативний метод синтезу подібних сполук, що базується на сульфонуванні сульфонілхлоридом діаніону, який одержують взаємодією 2,4-тіазолідиндіону з 2 еквівалентами BuLi:

