
- •Транспозиция магистральных сосудов
- •Введение________________________
- •Эмбриология___________________
- •Эмбриология коронарных артерий при d-транспозиции
- •Анатомия
- •Варианты анатомии единственной коронарной артерии
- •Патофизиология
- •Ограничение роли катетеризации сердца и ангиографии
- •Консервативное и интевенционная лечение
- •Показания и выбор времени операции
- •Лечение при высоком риске коронарных артерий
- •Управление искусственным кровообращением
- •Единственная коронарная артерия от переднего левого синуса
- •Процедуры rastelli и nikaidoh
- •Результаты процедуры артериального переключения в детской больнице бостона
- •Влияние анатомии коронарных артерий на результаты хирургической коррекции процедуры артериального переключения
- •Случаи с риском летальности при процедуре артериального переключения, обусловленные коронарной анатомии, в Детской больнице Бостона
- •Результаты хирургической коррекции при единственной коронарной артерии в Детской больнице Бостона
- •Отдаленные коронарные проблемы после процедуры артериального переключения
- •Результаты развития после артериального переключения
- •Двухэтапное артериальное переключение
- •Показания для двухэтапного артериального переключения
- •Период интервала
- •Библиография
Показания и выбор времени операции
Диагноз транспозиция - сам по себе показание для операции. Как обсуждено в истории развития хирургического лечения транспозиции (см. ниже), процедура артериального переключения в настоящее время является предпочтительным методом хирургической коррекции. Почти нет такой ситуации, при которой было оправданным выполнение процедуры Сеннинга или Мастарда при d-транспозиции. По этому данные процедуры описаны в Главе 28.
С появлением внутриутробной эхокардиографии и точного диагноза при рождении почти у всех детей со значимой сердечной патологии, вопрос относительно того, как поздно первичная процедура артериального переключения может быть благополучно сделана возникает редко. Однако, такая ситуация может возникнуть в странах без всестороннего скрининга новорождённых и в ситуациях, при которых ребенок является тяжело больным, например от сепсиса или внутричерепного кровоизлияния, чтобы позволить провести хирургическую коррекцию в период новорожденности.
Левый желудочек остается готовым к одноэтапной процедуре артериального переключения, пока есть ДМЖП или проходимый открытый артериальный проток, который является достаточно большим, чтобы поддержать давление в левом желудочке больше чем две трети от системного давления. Однако, если желудочковая перегородка интактна, левый желудочек в известной мере истончается в течение нескольких недель после рождения18. Ранее мы полагали эмпирически, что приблизительно через четыре недели после рождения большинство детей с интактной перегородкой и отсутствием ОАП имеют слишком большой риск выполнения одноэтапной процедуры артериального переключения. Последующие результаты мультиустановленного исследования Общества Хирургов Врожденных Пороков Сердца стали причиной снижения сроков до возраста трех недель23. Однако для очень многих хирургов это были начальные годы выполнения данной операции. В последующих сообщениях deLeval и Mee предложили, что в большинстве случаев при широком использовании механической желудочковой поддержки будет разумным повысить верхний предел до восьминедельного возраста24,25 Старше этого возраста, значительно лучше будет подготовить желудочек предварительной процедурой, предназначенной, чтобы поднять левожелудочковое давление (см. ниже "Двухэтапная процедура артериального переключения").
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
История
Среди самых ранних попыток хирургической коррекции в середине 1950-ых были процедуры, предназначенные для атомической коррекции транспозиции, то есть пересечение и переключение магистральных сосудов, а так же перемещения коронарных артерий. Все эти начальные попытки потерпели неудачу по ряду причин. Во-первых, большинство младенцев имело интактную межжелудочковую перегородку и интактную межпредсердную перегородку, и поэтому имели очень тяжелое состояние после закрытия ОАП. Хотя Blalock и Hanlon изобрели паллиативную процедуру, хирургической резекции межпредсердной перегородки26, это приводило к развитию внутриперикардиального спаечного процесса и увеличивало трудность и риски последующей коррекции. Кроме того, в начальные годы кардиохирургии, у больных с интактной межжелудочковой перегородкой не было данных о том, что давление в левом желудочке уменьшается к такому низкому давлению в течение нескольких дней после рождения, и что в течение одного - двух месяцев после рождения левый желудочек является неприготовленным, чтобы немедленно принять рабочую нагрузку большого круга кровообращения. Ранние аппараты искусственного кровообращения наносили особенно большой вред очень маленьким пациентам, поэтому требование, чтобы всем пациентам с транспозицией хирургическая коррекция проводилась в ранние сроки жизни, привело к тому, что они подверглись многим отрицательным эффектам экстрапульмонального кровообращения. Наконец в 1950-ых и даже в начале 1960-ых хирурги просто еще не имели необходимый микрососудистый инструмент и методы, требующиеся для успешного перемещения коронарных артерий, существенного компонента процедуры артериального переключения. В конце 1960-ых во время развития коронарного шунтирования при лечении приобретенной патологии коронарных артерий, стало причиной быстрого ускоренного развития хирургами методов, позволяющих выполнить микрососудистый анастомоз.
К концу 1960-ых и в начале 1970-ых Барратт Бойес в Новой Зеландии и Кастанеда в Бостоне начинал демонстрировать, что первичная коррекция у новорожденных с широким диапазоном врожденных аномалий могла быть предпринята с приемлемо низким риском летальности при минимизированном воздействии экстрапульмонального кровообращения. Барратт Бойес популяризировал использование глубокой гипотермии с циркуляторным арестом, чтобы достигнуть этого. К этому времени, то есть начало 1970-ых, Рашкинд представил свою процедуру баллонной септостомии1, огромный прогресс паллиативной хирургии у новорождённых с интактной межпредсердной и межжелудочковой перегородкой и закрытым артериальным протоком. Кроме того, Сеннинг28 и впоследствии Мастард29 представили свои коррекции на уровне предсердий. В конце 1970-ых Бром повторно популяризировал процедуру Сеннинга и сообщил совместно с Quaegebeur о чрезвычайно низком уровне летальности при процедуре Сеннинга30. В Торонто, где Мастард был инициатором своей коррекции на предсердном уровня, Trusler и Williams также сообщали, о чрезвычайно низком риске летальности хирургической коррекции процедуры Мастарда31. Однако, к этому времени, Жатене в Бразилии демонстрировал техническую выполнимость анатомической коррекции32, Он выполнил ее у ребенка вне периода новорожденности, у которого имелся ДМЖП, что обусловило достаточное давление в левом желудочке и поэтому подготовленность левого желудочка.
Yacoub в Великобритании начал осваивать процедуру артериального переключения у пациентов с транспозицией33, он выбрал тактику двухэтапной коррекции, при которой левый желудочек ребенка был адаптирован к процедуре артериального переключения операцией «бэндинга» легочной артерии. Процедура артериального переключения проводилась тогда приблизительно через один год. В Бостоне, Кастанеда и Норвуд предприняли смелый для того времени подход выполнения первичной процедуры артериального переключения у новорожденных, которые имели интактную межжелудочковую перегородку, то есть большинство пациентов с транспозицией2, успех этой процедуры базировался на предпосылке, что левый желудочек подвергался системному давлению пренатально у больных с транспозицией из-за раскрытого состояния артериального протока (таким же образом, как правый желудочек подвергнут системному давлению пренатально у детей с обычно расположенными магистральными артериями). Важно помнить, что в это время, то есть в начале 1980-ых, понимание хирургами многих потенциальных вариантов анатомии коронарных артерий, которая могла встречаться в сочетании с транспозицией магистральных артерий находилась в зачаточном состоянии. Первоначально Кастанеда и Норвуд полагали, что при некоторых редких вариантах расположения ветвей коронарных артерий нет возможности выполнить транслокацию и рекомендовали выполнять этим детям процедуру Сеннинга. Напротив в это же время Якуб утверждал, что все варианты коронарной анатомии могут быть перемещены, и время действительно доказало его правоту14. Вместе с тем будет правильным сказать, что некоторые из наиболее редких вариантов расположения коронарных ветвей, особенно отхождение обеих основных коронарных артерий от единственного устья, представляют значительно большие технические трудности кардиохирургу.
Технические особенности
ПРОЦЕДУРА АРТЕРИАЛЬНОГО ПЕРЕКЛЮЧЕНИЯ
Доступ - стандартная срединная стернотомия, тимус субтотально резецирован. Накладываются швы-маркеры в те точки проксимальной легочной артерии, куда будут перемещены коронарные артерии. Отобранные зоны - просто точки, в которые артерии будет наиболее удобно ротировать после мобилизации первых 3 или 4 мм. Кисетные швы для канюляции аорты накладываются несколько проксимальнее безымянной артерии. Кисетный шов для венозной канюли накладывается в ушко правого предсердия. Артериальный проток выделяется и прошивается двумя лигатурами 5/0 Prolene, сразу после начала ИК он перевязывается и пересекается (Рисунок 15.4a).
Пациенту проводится экстрапульмональное кровообращение, он охлаждается до уровня ректальной температуре ниже 18°C, используется единственная венозная канюля, установленная в правое предсердие. Наконечник канюли упирается в отверстие верхней полой вены. Во время охлаждения ветви легочные артерии мобилизованы до уровня деления в корне легких. Аорта пережата, и единственная доза кардиоплегического раствора влита в корень аорты. Аорта пересечена приблизительно посередине напротив бифуркации легочной артерии (Рисунок 15.4b). Коронарные артерии иссечены методом "кнопок", составленных в большинстве из смежного синуса Вальсальвы (вставка Рисунка 15.4b). Первые 2-4 мм коронарных артерий мобилизованы с тщательным сохранением всех ветвей (Рисунок 15.4c). Если необходимо, маленькие эпикардиальные ветви мобилизованы из-под эпикарда.
Ствол легочной артерии пересечен проксимальнее бифуркации (Рисунок 15.4d). Маневр Lecompte34 выполнен, переводя бифуркацию легочной артерии, спереди от восходящей аорты. Соответствующий U-образный лоскут ткани, отсечен от проксимальной неоаорты. Основание U-образного лоскута - расположено на уровне вершин комиссур клапана неоаорты. Важным для иссечения области неоаорты является использование в качестве направителей первоначальных швов-маркеров.
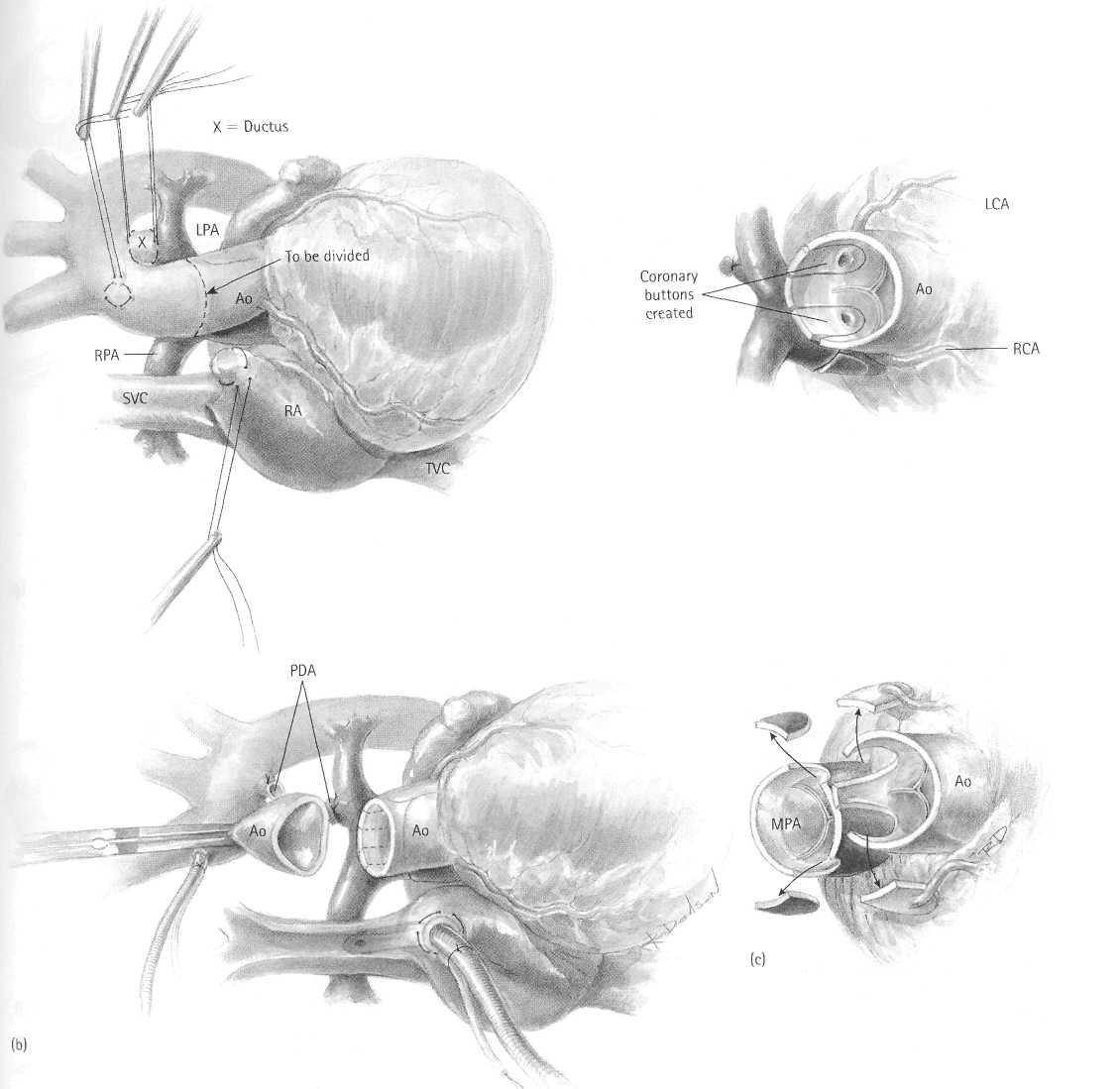
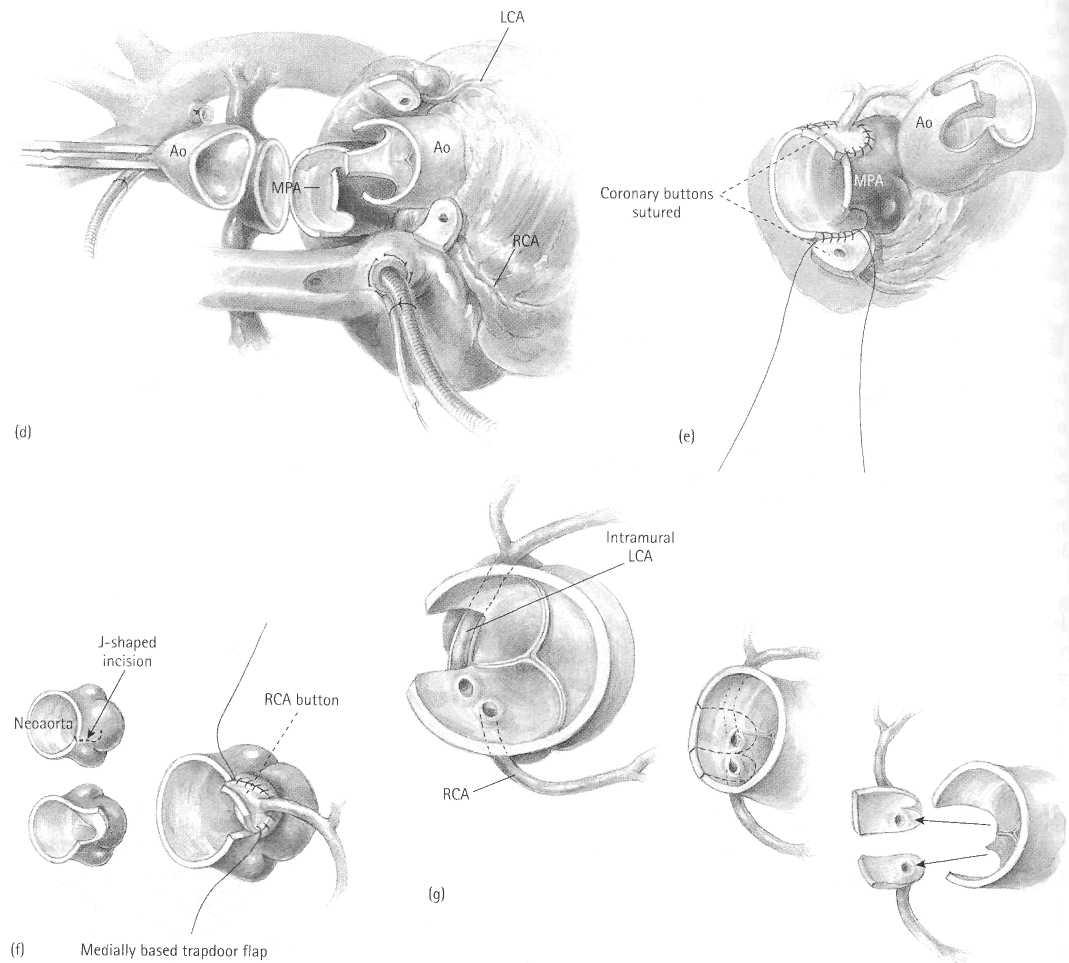
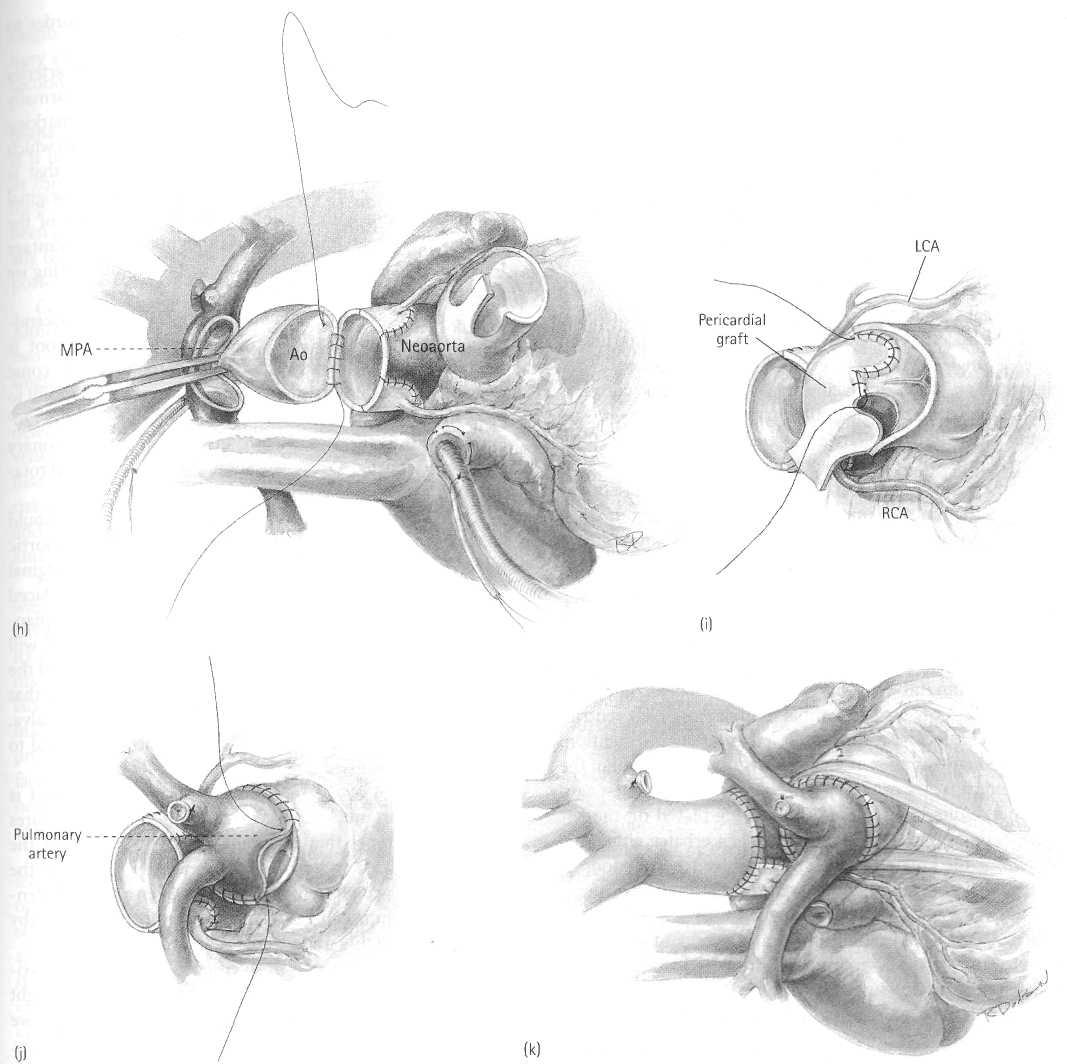
Рисунок 15.4h-k (h) После завершения линии коронарного шва формируется аортальный анастомоз, используя непрерывный шов 6/0 Prolene. Область соединения с линиями коронарного шва укреплены матрасными швами. (i) Дефект в донорской коронарной области замещен отдельной раздвоенной заплатой из аутоперикарда, слегка фиксированного в глутаральдегиде. (j) Легочный анастомоз формируется после снятия зажима с аорты. Используется техника непрерывного шва. (k) Законченный вид процедуры артериального переключения.
Коронарные кнопки соединяются с неоаортой с использование непрерывного шва 7/0 Prolene (Рисунок 15.4e). Швы завязаны на каждом конце. Линия шва очень тщательно проверяется на предмет любых очень незначительных дефектов, и любые подозрительные области укрепляются одиночными швами. Области, расположенные непосредственно под коронарными артериями, особенно слева, являются очень труднодоступными после завершении процедуры; поэтому, крайне важно, чтобы там не было кровотечения.
Альтернативой к иссечению U-образного лоскута из неоаорты должен стать J-образный разрез, как обозначено во вставке, и сместить к середине основание откидной створки люка (Рисунок 15.4f). Это позволяет меньше смещать коронарные артерии, но увеличивает окружность проксимальной неоаорты, которая является уже несколько большей, чем дистальная рассеченная восходящая аорта. Мы крайне редко находим необходимым выполнять этот прием. Еще раз, можно увидеть, что коронары имплантированы выше уровня клапана неоаорты и, таким образом, не должны в отдаленном периоде нарушать работу клапана.
Если имеется интрамуральная коронарная артерия, то обычно иссекают более длинную кнопку, включая отслоение задней комиссуры неолегочного клапана, если это необходимо (Рисунок 15.4g). Эта комиссура может быть повторно восстановлена, когда легочная артерия будет восстановлена с использованием перикарда.
Проксимальная часть неолегочной артерии восстанавливается с использованием заплаты из аутоперикарда, фиксированного в 0.6 % р-ре глутаральдегида, в течение, по крайней мере, 20 минут. Непрерывный шов 6/0 Prolene используется (Рисунок 15.4i). Используется кратковременный арест, при этом канюли не удаляются.
Короткий косой разрез сделан низко по свободной стенке правого предсердия. ДМПП ушит, с использованием непрерывного шва 5/0 Prolene.
Снят зажим с аорты. Должна быть соблюдена удовлетворительная перфузия всех областей. Легочный анастомоз сформирован, используя непрерывный 6/0 Prolene (Рисунок 15.4j). Короткий косой разрез сделан низко по свободной стенке правого предсердия. ДМПП закрыт ушиванием, используя непрерывный шов 5/0 Prolene.
Снят зажим с аорты. Должна быть соблюдена удовлетворительная перфузия всех областей. Легочный анастомоз сформирован, используя непрерывный 6/0 Prolene (Рисунок 15.4j).
Во время периода согревания устанавливается линия контроля в левое предсердие вставлен через правую верхнюю легочную вену. Два предсердный и один желудочковый электрода подшиты. После окончания периода согревания ребенка необходимо отключить от аппарата ИК, с поддержкой допамином в 5 мкг/кг в минуту. После того, как удалены канюли, вводится протамин. Гемостазу помогают гелиевая пена, содержащая тромбин. Правопредсердная линия установлена через ушко правого предсердия. Плевральная полость дренирована. Грудная клетка закрывается одиночными швами проволокой из нержавеющей стали (на грудину), непрерывным викриловым швом ушивается предстернальная фасция и подкожная клетчатка и внутрикожным швом заканчивается закрытие раны.
