- •Қ.А. Ясауи атындағы халықаралық қазақ-түрік университеті
- •2. Жұмыс оқу жоспарынан көшірме
- •3. Пән сағатының бөлінуі
- •4. Лекцияның күнтізбелік-тақырыптық жоспары
- •5. Лабораториялық сабақтың күнтізбелік-тақырыптық жоспары
- •6. Студенттің өзіндік жұмыс (сөж) тақырыптары
- •Оқулықтар мен web сайттар тізімі Негізгі әдебиеттер
- •Қосымша әдебиеттер
- •8. Оқулықтар, оқу-әдістемлік құралдармен қамтамасыздандыру картасы
- •01.09.200__ Ж. _________ студент саны
- •9. Бақылау түрлері:
- •10. Аралық бақылау ( модуль) сұрақтары:
- •11. Емтихан/тест сұрақтары
- •12. Студенттің білімін бағалау ережесі
- •13. Кафедра және оқытушы тарапынан студентке қойылатын талаптар
- •Лекция тезистері
- •1.2. Химиялық өндірістерді технологиялық негізге байланысты классификациялау.
- •5.6. Күкірт қышқыл өндірістерінің негізгі бағыттары.
- •2Ch3cooh
5.6. Күкірт қышқыл өндірістерінің негізгі бағыттары.
Шикізат кµзін, ќорын кењейту.
Жеке аппараттыњ жєне т±тас ж‰йеніњ ќуатын кµбейту.
¤ндірісті ќарќындату.
Ќоршаѓан ортаны ќорѓау.
Шикізатты толыќ пайдалану.
Химиялыќ реакциялар жылуын максималды шамада пайдалану.
1. Шикізаттыњ кµзін, ќорын кењейту жолдары: Пеш газыныњ, металлургия газдарыныњ ќ±рамындаѓы к‰кірт диоксидін пайдалану. ¤ндіріс ќалдыќтарын: фосфогипс, ќышќыл гудрон, кµмірлі колчедан жєне т.б. ќолдану (пайдалану).
2. Аппараттыњ жєне т±тас химико-технологиялыќ ж‰йеніњ ќуатын арттыру – аппараттардыњ µнімділігін олардыњ ќарќындылыѓын арттыру арќылы, конструкциясын µзгерту арќылы орындалады.
3. Технологиялыќ процестерді ќарќындату – шикізатты к‰йдіргенде техникалыќ оттекті пайдалану, SO2 жєне О2 концентрацияларын жоѓарылату жєне абсорбциялау процесінде SO3 концентрациясын жоѓарылатып, оњтайлы температура жєне ќысым орнату, активті жєне берік катализатор ќолдану, ќарќыны жоѓары ж±мыс істейтін реакторларды, бірінші ќатарда “ќайнау ќабатында” шикізатты к‰йдіретін пештерді ќолдану, оны таѓы да контакт бµлімінде катализ процесінде ќолдану жєне т.б. єдістерді ќолдану арќылы орындалады.
4. Химиялыќ реакциялар жылуын толыќ пайдалану нєтижесінде 1 т. к‰кірт ќышыќылын µндіргенде 1,5-2 т. су буы µндіріледі, су буы к‰кірт ќышќылыныњ µзіндік ќ±нын тµмендетеді.
Бақылау сұрақтары.
1. Элементтік күкірт және сульфид рудаларын күйдіретін пештердің құрылысы қандай?
2. Күкiрт қышқылын контакт әдiсiмен өндiрудiң технологиялық схемасы.
3. Күкірт қышқылының физика-химиялық қасиеттері?
4. Күкiрт қышқылын нитроза әдiсiмен өндiрудiң технологиялық схемасы.
5. Күкiрт қышқылын өндiру процесiн күшейту жолдары.
6. Күкіртті газды өндіруге қандай шикізаттар қолданылады?
7. Күкіртті газды өндіру схемасы.
8. Күкірт қышқылын концентрлеу әдістері.
9. Күкірт қышқыл өндірістерінің даму бағыттары.
6-лекция. Тақырыбы: Байланысқан азот технологиясы. Азот қышқылын өндіру.
Жоспары: 6.1. Атмосфера азотын фиксациялау әдістері.
6.2. Аммиакты синтездеудің физико-химиялық негізі.
6.3. Синтетикалық аммиак өндірудің схемасы.
6.4. Азот қышқылын өндіру әдістері.
6.5. Сұйытылған азот қышқылын өндіру.
6.6. Азот қышқылын концентрлеу.
Лекция мақсаты: Аммиакты синтездеудің физико-химиялық негізін және синтетикалық аммиак өндірудің схемасын түсіндіру. Азот қышқылын өндірудің технологиялық схемасы туралы түсінік қалыптастыру.
Лекция мәтіні. 5.1. Атмосфера азотын фиксациялау әдістері. Азотты фиксациялау – ауадаѓы молекулалыќ азотты µсімдіктерге сіњімтал, азоттыњ ќосылыстарына ауыстыру. Табиѓи жаѓдайда арнайы микроорганизмдердіњ кµмегімен іске асады.
Атмосфера азотын фиксациялаудыњ негізгі ‰ш т‰рлі технологиялыќ єдістері белгілі, олар:
Доѓа єдісі;
Цианамид єдісі;
Аммиак синтезі.
Єдістердіњ ‰шеуі ХХ-ѓасырдыњ алѓашќы жылдарында ±сынылѓан.
1.1. Доѓа єдісі табиѓи ќ±былыстарѓа (найзаѓай) негізделіп ±сынылѓан. Жоѓары температурада (3000-40000С) электр доѓасы арќылы ауа аѓыны µткенде инертті азот тотыѓады:
N2+O22NO - 181,4 кДж
Б±л процес ќайтымды. Т‰зілген азот (ІІ) оксидініњ шыѓымы 2% шамасында, температураны одан єрі жоѓарылатќан сайын шыѓымы тµмендей береді – азот (ІІ) оксидініњ ыдырауы артады, температура тµмендеген сайын азоттыњ тотыѓу жылдамдыѓы тµмендейді. 1 т азотты тотыќтыруѓа 60 000 квт.с электр энергиясы ж±мсалады.
Доѓа єдісімен атмосферадаѓы азотты ќосылыстарѓа айналдыратын (фиксациялау) зауыт 1901 ж. Америкада Ниагара сарќырамасыныњ мањайында салынѓан, 1905 ж. Норвегияда осы єдіспен азот (ІІ) оксиді µндіріле бастады. Осы єдіс бойынша азот (ІІ) оксидініњ шыѓымын арттыру ‰шін тотыѓу процесі кезінде т‰зілген газдар ќоспасын жылдам суытып, азот (ІІ) оксидініњ ыдырауын тµмендетеді. Электр энергиясыныњ тым кµп мµлшерде ж±мсалуына байланысты, б±л єдіс кµрнекті т‰рде дами алмады.
Электр доѓасы арќылы µткен ауа ќ±рамындаѓы т‰зілген азот (ІІ) оксидін барботаж єдісімен єк суы мен оттектіњ ќатысуымен кальций нитратына айналдырып, бµліп алѓан орынды.
4NO+3O2+2Ca(OH)2=2Ca(NO3)2+2H2O
1.2. Цианамид єдісі кальций карбидініњ азотпен тікелей ќосыла алатын-дыѓына негізделген.
Кальций карбиді, сµндірілмеген єк пен кµмір (антрацит немесе кокс) ќоспасын электр пешінде ќыздыру єдісімен алынады. Карбидтіњ єрбір тоннасын µндіргенде 2600-2900 квт.с электр энергиясы ж±мсалады.
¦сатылѓан 1000-11000С температурадаѓы кальций карбиді арќылы ауадан бµліп алѓан азотты ‰рлейді, осы жаѓдайда ж‰ретін химиялыќ реакция:
CaC2+N2=CaCN2+C+302 кДж
Осылайша алынѓан кальций цианамиді - ±нтаќ ќатты зат, кµмір араласќандыќ-тан ќара т‰сті. 0,6 МПа ќысымдаѓы 110-1150С температурадаѓы су буын каль-ций цианамиді арќылы ‰рлегенде реакция нєтижесінде аммиак жєне кальций карбонаты т‰зіледі:
CaC2+3H2O=2NH3+CaCO3
Кальций циамидін µндіретін бірінші зауыт 1901 жылы Италияда салынып, 1905 жылдан бастап µндіріс мµлшерінде µндіре бастады.
1921 жылы цианамид µндірісі жылына 500 000 т цианамид µндіретін болды. Одан кейінгі уаќытта жања зауыт салыну тоќтатылды, µйткені басќа єдіс табылып сол µріс алып кетті, ол - аммиак алудыњ техникалыќ єдісі. Аммиакты сутек пен азоттан синтездеу єдісі.
Цианамид єдісімен 1 т азотты фиксациялауѓа 12000 квт.с электр энергиясы ж±мсалды, аммиакты синтездеу әдісіне 5000 квт.с. электр энергиясы ж±мсалды.
1.3. Аммиак синтезі.
Азот пен сутек тµменгі температурада ќосыла алмайтын болѓанымен, ол газдардыњ ќоспасына электр ±шќынын жібергенде аммиак т‰зіле алатындыѓы ертеден белгілі болатын. Сен Клер Девилль 1864 жылы осы реакцияныњ егжей-тегжейін зерттеп, электр ±шќынын жіберу аммиак т‰зуге ѓана емес, оныњ ќайтадан азот пен сутекке айналуына да єсер ететіндігін аныќтаѓан. Яѓни азот пен сутектіњ арасындаѓы реакция ќайтымды реакция жєне олар тепе-тењдік к‰йіне келеді:
N2+3H22NH3
Электр ±шќыныныњ єсерінен туатын жоѓары температурадан тепе-тењдік солѓа ќарай ыѓысады, сондыќтан шыѓатын аммиактыњ мµлшері µте аз, соны µсіреміз деген талап кµп уаќыт іске аспай келеді.
ХХ-ѓасырдыњ бас кезінде Нернст µз шєкірттерімен (Габер жєне Бош) ±заќ ќажырлы ењбектерден кейін ѓана б±л процесті зауыттыќ кµлемде ж‰ргізуге м‰мкіншілік беретін жаѓдайын тапќан. Басты жаѓдай Ле-Шателье принципі бойынша ќысымды кµтергенде аммиактыњ шыѓымы кµбеюуі керек, б±л тєжірибе ж‰зінде дєлелденді. Екінші жаѓынан, азот пен сутек ќосылѓанда жылу бµлініп шыѓатындыѓы аныќталды:
N2+3H22NH3+112 кДж (5000С жєне 30 МПа)
Демек неѓ±рлым температура жоѓары болса, соѓ±рлым аммиак аз µндіріледі. Сондыќтан реакцияны м‰мкіндігінше тµменгі температурада µткізу керек. Біраќ тµменгі температурада реакцияныњ ж‰ру жылдамдыѓы µте баяу. Процесті тездету ‰шін катализатор жєрдемі керек болады, катализдік єсер тигізетін металдар аз емес, мысалы – маргенец, темір, родий, вольфрам, рений, осьмий, платина, уран жєне т.б. яѓни d жєне f – ұяшықтары толмаѓан элементтер. Осы элементтердіњ ішінен активтілігі ерекше жоѓары тµрт элементті айтуѓа болады: темір, осьмий, рений жєне уран, біраќ соњѓы ‰ш элемент бір жаѓынан ќымбат, екінші жаѓынан µндірісте ќауіпті. Ќазіргі кезде µнеркєсіпте ењ ќолайлы катализатор-промоторланѓан темір. Промотор ретінде Al2O3; K2O; CaO жєне SiO2 ќолданылады. Темір катализаторыныњ активтілігін к‰кірт ќосылыстары ќайтымсыз баѓытта тµмендетсе, ал оттек, оттектіњ ќосылыстары жєне кµміртек (ІІ) оксиді ќайтымды т‰рде уландыру нєтижесінде катализатор активтілігін тµмендетеді.
Кµп зерттеулерден кейін оњтайлы деп табылѓан жаѓдайдыњ бірі 20-100 МПа, 250-4500С. Соныњ µзінде аммиактыњ шыѓымы 15-20%, т‰зілген аммиакты бµліп алу ‰шін газдар ќоспасын салќындатып, аммиакты конденсациялайды, реакцияласып ‰лгермеген азот сутек ќоспасын ќажетті мµлшерде азот пен сутекті ќосып процеске (синтез коллонасына) ќайта жібереді (циркуляциялайды).
5.2. Аммиакты синтездеудің физико-химиялық негізі. Азот пен сутектіњ аммиакќа айналу дєрежесін 97%-ѓа жеткізуге 350 МПа ќысым, 4000С температура ќажет. Температура тµмендеген сайын аммиактыњ тепе-тењдік шыѓымы артады, біраќ тепе-тењдік орнау жылдамдыѓы тµмендейді. 4500С температурада 10 МПа ќысымда аммиак шыѓымы 16% болса, сол температурада 30 Мпа ќысымда шыѓым 36% болады.
Азот пен сутек реакцияласу процесініњ жылдамдыѓы азоттыњ активтілігіне тєуелді екені аныќталѓан. Азотты активтеу энергия мµлшері тым жоѓары, осыѓан байланысты реакция жылдамдыѓы µте тµмен, аммиак шыѓымы аз мµлшерде болады. Азоттыњ активтеу энергиясын тµмендету ‰шін катализатор ќолданады.
А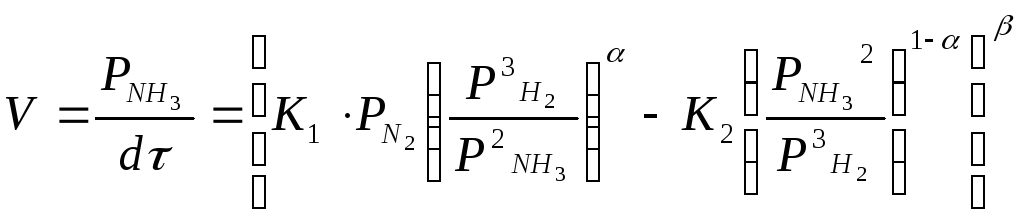 ммиак
синтезіндегі катализатор єсерініњ
механизмі ‰ш сатыдан ќ±ралѓан: 1. Азот
пен сутек газ фазадан катализатордыњ
беткі ќабатына жєне кеуектерінде
диффузияланады; 2. Азот пен сутек
катализатордыњ єсерімен активтелінеді;
3. Активтелінген азот пен сутек
реакцияласады. Катализдіњ электрондыќ
теориясы бойынша аммиак синтездеудіњ
екінші сатысында азот катализатордан
электронды µзіне ќосып алып теріс
зарядталып, сутек керісінше µз электронын
катализаторѓа беріп, оњ зарядталады.
Зарядталѓан азот пен сутек реакцияласып
алѓашындаNH
(имид), сонан соњ NH2
(амид)
ењ соњында NH3
(аммиак)
т‰зеді. Т‰зілген аммиак катализатордан
десорбцияланып газ фазасына ауысады.
Аммиак синтезінде азоттыњ катализаторѓа
адсорбциялану нєтижесін-де активтелінетінін
Темкин мынадай жылдамдыќ тењдеуімен
дєлелдеген:
ммиак
синтезіндегі катализатор єсерініњ
механизмі ‰ш сатыдан ќ±ралѓан: 1. Азот
пен сутек газ фазадан катализатордыњ
беткі ќабатына жєне кеуектерінде
диффузияланады; 2. Азот пен сутек
катализатордыњ єсерімен активтелінеді;
3. Активтелінген азот пен сутек
реакцияласады. Катализдіњ электрондыќ
теориясы бойынша аммиак синтездеудіњ
екінші сатысында азот катализатордан
электронды µзіне ќосып алып теріс
зарядталып, сутек керісінше µз электронын
катализаторѓа беріп, оњ зарядталады.
Зарядталѓан азот пен сутек реакцияласып
алѓашындаNH
(имид), сонан соњ NH2
(амид)
ењ соњында NH3
(аммиак)
т‰зеді. Т‰зілген аммиак катализатордан
десорбцияланып газ фазасына ауысады.
Аммиак синтезінде азоттыњ катализаторѓа
адсорбциялану нєтижесін-де активтелінетінін
Темкин мынадай жылдамдыќ тењдеуімен
дєлелдеген:
М±нда К1 жєне К2 – солдан оњѓа ќарай жєне оњнан солѓа ќарай ж‰ретін реакциялардыњ жылдамдылыќ константалары;
Р- газдардыњ парциалдыќ ќысымдары;
- 0 мен 1 аралыѓында µзгеретін, азоттыњ катализаторѓа адсорбциялау мµлшеріне тєуелді коэффициент.
- қысымныњ К1 жєне К2 єсерін тигізетін коэффициенті.
Е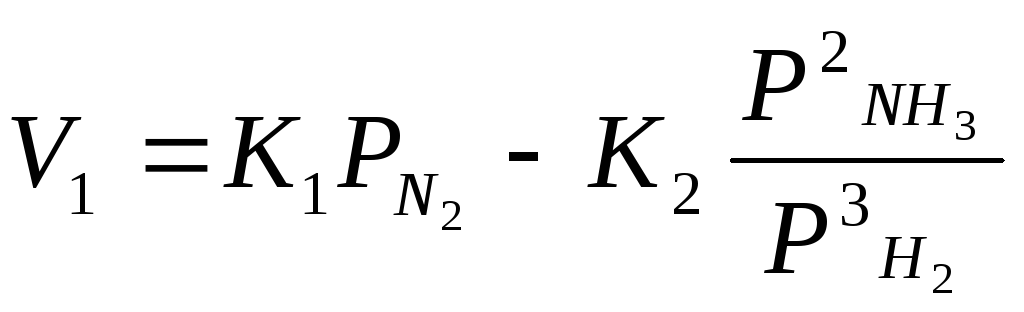 гер=0
болса
гер=0
болса
я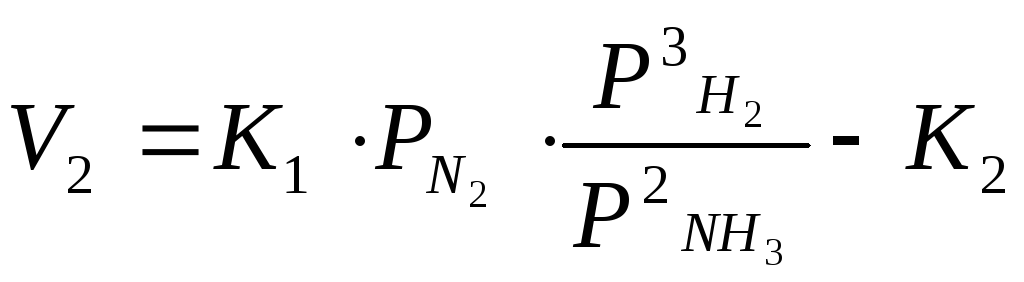 ѓни
реакция кері баѓытта ж‰реді: 2NH3=N2+3H2
ѓни
реакция кері баѓытта ж‰реді: 2NH3=N2+3H2
Егер =1 болса,
онда реакция солдан оњѓа ќарай ж‰реді.
Аммиак шыѓымына температура жєне ќысымнан басќа да кµлемдік жылдамдыќ та єсер етеді (кµлемдік жылдамдыќ µлшемі м3/м3с). Кµлемдік жылдамдыќтыњ µзіне тиісті оњтайлы температурасы болады. Аммиак шыѓымы кµлемдік жылдамдыќпен кері байланыста, кµлемдік жылдамдыќ кµбейген сайын, аммиак шыѓымы тµмендегенмен µндіріс µнімі артады. ¤ндіріс µнімініњ мµлшері мына тењдеумен есептелінеді:
М![]() ±нда:
0,77 – м3
аммиактыњ ќалыпты жаѓдайдаѓы массасы.
±нда:
0,77 – м3
аммиактыњ ќалыпты жаѓдайдаѓы массасы.
![]() –газ
ќоспасындаѓы аммиактыњ моль саны.
–газ
ќоспасындаѓы аммиактыњ моль саны.
W – кµлемдік жылдамдыќ.
Кµлемдік жылдамдыќ кµбейген сайын оњтайлы температура жоѓарылайды. Қазіргі кезде кµпшілік µндіріс процестерінде ќолданылатын кµлемдік жылдамдыќ 40 000 С-1.
Аммиакты синтездеу єдістері технологиялыќ процесте ќолданылатын ќысымѓа байланысты ‰ш т‰рге бµлінеді: 1) Тµменгі ќысымдаѓы – 10 МПа дейін ќысым; 2) Орташа ќысымдаѓы – 20-30 МПа; 3) Жоѓары ќысымдаѓы 75-100 МПа. Ќазіргі кездегі кµпшілік µндіріс орындарында аммиакты синтездеу процесі орташа ќысымда ж‰ргізіледі (20-30 МПа).
Аммиак шыѓымы 15-20% болѓандыќтан, алѓашќы к‰йінде ќалѓан азот жєне сутек ќоспасы технологиялыќ процестіњ бас жаѓына ќайта оралады (схема бойынша – “6”).
5.3. Синтетикалық аммиак өндірудің схемасы. Аммиакты синтездеудіњ технологиялыќ процесі негізгі 7 операциядан ќ±ралады. Табиѓи газ к‰кірт ќосылыстарынан тазартылып (І) су буымен араласып (3,7:1), 800-8500С температурада никель катализаторларыныњ ќатысуымен конверсияланады (2), (9-10) мµлшерде алѓашќы ќалпында ќалѓан метан су буымен араласып (0,8:1) шахты конвертиріне келіп 900-10000С температурада ауамен араласып, конверсия процесініњ екінші сатысына ±шырайды (3). Шахты конверторынан шыќќан газдыњ жылуын іске асыру маќсатпен, ыстыќ газды утилдеу ќазанымен жанастырып 10 МПа ќысымдаѓы 4800С температурадаѓы су буы алынады (4). Утилдеу ќазанынан µткен газ 430-4700С температураѓа ќыздырылѓан темір-хром катализаторы толтырылѓан конверторѓа келіп кµміртек (ІІ) оксидініњ конверсиялауыныњ бірінші сатысына т‰седі, 2-4% мµлшерде ќалѓан кµміртек (ІІ) оксиді тµменгі температурада (200-2600С мырыш-хром-мыс катализаторы толтырылѓан конвертор келіп (5) конверсиясыныњ екінші сатысына т‰седі, сонѓы конвертордан шыќќан газ ќ±рамындаѓы кµміртек (ІІ) оксидініњ ќалдыѓы 0,2-0,4%-дан аспайды.
Конверсияланѓан газды СО2, СО жєне О2-ден тазартып, 30 МПА – дейін ќысып, синтез ќ±бырына жібереді. Аммиакты синтездеу ќ±бырларындаѓы жылу-алмастыру арќылы (6) катализаторды 450-5000С дейін ќыздырады. Синтез ќ±бырынан шыќќан аммиак-азот-сутек ќоспаларынан аммиакты бµліп алу ‰шін су суытќышымен салќындатып аммиакты с±йыќ к‰йіне ауыстырып сеператорда бµліп алынады (7). Газ к‰йінде ќалѓан аммиак, аммиак суытќышымен – 10-150С температураѓа суытылып азот-сутек ќоспаларынан бµлінеді. С±йыќ к‰йіндегі аммиак сол ќалпында ќоймаѓа жиналады. “Аммиак-синтез” ќ±бырына ерекше тµзімділік ќасиеті бар хром-никель болатынан ќ±йылѓан т±тас ќ±ймадан кеуектеу єдісімен таѓайындалады. Бейнесі – цилиндр тєрізді, биіктігі 24 м, ќабырѓасыныњ ќалыњдыѓы 18 см, диаметрі 1,2-2,4 м. Синтез ќ±бырыныњ жоѓарѓы жартысына катализатор коропкасы (ќорап), тµменгі жартысына жылуауыстырѓыш орналасќан. Ќ±быр корпусыныњ ќ±рамында мыс, кµміртек болмауы міндетті. Себебі реагенттер ќ±рамындаѓы сутек жєне синтезделінген аммиак технологиялыќ жаѓдайда агресивтік ќасиетін кµресетеді, яѓни сутек гидрлеу процесіне: аммиак мыстыњ комплекс ќосындыларыныњ т‰зілуіне активті ќатысып, синтездеу колонасы кеуектелініп, беріктілігін тµмендетеді.
5.4. Азот қышқылын өндіру әдістері. Азот ќышќылын µндірудіњ бірнеше єдістері бар: олармен тарихи реті бойынша танысайыќ.
1.1. Селитрадан алу. XVII ѓасырдыњ ортасынан бастап, ХХ ѓасырдыњ басына дейін, 2,5 ѓасыр бойы, к‰ллі жер ж‰зінде азот ќышќылын алудыњ єдісі, натрий селитрасын концентрленген к‰кірт ќышќылымен араластырып ќыздыру (Глаубер) єдісі болды.
NaNO3+H2SO4=NaHSO4+HNO3
Б±л єдіс бас кезінде лабораторияларда ѓана жєне кейбір натрий селитрасы кµп жерде ќолданылѓан болатын.
1.2. Ауадан алу. 1905 жылы Норвегия елінде (Беркиланд) пен (Эйде) ауадаѓы азот пен оттекті ќосып, азот ќышќылына айналдырудыњ технологиялыќ єдісі табылды. М±ндаѓы химиялыќ реакциялар:
Азот пен оттек 12000С жоѓары температурада (электр ±шќынында) тепе-тењдік оњѓа ќарай ыѓыса береді (Кавендиш, 1785):
N2+O22NO-103 кДж
осылай т‰зілген азот (ІІ) оксиді µздігінен оттекті оњай ќосып алып азот (IV) оксидіне айналады.
2NO+O2=2NO2+112 кДж
Азот (IV) оксиді суда ерігенде сумен реакцияласып, азотты ќышќыл жєне азот ќышќылын т‰зеді:
2NO+H2O=HNO2+HNO3+116 кДж
Азотты ќышќыл т±раќсыз болѓандыќтан, лезде айырылып кетеді:
3HNO2=HNO3+ H2O-76 кДж
Сондыќтан азот ќостотыѓыныњ сумен єрекеттесуі іс ж‰зінде мына тењдеу бойынша ж‰реді:
3NO2+H2O=2HNO3+ NO +136 кДж
Электрлік доѓаныњ жалынын екі к‰шті электромагниттіњ арасына орналастырса, онда жалын, диск тєрізді дµњгелек т‰рге келеді. Осы маќсатќа ќолданылатын доѓалардыњ дисктерініњ диаметрі 3 м-ге жетеді, енді осыны арнаулы пештерге орналастырып ішіне ауа ‰рлейді, пештіњ ішініњ температурасы 3000-35000С болады. Соныњ µзінде пештен шыѓатын газдарда 2-3% азот оксиді болады. Б±л газдар ќоспасын 1000-15000С дейін суыту процесінде, ондаѓы азот (ІІ) оксиді оттекті ќосып алып (IV) оксидіне айналады, оны суѓа сіњіргенде азот ќышќылына айналады. Б±л єдіс электр энергиясы арзан жерде болмаса, µте ќымбат єдіс болѓандыќтан, ќолданудан ќалып келеді.
Аммиакты тотыќтырып алу. Азот ќышќылын аммиактан алудыњ негізін салушы инженер И.И.Андреев. 1914 жылдан бастап, Донбаста кµмір кокстегенде шыѓатын аммиакты тотыќтырып азот ќышќылын алуѓа болатындыѓын дєлелдеп, 1917 ж. Юзовкада (ќазіргі Донецк) бірінші зауыт салынды.
Азот ќышќылын аммиакты тотыќтырып алу єдісініњ физика-химиялыќ негізі. Ќазіргі уаќытта азот ќышќылы µндірісте µндіріледі: 50-60% с±йытылѓан жєне 96-98%-ті концентрлі азот ќышќылын аммиактан µндіреді.
Азот ќышќылын аммиактан µндіру сатылары:
Аммиакты азот (ІІ) оксидіне катализ єдісімен тотыќтыру:
4NH3+5O24NO+6H2O+907 кДж (а)
Азот (ІІ) оксидін азот (IV) оксидіне тотыќтыру:
2NO+O22NO2+112 кДж (є)
Азот (IV) оксидін сумен абсорбциялап азот ќышќылын алу.
3NO2+H2O2HNO3+NO+136 кДж (б)
Бос ќалпында бµлінген NO диоксидіне тотыќтырып, ќайтадан абсорбцияланады.
Аммиактыњ катализатордыњ ќатысуымен тотыѓуы. Аммиак тотыќќанда негізгі “а” реакциядан басќа да реакциялар ж‰реді:
4NН3+4О22N2O+6Н2O+1105 кДж (в)
4NН3+3О22N2+6Н2O+1270 кДж (г)
4NН3+6NO5N2+6Н2O (д)
Олар азот (ІІ) оксидініњ шыѓымын тµмендетеді, аммиак “в”, “г” жєне “д” реакциялары нєтижесінде µндіріске ќажетсіз µнімдердіњ т‰зілуіне ж±мсалып, µнімніњ µзіндік ќ±нын кµтереді. (а) жєне (є) тепе-тењдік реакциялар µндіріс жаѓдайда толыѓымен оњѓа ќарай ыѓысады. 7500С температурада “а” жєне “г” тепе-тењдік константасы µте аз мµлшерде болатынын есептеп шыѓарылѓан:
7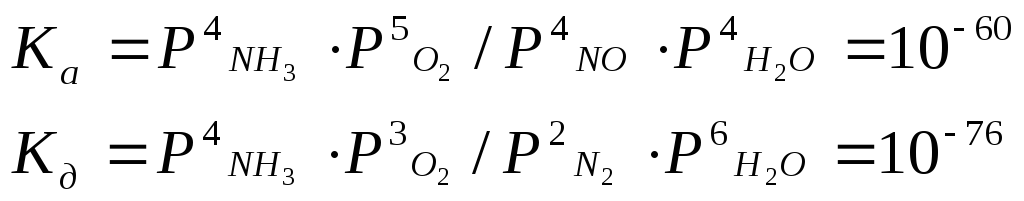 500C
температурада аммиак толыѓынан тотыѓып,
тепе-тењдік солдан оњѓа ќарай ќайтымсыз
толыќ ыѓысатыны дєлелденген.
500C
температурада аммиак толыѓынан тотыѓып,
тепе-тењдік солдан оњѓа ќарай ќайтымсыз
толыќ ыѓысатыны дєлелденген.
Катализаторсыз ењ жылдам ж‰ретін реакция – “д” болѓандыќтан, азот ќышќылы µндіру процесінде аммиакты тотыќтырѓанда (“а”) ќажетті реакцияѓа оњтайлы жаѓдай туѓызу маќсатпен тањдамалы катализатор ќолданады.
Катализатор ретінде 4% Pd жєне 3% Ru араластырылѓан платинаныњ жіњішке (0,04-0,09 мм) сымынан тоќылѓан жиі торды (1 см2 ауданда 1000-3500 т‰йін бар) ќолданады. Контакт аппаратында пакет т‰рінде орналасќан, егер аммиак тотыѓу процесі атмосфера ќысымында ж‰ретін болса, пакеттегі тор саны 3-4, егер ќысым атмосфера ќысымынан жоѓарылау болса тор саны 18-ге дейін болады, тор санын азайту маќсатпен аммиакты тотыќтыру процесін екі сатыда ж‰ргізуге болады: бірінші сатыда платина катализаторын ќолданса, екінші сатыда темір немесе хром оксидініњ кобальт т±здарымен араласќан ќоспаларын ќолданады.
Атмосфера ќысымында аммиак тотыќќанда єрбір тонна азот ќышќылы µндірілгенде 0,04-0,06 г платина ±саќ к‰йінде шыѓын болады, жоѓарылау ќысымда аммиак тотыќќанда платина шыѓыны он есе артады. Осы шыѓын азот ќышќылыныњ µзіндік ќ±нын жоѓарылатады. ¤ндіріс жаѓдайында аммиактыњ тотыѓу процесі µте аз мерзімде аяќталады (1-210-4сек.).
Аммиактыњ тотыѓу процесіне катализатордан басќа да температура, ќысым жєне газдар ќоспасыныњ ќ±рамы да єсер етеді. Температура жоѓарылаѓан сайын реакция жылдамдыѓымен ќатар газдардыњ диффузиялыќ коэффициенттері де артады, біраќ температура 800-8500С-тан асып кетсе, азот (ІІ) оксидініњ шыѓымы тµмендейді де, азот шыѓымы артады (“г” – реакциясы жєне аммиак десорбцияланады). Осы себептен платина катализатордыњ ќатысуымен ж‰ретін аммиактыњ тотыѓу процесінде атмосфералыќ ќысымда оњтайлы температура 8000С, жоѓарылау ќысымда 9000С, осы температурада жанасу уаќыты тым аз болѓандыќтан жанама реакциялар ж‰ріп ‰лгермейді.
Активтілігі тµмен металл оксидтерін ќолданѓанда жанасу уаќыты он есе µсіп, платина катализаторымен салыстырѓанда, оњтайлы температура 700-7500С дейін тµмендейді.
Ќысым жоѓарылаѓан сайын реакция кµлеміндегі реакцияласушы реагенттердіњ концентрациясы кµтеріледі, осымен ќатар газдар ќоспасыныњ кµлемі кішіреюі ќысымѓа тура пропорционал болѓандыќтан катализатор µнімділігі артады; біраќ ќысымныњ жоѓарылауы катализатор шыѓымын кµбейтеді, демек б±л жаѓдай аппаратура ќ±ны мен ќышќыл ќ±нын арттырады. Осы себептен азот ќышќыл µндірісінде ќысым 0,2-1,0 МПа шамасында болады.
Газ ќоспасыныњ ќ±рамы жєне температура шамасы технологиялыќ процестіњ жылдамдыѓына ‰лкен єсер етеді, “а” – реакция тењдеуі бойынша 1 моль аммиакќа 1,25 моль оттек ж±мсалса, азот (ІІ) оксидініњ шыѓымы 65% -дан аспайды, осы шыѓымды кµбейту маќсатпен іс ж‰зінде О2:NH3=1,8-2,0:1 ќатынаста болады, егер ауа ќрамында оттектіњ мµлшерімен есептегенде аммиактыњ єр-бір кµлемінде ауаныњ 9,5-10,5 кµлемі ќажет.
¤ндірісте естен шыѓармайтын жаѓдай – даѓдылы жаѓдайда аммиак пен ауа ќоспасыныњ ќ±рамындаѓы аммиак 16-27% аралыѓында болса, м±ндай ќоспа – “ќопарылѓыш”. Температура жоѓарылаѓан сайын ќопарылыс беретін интервал кењейе береді. Мысалы, 2500С температура 14-30,5% аммиак, егер ќоспа аммиак пен оттектен ќ±ралса атмосфера ќысымында 180С температурадаѓы ќопарылѓыш ќоспа интервалы – 15,3-79% NH3. Ќысым кµбейген сайын м±ныњ тµменгі шегі тµмендейді.
Азот (ІІ) оксидінің азот (ІV) диоксидіне тотыѓуы. Аммиакты тотыќтырѓанда пайда болѓан нитроз газдарыныњ ќ±рамындаѓы азот (ІІ) оксидініњ мµлшері 20% шамасында, ќалѓандары – оттек, азот жєне су буы. Азот ќышќылын µндіру ‰шін азот (ІІ) оксидін диоксидке мына ќайтымды реакциямен тотыќтырады:
2NO+O22NO2+112 кДж
Процесс солдан оњѓа ќарай ж‰ргенде жылу бµлінеді, кµлем кішірейеді. Ле-Шателье принципі бойынша ќысым жоѓарылап температура тµмендеген сайын реакция оњѓа ќарай ыѓысады.
А![]() зот
(ІІ) оксидініњ тотыѓу реакциясыныњ
тепе-тењдік константасыныњ температураѓа
тєуелділігі мынадай:
зот
(ІІ) оксидініњ тотыѓу реакциясыныњ
тепе-тењдік константасыныњ температураѓа
тєуелділігі мынадай:
Келтірілген тепе-тењдік константасыныњ температураѓа тєуелділігінен шыѓатын ќорытынды: 1000С температураѓа дейін реакция толыѓынан оњѓа ќарай ыѓысады (NO2 баѓытќа ќарай).
Температура 7000С жєне одан єрі кµтерілгенде тотыѓу реакциясы ж‰рмейді. Контакт аппаратынан шыќќан нитроз газыныњ ќ±рамында NO2 болмайды, сондыќтан NO2 алу ‰шін ыстыќ газ ќоспасын 1000С-дан тµмен температураѓа салќындатады. Азот (ІІ) оксидініњ тотыѓу реакциясыныњ бір ерекшелігі – реакция жылдамдыѓы температура µскен сайын тµмендейді. 1300С температурадаѓы жылдамдыќпен салыстырѓанда 00С температурада 12 есе ал 3000С температурада реакция жылдамдыѓы 30 есе тµмендейді. М±ндай аномал (ауытќулыќ) жаѓдайда былай т‰сінік беріледі. Азот (ІІ) оксидініњ тотыѓуы аралыќ процестер арќылы ж‰реді – димер оксиді т‰зіледі, б±л процесс экзотермиялыќ, ќайтымды. Температура жоѓарылаѓанда димер концентрациясы тµмендейді, димер концентрациясыныњ тµмендеуі тотыѓу реакциясыныњ жылдамдыѓын тµмендетеді:
2NO(NO)2+Q
(NO)2+O2NO2+Q
Азот ќышќылын µндіру процесіндегі ењ баяу ж‰ретін процесс - азот (ІІ) оксидініњ тотыѓуы.
NO2-тоњазытќанда NO2 полимеризацияланады: - 200С температурада полимеризациялану дєрежесі 92%.
2NО2N2O4+57 кДж
Полимеризациялану жылдамдыѓы µте жоѓары.
Абсорбцияѓа келетін нитроз газ ќ±рамында: NO2, N2O4, O2, N2O, NO, N2, су буы жєне басќалар болады.
Азот диоксидін жєне оныњ димерініњ абсорбциялану схемасы.
2NO2+H2OHNO3+HNO2+116 кДж
N2O4+H2OHNO3+HNO2+59 кДж
Азотты ќышќыл т±раќсыз ол ыдырайды:
3НNO2HNO3+2NO+ Н2О - 76 кДж
Ќорытып жазѓанда:
3NO2+H2OHNO3+NO+136 кДж
Азот диоксидініњ суда сіњірілуі-типтік хемосорбциялыќ газ с±йыќтыќ ж‰йесіндегі процесс.
Тепе-тењдікті азот ќышќылына ќарай ыѓыстыру маќсатпен температураны тµмендетіп, ќысымды жоѓарылатыды. Азот оксидін абсорбциялауѓа ќарама-ќарсы принципті ќолданады, яѓни концентрлі газ концентрлі азот ќышќылымен кездесіп, соњында бос ќалѓан NO2 с±йытылѓан азот ќышќылымен абсорбцияланады.
Абсорбциялыќ процесс экзотермиялыќ процесс болѓандыќтан µндірілген азот ќышќылыныњ температурасы 500С, концентрациясы (атмосфера ќысымында т‰зілген) 50% болды, егер µндіріс ќысымы 0,6-0,8 МПа шамасында болса, азот ќышќылыныњ концентрациясы 58-60%-ѓа жетеді.
¤ндіріс ќысымын 5 Мпа дейін кµтеріп тікелей синтез ќондырмасында азот оксиді мен оттек ќоспасынан концентрлі 98% азот ќышќылын µндіруге болады.
2N2O4(C)+2H2O(c)_+O2(г)4HNO3 (c) =59,5 кДж
5.5. Сұйытылған азот қышқылын өндіру. С±йытылѓан азот ќышќылын аммиактан µндіруге µндірісте ‰ш технологиялыќ процесті ќолданады: 1. Атмосфера ќысымында;
2. Кµтеріњкі (жоѓарылау) ќысымда;
3. Ќ±растырылѓан (комбинированный).
Аммиакты атмосфера ќысымында тотыќтырып, азот (ІІ) оксидін кµтеріњкі ќысымында тотыќтырып, т‰зілген азот диоксидіне сол ќысымда сумен абсорбциялайды.
Ауа тозањдардан тазартылып, аммиакпен араласып (10:1), контакт аппаратына келіп, 8500С температурадаѓы нитроз газы утильдеу ќазанына келіп, су буын µндіріп температурасын 2500С-ке дейін тµмендетеді, нитроз газы келесі салќындатќышќа келіп, 300С дейін салќындап, нитроз газыныњ ќ±рамындаѓы су буы конценсацияланып азот (ІІ) оксидініњ диоксидке тотыќќан т‰рі мен єрекеттесіп с±йытылѓан азот ќышќылын т‰зеді. Газ к‰йінде ќалѓан нитроз газдарын газ ‰рлегіш абсорбциялау м±нарасына жібереді, ењ соњѓы абсорциялау м±нарасы жоѓарѓы жаѓынан сумен суѓарылады. Бірінші м±нарадан µнім шыѓарылады. Абсорциялау м±нараларында азот оксидініњ ќышќылѓа ауысу дєрежесі 92% шамасында. Азот оксидтері адсорбцияланѓанда реакцияѓа ќатыспаѓан инертті азот (ІІ) оксиді бµлінеді, осы себептен абсорбциялау м±нараларыныњ соњынан тотыќтырѓыш м±нара орнатылады, осы соњѓы м±нарада азот (ІІ) оксиді диоксидке тотыѓады. Тотыѓу м±нарасынан шыќќан газ ќоспалары атмосфераѓа шыќпастан б±рын азот оксидтерін сода ертіндісімен сорып нитрит – нитрат сілтішесіне айналдырып м±нараныњ тµменгі шетінен шыѓарып алынады. Сода ертіндісініњ орнына кµбінесе к‰йдіргіш натр немесе сµндірілген єк ќолданылады:
NO+NO2+ Na2CO3=2NaNO2+CO2
Атмосфераѓа шыѓарылатын газды азот оксидінен толыќ тазарту маќсатпен газ ќоспасын 370-4200С дейін ќыздырып, аз мµлшерде табиѓи газ ќосып палладий катализаторы орналасќан конвертірге жіберіледі. Конвертірде (реакторда) мынадай реакциялар ж‰реді:
2CH4+O22CO+4H2+Q1
2NO2+4H2=N2+4H2O+Q2
2NO+2H2=N2+2H2O+Q3
Реакциялар жылу бµлумен ж‰реді, реакциядан шыќќан газ ќоспаларыныњ температурасы 700-7300С шамасында болады; газ жылуын су буын дайындауѓа пайдаланады.
Концентрлі азот ќышќылын тікелей синтездеу єдісімен ќатар с±йытылѓан азот ќышќылын концентрлі су сорѓыш к‰кірт ќышќылымен айдау єдістерімен µндіруге болады.
5.6. Азот қышқылын концентрлеу. С±йытылѓан азот ќышќылыныњ ертіндісін буландыру арќылы 68,4%-ды азот ќышќылыныњ ертіндісін (азеотропты ќоспа-ќ±рамы жєне ќайнау температурасы µзгермей айдалатын ертінді) алуѓа болатыны белгілі. Осы себептен с±йытылѓан азот ќышќылын концентрлеу суды µз ќ±рамына µте жаќсы ќосып алатын концентрлі к‰кірт ќышќылыныњ ќатысуымен тєрелке тєрізді барботаждау (барботаждау – газды немесе буды с±йыќтыќ ќабатынан ќысым к‰ші арќылы µтізе отырып, бµлшектеу) ќ±бырларында немесе ќондырмалы ќабырларда орындалады. К‰кірт ќышќылы с±йытылѓан азот ќышќылындаѓы суды µзіне байланыстырып 100%-ды азот ќышќылынан ќайнау температурасы жоѓары к‰кірт ќышќылыныњ гидратын т‰зеді. Осы себептен азот жєне к‰кірт ќышќылдарыныњ ќоспасын ќыздырѓанда ќоспадан бу ќалпында тек ќана азот ќышќылы болатын жаѓдай орындауѓа болады. С±йытылѓан азот ќышќылын концентрлейтін ќондырѓыныњ схемасы суретте кµрсетілген. Концентрлеу ќ±бырына берілетін с±йытылѓан азот ќышќылы екіге бµлінеді, бір бµлігі буландырѓыш арќылы буѓа айналып барботаждау ќ±бырыныњ оныншы (барлыќ тєрелкеніњ саны 20) тєрелкеге беріледі (2), с±йытылѓан азот ќышќылыныњ екінші белгілі тікелей оныншы тєрелкеден жоѓары орналасќан барботаждау ќ±бырындаѓы тєрелкеге жіберіледі. 92-94%-ды концентрлі к‰кірт ќышќылы жоѓары орналасќан тєрелкеніњ біреуіне жіберіледі. Ќоспаны жылытуѓа ќ±бырдыњ тµменгі жаѓынан µткір су буы (2500С температурадаѓы) енгізіледі. Азот ќышќылыныњ буы аз мµлшерде су буы жєне азот ќышќылыныњ ыдырауынан пайда болѓан азот оксидтері ќ±бырдан тоњазытќыш конденсаторына (3) жіберіліп, азот ќышќылы конденсацияланады, ал нитроз газдарын (азот оксидтері) бµліп алып, азот ќышќылын µндіретін цехта жартылай шикізат ретінде ќолданады. Азот оксидтерініњ бірсыпырасы конденсацияланѓан азот ќышќылында ериді, солардан азот ќышќылын тазарту ‰шін ол ќышќыл конденсатордан ќайтадан ќ±бырдаѓы жоѓарыда орналасќан тєрелкелерге ќайта келіп тµменнен кµтерілген бу ќалпындаѓы азот ќышќылы мен азот оксидтерініњ ќоспасымен ‰рленіп оксидтерден тазартылып тоњазытќышќа (4) келіп салќындап µнім ретінде т±тынушыларѓа ±сынылады.
Пайдаланылѓан с±йытылѓан 68%-ды к‰кірт ќышќылы ректификациялау ќ±бырыныњ тµменгі шетінен шыѓарылып ыстыќ ќалпында буландырылып 92-94%-ды концентрлі ќышќылѓа айналады.
Єрбір тонна азот ќышќылын концентрлеуге ‰ш-тµрт тонна к‰кірт ќышќылы шыѓындалады. Ректификациялау ќ±бырын дайындауѓа ќышќылѓа тµзімді ферросилид (ќ±рамында 14-18% кремний бар шойын) ќолданады.
Қазақстанда аммиак, азот қышқылы және аммиак селитрасын Ақтау қаласында «Қазазот» біріккен кәсіпорны (БК) өндіреді.
Бақылау сұрақтары.
1. Атмосфера азотын фиксациялау әдістері.
2. Аммиакты синтездеудің физико-химиялық негізі.
3. Синтетикалық аммиак өндірудің схемасы.
4. Азот қышқылын өндіру әдістері.
5. Азот ќышќылын аммиакты тотыќтырып алу єдісініњ физика-химиялыќ
негізі.
6. Азот (ІІ) оксидінің азот (ІV) диоксидіне тотыѓуы.
7. Азот диоксидін жєне оныњ димерініњ абсорбциялану схемасы.
8. Сұйытылған азот қышқылын өндіру.
9. Азот қышқылын концентрлеу.
76-лекция. Тақырыбы: Күйдіргіш натр және хлорды өндіру.
Жоспары: 7.1. Күйдіргіш натр өндіру.
7.2. Хлор және күйдіргіш натр өндірудің физика-химиялық негізі.
7.3. Электролиз өнімін өңдеу.
Лекция мақсаты: Химиялық және электрохимиялық әдістермен күйдіргіш натр және хлорды өңдіру әдістерін, хлор және күйдіргіш натр өндірудің физика-химиялық негізін түсіндіру.
Лекция мәтіні. 7.1. Күйдіргіш натр өндіру. К‰йдіргіш натр µндірісте химиялыќ жєне электрхимиялыќ єдістермен µндіріледі.
1. Химиялыќ єдістер: єк (ізбес) жєне феррит єдістері.
I.I. Єк єдісі. Сода ертіндісін ізбес суымен µњдегенде каустификациялау процесі ж‰ріп, каустикалыќ сода т‰зіледі:
![]()
Соданыњ
каустификациялау дєрежесі
![]() ерітіндісініњ бастапќы концентрациясына
тєуелді болатыны аныќталды. Ерітіндініњ
бастапќы концентрациясы аз болѓан
сайын соданыњ каустификациялану
дєрежесі жоѓарылайды. Мысалы,
5%
ерітіндісініњ бастапќы концентрациясына
тєуелді болатыны аныќталды. Ерітіндініњ
бастапќы концентрациясы аз болѓан
сайын соданыњ каустификациялану
дєрежесі жоѓарылайды. Мысалы,
5%![]() ерітіндісініњ
каустификациялау 99,2 %болса, 22 %
ерітіндісініњ каустификациялау дєрежесі
78,1 % шамасында болады. Іс ж‰зінде
µндірісте сода ерітіндісініњ
концентрациясы 12 % мµлшерінде болады,
каустификациялау дєрежесі 90 %, сілті
ќ±рамында
ерітіндісініњ
каустификациялау 99,2 %болса, 22 %
ерітіндісініњ каустификациялау дєрежесі
78,1 % шамасында болады. Іс ж‰зінде
µндірісте сода ерітіндісініњ
концентрациясы 12 % мµлшерінде болады,
каустификациялау дєрежесі 90 %, сілті
ќ±рамында ![]() -100-120г/л.
-100-120г/л.
Технологиялыќ
натр сілтісін µндіру процесініњ
температурасы жоѓарылаѓан сайын
![]() шыѓымы тµмендейді, оѓан себепєктіњ
ерігішітігі азаяды.
¤ндірісте оптимал температура: 1000С,
осы температурада реакция жылдамдыѓы
жоѓары жєне реакция нєтижесінде
бµлінетін шыѓымныњ /
шыѓымы тµмендейді, оѓан себепєктіњ
ерігішітігі азаяды.
¤ндірісте оптимал температура: 1000С,
осы температурада реакция жылдамдыѓы
жоѓары жєне реакция нєтижесінде
бµлінетін шыѓымныњ /![]() жєне таѓы басќа ќоспалар/ т±ну жылдамдыѓы
жоѓары. Сµндірілгенєктіњ
еру дєрежесін арттыру маќсатпен
суспензияны ќарќынды т‰рде араластыру
ќажет.
жєне таѓы басќа ќоспалар/ т±ну жылдамдыѓы
жоѓары. Сµндірілгенєктіњ
еру дєрежесін арттыру маќсатпен
суспензияны ќарќынды т‰рде араластыру
ќажет.
Каустикалыќ содасын (к‰йдіргіш натр) µндіру технлогиялыќ процесініњ негізгі сатылары :
Техникалыќ натр бикорбанатын бумен ќыздырып сода ерітіндісін дайындау.
![]()
«Ќалыпты» ерітінді деп аталатын 12 %-ды сода ерітіндісін дайындау.
«Ќалыпты» ерітінді мен єк с‰тін єрекеттестіру (бірінші каустификациялау).
Шламды бµліп алу.
Шламды декарбонизатордан бµлінген с±йыќтыќпен µњдеу (2-ші каустификациялау).
Шламды жуу.
Сілтіні ќайната суалту.
К‰йдіргіш натрды сусыздандыру.
Сегіз сатыныњ ењ баяу ж‰ретіні 4-ші жєне 6-шы саты. Осы екі сатыныњ жылдамдыѓын арттыру маќсатпен крахмал, темір т±здарын жєне натр сульфатыныњ ерітінділерін ќолданады.
Єк єдісініњ негізгі кемшіліктері:
Сілті ќ±рамындаѓы
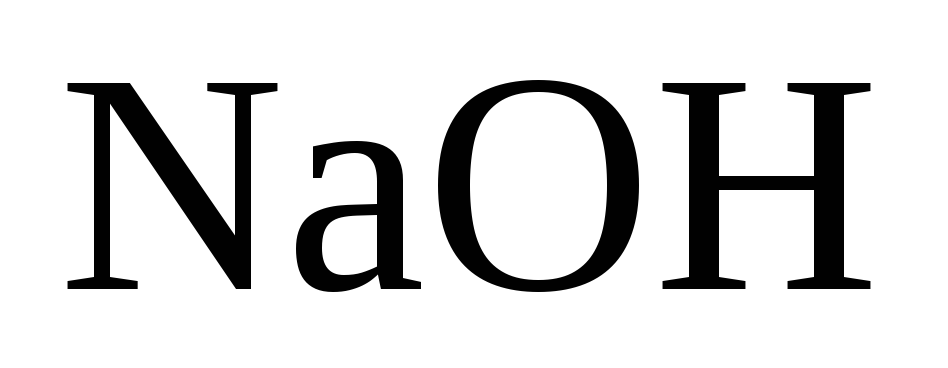 концентрациясы тым аз (90-135г/л).
концентрациясы тым аз (90-135г/л).Іске аспайтын жиналып ќалатын шлам. Ќазіргі уаќытташламдыµртеп,єкµндіріп, оны ќайтадан технологиялыќ процесс басына т‰сіреді (каустификациялауѓа).
1.2. К‰йдіргіш натрды феррит єдісімен µндіру. 1100-12000С температурада темір оксидімен кальцинирленген соданы араластырып дайындалѓан шихтаны пісіріп, ќатты ќалпындаѓы піскен натр ферритін шаймалап сілті ерітіндісін бµліп алуѓа негізделген.
Технологиялыќ процестіњ негізгі сатылары:
Шикіќ±рамды (шихта) дайындау: Na2CO3+Fe2O3 = 25%+75%, шикіќ±рамды1100-12000С температурада аса ќыздыру.
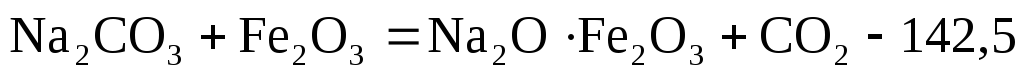 кДж
кДжНатр ферритін шаймалау жєне сµндіру.
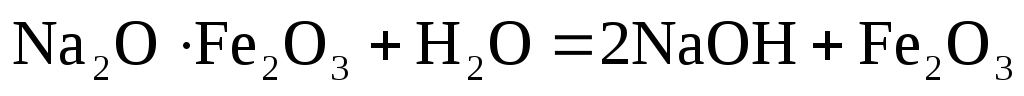
![]() -технологиялыќ
процестіњ басына ќайтарылады.
-технологиялыќ
процестіњ басына ќайтарылады.
Сілтіні
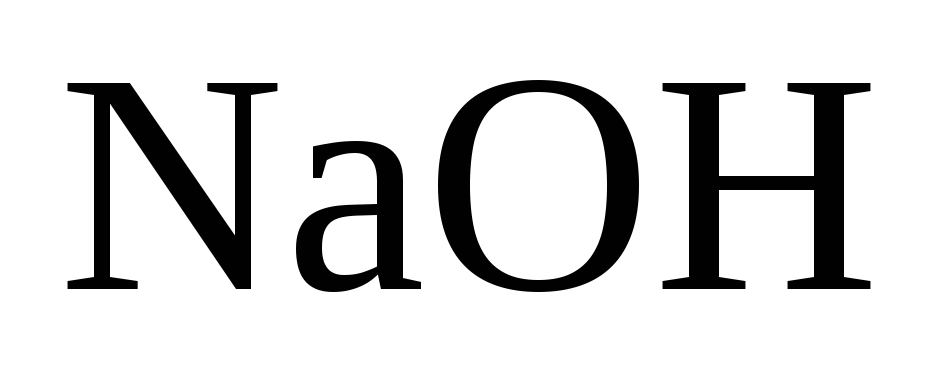 мµлшері 610 г/л-ге жеткенше ќайната
суалту; (натр ферритін шаймалаудан
шыќќан ерітінді ќ±рамында 360-380 г/л
мµлшері 610 г/л-ге жеткенше ќайната
суалту; (натр ферритін шаймалаудан
шыќќан ерітінді ќ±рамында 360-380 г/л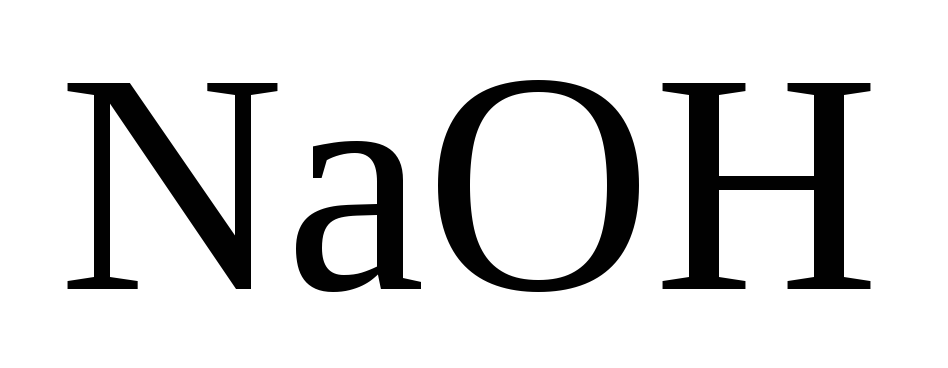 болады).
болады).Суалтылѓан сілтішені с‰зіп тазарту.
Біржолата суытып, к‰йдіргіш натрды балќыту.
Балќыѓан
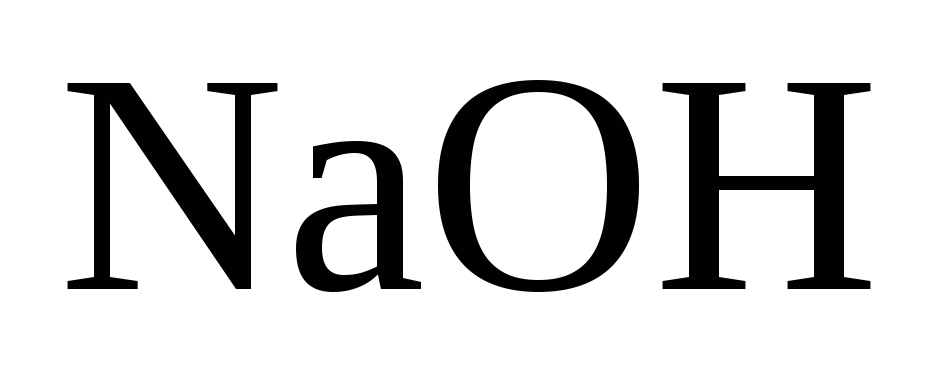 -ты мµлдір ќалпында бµшкеге ќ±ю.
-ты мµлдір ќалпында бµшкеге ќ±ю.
Осы єдіспен каустификациялау дєрежесі 87-90 % шамасында болады. Негізгі кемшіліктер: Отын кµп ж±мсалынады, сода шыѓымы жоѓары жєне ењбек жаѓдайы ауыр.
7.2. Хлор және күйдіргіш натр өндірудің физика-химиялық негізі. Натрий хлоридініњ ертіндісін электролиздегенде: хлор, сутек жєне к‰йдіргіш натр µнеді. Б±л єдісті XIX - ѓасырдыњ соњѓы жылдарынан бастап хлор мен сілті µндіруге ќолданыла бастады.
Натрий хлоридініњ судаѓы ерітіндісін электролиздеу процесі ќатты немесе с±йыќ катодтан, графит анодынан ќ±ралѓан электролиздікастаудаѓыж‰реді. Ќатты катод ретінде таза (ж±мсаќ) темірді, с±йыќ ќатод ретінде сынапты ќолданады. Ќатты катодты электролиздік астау екі т‰рлі болады: тік с‰згіш диафрагмалы жєне кµлденењ с‰згіш диафрагмалы катодтыастаулар.
Ќатты катодты электролиздік астауда ас т±зыныњ ќаныќ ертіндісі (310 г/л) электролиздеу процесініњ механизмі:
NaCl ![]() Cl-
+ Na+
Cl-
+ Na+
H2O
![]() OH-+H+
OH-+H+
Ертіндіде: Na+,H+, Cl-, OH- иондары бар.
Электродтарды т±раќты тоќ кµзіне жалѓастырѓанда, ерітінді арќылы электр тоѓы ж‰ргенде анодта оттекпен хлордыњ бµлінуін к‰туге болады:
![]() (а)
(а)
![]() (є)
(є)
Бірінші /а/ тотыѓу процесіне бейтарапты ас т±зыныњ ќаныќќан ерітіндісінде Нернст тењдеуі бойынша ОН- ионыныњ зарядсыздану потенциалы:
![]() в тењ
болады
в тењ
болады
Осы
жаѓдайдаѓы /є/
![]() иондарыныњ зарядсыздану потенциалы:
иондарыныњ зарядсыздану потенциалы:
![]() +1,33
втењ болады.
+1,33
втењ болады.
М±ндаѓы:
![]() -
ерітіндідегі ОН-иондарыныњ
активтілігі,г-ион/л; 5,4
–анолиттегі
-
ерітіндідегі ОН-иондарыныњ
активтілігі,г-ион/л; 5,4
–анолиттегі![]() концентрациясы, г-мол/л;0,6-
концентрациясы, г-мол/л;0,6-![]() -ныњ
активттік коэффиценті.
-ныњ
активттік коэффиценті.
Аниондардыњ
зарядсыздану потенциал мµлшері бойынша
бірінші ретте анодта оттек бµлінуі
тиіс, іс ж‰зінде графит анодында
оттектіњ асќын кернеуі сол жаѓдайдаѓы
хлордыњ бµліну асќын кернеуініњ жоѓары
болѓандыќтан, анодта хлор газ ќалпында
бµлінеді (є-реакциясы).
Хлордыњ бµлінуі ас т±зыныњ ертінді
концентрациясы артќан сайын жењілденеді,
осы себептен ерітінділердіњоњтайлыконцентрациясы-310-315г/л![]() екені аныќталѓан.
екені аныќталѓан.
Катодта
- Н+жылжуы![]() -дан
шапшањыраќ (
-дан
шапшањыраќ (![]() )
єрі зарядсыздану потенциалы тµмен
)
єрі зарядсыздану потенциалы тµмен![]() ,
сондыќтан Н+
иондары катодќа б±рын барып зарядсызданып
газ ќалпында бµлініп шыѓады.
,
сондыќтан Н+
иондары катодќа б±рын барып зарядсызданып
газ ќалпында бµлініп шыѓады.
2Н+ + 2е = 2H → H2
2H2O + 2e = H2 + 2OH- (б)
Қорытқанда: 2Cl- - 2e = Cl2
2H2O + 2e =H2 + 2OH-

2H2O + 2Cl- = Cl2 + H2 + 2OH-
2H2O + 2NaCl = Cl2 + H2 + 2NaOH
Электролиз кезінде негізгі "а,є" жєне "б" процестерімен ќатар таѓы да басќа ќосымша процестер ж‰руі м‰мкін:
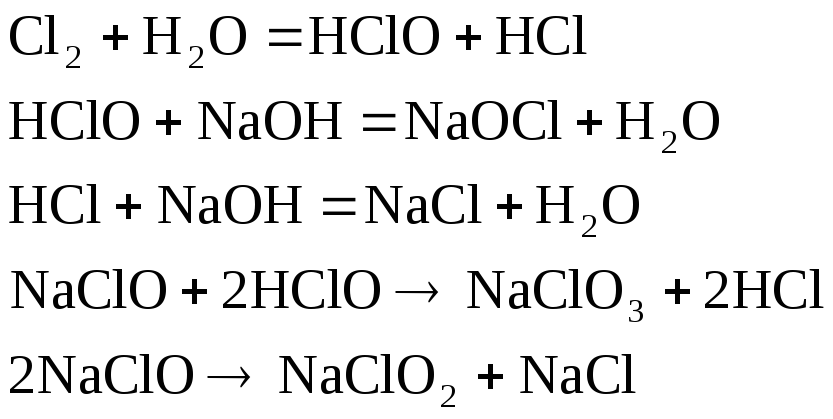
![]() иондары анодта
тотыѓып CIO3-иондарын т‰зеді.
иондары анодта
тотыѓып CIO3-иондарын т‰зеді.
Ќосымша процестер µндірілетін ќажетті - маќсатты заттардыњ шыѓымы тµмендейді, электр энергиясыныњ шыѓымын арттырады:
анодта:
![]()
анодта бµлінген оттек атомдары графитпен єрекеттесіп кµміртек оксидін т‰зеді:
C+O=CO
CO+O=CO2
Егер катодта бµлінетін заттар анодта бµлінетін заттардан бµлінбесе, катод жанында ертіндіде пайда болѓан к‰йдіргіш натр, анод жанында пайда болѓан ќышќылдармен мынадай тењдеумен єрекеттеседі:
![]()
Жоѓарыда келтірілген ќосымша процестерді ж‰ргізбеу ‰шін катод жєне анод кењістіктерін дифрагмамен оќшауландырады, осыѓан ќосымша электролиттіњ аѓу баѓыты анодќа ќарама-ќарсы болуы міндетті. С‰згіш диафрагма ретінде жапыраќталѓанталшыќтас(азбест)ќолданады.
Электролиздік
астаудаѓы ас т±зы электролиз кезінде
толыќ электролизденбейді, ерітінді
ќ±рамында 180-170 ![]() г/л жєне 110-120 г/л
г/л жєне 110-120 г/л ![]() болады, астаудан шыѓарылатын ерітіндіні
"сілтіше" деп атайды.
болады, астаудан шыѓарылатын ерітіндіні
"сілтіше" деп атайды.
7.3. Электролиз өнімін өңдеу. Электролиз процесініњ нєтижесінде µнген сілтіше ќ±рамында к‰йдіргіш натр мµлшері электролиздік астаудыњ т‰ріне байланысты єр т‰рлі болады – бір жаѓынан, екінші жаѓынан электролизден-беген ас т±здардыњ да шамасы єр т‰рлі мµлшерде болады. Сілтіше ќ±рамындаѓы ас т±зын бµліп алу маќсатпен ерітіндіні буландырады, к‰йдіргіш натр ертіндісініњ концентрациясы 50%- ѓа жеткенде ас т±зы т±нбаѓа т±нады. (Ас т±зыныњ ерігіштілігі сілті ертіндісініњ концентрациясына байланысты – концентрация µскен сайын т±здыњ ерігіштігі тµмендейді). Бµлініп алынѓан ас т±зын электролизге берілетін электролит дайындауѓа ќолданылады.
С±йытылѓан жєне ас т±зынан тазартылѓан к‰йдіргіш натрий ертіндісі буландыру єдісімен концентрленеді, соњында шойын ќазанда балќытып темір бµшкелеріне ќ±йылып ќоймаѓа келіп т‰седі.
Хлор электролиздік астаудансу буымен ќаныќќан к‰йінде су буынан ќ±рѓату ‰шін бірінші сатыда 20-300С температурадаѓы сумен шайќалып, су буыныњ кµпшілік мµлшері конденсацияланып су ќ±рамына ќосылады, (жуынды сумен ќосылады). Аз дымќылды хлор концентрлі к‰кірт ќышќылымен ќ±рѓатылады (ќ±рѓатќыш м±нараларда).
Ќ±рѓатылѓан хлор ‰ш т‰рлі єдістермен с±йылады:
1-1,2 Мпа ќысымда жєне 200С температурада
Атмосфералыќ ќысымда,-500С температурада
0,3-0,6 Мпа ќысымда,- 50С тен –250С температура аралыѓында.
С±йылтылѓан хлорды болат баллондарында, бµшкелерде, иє 50 т цистерналарда т±тынушыларѓа ±сынады.
Бақылау сұрақтары:
1. Күйдіргіш натр өндіру әдістері.
2. Күйдіргіш натр өндірудің технологиялық процесінің негізгі сатылары.
3. Хлор және күйдіргіш натр өндірудің физика-химиялық негізі.
4. Электролиз өнімін өңдеу.
8-лекция. Тақырыбы: Органикалық заттар технологиясы.
Жоспары: 8.1. Органикалық синтездеу өнеркәсіптеріндегі негізгі процестер
және шикізаттар.
8.2. Көміртек (ІІ) оксидіне негізделінген синтездер.
8.3. Олефиндерге негізделген синтездер.
8.4. Ацетиленге негізделген синтездер.
Лекция мақсаты: Негізгі органикалық синтездегі өнімдердің түрлері, олардың сипаттамасы, қасиеттері, халық шаруашылығындағы маңызын түсіндіру. Органикалық синтезде қолданылатын типті химия-технологиялық процестер: гидрлеу, тотығу, дегидрлеу, гидраттау, гидролиз, алкилдеу, нитрлеу, хлорлау әдістерін оқыту.
Лекция мәтіні. 8.1. Органикалық синтездеу өнеркәсіптеріндегі негізгі процестер және шикізаттар. Органикалыќ синтездеу µнеркєсіптерінде ќолданылатын шикізат химиялыќ µнеркєсіптерінде мањызды маќсаттарды орындауды: шикізат материалдарын кешенді т‰рді пайдалануды, ќиыстыру µндірістерінде таѓамдыќ азыќ-т‰лік шикізаттарын, азыќ-т‰лік емес шикізаттармен ауыстыруды жєне µсімдік шикізаттарын минералдыќ заттармен ауыстыруды ќамтамасыз етеді.
Негізгі
шикізаттардыњ т‰рлері: табиѓи жєне
жолай (попутный) кµмірсутек газдары,
газ жєне с±йыќ ќалпында м±най µњдеудегі
µнімдер, сондай-аќ синтез газ (![]() ),
кокс газы жєне аѓаш, тас кµмірді,
тактатасты (сланц), шымтезекті термиялыќ
µњдеуде бµлінетін µнеркєсіп шайырлары.
),
кокс газы жєне аѓаш, тас кµмірді,
тактатасты (сланц), шымтезекті термиялыќ
µњдеуде бµлінетін µнеркєсіп шайырлары.
Химиялыќ µњдеуде т‰сетін шикізаттар алдын-ала таза заттарды алуѓа µњделінеді жєне концентрленеді. Ылѓалдылыќтан, механикалыќ ќоспа т‰ріндегі бµлшектерден, к‰кірт ќосындыларынан тазарту ‰шін ќ±рѓатќыш матриалдардан, с‰згіштерден, сіњіргіш массалардан µткізіледі. Газдар ќоспасынан концентрлі затты бµліп алу маќсатпен ќоспаны конденсациялау єдісін, сондай-аќ абсорбциялау-десорбциялау єдістерін ќолданады. С±йыќтарды жекелеудіњ (бµлудіњ) негізгі єдістері: айдау жєне ректификациялау (ќайнау температуралары жаќын с±йыќ заттарды буѓа айналдыру єдісімен бір-бірінен бµліп тазарту).
Органикалыќ синтездеу µнеркєсіптеріндегі µнім µндіру органикалыќ химияныњ типтік реакцияларына: гидрлеу жєне дегидрлеу, гидратациялау жєне дегидратациялау, хлорлау, гидрохлорлау жєне дегидрохлорлау, тотыѓу, сульфиттеу, нитрлеу, конденсациялау, полимеризациялау жєне т.б негізделінген.
Химиялыќ реакция баѓыты жєне оныњ жылдамдыѓы химиялыќ жєне физикалыќ процесстер параметрлерініњ жиынтыѓына: температура, ќысым, уаќыт, агрегаттыќ к‰йіне жєне реагенттер ќатынасына катализаторлар ќолдануына, ерігіштерді жылыту, салќындату єдістері т.б. тєуелді.
Органикалыќ синтездеу процестері кинетикалыќ саласында ж‰ретін болѓандыќтан олардыњ жалпы жылдамдыѓы химиялыќ реакция жылдамдыѓымен аныќталѓанда мынадай тењдеумен есептелінеді:
![]()
М±ндаѓы:
![]() -процестіњ
ќозѓаушы к‰ші, реакцияласуы заттардыњ
єсер етуші концентрацияларыныњ
кµбейтіндісіне тењ; К-жылдамдық
константасы, Арренус теңдеуіне сәйкес.
-процестіњ
ќозѓаушы к‰ші, реакцияласуы заттардыњ
єсер етуші концентрацияларыныњ
кµбейтіндісіне тењ; К-жылдамдық
константасы, Арренус теңдеуіне сәйкес.
Органикалыќ синтездеу процестерінде бір ѓана реакция ж‰рмей бірнеше параллельді жєне тізбекті реакциялар ж‰ретін болѓандыќтан негізгі (маќсатты) µнімнен басќа ќосымша заттар алынады, немесе µндіріс ќалдыќтары бµлінеді. Реакциялар санына байланысты процестіњ жылдамдыќ константасы к‰рделі функциялы бірнеше реакциялар константасына айналады.
![]()
Сонымен бірге функциялы тєуелділік температура жєне ќысым, реакцияласатын заттардыњ концентрациясы µзгеруіне жєне басќа параметрлер режиміне байланысты µте ‰лкен µзгеріске ±шырайды.
Органикалыќ синтездеуде тек ќана негізгі реакцияны жылдамдататын катализаторды ќолданады. М±ндай жаѓдайда тек ќана функциялы тєуелділік µзгермейді, сонымен ќатар реакция реттілігі µзгереді.
Органикалыќ
синтездеу технологиясында процесс
жылдамдыѓын кµтеру ‰шін єрт‰рлі
єдістерді ќолданады: процестердіњ
ќозѓаушы к‰шін (![]() ),
реакция жылдамдылыќ константасын,
гереогенді процестердіњ фазалар беткі
ќабат жанасуын кµбейтеді.
),
реакция жылдамдылыќ константасын,
гереогенді процестердіњ фазалар беткі
ќабат жанасуын кµбейтеді.
Органикалыќ синтездеу процестерін ќарќындандыру ‰здіксіз ж±мыс істейтін аппараттарды ќолдануѓа тєуелді. Кµп мµлшерде ќолданылатын ‰здіксіз ж±мыс істейтін аппараттар: коррозияѓа берікті жєне ќызуѓа тµзімді материалдардан дайындалѓан баѓана (колонна) тєрізді реакторлар, ќ±быр тєрізді реакторлар жєне контакт аппараттары.
Органикалыќ синтездеу процестерін єр т‰рлі кµрсеткішке байланыстыклассификациялауѓа болады, соныњ ішінде кµбінесе ќолданылатыны-шикізаттарѓа байланысты классификациялау.
8.2. Көміртек (ІІ) оксидіне негізделінген синтездер. Метил спиртін өњдеу. 1933 жылѓа дейін метил спирті аѓашты ќ±рѓаќ айдау єдісімен µндірілген (осы себептен метанол-аѓаш спирті деп аталынады). Єр бір кубометр аѓаштан 3-6 кг метанол µндірілген. Ќазіргі кезде метил спиртін синтез газдан µндіреді. Метил спиртін синтездеудіњ физика-химиялыќ негізі жєне технологиясы аммиакты синтездеу єдісіне ±ќсас. Синтез газ (СО+Н2) азот-сутек ќоспасы сияќты генератор газдарын немсе табиѓи газдарды конверсиялау єдістерімен µндіріледі. Метил спирті формальдегид, диметилсульфат, антидетонация ќоспаларын, ингибиторларды, антифриздарды, метиламинді, акрил ќышќылыныњ метил эфирін, лактарды, бояуларды жєне басќа кµптеген заттарды µндіруге шикізат ретінде ерекше мол мµлшерде ќолданылады. Метил спирті таза к‰йінде мотор отынына ќоспа ретінде жєне еріткіш ретінде де ќолданылады.
Метил спиртін синтездеу процесі жоѓары ќысымда жєне ‰лкен температурада катализатордыњ ќатысуымен ж‰реді. Метил спиртініњ шыѓымы аммиак шыѓымы сияќты аз болѓандыќтан технологиялыќ процесс ‰здіксіз т±йыќ схемамен ж‰реді, реагенттер толыќ аяѓына дейін єрекеттеспейді. Аммиак жєне метил спиртін синтездеу єдістерініњ технологиясы бірдей болѓандыќтан аппаратура ќ±рылысы жєне технологиясы метил спиртін синтездеуге саќталынѓан.
Метил
спиртін синтездеуге СО жєне Н2ќоспасын 1:2-ден 1:4 ќатынаста дайындайды.
Синтез процесін 375-4000С температурада
20-30 Мпа ќысымдамырыш-хром
(![]() )
ќоспасынан ќ±ралѓан катализатордыњ
ќатысуымен ж‰ргізеді.
)
ќоспасынан ќ±ралѓан катализатордыњ
ќатысуымен ж‰ргізеді.
Процестіњ
негізгі реакциясы:
![]()
Егер ќысым оњтайлы ќысымнан тµмен, температура оњтайлы температура-дан жоѓары болса, мынадай ќосымша реакциялардыњ ж‰руі ыќтимал:
![]() кДж
(1)
кДж
(1)
![]() кДж
(2)
кДж
(2)
![]() кДж
(3)
кДж
(3)
![]() (4)
(4)
![]() (5)
(5)
![]() (6)
(6)
![]() (7)
(7)
Кµрсетілген процестермен (1-7) салыстырѓанда, метил спиртін синтездеу процесі кµлем ењ кµп мµлшерде кішірейетін баѓытта ж‰ретін болѓандыќтан, Ле-Шателье принципі бойынша ќысым ‰лкейген сайын тепе-тењдік метил спирті т‰зілетін баѓытќа ыѓысуына сєйкес ‰лкен ќысым негізгі реакцияны жылдамдатып, ќосымша реакцияларды басады.
Синтез газ синтез колоннасынан бір рет µткенде алѓашќы ќоспаныњ соњѓы затќа (метил спиртіне) айналу дєрежесі 5%-ен 20% аралыѓында ѓана болады, осы себептен метил спирті бµлініп алынѓаннан кейін реакцияласпаѓан ќоспа ќалдыѓы жања ќоспамен араластырылып контакт аппаратына (синтез колоннасына) жіберіледі, яѓни процесс (т±йыќ) циклді т‰рде ж‰реді.
Метил спиртін синтездеу процесі ‰лкен кµлем жылдамдыѓында ж‰реді- 10 000-30 000 С.
Синтез схемасы суретте көрсетіледі.
Тазартылѓан бастапќы ќоспа компрессормен (1) 25,0 Мпа ќысымѓа ќысылып, араластырѓышта (2) ќайта айналып, келген газ ќоспасымен араласып, майдан тазартылуѓа с‰згіштен (3) µтеді. Жылу алмасу аппаратында (4) 2200С температураѓа дейін реакцияласќан газ ќызуымен ќызады. Ќызѓан газ ќоспасы синтез колоннасына (H=12-18 м, ішкі диаметрі –0,8-1,2 м жєне ќабырѓа ќалыњдыѓы-0,09-0,1м) жіберіледі. Ќажетті температурада реакция температура-сымен саќталынады. Егер температураны тµмендету ќажет болса, колоннаѓа тµменнен салќын газ ќоспсын енгізеді. Контакталынѓан газ колоннаныњ тµменгі жаѓынан шыѓып жылуын бастапќы жылу алмасудаѓы газ ќоспасына беріп су суытќыш-конденсатор (7) арќылы сеператорѓа (8) келіп реакцияласпаѓан газ ќоспасынан 96%-ды шикі спирт бµлініп алынады, реакцияласпаѓан газ ќоспасы компрессор (5) мен керекті ќысымѓа дейін ќысылып араластырѓышќа (2) жіберіледі, метил спирті шикі спирт жинаѓышќа (9) ќ±йылады.
Ќайта айналатын газ ќоспасыныњ ќ±рамында ќосымша процестердіњ µнімдері (метан, азот, кµміртек (IV) оксиді жєне т.б.) кµп мµлшерде жиналуына байланысты, оќтын-оќтын ќайта айналатын газдыњ бір сыпырасын µртеп, ќалѓанын жањартады. 1 т метил спиртін алуѓа шамамен 700 м3 СО жєне 1400-2000м3 Н2 ж±мсалынады.
Синтез кезінде кµміртек (II) оксиді колонна ќабырѓасымен єрекеттесіп темір пентакарбонилін Fe(CO)5т‰зеді, ол катализатор бетінде ыдырап дисперсияланѓан темір т‰зіліп, катализатордыњ бетін ќаптайды. Катализатордыњ темірмен ќапталуы метан т‰зілетін ќосымша процесті к‰шейтеді. Сондыќтан оралатын газды зиянды заттардан активті кµмір мен тазартады, колонна ќабырѓасын мыспен ќаптайды немесе сапалы легирленген болаттан дайындайды. ¤ндірілген шикі спиртті бірнеше рет ректификациялап, тазартып таза метил спиртіналады.
8.3. Олефиндерге негізделген синтездер. Синтетикалық этил спиртін өндіру. Этил спирті-C2H5OH, т‰ссіз с±йыќтыќ, tk=780С, ерігіш, жанѓыш. Ауамен араласќанда (30% C2H5OH бу к‰йінде) ќопарылѓыш ќоспаѓа айналады. Сумен азеотропты ќоспа т‰зеді (95,6% C2H5OH).
Этанол еріткіш ретінде – лак, бояѓыштар, дєрі, парфюмерия µндірісінде пайдаланады. Одан басќа синтетикалыќ каучук алуда да ‰лкен мањызы бар. Органикалыќ синтездеуде µте кµп мµлшерде жартылай шикізат ретінде: мысалы к‰рделі эфирлерді, хлорформды, хлоральді, ацетальдегидті, сірке ќышќылыын, бутадиенді жєне басќа µнімдерді µндіруге пайдаланылады. Этил сприті - ракетаныњ с±йыќ отыныныњ, антифриздерініњ жєне т.б. негізгі компоненттерініњ біреуі. Синтетикалыќ этил спиртініњ µндірілу кµлемі органикалыќ ќоспалардыњ ењ алдыњѓы ќатарында. Бастапќы кезде этил спиртін алу ‰шін ішінде крахмал бар, мысалы, астыќ даќылдарын: картоп т.б. таѓамдыќ азыќ-т‰лік ж±мсалынатын. Крахмалды ќантќа айналдырып, ашытып спиртке айналдыратын. Соњѓы кезде аѓаш с‰регініњ клетчаткасын ќантќа айналдырып, ол ќантты ашытып гидролиз спиртін µндіреді.
Ќазіргі уаќытта этил спиртін к‰кірт ќышќылыныњ ќатысуымен жєне тіке гидраттандыру єдістерімен µндіреді.
Күкірт
қышқылы әдісі бойынша этилен 1,5-2,5 Мпа
ќысыммен барботаж бейнелі абсорберге
(1) келіп, 97%-ды к‰кірт ќышќылымен шашырату
(себелеп жањбыр тєрізді) єдісімен
жанасады (сурет). Абсорбердегі (1)
температура 65-750С
аралыѓында. К‰кірт ќышќылы абсорбердегі
процесте катализатор жєне реагент
есебінде екі міндет атќарады. Этилен
жоѓарыда айтылѓан жаѓдайда к‰кірт
ќышќылымен єрекеттесіп, моноэтилсульфатын
![]() жєне диэтил-сульфатын (
жєне диэтил-сульфатын (![]() )2SO2
т‰зеді.
)2SO2
т‰зеді.
![]()
Абсорберде
(1) сіњірілмеген газдар, су (2) жєне сілті
(3) скрубберлеріне жіберіліп, су
скубберінде (2) сумен жуылып, сілті
скубберінде (3) 10%-ды
![]() ерітіндісімен жуылады, к‰кірт ќышќылынан
тазартылып отын ретінде пайдаланылады.
Этилсульфаттар жєне к‰кірт ќышќылы
абсорберден (1) гидролизерге (6) жіберіледі.
Гидролизердіњ (гидролиз ж‰ретін
аппараты) (6) жоѓары шетінен гидролиз
аппаратына су енгізіледі.
ерітіндісімен жуылады, к‰кірт ќышќылынан
тазартылып отын ретінде пайдаланылады.
Этилсульфаттар жєне к‰кірт ќышќылы
абсорберден (1) гидролизерге (6) жіберіледі.
Гидролизердіњ (гидролиз ж‰ретін
аппараты) (6) жоѓары шетінен гидролиз
аппаратына су енгізіледі.
1Мпа ќысымында 70-900 температурада гидролиз аппаратында (6) этилсульфаттары гидролизденіп этил спиртін т‰зеді.
![]()
Бу к‰йіндегі спирт сутоњазытќышында (4) конденсацияланып, конденсатор ректификациялау колоннасында (5) айдалып ќоспалардан тазартылады. С±йылѓан к‰кірт ќышќылы 50%-ды гидролизерден шыѓаралып концентрлеуге жіберіледі, концентрленген к‰кірт ќышќылы технологиялыќ процеске ќайтадан келіп абсорберді (1) шашырау єдісімен суѓарады.
Ректификатордан шыќќан этил спиртініњ концентрациясы 95-96% шамасында болады. К‰кірт ќышќыл єдісімен 1 т этиленнен 1,2 т этанол жєне 100 кг этил эфирі µндіріледі.
Этиленді
тікелей гидраттандыру єдісімен этанолды
синтездеу. Этиленді
тікелей гидраттандыру алюминий
силикатына, силикагельге сіњірілген
ортафосфор ќышќылыныњ (35-40%
![]() )
катализатор ретінде ќатысуымен бір
фазада ж‰реді.
)
катализатор ретінде ќатысуымен бір
фазада ж‰реді.
Этиленніњ гидратталуы ќайтымды жєне жылу бµлінетін процесс
![]() кДж
кДж
Этиленді
тікелей гидраттау технологиялыќ процесс
280-2900С
температу-рада 7-8 Мпа ќысымда ж‰реді.
Этанол шыѓымына
![]() моль ќатынаста-ры, жанасу уаќыты жєне
кµлем жылдамдыѓы єсер етеді. Оњтайлы
моль ќатынасы-
моль ќатынаста-ры, жанасу уаќыты жєне
кµлем жылдамдыѓы єсер етеді. Оњтайлы
моль ќатынасы-![]() ;
газ бу ќоспасыныњ кµлемдік жылдамдыѓы
1800-2500С-1.
;
газ бу ќоспасыныњ кµлемдік жылдамдыѓы
1800-2500С-1.
Бір циклдегі этиленніњ конверсиялану дєрежесі 4-5%-дан аспайды.
Сондыќтан процесті циркуляциялау айналмалы технологиялыќ схемамен ж‰ргізеді, реакцияласпаѓан этилен бірнеше рет гидраттауѓа ќайтадан жіберіледі.
Этиленді тікелей гидраттандыру процесініњ технологиялыќ схемасы суретте кµрсетіледі.
7-8
МПа ќысымдаѓы этилен жоѓары ќысымдаѓы
циркуляцияланѓан газ жєне бумен
араластырылып жылу алмастырѓышќа (1)
келіп, одан соњ ќ±бырлы пешінде 2800С-ѓа
дейін ќыздырылып, контакт аппаратына
(3) келеді. Контакт аппаратында
катализатордан с‰зіліп µтіп бу к‰йіндегі
этил спиртін т‰зеді. Контакт аппаратынан
(3) шыѓарылатын бу газ ќоспасы кµршіорналасќан жылуалмастырѓышќа (1)
келтіріліп (1) салќындайды. Конденсацияланѓан
су жєне спирт жинаѓышта (4) газдан бµлініп
шикі-спирт (15-16%![]() )
аталып тазартылауѓа жіберіледі.
Реакцияласпаѓан этилен сутоњазытќышынан
(5)µтіп этанолды этиленнен
толыќ бµліп алу ‰шін ќондырмалы
колоннада (6) сумен шашырату єдісімен
жуылады, жуынды су шикі-спритке ќосылып
тазартуѓа жіберіледі. Тазартылѓан
реакцияласпаѓаан этилен (циркуляцияланѓан)
этиленніњ жања мµлшерімен араласуѓа
технологиялыќ схемабасына келеді.
)
аталып тазартылауѓа жіберіледі.
Реакцияласпаѓан этилен сутоњазытќышынан
(5)µтіп этанолды этиленнен
толыќ бµліп алу ‰шін ќондырмалы
колоннада (6) сумен шашырату єдісімен
жуылады, жуынды су шикі-спритке ќосылып
тазартуѓа жіберіледі. Тазартылѓан
реакцияласпаѓаан этилен (циркуляцияланѓан)
этиленніњ жања мµлшерімен араласуѓа
технологиялыќ схемабасына келеді.
Этанолды этиленді тікелей гидраттандыру єдісімен синтездеу-шыѓыны жєне ж±мыс істеу жаѓдайыныњ к‰кірт ќышќыл єдісімен салыстырѓанда ±тымды екені тµменде келтірілген мєліметтерден кµрінеді.
|
Шыѓын,
т/т
|
К‰кірт ќышќыл єді-сімен гидраттандыру |
Тікелей гидраттан-дыру єдісімен |
|
Этилен (100% С2Н4) |
0,75 |
0,69 |
|
К‰кірт
ќышќылы (100%
|
1,15 |
- |
|
К‰йдіргіш
натр (42%
|
0,04 |
0,02 |
|
Ортофосфор ќышќылы |
- |
0,006 |
Этиленнен синтетикалыќ этанол алу астыќ даќылдарын пайдалануды ќысќартады. Мысалы, этанолды синтездеуде 1 т этилен 4 т бидай дєнін ‰немдейді.
8.4. Ацетиленге негізделген синтездер.Ацетиленді өндіру жєне өњдеу. Ацетиленді µнеркєсіптерінде кальций карбидінен жєне метаннан µндіреді. Кальций карбиді электртермиялыќ µндірісініњ µнімі ол 18000С-20000С темпера-турада электрпешінде сµндірілмеген єктіњ кокспен єрекеттесуінен т‰зіледі:
![]()
1) Кальций карбиді сумен жанасќанда химиялыќ процесіс ж‰ріп ацетилен жєне кальций гидроксиді бµлінеді:
![]()
Карбидті ыдырату ацетилен генераторларына екі єдіспен орындалады: "Карбидті суѓа" жєне "Суды карбидке", соњѓы єдіс ‰немді. "Суды карбидке" єдісі бойынша кальций карбиді генератордыњ ‰стіњгі сµресінде орналасады да, ("ВТЗ" пеші тєрізді) жоѓарыдан шашыраѓан сумен мол мµлшерде суландырылып, суландырылѓан карбид тырманыњ кµмегімен жоѓарыдан тµмен ќарай жылжиды. Карбид тµмендеген сайын оныњ ыдырау дєрежесі артады, соњѓы тµменгі сµреде ыдырау толыќ аяќталады.
Ацетилен
ќ±рамындаѓы
![]() ,
,
![]() жєне
жєне
![]() ќоспалардан тотыќтырѓыш ертінділерімен
(олар натрий гипохлориті, хлор суы, хром
ќышќылы) жуып тазартады.
ќоспалардан тотыќтырѓыш ертінділерімен
(олар натрий гипохлориті, хлор суы, хром
ќышќылы) жуып тазартады.
Ацетиленді карбид єдісімен µндіргенде электрэнергиясы тым кµп ж±мса-лынады: 1кг ацетилен µндіруге ќажет кальций карбидін µндіруге 10-12 квт электр энергиясы ж±мсалынады.
2) ‡лкен температурада парафин кµмірсутектерін ыдырату єдісімен ацетиленді µндіру.
Ацетилен µндіретін µндірістерде шикізат ретінде кµбінесе метан жєне оныњ гомологтарын ќолданады.
Ацетилен µндіру процесініњ химиялыќ реакциясы мынадай т‰рде жазылады:
![]()
Б±л єдіс метан жєне кµмірсутектермен салыстырѓанда ацетиленніњ ‰лкен температурада термодинамикалыќ т±раќтылыѓыныњ жоѓарылыѓына негізделген. Метан ыдыраѓанда бос радикалдар т‰зіледі, олар бір-бірімен ќосылып, єр т‰рлі заттар (этан, этилен, ацетилен) т‰зеді.
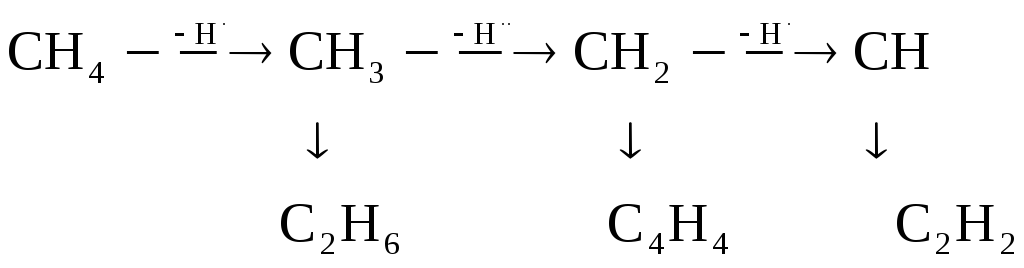
Метан ыдыраѓанда кµптеген жанама реакциялар ж‰реді, олардыњ ішінде ењ ќажетсізі – кµмірсутектердіњ кµміртекке (к‰йе) жєне сутекке ыдырауы.
![]()
Ацетилен
µнімдерін жоѓарылату ќажетті жєне
жанама процестерді басудыњ оњтайлы
жаѓдайы: ![]() болса, тµменгі ќысым жєне ‰лкен кµлемдік
жылдамдыќ болады. Реакция зонасында
кµмірсутектердіњ болу уаќыты
0,01-0,001сек. Ацетилен ыдырамау ‰шін µнімді
тез суыту ("шыныќтыру") керек.
болса, тµменгі ќысым жєне ‰лкен кµлемдік
жылдамдыќ болады. Реакция зонасында
кµмірсутектердіњ болу уаќыты
0,01-0,001сек. Ацетилен ыдырамау ‰шін µнімді
тез суыту ("шыныќтыру") керек.
Термототыќтандыру крекингі - экзотермиялыќ процесс, оттектіњ ќатысуы-мен ж‰реді, реакция температурасы крекинг процесініњ оњтайлы температура-сын ±стауѓа пайдаланады:
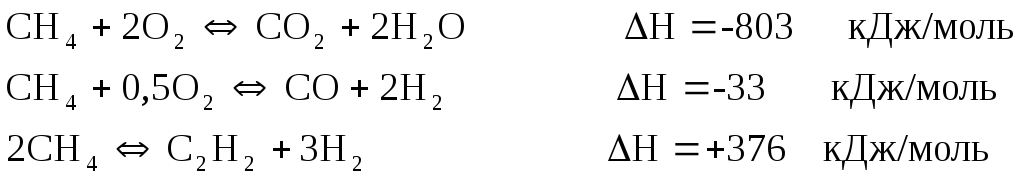
Крекинг процесін термототыќтырѓыш крекинг пешінде ж‰ргізеді. Метан жєне оттек жеке-жеке 400-6000С температурада ќыздырылып, камерада 2,0:1,6 ќатынаста орналастырылып температурасы 1400-15000С аралыѓында 2-ші камераѓа ‰лкен жылдамдыќпен µткізеді, камерада реагенттердіњ болу уаќыты 0,001 секунд шамасында. Крекинг µнімдерініњ ќ±рамында ацетиленнен басќа сутек, к‰йе, кµміртек оксиді болады. 1т ацетилен µндірілгенде бµлініп шыѓатын сутектен 3-4 тонна аммиак синтездеуге болады. 1т ацетиленді электркрекинг єдісімен µндіргенде 50-100 кг к‰йе алынады. Ќосылу жєне конденсациялау реакцияларында ацетиленді химиялыќ єдіспен µњдеу ацетиленніњ активтілігіне тєуелді, ацетилен ќ±рамындаѓы сутек µте ќозѓалмалы.
Ацетиленге негізделген синтездерде ерекше орын алатындар: сірке альдегидін жєне сірке ќышќылын ацетиденді гидратациялау єдісімен µндіреді.
Ацетальдегидті өндіру. Ацетиленді М.Г.Кучеров реакциясымен гидратациялау. Гидратациялау процесі сынап сульфатыныњ (катализатор) ќатысуымен орындалады, бірінші сатыда т±раќсыз винил спирті т‰зіліп, ол тез мезгілде сірке альдегидіне изомерленеді:
![]()
Суретте
ацетальдегидті өндірудің технологиялық
схемасы беріледі. Гидраторѓа (1) ‰здіксіз
ќысылѓан, тазартылѓан ацетилен
циркулияциялан-ѓан ацетиленмен араласќан
к‰йінде келіп т‰седі. Газ ќоспалары
контакт с±йыѓы (1л контакт с±йыѓыныњ
ќ±рамында 200 г
![]() ,
0,4г
,
0,4г![]() жєне
40г темір (III) оксидтері болады) арќылы
барботирленіп, 80-1000
температурада гидратация-лау процесіне
ќатысады. Реакциядан ќоспа бір рет
µткенде ацетиленніњ ацетальдегидке
айналуы 50-60% шамасында болады. Бу-газ
ќоспасы (ацетальдегид, ацетилен жєне
су буы) тоњазытќышќа келіп конденсацияланып,
конденсацияланѓан су гидраторѓа ќайта
оралып, ацетальдегидтіњ судаѓы ертіндісі
басќа тоњазытќыштан µтіп, жинаѓышќа
жіберіледі. Конденсациялан-баѓан газдар
тарелка тєрізді абсорберге келіп сумен
(шайылады) суѓарылады-суда ацетальдегид
еріп, ерітінді жинаѓышќа келіп ќосылады,
ацетилен µндіріс басына ќайта оралады.
Ацетальдегидті алдымен дистилляциялап,
сонан соњ ректификациялап тазартып
алады.
жєне
40г темір (III) оксидтері болады) арќылы
барботирленіп, 80-1000
температурада гидратация-лау процесіне
ќатысады. Реакциядан ќоспа бір рет
µткенде ацетиленніњ ацетальдегидке
айналуы 50-60% шамасында болады. Бу-газ
ќоспасы (ацетальдегид, ацетилен жєне
су буы) тоњазытќышќа келіп конденсацияланып,
конденсацияланѓан су гидраторѓа ќайта
оралып, ацетальдегидтіњ судаѓы ертіндісі
басќа тоњазытќыштан µтіп, жинаѓышќа
жіберіледі. Конденсациялан-баѓан газдар
тарелка тєрізді абсорберге келіп сумен
(шайылады) суѓарылады-суда ацетальдегид
еріп, ерітінді жинаѓышќа келіп ќосылады,
ацетилен µндіріс басына ќайта оралады.
Ацетальдегидті алдымен дистилляциялап,
сонан соњ ректификациялап тазартып
алады.
Гидратордан шыѓатын контакт с±йыѓын регенерациялап процеске ќайтадан ќайтарады.
М.Г. Кучеров реакциясымен гидратациялау єдісініњ ќауіптілік кемшілігі бар, ол сынаптыњ уыттылыѓы жєне тым кµп ж±мсалынады: 1т ацетальдегид µндіргенде 1,0 кг сынап шыѓын болады. Осы себептен сынапсыз єдістерді ќолдануѓа ерекше кµњіл бµлінгені орынды. Мысалы, ацетиленді ќатты катализаторда (металл оксидтері, фосфор ќышќылыныњ т±здары) гидрациялау, этиленді тотыќтыру.
Сірке
альдегидінен сірке ќышќылын өндіру.
С±йыќ фазада 60-700С
температурада марганец ацетаты
![]() катализаторыныњ ќатысуымен ацетальдегид
ауа ќ±рамындаѓы оттекпен тотыѓып сірке
ќышќылына айналады. Тотыѓу процесінде
т±раќсыз аралыќ жењіл ыдырайтын асќын
тотыќты сірке ќышќылы т‰зеді.
катализаторыныњ ќатысуымен ацетальдегид
ауа ќ±рамындаѓы оттекпен тотыѓып сірке
ќышќылына айналады. Тотыѓу процесінде
т±раќсыз аралыќ жењіл ыдырайтын асќын
тотыќты сірке ќышќылы т‰зеді.
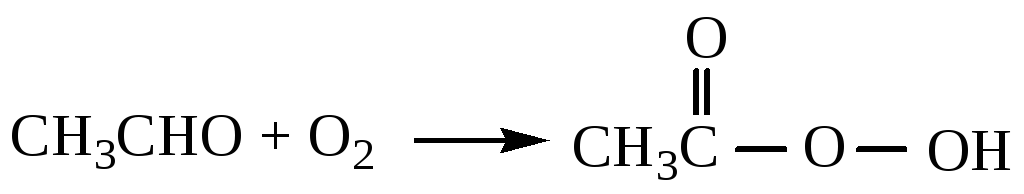
Асќын тотыќты сірке ќышќылы, ацетальдегидтіњ екінші молекуласымен єрекеттесіп, асќын тотыќ ќосындысын т‰зеді, ол сірке ќышќылыныњ екі молекуласына ыдырайды.
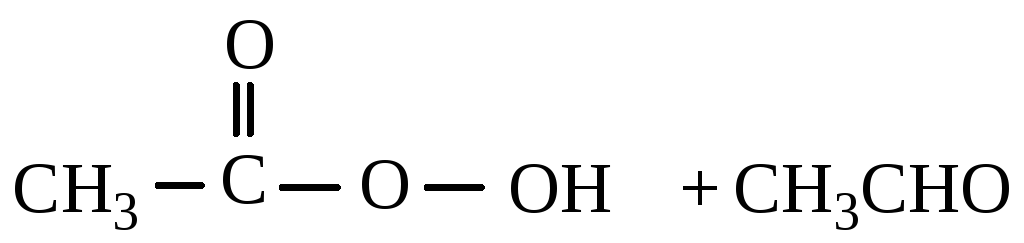
![]()