
Репарація днк
Загальні положення
Репарація вирізанням у E. coli
Репарація при реплікації
Відновлення пошкоджень
1. Загальні положення
ДНК є єдиною молекулою, яка при пошкодженні переважно репарується, а не деградує. Репарація дуже ефективна – краще ніж одна на 1000 випадкових пошкоджень ДНК. Решта коригується іншими процесами. Швидкість мутування виявляли двома незалежними підходами: за частотою появи мутантів у популяціях (на прикладі популяцій плодової мушки), або за частотою появи специфічних білків (в клітинах культури тканин). Було виявлено, що за одне покоління мутує одна пара основ на 109 пар. На основі цього розрахували, що для середнього білка, який кодується 1000 парами основ, мутація має відбутись один раз на 106 генерацій клітини. Статеві клітини захищаються від мутацій для збереження виду, а соматичні, щоб уникнути хвороб та неконтрольованого росту.
Виявлено два типи репарацій: перший, але дуже мало поширений – пряме обернене пошкодження; другий – широко поширений механізм – заміщення пошкодженої ділянки ДНК. Останній залежить від наявності двох комплементарних ланцюгів ДНК. Він забезпечує постреплікаційну репарацію рідких зшивок та постреплікаційну SOS-репарацію. При такій репарації корекція відбувається з використанням непошкодженої нитки ДНК як матриці. Ферменти, які беруть участь у репарації ДНК, беруть також участь і в рекомбінації і, частково, в транскрипції. Метаболізм ДНК інтегрує важливі процеси, які координуються через використання одних і тих самих молекулярних інструментів для вирішення різних завдань.
2. Репарація вирізанням у E. coli
Цей механізм, забезпечує репарацію специфічних пошкоджень ДНК, універсальний і виявлений в усіх досліджених організмах. Він характеризується чотирма послідовними етапами: надрізання, вирізання, ресинтезу і з’єднання. Надрізання – етап розпізнавання і є індивідуалізованим для специфічного пошкодження. Цей момент контролює швидкість усього процесу репарації. В результаті вирізання на молекулі ДНК утворюється вільний проміжок. Проміжок заповнюється ДНК-полімеразою I. Фосфоефірний зв’язок після синтезу коректної ділянки замикає ДНК-лігаза.
Репарація вирізанням основи
Дезаміновані, метильовані чи модифіковані іншим шляхом азотисті основи гідролітично видаляються ДНК-глікозилазами з утворенням апуринової чи апіримідинової ділянки (АР) ДНК. Аналогічний гідроліз може відбуватись і спонтанно. Далі специфічна до АР-ділянок ендонуклеаза вирізає залишок пошкодженого нуклеотиду.


АР-ендонуклеаза

Рис. 4.1. Репарація вирізанням основи у E. сoli.
Репарація вирізанням нуклеотиду
Цей тип репарації функціонує, коли утворюються „об’ємні” адукти. Наприклад, в результаті взаємодії поліциклічних ароматичних вуглеводів, таких як бензо[а]пірени і диамінбензантрацени, генеровані курінням, тимінпсораленові адукти і гуанінцисплатинові адукти, утворені хеміотерапевтичними засобами.
Ультрафіолетове світло також каталізує утворення об’ємних адуктів в результаті димеризації піримідинів. При утворенні зшивки ендонуклеаза розрізає модифікований ланцюг з обох сторін і вирізає їх. UvrА – розпізнає і „мітить” пошкоджену ділянку. Дана нуклеаза розпізнає спіраль і зв’язує UvrB, викликаючи перед цим конформаційні зміни UvrB. Далі UvrА дисоціює від комплексу ДНК-UvrB, що робить можливим з’єднання з ним UvrС. UvrB розрізає пошкоджений ланцюг з 3´-кінця, а UvrС розпізнає його з 5´-кінця. Геліказа II (UvrD) звільнює вирізаний олігонуклеотид, а ДНК-полімераза заміщує UvrВ і заповнює звільнений проміжок. Останні кроки в цього типу репарації полягають в з’єднанні синтезованої ділянки з рештою ланцюга ДНК-лігазою.
зшивка![]() ка
ка
UvrА
Рис. 4.2. Репарація вирізанням нуклеотиду
у E.
сoli.
ДНК-полімераза


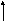





















UvrА UvrB




UvrВ UvrС


UvrD
фрагмент ДНК
3. Репарація вирізанням у еукаріотів
Цей тип репарації дуже подібний у про- і еукаріотів. Проте в останніх в цьому бере участь значно більша кількість білків~16-17. У E. coli їх небагато – всього чотири: UvrA, B, C і D. Так білки XPA, В, XPG ідентифіковані як 7 генетичних елементів групи (A-G) у пацієнтів з інтенсивною пігментацією шкіри (серодерми (Хeroderma Рigmentifolium – XP). Характеризуються підвищеною чутливістю до УФ-опромінення з відповідною недостатністю в репарації ДНК. Гени репарації нуклеотидів людей тому називають ХР, або ERC (Excision Repair Component).
Через репарацію вирізанням вирізаються зшивки між комплементарними нитками ДНК, викликаними гірчицею і лікарствами, що використовуються в терапії ракових захворювань (такими як мітоцин D і платинові комплекси).
Даний тип репарації функціонує практично без помилок, бо в якості матриці для репарації пошкодженого ланцюга ДНК використовується другий непошкоджений ланцюг. Проте такого роду репарація неможлива, коли утворюються поперечні зшивки між основами з двох різних ланцюгів ДНК.
4. Репарація при реплікації
Цей механізм функціонує для корекції помилок, які виникають в ході реплікації – як у про- так і в еукаріотів. Суть його полягає в ідентифікації нуклеотиду, помилково приєднаного до ланцюга, його вирізанні та в з’єднанні коректно синтезованого олігонуклеотиду з рештою молекули ДНК. Даний механізм дуже істотно зменшує кількість помилок синтезу ДНК – більш, як в 1000 разів. Особливість даного типу помилок полягає в тому, що хочаоснови й некоректні, але вони мають незмінну хімічну структуру, тому необхідно розрізняти старий і новий ланцюги ДНК. Сигналом для розпізнавання у E. coli є метилювання ДНК ферментом Dam-метилазою. В послідовності GATC він метилює аденін в положенніN-6. Зразу після реплікації новий ланцюг не метильований, а цей процес відбувається відносно повільно. Тому ферменти репарації по наявності метильованих груп у аденіні згаданої вище послідовності розпізнають лише материнську, а не дочірню молекулу ДНК.

Рисунок
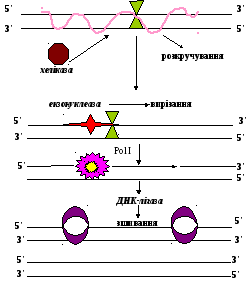
Рис. 4.2. Репарація при реплікації у E. сoli.
Ініціація починається зі зв’язування білка MutS до некоректного місця. До нього приєднується білок MutL. Комплекс MutS-MutL активує латентну GATC-ендонуклеазну активність білка MutH. Саме він надрізає неметильований ланцюг ДНК (тобто – дочірній) біля ділянки GATC. В результаті вирізається ділянка в кількасот нуклеотидів від 3´-кінця некоректного ланцюга. Синтез потребує участі ДНК-гелікази II (деколи її називають MutU), 3´à5´-екзонуклеази, ДНК-полімерази III і, накінець, ДНК-лігази – для з’єднання репарованої нитки з рештою молекули ДНК. Дуже подібний механізм корекції помилок, що виникають при реплікації, існує і в еукаріотів.
5.Відновлення пошкоджень
Утворення димерів може бути спричинене дією світла. Фотовідновлення каталізується фотоліазою дезоксирибопіримідинів. Вони розривають ковалентні зв’язки, які утримують разом молекули пиримідинів у димері. Фотоліази активуються світлом в області 300-600 нм. Ці ферменти виявлені у бактерій і не є абсолютно необхідними для них. В людини ферментів цього типу не виявили.
Видалення метильних чи етильних груп з 6-го положення фенольної форми гуанідину відновлює його нормальну структуру. Спеціальний білок „забирає” відповідну групу і, таким чином, сам стає алкільованим. Надалі від деградує.
Лекція 5
