
- •Строение белка. Уровни структурной организации молекулы белка.
- •Строение, размер и форма белковой молекулы, функции белков.
- •Денатурация, причины и признаки, использование в медицине.
- •1. Энергетическая функция.
- •2. Пластическая функция.
- •3. Регуляторная.
- •1. Сходства: а) они имеют одинаковые начало и конец и одинаковую суммарную разность потенциалов (а значит одинаковый градиент энергии в начале и конце);
- •2. Различия: а) по локализации;
1. Энергетическая функция.
ЦТК - конечный этап БО, в котором окисляются унифицированные соединения различного происхождения.
2. Пластическая функция.
Поскольку ЦТК «питается» субстратами различного происхождения, то он может быть источником углеродных скелетов для различных веществ.
ЩУК Цитратсинтез ЖК, т. е. избыток углеводов депонируется в виде нейтрального жира.
Сукцинил КоА синтез ГЛУ, АРГ, ПРО, ГИС.
-кетоглутарат синтез гема (Hb, цитохромы, каталаза, пероксидаза).
ГНГ (образование Гл из неуглеводных компонентов).
3. Регуляторная.
Перекачка субстратов из одного в другой.
Регуляция ЦТК.
ЦТК связан с предшествующими стадиями энергетического обмена (гликолиз, окисление ЖК и АК), поэтому механизмы регуляции этих процессов будут справедливы и для ЦТК:
1) ретроингибирование; 2) путем изменения концентрации субстрата на входе ЦТК; 3) аллостерическаярегуляция (с помощью НАД, НАДН2, АТФ); 4) ионная (pH, [Ca++]).
Так как цикл Кребса начинается со стадии ЩУК + ацетил КоА, то эти метаболиты и управляют интенсивностью ЦТК. Первым регуляторным фактором является концентрация ЩУК, которая в основном образуется из ПВК, ацетил КоА в принципе тоже:
+CO2 -CO2
ЩУК <----- ПВК ------> ацетил КоА
+ГТФ
ПВК же образуется из углеводов (Гл), поэтому при диабете или углеводном голодании наблюдается недостаток ПВК, а значит и ЩУК и ЦТК блокируются. Ацетил-КоА не является лимитирующим субстратом, т. к. в основном образуется при окислении ЖК.
Но в то же время ЩУК - конкурентный ингибитор сукцинатдегидрогеназы, поэтому при избытке ЩУК, ЦТК блокируется на 6 стадии (так называемое «щуковое торможение»). Это торможение можно убрать ГЛУ, который переаминирует ЩУК в АСП.
Второй регуляторный фактор - концентрация НАД и НАДН2. В живых системах концентрация НАД + НАДН2 = const. Любые факторы, ведущие к увеличению НАД.Н2 (гипоксия, алкогольная интоксик5ация) и дефициту НАД+ блокирует ЦТК. Следовательно увеличение концентрации НАД+ при активной работе ДЦ стимулирует ЦТК.
Так как АТФ является косвенно конечным продуктом ЦТК, то ее избыток блокирует ЦТК, а значит АДФ стимулирует ЦТК. (АДФ рассматривается как аллостерический активатор изоцитратдегидрогеназы).
Стимулятором ЦТК является также кислород, потому что он стимулирует распад АТФ.
Нормальная концентрация Ca2+в клетке 10-7моль. При увеличении концентрации кальция до 10-6 моль активируются дегидрогеназные реакции: пируватДГ, изоцитратДГ, альфа-КГДГ, а значит и ЦТК.
Цикл Кребса активируется при сердечной недостаточности. Это объясняется тем, что миокард не может самостоятельно убрать избыток Ca2+и эту роль берут на себя митохондрии, возрастает потребность в кислороде.
|
Заведующий кафедрой биологической химии, д.м.н., проф. |
Грицук А. И. |
___________ |
21.10.2006
Министерство здравоохранения Республики Беларусь
УО «Гомельский государственный медицинский университет»
Кафедра биологической химии
Обсуждено на заседании кафедры (МК или ЦУНМС)
Протокол № _________________200__года
ЛЕКЦИЯ по биологической химии
наименование дисциплины
для студентов _2__ курсалечебногофакультета
Тема Биологическое окисление 2. Тканевое дыхание. Окислительное фосфорилирование.
Время 90 мин.
Учебные и воспитательные цели:
Дать представление:
О строении дыхательной цепи (ДЦ), ингибиторах; механизмах работы ДЦ; пунктах сопряжения, величинах ОВП компонентов ДЦ. О коэффициенте Р/О, его значении.
О свободном и разобщенном дыхании. О теориях сопряжения ОФ.
О механизме генерации Н+.
О структуре и функциях протонной АТФ-азы; о механизме разобщения.
Об окислительдном фосфорилировании (pH и); о механизмах термогенеза, роли бурой жировой ткани.
О роли энергетического обмена; Путях утилизации Н+и АТФ. О прикладных аспектах биоэнергетики.
О путях потребления O2в организме (митохондриальный, микросомальный, перекисный). О характеристике микросомальной ДЦ, в сравнении с митохондриальной. О характеристике цитохромаP450, функции.
О перекисном окисление. О механизме образования активных форм кислорода O2-, O2, O2. О роли перекисных процессов в норме и при патологии. О перекисном окислении липидов (ПОЛ): (НЭЖК → R→ диеновые коньюгаты → гидроперекиси → МДА). О способах оценки активности ПОЛ.
Об антиоксидантной защите: ферментной и неферментной. О характеристиках СОД, каталазы, глютатионпероксидазы, GSH-редуктазы,NADPH-воспроизводящих систем. О неферментных АОС:витаминах Е, А, С, каротиноидах, гистидине, кортикостероидах,билирубине, мочевине и др.
ЛИТЕРАТУРА
Березов Т. Т., Коровкин Б. Ф.Биологическая химия. М.: Медицина, 1990. С. 213–220; 1998. С. 305–317.
Николаев А. Я.Биологическая химия. М.: Высшая школа, 1989. С. 199–221.
Дополнительная
Филиппович Ю. Б. Основы биохимии. М.: Высшая школа, 1993. С. 403–438.
Марри Р. и др. Биохимия человека. М.: Мир, 1993. Т. 1. С. 111–139.
Ленинджер А.Основы биохимии. М.: Мир, 1985. Т. 2. С. 403–438, 508–550.
Албертс Б. и др., Молекулярная биология клетки. М.: Мир, 1994. Т. 1. С. 430–459.
Скулачев В.П. Энергетика биологических мембран. М.: Наука. 1989.
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ
1. Мультимедийная презентация.
РАСЧЕТ УЧЕБНОГО ВРЕМЕНИ
|
№ п/п |
Перечень учебных вопросов |
Количество выделяемого времени в минутах |
|
|
Строение дыхательной цепи (ДЦ), ее комплексы, ингибиторы. Механизм работы ДЦ. Пункты сопряжения, величина ОВП компонентов ДЦ. Коэффициент Р/О, его значение. |
10 |
|
|
Свободное и разобщенное дыхание. Теории сопряжения ОФ (химическая, конформационная, хемиосмотическая – П. Митчелла). |
10 |
|
|
Механизм генерации Н+, его компоненты, стехиометрия Н+/е. |
10 |
|
|
Структура и функция протонной АТФ-азы. Механизм разобщения. |
10 |
|
|
ОФ (снятие pH и). Механизмы термогенеза. Роль бурой жировой ткани. |
10 |
|
|
Основополагающая роль энергетического обмена. Пути утилизации Н+и АТФ. Прикладные аспекты биоэнергетики. |
10 |
|
|
Пути потребления O2в организме (митохондриальный, микросомальный, перекисный). Характеристика микросомальной ДЦ, ее сравнение с митохондриальной. Характеристика цитохромов P450, их функция. |
10 |
|
|
Перекисное окисление. Механизм образования активных форм кислорода O2-, O2, O2. Роль перекисных процессов в норме и при патологии. Общее представление о ПОЛ (НЭЖК → R→ диеновые коньюгаты → гидроперекиси → МДА). Способы оценки активности ПОЛ. |
10 |
|
|
Антиоксидантная защита: ферментная и неферментная. Характеристика СОД, каталазы, глютатионпероксидазы, GSH-редуктазы,NADPH-воспроизводящих систем. Неферментные АОС:витамины Е, А, С, каротиноиды, гистидин, кортикостероиды,билирубин, мочевина и др. |
10 |
Всего 90 мин
Строение дыхательной цепи (ДЦ), комплексы, ингибиторы. Механизм работы. Пункты сопряжения, величина ОВП компонентов ДЦ. Коэффициент Р/О, его значение.
Дыхательная цепь.
Поэтапное «контролируемое сгорание» достигается путём промежуточного включения дыхательных ферментов, обладающих различным редокс-потенциалом. Редокс-потенциал(окислительно-восстановительный потенциал)определяет направление переноса протонов и электронов ферментами дыхательной цепи (рис.1).
Редокс-потенциал выражаетсязначением электродвижущей силы (в вольтах), которая возникает в растворе между окислителем и восстановителем, присутствующих в концентрации 1,0 моль/л при 25˚ С (при рН=7,0 оба находятся в равновесии с электродом, который может обратимо принимать электроны от восстановителя). При рН=7,0 редокс-потенциал системы Н2 /2Н++2ē равен–0,42v. Знак–означает, что данная редокс-пара легко отдаёт электроны, т.е. играет роль восстановителя, знак+указывает на способность редокс-пары принимать электроны, т.е. играть роль окислителя. Например, редокс-потенциал пары НАДН∙Н+/ НАД+ равен – 0,32v, что говорит о высокой её способности отдавать электроны, а окислительно-восстановительная пара ½О2/Н2О имеет наибольшую положительную величину +0,81v, т.е. кислород обладает наивысшей способностью принимать электроны.
В процессе окисления АцКоА в ЦТК, восстановленные формы НАДН2 и ФАДН2 поступают в ДЦ, где энергия электронов и протонов трансформируется в энергию макроэргических связей АТФ.
ДЦ - совокупность дегидрогеназ, которые транспортируют электороны и протоны с субстрата на кислород.
Принципы функционирования ДЦ основаны на 1-ом и 2-ом законах термодинамики.
Движущей силой ДЦ является разность ОВП. Суммарная разность всей ДЦ составляет 1,1 В. Пункты фосфорилирования должны иметь перепад ОВП = 0,25 - 0,3 В.
1. Пара НАД-Н имеет ОВП = 0,32 В.
2. Пара Q-b - / - /- - 0 В.
3. O2 - имеет +0,82 В.
ДЦ локализуется во внутренней мембране митохондрий и имеет 2 пути введения электронов и протонов или 2 входа; ДЦ образует 4 комплекса.
1 вход: НАД-зависимый (поступают электроны и протоны со всех НАД-зависимых реакций).
2 вход: ФАД-зависимый
НАД ---->ФП
Q --->b--->c1--->c--->aa3---->1/2O2
Янтарная кислота ---->ФП
Дыхательная цепь – форма реализации биологического окисления.
Тканевое дыхание – это последовательность окислительно-восстанови-тельных реакций, протекающих во внутренней митохондриальной мембране с участием ферментов дыхательной цепи.Дыхательная цепь имеет чёткую структурную организацию, её компоненты формируютдыхательные комплексы, порядок расположения которых зависит от величины их редокс-потенциала (рис.5.1). Количество дыхательных цепей в отдельно взятой митохондрии из клеток разных тканей неодинаково: в печени – 5000, в сердце – около 20 000, следовательно, миокардиоциты отличаются более интенсивным дыханием, чем гепатоциты.
Рис. 5.1 Порядок
расположения комплексов дыхательной
цепи во внутренней мембране митохондрий
Прежде чем остановиться на характеристике каждого из компонентов дыхательной цепи, познакомимся с субстратами тканевого дыхания.
Субстраты тканевого дыханияподразделяются на 2 группы:
НАД-зависимые– субстраты цикла Кребса изоцитрат, α-кетоглутарат и малат. Это также пируват, гидроксибутират и β–гидрокси-ацил~КоА, глутамат и некоторые другие аминокислоты. Водород от НАД-зависимых субстратовcпомощьюНАД-зависимых дегидрогеназпередаётся наI-й комплекс дыхательной цепи.
ФАД-зависимые –сукцинат, глицерол-3-фосфат, ацил~КоА и некоторые другие. Водород от ФАД-зависимых субстратов передаётся наII-й комплекс дыхательной цепи.
При дегидрировании субстратов НАД-зависимыми дегидрогеназамиобразуется восстановленная форма НАД (НАДH∙H+).

Указана окисленная форма кофермента НАД+. Этот кофермент является динуклеотидом (никотинамид-аденин-динуклеотид): в состав одного нуклеотида входит витамин РР (никотинамид), другой представляет собой АМФ. Способность кофермента играть роль промежуточного переносчика водородов связана с наличием в его структуре витамина РР. В электронно-протонной форме процесс обратимого гидрирования-дегидрирования может быть представлен уравнением (R- остальная часть кофермента):
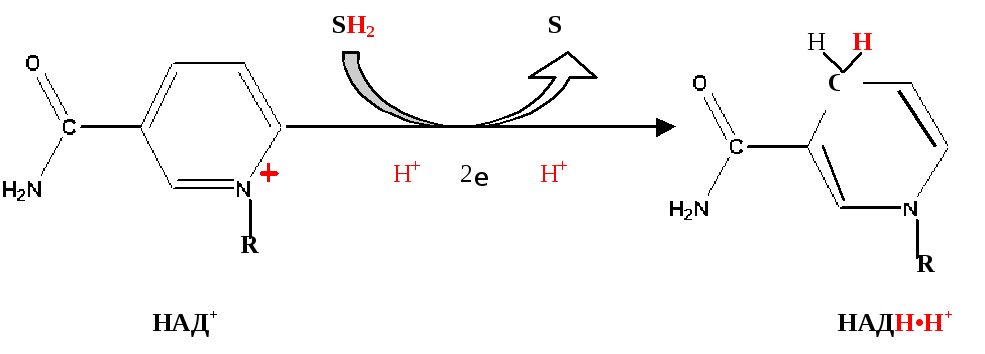
НАДH∙H+может образовываться не только в митохондриях, но и в цитозоле клетки при протекании определённых процессов метаболизма. Однако цитоплазматический кофермент не может проникать в митохондрии. Водород восстановленного кофермента должен быть сначала перенесен на субстраты, которыемогутпроникать в митохондрии. Такими «Н2-переносящими субстратами» являются:
Оксалацетат → малат
Ацетоацетат → β-гидроксибутират
Дигидроксиацетон фосфат → глицерол-3-фосфат
НАДH∙H+ затем окисляется 1-м комплексом дыхательной цепи. Рассмотрим работу этого комплекса.
I комплекс цепи тканевого дыхания– НАДH∙H+-убихинон-оксидодуктаза.
Первый комплекс является самым большим в дыхательной цепи (представлен 23-30 субъединицами). Он катализирует перенос водорода от НАДH∙H+ на убихинон (рис. 5.1 и рис. 5.3). В его состав входят кофермент ФМН (флавинмононуклеотид) и железосерные белки, содержащие негеминовое железо. Функция этих белков заключаетсяв разделении потока протонов и электронов: электроны переносятся от ФМН∙Н2к внутренней поверхности внутренней мембраны митохндрий (обращенной к матриксу), а протоны – к внешней поверхности внутренней мембраны и затем высвобождаются в митохондриальный метрикс.
При транспорте протонов и электронов редокс-потенциал первого комплекса снижается на 0,38 v, что вполне достаточно для синтеза АТФ. Однако в самом комплексе АТФ не образуется, а высвобождающаяся в результате работы комплекса энергия аккумулируется (см. ниже образование электро-химического потенциала) и частично рассеивается в виде тепла.
По своему строению ФМН – мононуклеотид, в котором азотистое основание представлено изоаллоксазиновым ядром рибофлавина, а пентозой является рибитол (иными словами, ФМН – это фосфорилированная форма витамина В2).
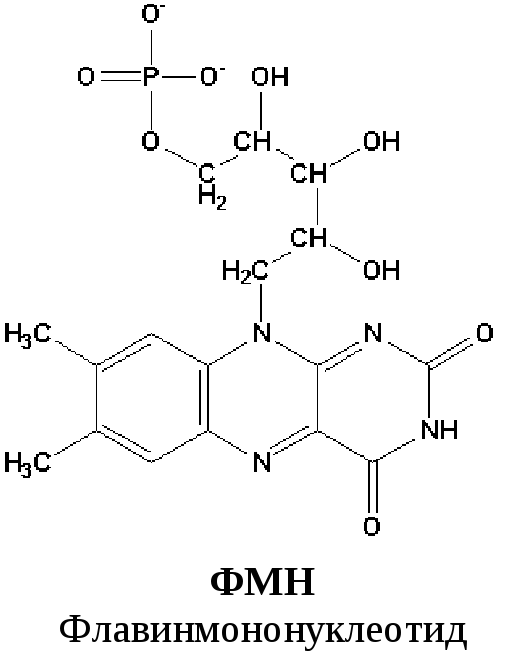
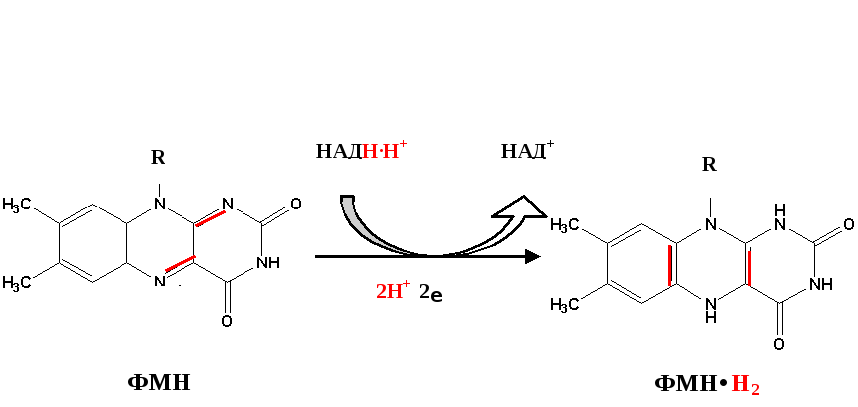
Функция ФМН заключается в акцепции 2 атомов водорода от НАДH∙H+ и передачи их железосерным белкам. Водород (2 электрона и 2 протона) присоединяется к атомам азота изоаллоксазинового кольца, при этом происходит внутримолекулярная перегруппировка двойных связей с образованием промежуточного семихинона – соединения свободнорадикальной природы (на схеме представленосуммарноеуравнение реакции, гдеR– остальная часть молекулы)
II комплекс цепи тканевого дыхания – сукцинат-убихинон-оксидоредуктаза.
Этот комплекс имеет меньшую молекулярную массу и также содержит железосерные белки. Сукцинат-убихинон-оксидоредуктаза катализирует перенос водорода от сукцинатана убихинон. В состав комплекса входит кофермент ФАД (флавин-аденин-динуклеотид) и фермент сукцинатдегидрогеназа, который является одновременно ферментом цикла Кребса.Ацил~SКоА, 3-фосфо-глицерат и диоксиацетон фосфат также являются ФАД-зависимыми субстратами тканевого дыхания и с помощью этого кофермента контактируют со вторым комплексом.
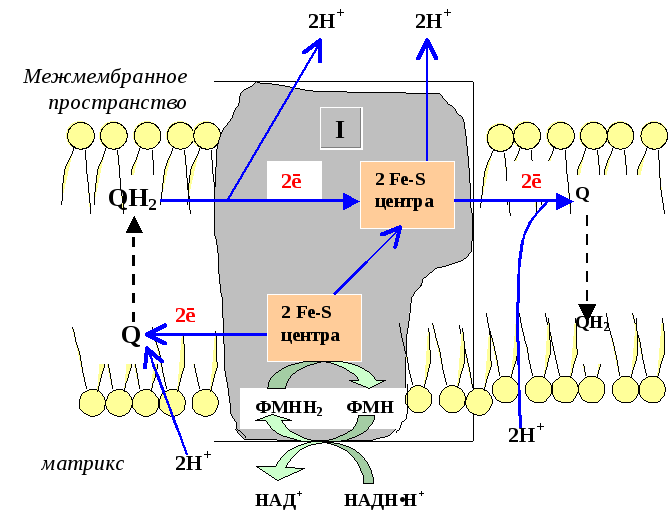
Рис. 5.3 Первый комплекс дыхательной цепи
Энергия включения водорода субстратов во IIкомплекс цепи тканевого дыхания рассеивается в основном в виде тепла, так как на этом участке цепи редокс-потенциал снижается незначительно и этой энергии для синтеза АТФ мало.

Процесс восстановления ФАД протекает аналогично таковому ФМН.
Кофермент Q или убихинон - гидрофобное соединение, является компонентом клеточных мембран, содержится в большой концентрации, относится к группе витаминов. относится к группе витаминов.
Убихинон (коэнзим Q). Убихинон – небольшая липофильная молекула, по химическому строению представляющая собой бензохинон с длинной боковой цепью (число изопреноидных единиц колеблется от 6 у бактерий до 10 у млекопитающих).
В дыхательной цепи коэнзим Q является своеобразным депо (пулом) водорода, который он получает от различных флавопротеинов. Липофильный характер молекулы убихинона обуславливает его способность свободно перемещаться в липидной фазе митохондриальной мембраны, перехватывая протоны и электроны не только от I и II комплексов дыхательной цепи, но и захватывая из митохондриального матрикса протоны. При этом убихинон восстанавливается с образованием промежуточного свободнорадикального продукта – семихинона .
Восстановленная форма убихинона – убихинол – передаёт протоны и электроны на III комплекс дыхательной цепи.

Цитохромоксидаза имеет высокую степень сродства к кислороду и может работать при его низких концентрациях.
аа3 - состоит из 6 субъединиц каждая из которых содержит гем и атом меди. 2 субъединицы составляют цитохром а, а остальные 4 относятся к цитохрому а3.
Между НАД и ФП, b-c, a-a3 имеет место max перепад ОВП. Эти пункты являются местом синтеза АТФ (местом фосфорилирования АДФ).
III комплекс цепи тканевого дыхания – убихинол-цитохром С-оксидоредуктаза.В составIIIкомплекса входятцитохромы bис1, относящиеся к группе сложных белковхромопротеинов. Простетическая группа этих белков окрашена (chroma– краска) и близка по химическому строению к гему гемоглобина. Однако в противоположность гемоглобину и оксигемоглобину, в которых железо должно быть только в 2-х валентной форме, железо в цитохромах при работе дыхательной цепи переходит от двух- к трёхвалентному состоянию (и обратно).
Как видно из названия, IIIкомплекс переносит электроны от убихинола на цитохром С. Вначале электроны поступают на окисленную форму цитохромаb(Fe3+), который при этом восстанавливается (Fe2+), затем восстановленный цитохромbпередаёт электроны окисленной форме цитохрома с, который также восстанавливается и, в свою очередь, передаёт электроны цитохрому С.
митохондриальной
мембраны от III
комплекса к IV
и обратно. При этом 1 молекула цитохрома
С, попеременно окисляясь и восстанавливаясь,
переносит 1 электрон.
IV комплекс дыхательной цепи–цитохром С-оксидаза. Комплекс названоксидазой из-за способности непосредственно взаимодействовать с кислородом. У млекопитающих этот крупный (~ 200kD) трансмембранный белок состоит из 6-13 субъединиц, из которых некоторые кодируются митохондриальной ДНК. В составIVкомплекса входят 2 хромопротена –цитохром аицитохром а3.В отличие от других цитохромов, цитохромыаиа3 каждый содержат не только атом железа, но и атом меди. Медь в составе этих цитохромов при транспорте электронов также попеременно переходит в окисленное (Cu2+) и восстановленное (Cu+) состояние.
Цитохром с-оксидаза катализирует одноэлектронное окисление 4-х восстановленных молекул цитохрома с и при этом одновременно осуществляет полное (4-х электронное) восстановление молекулы кислорода:
4 цитохромас (Fe2+)
+ 4H+ +O2
4 цитохромас (Fe3+)
+H2O
цитохромас (Fe2+)
+ 4H+ +O2
4 цитохромас (Fe3+)
+H2O
Протоны для образования молекул воды поступают из матрикса. Следует заметить, что эта реакция весьма сложна и протекает через промежуточные стадии образования свободных радикалов кислорода.
Окислительно-восстановительный потенциал IVкомплекса является самым большим (+0,57v), его энергии вполне достаточно для синтеза 3-х молекул АТФ, однако большая часть этой энергии используется на «перекачивание» протонов из матрикса митохондрий в межмембранное пространство. В связи с активным транспортом протонов цитохромс-оксидаза получила название«протонного насоса».
Таким образом, тканевое дыхание представляет собой процесс транспорта электронов и протонов от НАД- или ФАД-зависимых субстратов на кислород, а также протонов, поставляемых матриксом митохондрий. При транспорте падает редокс-потенциал, что сопровождается высвобождением заключённой в субстратах тканевого дыхания энергии. Полное восстановление молекулярного кислорода воздуха в дыхательной цепи сопровождается образованием воды.
Свободное и разобщенное дыхание. Теории сопряжения ОФ.
Окислительное фосфорилирование – один из механизмов образования АТФ
Транспорт электронов в дыхательной цепи сопряжён (связан) с образованием протонного градиента, необходимого для синтеза АТФ. Этот процесс называется окислительным фосфорилированием. Иными словами, окислительное фосфорилировние – это процесс, в котором энергия биологического окисления превращается в химическую энергию АТФ.
Образование протонного градиента(генерирование электро-хими-ческого потенциала). Хемиосмотическая теория Митчелла.
Ингибиторы цепи тканевого дыхания – это яды.
Ингибиторы дыхательной цепи являются ядами. Они в равной степени тормозят и дыхание, и фосфорилирование, соотношение Р/О при этом не изменяется. Наиболее популярными являются следующие ингибиторы: ротенон(растительный токсин, применяемый индейцами Амазонии при ловле рыбы, а также используемый в качестве инсектицида),амитал (аминобарбитал – производное барбитуровой кислоты),антимицин А(антибиотик) ицианиды.Ротенон и амиталтормозят перенос водорода от ФМН к убихинону;антимицин Атормозит транспорт электронов от цитохромаb к цитохромус1;CN-, CO, H2S– ингибиторы цитохромоксидазы (рис.5. 8):

НАДН∙Н+КоQ С О2
ротенон антимицин А СО, СN-
амитал H2S
Рис.5.8. Ингибиторы дыхательной цепи
Следует различать ингибиторыцепи тканевого дыхания иразобщители окислительного фосфорилирования.
Механизм генерации Н+, его компоненты, стехиометрия Н+/е.
Движение электронов через электронтраспортную систему дыхательных ферентов сопровождается одновременно «перекачиваем» протонов из матрикса в межмебранное пространство. Эта передислокация протонов осуществляется I,IIIиIVкомплексами дыхательной цепи. Английский биохимик Питер Митчелл предложил рассматривать внутреннюю мембрану митохондрий как конденсатор, который со стороны матрикса заряжается отрицательно (благодаря направленному току электронов), а со стороны межмембранного пространства – положительно. Следовательно, при тканевом дыхании совершается осмотическая работа по концентрации протонов в межмембранном пространстве и возникает разность электрических потенциалов, т.е. генерируется электро-химический (или протонный) потенциал:
Δ μН+ = Δ Ψ – (-)ΔрН+
Электрохимический Мембранный Градиент рН
градиент рН потенциал
Градиент ΔрН+ имеет отрицательное значение, поскольку измерение проводится от внутренней поверхности мембраны, имеющей более отрицательную величину, к наружной. В целомΔ μН+ имеет положительное значение, равное +0,224v.
Внутренняя мембрана не может заряжаться сколь угодно долго. Если продолжить аналогию с конденсатором, то перезарядка приводит к «пробою», т.е. разрядке. Роль разряжающего устройства выполняет АТФ-синтаза –Vкомплекс дыхательной цепи.
Каким же образом генерирование протонного потенциала связано (сопряжено) с образованием АТФ?
Структура и функция протонной АТФ-азы. Механизм разобщения.
Свободная энергия электрохимического протонного градиента митохондриальной мембраны используется для синтеза АТФ с помощью протон-переносящей АТФ-синтазы (она также называется протонным насосом, АТФ-азой, F1Fo-АТФ-азой,Vкомплексом дыхательной цепи).
АТФ-синтаза является самым крупным, по форме напоминающим гриб, структурным компонентом внутренней митохондриальной мембраны. АТФ-синтаза представлена 2 большими полиферметными белками -F1 (шляпка гриба) и Fo (ножка), каждый из которых, в свою очередь, состоит из нескольких неоднородных полипептидов.

Рис. 5.6 . Модель грибовидного комплекса АТФ-синтазы. Vкомплекс.
Fо– не растворимый в воде трансмембранный белок, главной частью которого является канал для транслокации протонов.Foозначает «факторО» (от словаолигомицин- антибиотик, продуцируемыйStreptomyces). Олигомицин ингибирует транспорт протонов через «ножку»Fо, реагируя с единственным остатком глутаминовй кислоты на одной из субъединиц. Блокада транспорта протонов приводит к потере способности АТФ-азы синтезировать АТФ.
F1 - водорастворимый периферический мембранный белок, состоящий из 5 субъединиц. Если отделить (например, мочевиной)F1отFо, то первый сможет только гидролизовать АТФ, но потеряет способность эту молекулу синтезировать.
Синтез АТФ катализирует β-субъединица белка F1. Этот синтез осуществляется спонтанно, т.е. без затраты энергии. Происходит это следующим образом (рис.5.7):F1имеет 3 химически идентичных, но конформационно различно взаимодействующих αβ-протомеров:О (open) – соткрытойконформацией, характеризующейся очень низкое сродство к лигандам и каталитически неактивной;L (loose)-легкосвязывающей лиганды и каталитически неактивной;T (tight) – жёсткосвязывающей лиганды и каталитически активной.
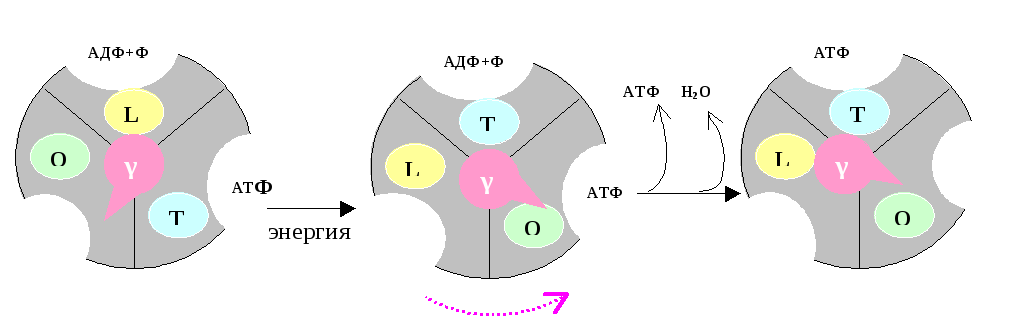
Рис. 5. 7. Работа «молекулярной турбины» – фактора F1.
В состав F1входит γ-субъединица, способная вращаться подобно тому, как вращается турбина в воде («молекулярная турбина»). Вращение γ-субъдиницы обуславливает конформационные изменения в αβ-протомерах.
Связывание АДФ с неорганическим фосфатом происходит на участке L.После этого происходит вращение γ-субъединицы на 120˚ (на рис. против часовой стрелки). Этовращение требует затраты энергии, которая аккумулируется при генерации электро-химического потенциала и подпитывается протонным переносом через каналFo. При вращении γ-субъединицы происходят конформационные изменения αβ-протомеров, в результате чегоL-участок преобразуется вT, аT- вO. В Т-участке осуществляется синтез АТФ, а изО-участка (вследствие вращения «турбины») высвобождается АТФ.
Таким образом, энергия электро-химического потенциала требуется не для синтеза АТФ, а для удаления её из активного центра Vкомплекса. Эта энергия расходуется также на транспорт АТФ из матрикса через митохондриальные мембраны в цитоплазму клетки, а АДФ – в обратном направлении (на работу фермента АТФ-транслоказы). Львиная доля энергии протонного потенциала расходуется на транспорт ионов кальция. Доставка субстратов тканевого дыхания также осуществляется за счёт этой энергии.
Измерение «силы протонного потенциала» показало, что 1 молекула АТФ может образоваться за счёт окисления НАДН∙Н+первымкомплексом дыхательной цепи, 1 молекула АТФ – за счёт окисления убихинолатретьимкомплексом и 1 молекула – при окислении цитохромасчетвёртымкомплексом. Именно в этих местах падение редокс-потенциала превышает 0,2v, при таком перепаде освобождается энергия, вполне достаточная для синтеза молекулы АТФ (для синтеза АТФ необходимо затратить 42 кДж/моль). Таким образом, при окислении НАД-зависимых субстратов может образоваться 3 молекулы АТФ, а при окислении ФАД-зависимых – 2 молекулы АТФ (транспорт электронов начинается со второго комплекса дыхательной цепи).
Следует заметить, что ещё в 30-х годах академик В.А. Энгельгардт обнаружил, что при тканевом дыхании на 1 молекулу кислорода расходуется 3 молекулы фосфата, т.е. отношение Р/О=3 (при использовании НАД-зависиымых субстратов тканевого дыхания). Если в среду инкубации митохондрий добавлялся сукцинат, коэффициент Р/О=2. Эти показатели были названы В.А. Белицером и Е.Т. Цыбаковой коэффициентами фосфорилирования, аI,IIIиIVкомплексы дыхательной цепи –пунктами сопряжения (связи между процессами окисления и фосфорилирования).
Согласно подсчётам известного российского биохимика В.П. Скулачёва, в сутки у человека может синтезироваться более 30 кг (!) АТФ: поскольку в сутки у человека образуется 400 мл воды (22 моля), а коэффициент Р/О=3 (66 молей АТФ), то умножая на молекулярную массу АТФ (507), получаем
707 х 66 = 33 462 (т.е.>33 кг)
Транспорт электронов и протонов – сопряжённые процессы.
Транспорт электронов (окисление НАДН∙Н+и ФАДН2кислородом) и окислительное фосфорилирование (синтез АТФ) в норме тесно связаны Это называетсясопряжением окисления и фосфорилирования. В состоянии покоя, когда окислительное фосфорилирование минимально, электрохимический градиент внутренней митохондриальной мембраны достигает величины, при которой прекращается дальнейший перенос протонов. Тем самым ингибируется транспорт электронов.
Однако обнаружены вещества, например, 2,4-динитрофенол (ДНФ), которые разобщают эти процессы (ДНФ получил печальную известность как препарат для снижения массы тела). Присутствие во внутренней митохондриальной мембране агентов (ионофоров), увеличивающих их проницаемость для Н+, разобщает окислительное фосфорилирование от процесса транспорта электронов, поскольку при этом нарушается генерирование электро-химического потенциала и, следовательно, синтез АТФ. ДНФ является липофильной слабой кислотой, поэтому легко проходит через мембрану (снаружи внутрь митохондрии), ослабляя естественный ток протонов, идущий в противоположном направлении.
Путь транспорта электронов, не связанный с синтезом АТФ, называется свободным, нефосфорилирующим, окислением. При свободном окислении энергия не аккумулируется, а высвобождается в виде тепла. Это имеет физиологическое значение при охлаждении организма.
Частичное разобщение окисления и фосфорилирования наблюдается при многих заболеваниях, так как митохондрии являются наиболее чувствительными клеточными органеллами к действию различных повреждающих факторов. Нарушение их структуры, приводящее к частичному или полному распаду внутренней митохондриальной мембраны, неизбежно будет способствовать обратному току протонов и нарушать энергопродукцию. Поэтому особое значение приобретает стабилизация митохондриальных мембран биоантиоксидантами (витаминами Е, А и аскорбатом) при любой патологии.
В ряде случаев некоторые пункты фосфорилирования могут «выключатся» - такое состояние называется разобщением окислительного фосфорилирования - и в этом случае P/O снижается: для НАД-зависимых субстратов - ниже 3; для ФАД-зависимых субстратов - ниже 2-ух.
И исходя из 1-го закона термодинамики в разобщенных митохондриях увеличивается теплообразование. (Это происходит за счет того, что та энергия электронов, которая должна была быть использована для синтеза АТФ в «выключенном» пункте фосфорилирования, рассеивается в виде тепла).
Процесс разобщения окислительного фосфорилирования лежит в основе лихорадки, вызванной бактериями, вирусами и другими агентами.
Разобщение резко усиливается при охлаждении организма.
Работа митохондрий при «выключенных» всех пунктах фосфорилирования называется сопряженной, в противном, выше описанном случае, разобщенной и дыхание при этом называется свободным.
В качестве разобщителей окислительного фосфорилирования выступают слабые гидрофобные кислоты (ЖК), тиреоидные гормоны, лекарства(дикумарин, динитрофенол).
ДЦ имеет механизмы шунтирования: сброс электронов и протонов по протяжению с НАД на цитохромы, или с НАД на межмембранные дегидрогеназы, на наружную мембрану и гладкую ЭПС (микросомальную цепь).
Такой перенос характерен для печени. При воздействии какого-либо блокатора, возникает блок в 1-ом комплексе ДЦ, происходит накопление НАД.Н2 и становится реальной угроза гипоксии, печень может погибнуть. Чтобы этого не произошло происходит сброс НАД.Н2 с митохондрий ДЦ на микросомальную ДЦ через цитохром b5.
ОФ (снятие pH и ). Механизмы термогенеза. Роль бурой жировой ткани.
Регуляция процесса окислительного фосфорилирования.
Экспериментальные исследования показали, что добавление в ячейку полярографа с инкубируемыми митохондриями АДФ резко стимулировало потребление митохондриями кислорода. Накопление АДФ – регуляторный сигнал, вызывающий стимуляцию тканевого дыхания, т.е. усиление окисления субстратов тканевого дыхания. Это имеет большое физиологическое значение, так как увеличение концентрации АДФ в клетке является свидетельством низкой концентрации АТФ (соотношение адениловых нуклеотидов в клетке постоянно), следовательно, указывает на энергетическое её голодание. Отсюда вытекает и необходимость большего потребления субстратов. Помимо регуляторной роли соотношения АДФ/АТФ, в контроле скорости фосфорилирования участвуют НАД-зависимые коферменты: высокое соотношение НАДН∙Н+/НАД+, так же как и увеличение соотношения АТФ/АДФ будет снижать интенсивность тканевого дыхания.
Способность генерации энергии присуща всем тканям но для того, чтобы они все зароботали, необходимо сильное охлаждение организма.
Поэтому в организме есть ткань, которая обеспечивает термогенез в обычных условиях. Это бурая жировая ткань (БЖТ). Ее особенно много у новорожденных (от затылка до крестца, вдоль всей спины). У взрослого она локализуется в в определенных местах: между лопаток, в паху. Ярко выраженной способностью к теплопродукции обладает бурая жировая ткань новорождённых (а её много в организме зимнеспящих животных), которая отличается от типичной жировой ткани тем, что содержит много триацилглицеролов. Кроме того, в митохондриях этой ткани так много цитохромов, что она приобретает бурый цвет. Митохондрии бурой жировой ткани содержат разобщающий белок термогенин (димер 32 кД), который действует подобно каналу, контролирующему проводимость протонов во внутренней митохондриальной мембране. Поток протонов через этот канал ингибируется физиологическими концентрациями пуриновых нуклеотидов (АДФ, АТФ, ГДФ и др), но это ингибирование может быть устранено свободными жирными кислотами. Компоненты этой системы подчиняются гормональному контролю, в частности, норадреналину, который через систему цАМФ активирует гормончувствительную липазу, расщепляющую триацилглицеролы бурого жира с освобождением свободных жирных кислот.
БЖТ имеет большое количество митохондрий, т. к. митохондрии содержат цитохромы, то это и придает этой ткани бурый цвет. Особенностью митохондрий БЖТ является отсутствие АТФ-азы, Н+генерируется в обычном режиме, но нет инструмента (аденилаттранслаказы), трансформирующегоН+---> АТФ. Вместо нее есть белок термогенин, который шунтируетН+с наружной мембраны во внутрь и одновременно способствует рассеиванию энергииН+в виде тепла, так и происходит подогрев тканей. БЖТ охватывает крупные кровеносные сосуды и согревает кровь, а потом эта кровь согревает перефирические участки тела.
Это и есть несократительный термогенез.
Механизм сократительного термогенеза связан с окислительным фосфорилированием.
При охлаждении организма, активизируется симпатическая нервная система, в овет на это происходит выброс адреналина, под действием которого идет гликолиз, через аденилатциклазный механизм. Образующиеся при этом ЖК разобщают окислительное фосфорилирование и (согласно 1-му закону термодинамики) теплопродукция увеличивается. Именно поэтому, после принятия жирной пищи наступает состояние температурного комфорта.
Основополагающая роль энергетического обмена. Пути утилизации Н+ и АТФ. Прикладные аспекты биоэнергетики.
Энергетический обмен играет ведущую роль в жизнедеятельности организмов, т. к. все функции организма энергозависимы. Систему механизмов, обеспечивающих стабильный уровень субстратов энергообмена называют энергетическим гомеостазом.
Одним из механизмов поддержания постоянного уровня АТФ в клетке, является наличие мегамитохондрий, которое дает большое преимущество.
Если один участок клетки плохо снабжается кислородом, то при помощи мегамитохондрий энергия Н+транспортируется в этот участок и восполняет недостаток АТФ.
Пути потребления O2 в организме. Характеристика микросомальной ДЦ, ее сравнение с митохондриальной. Характеристика цитохромов P450, их функция.
Тканевое дыхание - один из процессов диссимиляции, по сути это и есть биологическое окисление в тканях и клетках организма. В организме существует 3 пути потребления и утилизации кислорода:
1 путь - 90-95% O2 идет на митохондриальное окисление.
2 путь - 5-10% идет на микросомальное окисление (в печени при поступлении больших количеств токсинов - 40%).
3 путь - перекисное окисление (2-5%).
Микросомальная дыхательная цепь.
Микросомы (микрочастицы) - это замкнутые мембранные пузырьки (везикулы), образуемые из гладкой ЭПС при гомогенизации клетки. Как таковых микросом не существует.
Микросомальное окисление - это окисление, протекающее на гладкой ЭПС нормальной неразрушенной клетки.
Наиболее интенсивно микросомальное окисление протекает в печени и надпочечниках, а также в местах контакта с внешней средой, в коже, почках, легких, селезенке.
ЭПС - 2-й слой мембран, ассоциированных с 3-мя основными классами ферментов:
1) оксидоредуктазы;
2) трансферазы;
3) гидролазы.
Главная функция этих ферментов - реакции детоксикации.
Микросомальное окисление осуществляется с помощью одноименной ДЦ, которая представляет собой систему переносчиков протонов и электронов с НАД или НАДФ на кислород.
Существует 2 варианта микросомальной ДЦ:
1) НАДФ ----> ФП ---> b5 ---> p450 ---> O2
2) НАД ----> ФП ----> b5-----
Цитохром b5 одной цепи может передавать свои электроны на цитохром b5 другой цепи, а также на цитохром p450.
Микросомальное окисление можно записать и так:
RH + НАД (НАДФ).H2 + O2 ---> ROH + НАД (НАДФ) + HOH
схема
FP - флавопротеид, включающий ФАД и Fe-белок, содержащий негеминовое железо.
P450 - восстановленный CO-комплекс, который имеет max поглощения при длине волны = 450 нм.
Многие гидрофобные вещества организма обладают токсичностью, за счет того, что растворяются в клеточных мембранах и тем самым разрушают их.
Задачей организма является перевод этих гидрофобных соединений в гидрофильные, которые легче выводятся почками. Это осуществляется микросомальным окислением.
Таким образом, основная роль микросомальной ДЦ заключается в осуществлении реакций синтеза с участием кислорода (в схеме видно образование фенола из бензола (гидроксилирование)).
Для связывания второго атома кислорода необходим косубстрат, каковым является аскорбат (Vit C), кторый также отдает 2H+ на синтез H2O. Для обеспечения реакций детоксикации необходимо большое количество Vit C в составе косубстрата: реакции детоксикации протекают по механизму гидроксилирование гетероциклических и алифатических соединений (ксенобиотики), поступающие из вне.
Реакции детоксикации могут привести к снижению концентрации токсических веществ или может возникнуть летальный синтез.
Роль микросомального окисления состоит в биосинтезе Vit D, кортикостероидов, коллагена, тирозина, катехоламинов.
- Реакции деалкилирования - отщепление алкильной группы;
- реакции окисления спиртов, альдегидов, кетонов, нитросоединений;
- реакции разрыва кольца ароматических соединений;
- реакции восстановления, когда идет сброс протов;
- реакции десатурации (перевод насыщенных ЖК в ненасыщенные).
В 70-е годы было показано, что микросомальная и митохондриальная дыхательные цепи взаимодействуют друг с другом через цитохром b5.
В условиях интоксикации (этанол, барбитураты) происходит ингибирование 1 комплекса митохондриальной ДЦ.
НАД ---> ФП -/-> Q ---> b ---> c1 ---> c ---> aa3 ---> ½ O2
Окисление НАД.Н2 не происходит и он накапливается. В межмембранном пространстве имеется цитохром b5, который принимает электроны с НАД.Н М/Х ДЦ и перебрасывает их на микросомальную ДЦ и тем самым угроза энергетического голода устраняется.
Таким образом ц. b5 - фермент, компонент микросомальной ДЦ, который обеспечивает межмембранный митохондриально-микросомальный перенос электронов.
Сходства и различие митохондриальной и микросомальной дыхательных цепей.
