
- •Анализ спектров испускания веществ с помощью монохроматора
- •Ход работы:
- •Порядок работы на монохроматоре специальном дифракционном мсд-2
- •Вопросы теории.
- •Излучение и поглощение энергии атомами и молекулами.
- •. Основные понятия квантовой теории.
- •Структура энергетических уровней сложных молекул. Молекулярные спектры.
- •Эмиссионный и абсорбционный спектральный анализ, его медицинское применение.
- •Спектроскопы, спектрографы, монохроматоры, спектрофотометры и их применение в медицине.
Вопросы теории.
Излучение и поглощение энергии атомами. Структура энергетических уровней атомов. Оптические спектры атома водорода и спектры сложных атомов.
Структура энергетических уровней сложных молекул. Молекулярные спектры.
Эмиссионный и абсорбционный спектральный анализ, его медицинское применение. Спектроскопы, спектрографы, монохроматоры, спектрофотометры и их применение в медицине.
Излучение и поглощение энергии атомами и молекулами.
В 1913 году Бором предложена теория излучения света, которая основывается на двух постулатах:
Внутренняя энергия атома дискретна, то есть может принимать только определённые дозволенные значения или уровни, кратные характерным для данного атома количествам, или квантам энергии. Состояния атома, соответствующие этим уровням энергии, являются стационарными: в таком состоянии атом не излучает электромагнитных волн, несмотря на происходящее в нём движение электронов.
Испускание (или поглощение) электромагнитного излучения происходит при переходе атома из одного стационарного состояния в другое. При этом испускается (или поглощается) фотон монохроматического излучения с энергией, равной разности энергий энергетических уровней Еm и En:
h = Em - En,
где Emи En- энергия системы в первом и втором состояниях,h– постоянная Планка, - частота излучаемой волны..
На основе этих постулатов Бор разработал теорию излучения и поглощения энергии света атомом водорода. Он предположил, что из всех возможных орбит электрона осуществляются только те, для которых момент импульса (момент количества движений) равен целому кратному постоянной Планка, делённой на 2 :
![]() (n= 1, 2, 3, .
. .) (1.1.)
(n= 1, 2, 3, .
. .) (1.1.)
Число n, называется главным квантовым числом, соответствует порядковому номеру орбиты.v– скорость движения электрона по стационарной орбите.
В случае атома водорода кулоновская сила взаимного притяжения протона и электрона является центростремительной силой, удерживающей электрон на орбите, то есть:
![]() ,
(1.2)
,
(1.2)
где m и е - масса и заряд электрона, r - радиус орбиты.
Исключая vиз (1.1) и (1.2), получим, что радиус электронных орбит в атоме может принимать лишь ряд дискретных значений:
из (1)
![]() подставляем в (1.2)
подставляем в (1.2)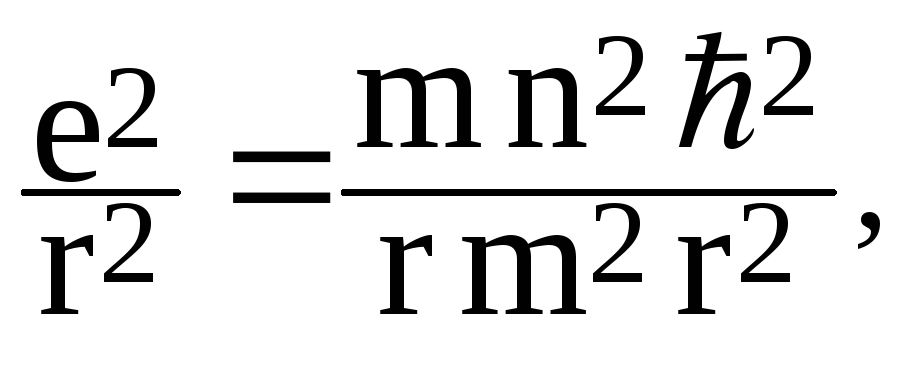 откуда
откуда![]() ,
(n= 1, 2, 3, ...).
,
(n= 1, 2, 3, ...).
Таким образом, радиусы стационарных орбит атома водорода прямо пропорциональны квадрату квантового числа n2.
Для первой,
основной, орбиты n = 1 и радиус
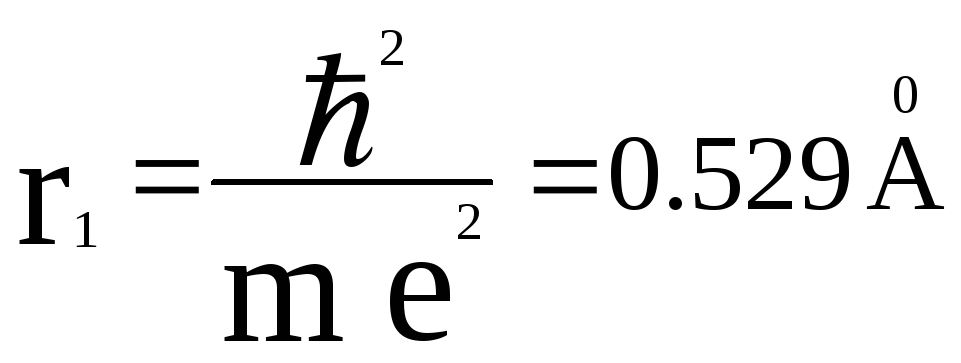 .
.
Из рассмотренных
соотношений находится и скорость
движения электрона по стационарной
орбите
![]() .
Для основной орбиты атома водорода (n= 1):
.
Для основной орбиты атома водорода (n= 1):![]() 2,3108см/сек.
Таков порядок скорости движения
электронов по орбите.
2,3108см/сек.
Таков порядок скорости движения
электронов по орбите.
Энергетический уровень атома обусловлен полной энергией электрона, которая слагается из кинетической энергии электрона (ядро неподвижно) и энергии взаимодействия электрона с ядром (потенциальной энергии). Потенциальная энергия электрона (по знаку она отрицательна как потенциальная энергия сил притяжения) равна:
![]()
Полная внутренняя энергия:
ЕЭ=![]()
учитывая, что
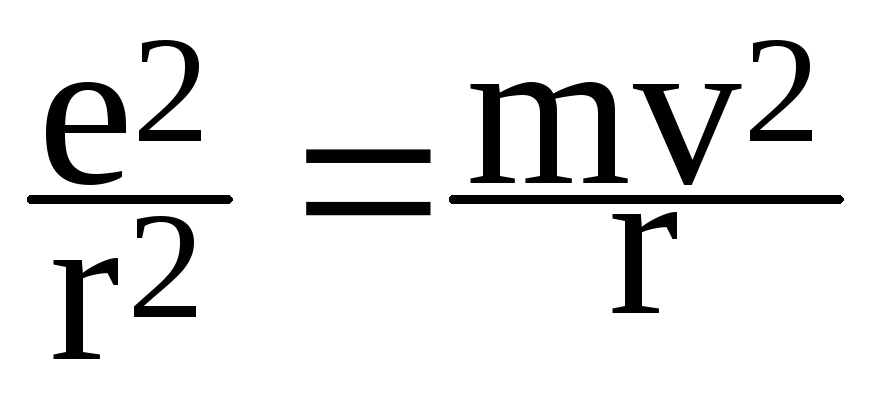 ,
,
находим:
ЕЭ =
![]()
Таким образом, энергия электрона, связанного в атоме с ядром, отрицательна. Энергия свободного электрона равна нулю.
Подставляя в это выражение значения скорости электрона, находим:
ЕЭ= (1.3)
(1.3)
Для атома водорода получаются следующие значения:
основной (нулевой) уровень, n= 1, Е1= - 13,55 эВ;
n= 2, Е2= - 3,38 эВ;
n= 3, Е3= - 1,5 эВ.
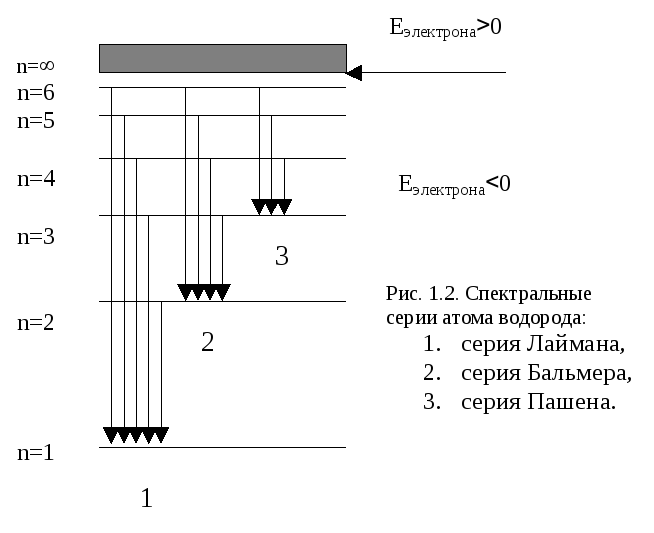
Схема энергетических уровней атома водорода представлена на рисунке.

Рис. 1.1. Структура энергетических уровней атома водорода.
Поскольку энергетические уровни обратно пропорциональны квадрату квантового числа n2, разность между каждыми двумя соседними уровнями по мере возрастания числа и по абсолютной величине уменьшается. Таким образом, по мере удаления от ядра разность между двумя соседними энергетическими уровнями атома убывает:
E2 - E1 > E3 - E2 > E4 - E3 ,. . .
Стационарный уровень с наименьшей энергией называется основным, он соответствует состоянию атома, не подвергающегося никаким внешним воздействиям. Остальные стационарные уровни называются возбуждёнными.
Возбуждение атома, то есть переход электрона на орбиту большего радиуса (Рис. 1.1., переход 1), требует сообщения атому дополнительной энергии и, следовательно, происходит в результате каких-либо внешних воздействий, например, при соударении частиц в процессе интенсивного теплового движения или при электрическом разряде в газах, при поглощении фотона электромагнитного излучения, в результате рекомбинации ионов в газе или электронов и дырок в полупроводнике, при воздействии на атом частиц радиоактивного излучения и т.д. Возбужденное состояние неустойчиво, примерно через 10-8сек электрон возвращается на основную орбиту, при этом излучается фотон, уносящий дополнительную энергию, полученную при возбуждении, и атом, переходит в основное состояние (Рис.1.1., переход 2).
Электрон может возвращаться на основную орбиту не только единым переходом, но и ступеньками через промежуточные уровни. В этом случае при переходе будет излучаться несколько фотонов (Рис. 1.1., переход 3) с частотами, соответствующими разности энергий этих уровней.
Теория Бора объясняла сериальные закономерности спектра атома водорода и водородоподобных атомов. В свое время теория являлась триумфом развития атомной физики. Однако, эта теория не объясняет различия интенсивностей спектральных линий, не раскрывает закономерностей более сложных атомов. Основной недостаток теории – ее непоследовательность. Она объединяет в себе положения принципиально отличных теорий: классической и квантовой. Так, согласно теории, электрон движется по круговой орбите вокруг ядра, что соответствует представлениям классической физики. В последствии теория Бора была заменена квантовой механикой.
Зависимость величины излучаемой атомами или молекулами энергии от длины волны или частоты световой волны называется спектром испускания, а поглощаемой - спектром поглощения. Интенсивность спектральных линий определяется числом одинаковых переходов, происходящих в единицу времени, и поэтому зависит от количества излучающих (поглощающих) атомов и вероятности соответствующего перехода.
Атомными спектрами называют как спектры испускания, так и спектры поглощения, которые возникают при квантовых переходах между уровнями свободных или слабо взаимодействующих атомов. Атомные спектры являются линейчатыми.
Под оптическими атомными спектрами понимают те, которые обусловлены переходами между уровнями внешних электронов с энергией фотонов порядка нескольких электрон-вольт. Сюда относятся УФ, видимая и близкая ИК (до мкм) области спектра. В спектре излучения атома водорода можно выделить несколько серий. Каждая серия соответствует переходам с различных уровней на один и тот же конечный.
Спектральные линии (частоты) этих серий можно рассчитать по формуле:
![]() (1.4.)
(1.4.)
Серия Лаймана расположена в ультрафиолетовой области и образуется при переходах электронов с верхних энергетических уровней (ni=2, 3, 4…) на нулевой уровень (n=1).
![]() (1.5.)
(1.5.)
Серия Бальмера расположена в видимой и близкой ультрафиолетовой областях, а серия Пашена – в инфракрасной области.
Структура энергетических уровней сложных атомов усложняется расщеплением электронных уровней, зависящим от взаимодействия электронов между собой и ядром. Спектры подобных атомов полосатые.
