
Основы токсикологии
.pdf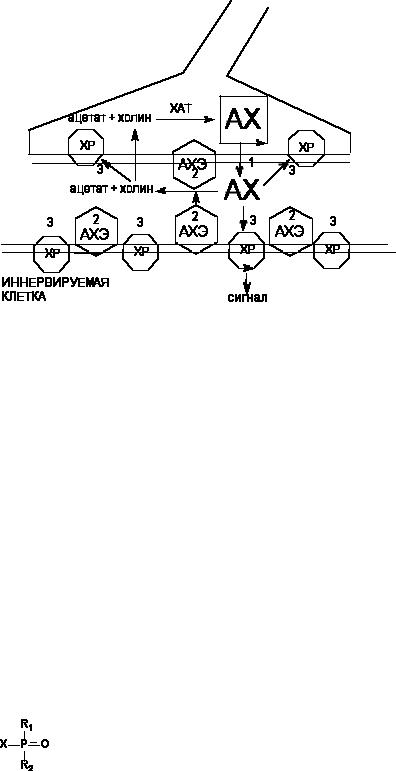
Рисунок 3. Схема функционирования холинэргического синапса.
1 - 3 - механизмы действия токсикантов:
1 - ботулотоксин
2 - ингибиторы АХЭ
3 - холинэргические и антихолинэргические средства
В ЦНС плотность М-холинорецепторв существенно выше, чем Н-холинорецепторов. Наивысшая плотность холинэргических нервных окончаний определяется в хвостатом, прилежащем, чичевичном ядрах, гиппокампе, гипоталамусе, коре головного мозга, мозжечке.
Перевозбуждение центральных холинэргических механизмов может приводить к развитию судорожного синдрома. Наибольшей активностью в этом плане обладают ингибиторы АХЭ, способные проникать через гематоэнцефалический барьер (ФОС, карбаматы).
Фосфорорганические соединения
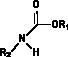
Все соединения фосфорной и фосфоновой кислот, обозначаемые как фосфорорганические соединения (ФОС), имеют структуру:
R1 и R2 - алкил-, алкокси-, диалкиламидные и др. группы; Х - кислотный остаток, в качестве которого могут выступать фтор-, циан-, ацильный- и другие радикалы.
Фосфорорганические соединения нашли применение как инсектициды (хлорофос, карбофос, фосдрин, лептофос и др.) и лекарственные препараты (фосфакол, армин и т.д.). Наиболее токсичные представители группы были приняты на вооружение армий целого ряда стран в качестве боевых отравляющих веществ (зарин, зоман, табун, Vx).
ФОС хорошо растворяются в липидах и, вследствие этого, легко проникают через гематоэнцефалический барьер и оказывают непосредственное действие на холинэргические
синапсы мозга. ФОС являются ингибиторами АХЭ, практически необратимо взаимодействующими с ее активным центром (фосфорилирование энзима). В результате их действия угнетается процесс разрушения АХ в синапсах. Медиатор накапливается в синаптической щели и вызывает гиперактивацию постсинаптических холинэргических рецепторов (непрямое холиномиметическое действие). Легкое поражение ФОС, как правило, развивается при угнетении АХЭ более, чем на 50%, средней степени тяжести - более 70%, тяжелой - около 90%. Кроме того, будучи в известной степени структурными аналогами ацетилхолина, вещества оказывают прямое возбуждающее действие на холинорецепторы. Гиперактивация холинорецепторов приводит к перевозбуждению холинэргических механизмов мозга, что, при достаточной степени поражения, приводит к развитию судорожного синдрома.
Восстановление нормального проведения нервного импульса осуществляется за счет медленно протекающих процессов дэфосфорилирования АХЭ (спонтанная реактивация энзима), синтеза АХЭ de novo, десенситизации холинорецепторов.
Элиминация ядов из организма проходит с разной скоростью. Некоторые вещества способны к относительно продолжительному персистированию (карбофос - сутки и более). Наиболее токсичные представители очень быстро разрушаются при участии гидролаз и оксидаз смешанной функции и уже спустя час после внутрибрюшинного введения экспериментальным животным в крови определяются в следовых количествах. Значительная часть ФОС связывается эстеразами плазмы крови и не оказывает действия на холинэргические синапсы ЦНС и ПНС.
Симптомы интоксикации ФОС при ингаляционном поражении развиваются практически немедленно, при поступлении через рот или кожу - через десятки минут. При действии в несудорожных дозах вещества вызывают возбуждение, бессонницу, головные боли, галлюцинации, чувство страха, апатию, депрессию, тремор. Интоксикация всегда сопровождается нарушениями со стороны жизненно важных органов и систем: дыхательной, сердечно-сосудистой, желудочно-кишечного тракта (активация парасимпатического отдела вегетативной нервной системы). При тяжелых поражениях судорожный синдром протекает на фоне полной утраты сознания и если не заканчивается летальным исходом (от остановки дыхания) приводит к коме. Продолжительность острой фазы интоксикации от нескольких часов до суток.
Специфическими противоядиями ФОС являются реактиваторы холинэстеразы (дипироксим, пралидоксим, токсогонин и др.) и холинолитики (М- и Н- , центральные и периферические). Наиболее часто используемый в клинической практике препарат - атропин, вводимый в дозах, существенно превосходящих максимальную суточную, рекомендуемую фармакопеей (десятки миллиграмм в сутки). В качестве средств борьбы с судорогами рекомендуют назначение производных бензодиазепина (диазепам).
Карбаматы
Производные карбаминовой кислоты - карбаматы (рисунок 4) давно известны, как активные ингибиторы холинэстеразы (ХЭ).
Рисунок 4. Структурная формула карбаматов
Некоторые представители группы, прежде всего растительного происхождения (физостигмин, галантамин), обладают высокой токсичностью, но в силу избирательности действия широко используются в качестве лекарственных препаратов. Многие синтетические аналоги, обладающие меньшей токсичностью для млекопитающих, но высокотоксичные для насекомых, применяются в качестве инсектицидов. Среди них: пропоксур (ЛД50 - 90 - 124 мг/кг), изопрокарб
(ЛД50 - 400 - 485 мг/кг), диоксакарб (ЛД50 - 60 - 80 мг/кг), бендиокарб (ЛД50 - 60 мг/кг). В настоящее время известны и весьма токсичные для человека синтетические производные
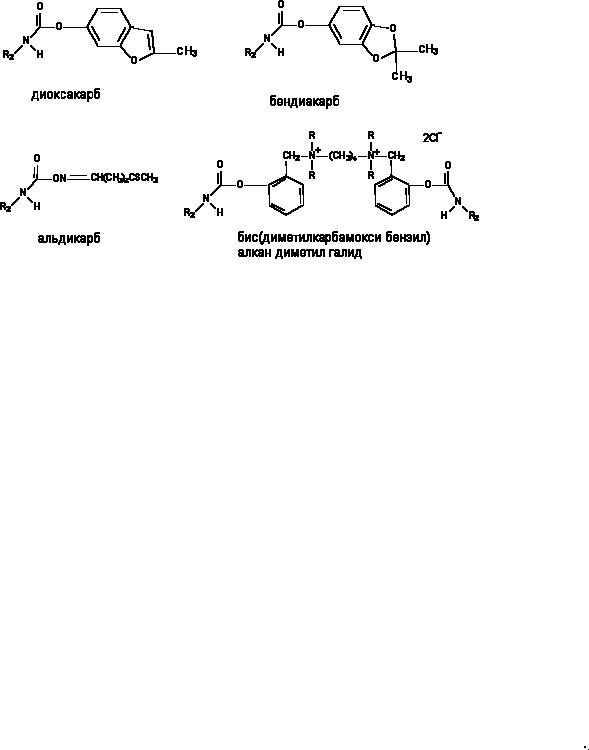
карбаминовой кислоты. Нпример, аминостигмин, альдикарб (ЛД50 - 1 мг/кг), бис- (диметилкарбамокси-бензил)-алкан-диметил-галид (ЛД50 - 0,005 мг/кг). Токсичность соединений определяется строением радикала (R1) при кислородном атоме карбоксильной группы кислоты (рисунок 5).
Рисунок 5. Структура некоторых производных карбаминовой кислоты (карбаматов)
Липофильные незаряженные молекулы легко проникают через гематоэнцефалический барьер и оказывают непосредственное действие на холинэргические синапсы. Соединения, содержащие в молекуле четвертичный (заряженный) атом азота, действуют в основном на ПНС (вегетативный и двигательный отделы). Поражение карбаматами (по механизму действия, патогенезу токсического процесса и проявлениям) чрезвычайно напоминает поражение ФОС. Основным проявлением тяжелого поражения карбаматами является судорожный синдром. Особенностью действия карбаматов, в сравнении с ФОС, является обратимый характер ингибирования АХЭ (карбамилирование энзима). В этой связи процесс восстановления нормального проведения нервного импульса в холинергических синапсах осуществляется, в основном, за счет быстрого, в течение нескольких часов, декарбамилирования АХЭ (спонтанной реактивации).
Холинолитики, как и в случае ФОС, являются специфическими противоядиями карбаматов.
Интересно отметить, что профилактическое введение веществ этой группы обеспечивает существенную защиту экспериментальных животных от высокотоксичных ФОС. Наибольшей активностью обладают третичные (проникающие через ГЭБ) карбаматы (физостигмин, галантамин, аминостигмин и др). Защитный механизм объясняют экранированием АХЭ и ХР от действия ФОС как самим карбаматом, так и АХ, накапливающимся в синаптической щели вследствие угнетения некоторой части холинэстеразы, а также развивающейся десенситизацией ХР. Добавление к профилактически вводимому обратимому ингибитору АХЭ холинолитических препаратов еще более усиливает степень защищенности экспериментальных животных.
4.1.1.1.3. Вещества, активирующие глютаматэргические структуры мозга
Глютамат представляет собой аминокислоту, в высокой концентрации содержащуюся в структурах центральной нервной системы. Она образуется путем аминирования 
 - кетоглютаровой кислоты. Декарбоксилирование глютаминовой кислоты под влиянием фермента декарбоксилазы (ДГК) приводит к образованию ГАМК. Действуя в малых количествах, глютамат возбуждает нейроны спинного мозга, коры головного мозга, мозжечка и других структур ЦНС млекопитающих. Установлено, что вещество является нейромедиатором, выделяющимся в специальных синаптических структурах и взаимодействующим с глютаматчувствительными рецепторами постсинаптических мембран.
- кетоглютаровой кислоты. Декарбоксилирование глютаминовой кислоты под влиянием фермента декарбоксилазы (ДГК) приводит к образованию ГАМК. Действуя в малых количествах, глютамат возбуждает нейроны спинного мозга, коры головного мозга, мозжечка и других структур ЦНС млекопитающих. Установлено, что вещество является нейромедиатором, выделяющимся в специальных синаптических структурах и взаимодействующим с глютаматчувствительными рецепторами постсинаптических мембран.

Основными глютаматергическими нейрональными трактами ЦНС являются: кортикостриатный, энторинал-гипокампальный; первичные слуховые волокна кохлеарного ядра, боковой обонятельный, ретино-тектальный, зрительный кортико-тектальный, зрительный кортико-геникулярный, кортико-таламический и др. (McGeer, McGeer, 1980).
Деполяризация постсинаптической мембраны, развивающаяся после действия глютамата на рецепторы, связана с увеличением её проницаемости для ионов натрия. Глютаматергические рецепторы активируются также такими веществами как аспарагиновая кислота, N-метил-D- аспарагиновая кислота (NMDA), 
 -амино-3-гидрокси-5-метил-4-изоаозолпропионовая кислота (АМПК) и др. Эти возбуждающие аминокислоты не способны проникать через гематоэнцефалический барьер, но вызывают судорожный синдром при их внутрицеребральном введении экспериментальным животным. По способности вызывать судороги аналоги глютамата могут быть ранжированы следующим образом: NMDA (0,5 мМ/кг) > иботеновая кислота (1,0 мМ/кг), D,L-гомоцистеиновая кислота > N-метил-L-аспартат (> 1 мМ/кг) > L-глютамат (20 мМ/кг) > D-глютамат > L-аспартат. Неодинаковая чувствительность глютаматергических рецепторов разных структур мозга к агонистам, позволила выделить несколько подтипов этих рецепторов: NMDA-чувствительный, каинатный, квисквалатный, метаботрофный рецепторы.
-амино-3-гидрокси-5-метил-4-изоаозолпропионовая кислота (АМПК) и др. Эти возбуждающие аминокислоты не способны проникать через гематоэнцефалический барьер, но вызывают судорожный синдром при их внутрицеребральном введении экспериментальным животным. По способности вызывать судороги аналоги глютамата могут быть ранжированы следующим образом: NMDA (0,5 мМ/кг) > иботеновая кислота (1,0 мМ/кг), D,L-гомоцистеиновая кислота > N-метил-L-аспартат (> 1 мМ/кг) > L-глютамат (20 мМ/кг) > D-глютамат > L-аспартат. Неодинаковая чувствительность глютаматергических рецепторов разных структур мозга к агонистам, позволила выделить несколько подтипов этих рецепторов: NMDA-чувствительный, каинатный, квисквалатный, метаботрофный рецепторы.
Токсические проявления системного действия глютамата в больших дозах у млекопитающих - это судороги (крысы, кошки) и рвота (собаки, обезьяны). У людей картину отравления глютаматом называют "синдром китайского ресторана" (поскольку в этих заведениях подают пищу богатую глютаматом), она характеризуется болями и ощущением жжения в верхней половине тела, возбуждением.
Веществом, широко использующимся в эксперименте в качестве судорожного агента, является каиновая кислота.
Каиновая кислота - одна из целой серии аминокислот, выделенных из растений, грибов, водорослей японским химиком Takemoto (1978). Многие из этих аминокислот структурно напоминают глютамат и обладают возбуждающими свойствами. Каиновая кислота является наиболее активным агентом. Судорожный синдром в эксперименте вызывают внутрицеребральным введением каината, поскольку вещество плохо проникает через ГЭБ. Богатым природным источником каиновой кислоты являются морские водоросли Digenea simplex.
Интересной особенностью действия агонистов возбуждающих аминокислот является их способность вызывать гибель нейронов мозга, активирующихся глютаматом, через механизм гиперактивации глютаматергических рецепторов. Это свойство получило название эксайтотоксическое действие (exceitotoxic action). В основе эффекта, как полагают, лежит нарушение гомеостаза внутриклеточного кальция в перевозбужденных нейронах.
В настоящее время синтезировано большое количество антагонистов глютамата, как неконкурентных (кетамин, фенциклидин, МК-801 - дозицилпин и др.), так и конкурентных (кинуренат, 2-амино-5-фосфоновалериановая кислота, 2-амино-7-фосфоногептаноевая кислота и др.), обладающих противосудорожной активностью.
4.1.1.2. Конвульсанты, блокирующие тормозные процессы в ЦНС
Многие конвульсанты, блокируют проведение нервного импульса в синапсах, участвующих в осуществлении механизмов пресинаптического и постсинаптического торможения в ЦНС. К числу таковых, прежде всего, относятся ГАМК-ергические и глицинергические синапсы. В этой связи и токсиканты разделяются на две группы:
-нарушающие проведение импульса в ГАМК-ергических синапсах;
-нарушающие проведение нервного импульса в глицинергичесих синапсах. ГАМК-ергические синапсы вовлечены в механизмы как пре-, так и постсинаптического торможения, глицинергические - только постсинаптического.
4.1.1.2.1. Конвульсанты, действующие на ГАМК-ергический синапс.
Существуют многочисленные данные, подтверждающие участие ГАМК в механизмах пресинаптического и, резистентного к глицину, постсинаптического торможения. ГАМК - нейромедиатор в тормозных синапсах, как позвоночных, так и беспозвоночных животных. ГАМК вызывает гиперполяризацию возбудимой мембраны, что сопровождается формированием ингибиторного пстсинаптического потенциала (ИПСП). Установлено, что в основе этого действия лежит усиление проницаемости возбудимых мембран для ионов хлора.
ГАМК обнаружена во всех структурах ЦНС. Концентрация аминокислоты в разных областях мозга колеблется в пределах от 2 до 10 мкМ/г ткани. Наивысшее её содержание - в чёрной субстанции. Высокая плотность ГАМК-ергических синапсов, выявлена в клиновидном ядре, ядре Дейтерса, на телах спинальных интернейронов, в обонятельных бугорках, коре головного мозга, коре мозжечка, гиппокампе, продолговатом мозге (нейронах ретикулярной формации), латеральных коленчатых телах, гипоталамусе, ядрах дорзальных рогов спинного мозга. Нейроны этих образований высоко чувствительны к ГАМК.
В нервных окончаниях ГАМК обнаруживается главным образом в цитоплазме в несвязанной форме (60 - 80%); относительно небольшое количество вещества находится в пресинаптических везикулах.
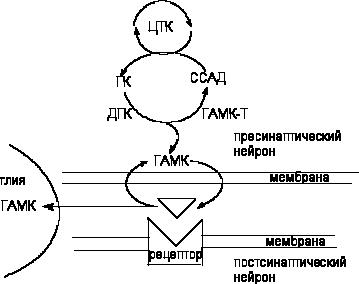
ГАМК образуется из глютамата под влиянием пиридоксальфосфат-зависимого энзима глютаматдекарбоксилазы (ДГК) (рисунок 6). ДГК - цитоплазматический энзим, широко представленный в структурах мозга, содержащих ГАМК в высокой концентрации. Источником глютамата является цикл Кребса. Катаболизм нейромедиатора осуществляется митохондриальным энзимом - трансаминазой ГАМК (ГМАК-Т). Он превращает вещество в сукцинатсемиальдегид, который, в свою очередь, окисляется другим митохондриальным энзимом, дегидрогеназой сукцинатсемиальдегида, с образованием янтарной кислоты. Последняя утилизируется циклом Кребса.
Рисунок 6. Схема обмена ГАМК в ЦНС:
ЦТК - цикл трикарбоновых кислот; ГК - глутаминовая кислота; ДГК - декарбоксилаза глутаминовой кислоты; ГМАК-Т - трансаминаза ГАМК; ССАД - сукцинатсемиальдегид
Большая часть выделившейся в синатическую щель ГАМК удаляется путем высоко афинного, Na-зависимого активного обратного захвата, как нервными окончаниями, так и клетками глии. До 50% ГАМК ЦНС определяется в глиальных элементах мозга.
Конвульсанты, действующие на ГАМК-ергический синапс, либо блокируют синтез и высвобождение ГАМК в синаптическую щель (аллилглдицин, 3-меркаптопропионовая кислота, антагонисты пиридоксальфосфата) либо являются её физиологическими антагонистами.
4.1.1.2.1.1. Антагонисты ГАМК
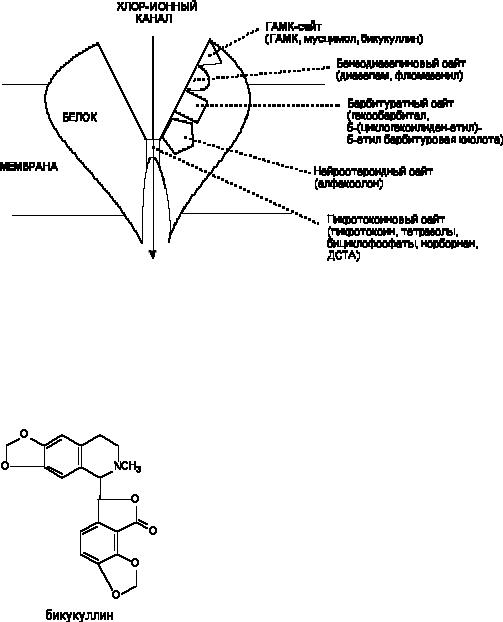
Структура и физиология ГАМК-рецепторов окончательно не изучены. Не существует и их единой классификации. Наиболее распространено разделение рецепторов на ГАМКА и ГАМКБ типы по их чувствительности к бикукуллину. Наиболее изучены ГАМКА рецепторы, действию на которые и приписывают основные эффекты, вызываемые тормозным нейромедиатором. С ГАМКА-рецепторами связывается большое количество химических веществ, как облегчающих, так и блокирующих поступление ионов хлора через возбудимую мембрану (рисунок 7). Эти вещества являются соответственно агонистами или антагонистами ГАМК.
Рисунок 7. Схема строения ГАМК-рецептора, с указанием сайтов связывания ГАМК-ергических биологически активных веществ
Бикукуллин
Бикукуллин - алкалоид, выделяемый из растения Dicentra cucullaria. Его структура представлена на рисунке 8.
Рисунок 8. Структура молекулы бикукуллина
В настоящее время вещество широко используется в практике экспериментальных исследований. Судорожный синдром развивается при подкожном введении крысам в дозе 5 мг/кг.
Токсикокинетика соединения не изучена.
Проявления судорожного синдрома похожи на судороги вызываемые пикротоксином. По существующим представлениям бикукуллин является селективным антагонистом ГАМК в структурах спинного мозга, ствола мозга и мозжечке и не вмешивается в проведение нервного импульса в глицинергических синапсах. Чувствительность различных ГАМК-рецепторов корковых нейронов к токсиканту неодинакова (на этом признаке построена их классификация на ГАМКА- и ГАМКБ-рецепторы). Полагают, что судороги, развивающиеся при отравлении бикукуллином, имеют субкортикальное происхождение и обусловлены гиперактивацией клеток Пуркинье мозжечка, а также нейронов клиновидного ядра, ствола мозга, спинальных нейронов, гиппокампа, латеральных коленчатых тел, гипоталамуса, ретикулярной формации. Бикукуллин препятствует связыванию ГАМК синаптосомами, содержащими ГМАК-рецепторы, что указывает на его способность действовать на сайт для ГАМК. В судорожных дозах вещество не влияет на активность ГАМК-трансаминазы и ДГК, а также на уровень ГАМК в структурах мозга. Этосуксимид и вальпроевая кислота практически не препятствуют развитию судорог, вызываемых бикукуллином.
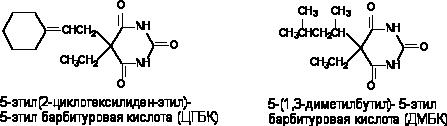
Судорожные барбитураты
Судорожные барбитураты представляют большой интерес, поскольку являются антагонистами свих аналогов - барбитуратов, усиливающих тормозные процессы в ЦНС (гексенал, барбитал и др.). Структура таких соединений представлена на рисунке 9. ЦГБК синтезирована и впервые изучена Vellus et al. в 1951 году, ДМБК - Swanson и Chen в тридцатые годы.
Рисунок 9. Структура молекул судорожных барбитуратов
Токсикокинетические характеристики веществ такие же, как и у других производных барбитуровой кислоты.
Клонико-тонические судороги у мышей ЦГБК при внутривенном введении вызывает в дозах 3 - 9 мг/кг, ДМБК - около 3 мг/кг. Судорожное действие веществ подавляется пентабарбиталом. Такие противосудорожные средства как фенитоин, триметадоин, мефенезин не предотвращают развитие эффекта. Механизм действия веществ не изучен. По всей видимости, они действуют на сайт связывания барбитуратов, выступая в качестве антагонистов ГАМК. При этом каким-то образом изменяется проницаемость возбудимой мембраны для ионов кальция, поскольку токсиканты не оказывают действия на реактивные структуры (препарат аорты кролика) в инкубационной среде, не содержащей Са2+.
Пикротоксин
Пикротоксин выделяют из Anamerta cocculus - кустарника, произрастающего в Восточной Индии. Исходный экстракт содержит два дилактона: пикротин, практически инертное вещество, и пикротоксинин активный конвульсант, структура которого представлена на рисунке 10.
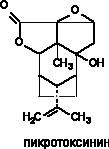
Рисунок 10. Структура молекулы пикротоксинина
Токсикокинетика вещества изучена недостаточно. Оно быстро абсорбируется при всех способах аппликации, однако судороги развиваются по прошествии определенного скрытого периода. Возможно, в этот период происходит биотрансформация вещества, его взаимодействие с ДГК или другие явления. Однако не исключено, что скрытый период - следствие медленного преодоления веществом гематоэнцэфалического барьера. Особенности распределения вещества и пути его биотрансформации неизвестны. Судя по кратковременности действия, процесс элиминации происходит с большой скоростью.
Пикротоксин вызывает клонические судороги. При увеличении дозы преобладает тонический компонент, причем тоническое сокращение сгибателей предшествует сокращению разгибателей. На фоне двигательных нарушений появляются вегетативные реакции: саливация, иногда рвота, повышение артериального давления. Предсудорожные дозы вещества стимулируют дыхание. Пикротоксин возбуждает все отделы ЦНС, однако у спинальных животных судорожный синдром вызывается более высокими дозами яда.
В опытах на животных установлено, что пикротоксин блокирует как пресинаптическое, так и резистентное к стрихнину постсинаптическое торможение в ЦНС. Известно, что стрихнин не влияет на тормозные процессы, реализуемые через ГАМК. Ни стрихнин, ни пикротоксин, применённые в отдельности не вызывают полной активации мотонейронов спинного мозга. Совместное действие стрихнина и пикротоксина приводит к полному блоку механизма торможения мотонейронов и их перевозбуждению. Таким образом, по крайней мере, половина тормозных синапсов мотонейронов ГАМК-эргичны.
ГАМК-эргические механизмы пресинаптического торможения представлены в структурах, ответственных за обработку сенсорной информации: дорзальных рогах спинного мозга, клиновидном и нежном ядрах продолглватого мозга, латеральных коленчптых телах, хвостатом ядре, талямусе. Блокадой мехенизмов торможения в сенсорных структурах можно объяснить своеобразный эффект, наблюдаемый у отравленных - появление генерализованных судорог при стимуляции сенсорных систем.
Поскольку ни ГАМК, ни её агонист мусцимол не влияют на связывание пикротоксина с ГАМКрецептором, вероятно, токсикант не взаимодействует с сайтом, связывающим ГАМК.
Существуют данные о прямом действии пикротоксина на возбудимые нейрональные мембран. При этом вещество угнетает прохождение ионов хлора через ионный канал.
Пикротоксин практически не влияет на энзимы синтеза и разрушения ГАМК, хотя в некоторых исследования зарегистрировано подавление синтеза нейромедиатора в мозге отравленных лабораторных животных.
Тетраметилендисульфотетрамин (дисульфотетразаадаматнтан, ДСТА).
ДСТА - смолоподобное вещество, которое первоначально, до обнаружения его высокой токсичности, использовали в мебельной промышленности для обработки древесины. Структура соединения представлена на рисунке 11.

Рисунок 11. Структура молекулы дисульфотетразаадамантана
Средняя смертельная доза токсиканта для грызунов составляет 0,2 - 0,4 мг/кг.
ДСТА является неконкурентным и обратимым антагонистом ГАМК. При системном введении экспериментальным животным ДСТА чувствительность части нейронов ствола головного мозга и клиновидного ядра к ГАМК и глицину существенно снижается. Поскольку вещество не влияет на характер связывания с рецептором ГАМК, бикукуллина и пикротоксин, полагают, что ДСТА действует через собственный сайт, вероятно ионофорный канал.
Бициклические фосфорорганические соединения (БЦФ)
В 1973 году Bellet и Casida исследовали группу бициклических фосфорорганических соединений, не обладающих антихолинэстеразной активностью, но вызывающих приступ судорог и гибель экспериментальных животных при введении в малых дозах. Структура БЦФ представлена на рисунке 12. Биологически активные вещества такого строения относятся к бициклофосфатам, бициклофосфоротионатам и бициклофосфитам.
Рисунок 12. Структура молекул бициклических фосфорорганических соединений
Все они твердые вещества, плохо растворимые в воде. Могут оказывать токсическое действие при подкожном, внутримышечном, внутривенном, а некоторые представители, и при ингаляционном способе введения (в форме аэрозоля).
Токсичность веществ существенно зависит от строения радикала R и может быть очень высокой для отдельных соединений. Так, ЛД50 третбутилбициклофосфата для грызунов составляет около 50 мкг/кг массы. Проявления судорожного синдрома одинаковы при действии всех токсикантов и характеризуются быстрым развитием приступов клонических судорог, постепенно перерастающих в клонико-тонические.
Токсикокинетика веществ не изучена.
Считается, что БЦФ - неконкурентные антагонисты ГАМК. Их токсичность обусловлена блокадой хлор-ионных ГАМК-рецепторов.
Близкие по структуре соединения бициклоортокарбоксилаты и бициклоортобензоаты (рисунок 13) также способны связываться с хлор-ионофорным сайтом ГАМК-рецептора и вызывать судороги.

Рисунок 13. Структура молекул триоксибициклокарбоксилатов
Токсичность веществ зависит от строения радикалов R1 и R2 и для некоторых представителей, при внутрибрюшинном способе введения, ЛД50 составляет около 1 мг/кг массы экспериментального животного (4-третбутил-1(3,4-дихлофенил)-бициклоортобензоат).
Норборнан
2,2-ди(трифторметил)-3,3-дициано-5,6-дихлорнорборнан (норборнан) - один из самых токсичных синтетических конвульсантов. Вещество синтезировано в начале 80-х годов Мидлтоном (США). Структура вещества представлена на рисунке 14.
Рисунок 14. Структура молекулы 2,2-ди-(трифторметил)-3,3-дициано-5,6-дихлорнорборнана
Кристаллическое вещество, растворимое в воде, оказывает эффект при всех способах введения. Видовая чувствительность к норборнану выражена слабо и составляет в среднем
0,07 - 0,2 мг/кг.
Токсикокинетика вещества не изучена.
Интоксикация характеризуется растянутой во времени клиникой поражения, что отличает её от клиники поражения лабораторных животных другими ГАМК-литиками. Так, при подкожном введении крысам смертельной дозы норборнана, скрытый период составляет около 1,5 часов, судорожный - до 4 часов, продолжительность жизни отравленных животных - более 6 часов (для сравнения, аналогичные токсикодинамические характеристики пикротоксина составляют, соответственно: 0,5 часа; 0,5 часа и 1 час). Судорожный период характеризуется волнообразным течением. Приступы клонико-тонических судорог сменяются периодами ремиссии. Сенсорная стимуляция провоцирует формирование ризуса.
По существующим представлениям норборнан - избирательный блокатор хлор-ионофоров ГАМКА-рецепторов. Фенобарбитал препятствует развитию судорог, вызываемых норборнаном. Производные бензодиазепина - малоэффективны.
4.1.1.2.1.2. Ингибиторы синтеза ГАМК
К числу веществ, угнетающих синтез ГАМК, принадлежат, прежде всего, ингибиторы декарбоксилазы глутаминовой кислоты (ДГК), в частности: аллилглицин, 3- меркаптопропионовая кислота, кислород под повышенным давлением, соединения - антагонисты пиридоксальфосфата (коэнзим ДГК). Антагонисты пиридоксальфосфата, в силу широкого использования их в практике, представляют особый интерес. Структура некоторых из них представлена на рисунке 15. По большей части это производные гидразина.
