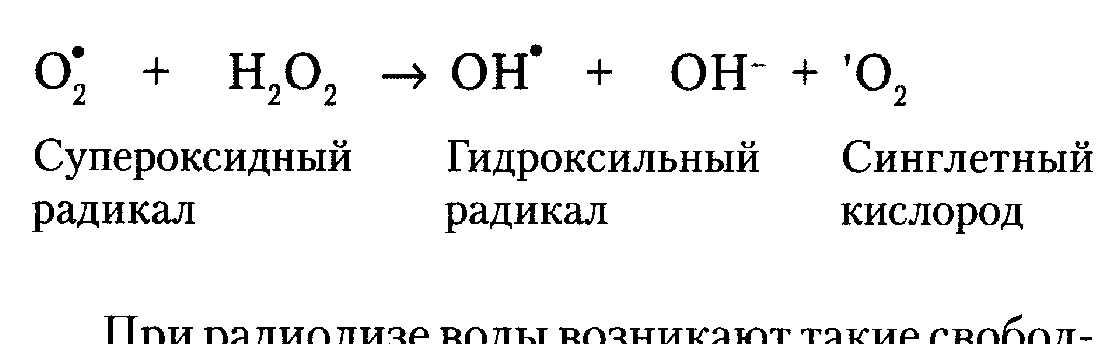Зачет 3. БХ. Липиды. Шпора
.docx|
1.Классификация липидов.Строение триглицеринов(ТГ), фосфолипидов(ФЛ), холестирина(ХС).Биологическое значение отдельных классов. По функциональной нагрузке в организме различают две группы липидов: 1.Резервные липиды (жиры жировых депо), их количество и состав непостоянны, зависят от режима питания и физического состояния организма. 2.Структурные липиды — их количество и состав в организме строго постоянны, генетически обусловлены и в норме не зависят от режима питания, функционального состояния организма. Триацилглицериды – это сложные эфиры глицерина и высших жирных кислот. Простые триацилглицериды содержат остатки одинаковых, смешанные – разных жирных кислот. Названия триацилглицеридов строятся на основе названий ацильных остатков, входящих в их состав жирных кислот. Смешанные триацилглицериды могут содержать хиральный атом углерода в положении 2 и иметь энантиомеры. Триацилглицериды – малополярные, не растворимые в воде вещества, так как их молекулы не содержат сильнополярных или заряженных групп. Триацилглицериды, содержащие преимущественно остатки ненасыщенных кислот, при обычных условиях являются жидкостями, насыщенных кислот – твердыми веществами. Они входят в состав животных жиров и растительных масел, которые представляют собой смеси триацилглицеридов. Животные жиры содержат в основном триацилглицериды с остатками насыщенных кислот и поэтому имеют твердую консистенцию. Растительные масла включают в основном остатки ненасыщенных кислот и являются жидкостями. Основная биологическая функция триацилглицеридов – запасные вещества животных и растений. Химические свойства триацилглицеридов определяются наличием сложноэфирной связи и ненасыщенностью. Как сложные эфиры триацилглицериды гидролизуются под действием кислот и щелочей, а также вступают в реакцию переэтерификации. Фосфолипиды – общее название липидов, содержащих остаток фосфорной кислоты. Фосфолипиды – основные липидные компоненты клеточных мембран. Основные структурные компоненты, составляющие молекулы фосфоглицеридов, – это глицерин, жирные кислоты, фосфорная кислота, аминоспирты (этаноламин или холин) или аминокислота серин. Их рассматривают как производные L-глицеро-3-фосфата в котором спиртовые группы этерифицированы жирными кислотами, а остаток фосфорной кислоты образует сложноэфирную связь с аминоспиртом. |
При нагревании в кислой и щелочной средах фосфоглицериды гидролизуются, распадаясь на основные структурные компоненты. Основные структурные компоненты молекул фосфосфинголипидов – сфингозин, жирные кислоты, фосфорная кислота, аминоспирты этаноламин или холин. Молекулы фосфолипидов дифильны. Они содержат полярную гидрофильную “голову” и неполярный гидрофобный “хвост”. В водной среде они способны образовывать сферические мицеллы – липосомы, которые можно рассматривать как модель клеточных мембран. Фосфолипиды – основные структурные компоненты клеточных мембран. Согласно жидкостно-мозаичной модели клеточные мембраны рассматриваются как липидные бислои. В таком бислое углеводородные радикалы фосфолипидов за счет гидрофобных взаимодействий находятся внутри, а полярные группы липидов располагаются на внешней поверхности бислоя. В жидкий липидный бислой встроены молекулы белков. Холесторин – важнейший представитель стеринов, для которых характерно налич. гидроксильной группы в положении 3 и боковой цепи в полож.17. У ХС все кольца наход. в транс-полож.,имеет двойную связь между 5 и 6 углеродн. атомами. ХС содерж. спиртовую гидроксильную группу при С-3 и разветв. алифатическую цепь из 8 атомов С при С-17. Каждая клетка в организме млекопитающих содерж. ХС. Наход. в составе мембран клеток, неэстерифицированный вместе с ФЛ и белками обеспеч. избират. проницаемость клеточной мембраны и оказ. Регулирулирующее влияние на сост. мембран. В цитоплазме ХС наход-ся в виде эфиров с ЖК. |
2. Особенности строения ФЛ. Роль в построении мембран, их биологическое значение. Биосинтез ФЛ. Фосфолипиды – основные липидные компоненты клеточных мембран. При гидролизе фосфолипидов образуются фосфорная кислота, жирные кислоты, спирты (глицерин или сфингозин), а также аминоспирты и др. соединения. К фосфолипидам относятся глицерофосфолипиды и сфингофосфолипиды Глицерофосфолипиды (фосфоацилцилглицеролы) являются производными фосфатидной кислоты (фосфатидата). Структура глицерофосфолипидов Наиболее широко представлен в клетках различных тканей фосфатидилхолин (лецитин) и фосфатидилэтаноламин (кефалин). У них к остатку фосфорной кислоты присоединены аминоспирты – холин и этаноламин. Эти два глицерофосфолипида метаболически тесно связаны друг с другом. Они являются главными липидными компонентами большинства биологических мембран. В тканях находятся также другие глицерофосфолипиды. В фосфатидилсерине фосфорная кислота этерифицирована гидроксильной группой серина, а в фосфатидилинозите – шестиатомным спиртом – инозитом. Производное фосфатидилинозита – соединение фосфатидилинозит-4,5-бисфосфат является важным компонентом биологических мембран. При стимуляции соответствующим гормоном он расщепляется. Продукты его расщепления (диацилглицерол и инозитолтрифосфат) служат в качестве внутриклеточных посредников действия гормонов. С глицерофосфолипидами метаболически очень тесно связаны лизофосфолипиды. В их составе содержится только один остаток жирной кислоты. Примером может служить лизофосфатидилхолин, который играет важную роль в метаболизме фосфолипидов. Лизофосфатидилхолин способен вызывать лизис эритроцитов. Поэтому наличие в змеином яде большого количества лизофосфолипидов является причиной гемолиза, который наблюдается при укусах змей. Молекулы фосфолипидов дифильны. Они содержат полярную гидрофильную “голову” и неполярный гидрофобный “хвост”. В водной среде они способны образовывать сферические мицеллы – липосомы, которые можно рассматривать как модель клеточных мембран. Фосфолипиды – основные структурные компоненты клеточных мембран. |
Согласно жидкостно-мозаичной модели клеточные мембраны рассматриваются как липидные бислои. В таком бислое углеводородные радикалы фосфолипидов за счет гидрофобных взаимодействий находятся внутри, а полярные группы липидов располагаются на внешней поверхности бислоя. В жидкий липидный бислой встроены молекулы белков. Биосинтез ФЛ происходит в печени,стенке кишечника, семенниках, яичниках, молоч. железе. Наиболее важные ФЛ, синтез. в эндоплазм. сети клктки. Центр. роль в биосинтазе ФЛ играет 1,2-диглицерид, а также цитидинтрифосфат участ. в синтезе ФЛ. |
|
|
3. Переваривание и всасывание липидов в ЖКТ. Для последующего всасывания ТАГ сначала должны подвергнуться ферментативному гидролизу до свободных жирных кислот (СЖК) и моноацилглицеролов (МАГ). Гидролиз, хотя и в очень малой степени, начинается в желудке под действием кислой липазы. Этот фермент секретируется слюнными железами и клетками слизистой желудка. Оптимальной средой для её действия является среда, близкая к нейтральной. Поэтому липаза в желудке взрослого человека практически неактивна из-за низких значений рН, которые там имеют место в норме. Тем не менее, её действие способствует эмульгированию жира в химусе и, тем самым, увеличению площади раздела двух фаз - жира и воды. У взрослого человека основным местом переваривания липидов является тонкий кишечник. В двенадцатиперстной кишке происходит нейтрализация попавшей в кишечник с пищей соляной кислоты желуд. сока бикарбонатами желчи и сока поджелудочной железы, выделяющиеся при разложении бикарбонатов пузырьки СО2 способ. хорошему перемеш. пищевой кашицы с пищеварит. соками. На первом этапе там происходит эмульгирование жира. Эмульсия представляет собой взвесь в водной среде частиц неполярных липидов. По сути дела эмульгирование заключается в дроблении крупных
|
липидных частиц на более мелкие. Происходит этот процесс благодаря трем факторам: 1) перистальтика кишечника, которая способствует перемешиванию и дроблению жировых капель; 2) углекислому газу. Он образуется в результате реакции нейтрализации гидрокарбонатов кишечного сока кислым содержимым желудка, поступающим туда с пищей; 3) желчным кислотам. Всасывание происход. в проксимальной части тонкой кишки. Тонкоэмульгированые жиры частично могут всасываться через стенки кишечника без предвар. гидролиза. Основ. часть жира всасывается лишь после расщепления его панкреат. липазой на ЖК, моноглицериды и глицерин. Процесс всасывания ЖК с длинной углеродной цепью и моноглицеридов осущ. при участии желчи и желчных кислот. ЖК с короткой углерод. цепью и глицерин,будучи хорошо растворимыми в воде, свободно всасываются в кишечнике и поступ. в кровь воротной вены ,оттуда в печень, минуя какое-либо превращение в кишечном тракте. |
4. Желчные кислоты – продукты конечного метаболизма холестерина. В печени образуются холевая и хенодезоксихолевая кислоты (первичные), затем, под действием бактерий кишечника они переходят в дезоксихолевую и литохолевую. Кроме того, желчные кислоты конъюгируют с глицином или с таурином и образуют гликохолевую, таурохолевую, гликодезоксихолевую и т.д. Желчные кислоты, как амфифильные соединения, ориентируются на границе жир-вода, погружаясь гидрофобной частью молекулы в жир, а гидрофильной – в воду. Это приводит к снижению поверхностного натяжения и дроблению капель жира. В итоге увеличивается общая поверхность капель жира, что увеличивает контакт жира с ферментами (по закону адсорбции), растворенными в водной среде. После гидролиза липидов и образования жирных кислот для их всасывания в кишечнике желчные кислоты образуют конъюгаты с жирными кислотами и обеспечивается транспорт такого комплекса через мембрану эпителиальных клеток. Желчные кислоты (кроме литохолевой) и их конъюгаты постоянно участвуют в печеночно-кишечном цикле (энтеро-портальная рециркуляция). Одна молекула желчной кислоты может за сутки проходить 5 – 15 циклов. Литохолевая кислота, при первом же попадании в печень связывается с серной кислотой и более не возвращается в портальную систему, а экскретируется с фекалиями. |
|
|
|
5. Все ферменты, принимающие участие в гидролизе липидов, растворены в водной фазе содержимого тонкого кишечника и могут действовать на молекулы липидов лишь на границе раздела липид/вода. Отсюда, для эффективного переваривания липидов необходимо увеличение этой поверхности с тем, чтобы большее количество молекул ферментов участвовало в катализе. Увеличение площади поверхности раздела достигается за счет эмульгирования липидов – разделение крупных липидных капель пищевого комка на мелкие. Происходит этот процесс благодаря трем факторам: 1) перистальтика кишечника, которая способствует перемешиванию и дроблению жировых капель; 2) углекислому газу. Он образуется в результате реакции нейтрализации гидрокарбонатов кишечного сока кислым содержимым желудка, поступающим туда с пищей; 3) желчным кислотам. В результате поверхность частицы приобретает суммарный электрический заряд, который будет одноименным у всех других эмульсионных частиц. В силу электростатического взаимодействия между отдельными частицами возникает отталкивание. Для эмульгирования необходимы поверхностно-активные вещества – ПАВы, представляющие собой |
амфифильные соединения, одна часть молекулы которых гидрофобная и способна взаимодействовать с гидрофобными молекулами поверхности липидных капель, а вторая часть молекулы ПАВов должна быть гидрофильной, способной взаимодействовать с водой. При взаимодействии липидных капель с ПАВами снижается величина поверхностного натяжения на границе раздела липид/вода и крупные липидные капли распадаются на более мелкие с образованием эмульсии. В качестве ПАВов в тонком кишечнике выступают соли ЖК и продукты неполного гидролиза триацилглицеринов или ФЛ, однако основную роль в этом процессе играют желчные кислоты. Наиболее эффективное эмульгирование жиров происходит при комбинированном действии на капельки жира трех веществ: солей жёлчных кислот, ненасыщенных жирных кислот и моноацилглицеролов. При таком действии поверхностное натяжение частиц жира на разделе фаз жир/вода резко уменьшается. Крупные частицы жира распадаются на мельчайшие капельки. Мелкодисперсная эмульсия, содержащая указанную комбинацию эмульгаторов, очень стабильна, и укрупнения частичек жира не происходит. Совокупная поверхность капелек жира очень велика. Это обеспечивает большую вероятность взаимодействия жира с ферментом липазой и гидролиз жира. |
6. Основным ферментом, который катализирует расщепление липидов пищи, является панкреатическая липаза. Этот фермент присутствует в соке поджелудочной железы и активируется в просвете кишечника. Дело в том, что в водной среде доступ к активному центру липазы заблокирован -спиральным участком её молекулы. На границе раздела жир-вода активный центр становится доступен для субстратов. Этому способствует также специальный белок, названный колипазой. Колипаза связывается с С-концом некаталитического участка молекулы панкреатической липазы. Происходящее вслед за этим изменение конформации обусловливает прикрепление ферментативного комплекса к липидной поверхности эмульсионных частиц. Активный фермент ускоряет реакцию гидролиза ацилглицеролов. Оптим. каталитич. активность липаз проявляется при рН 8-9. Однако нек-рые липазы растений и микроорганизмов активны в слабокислой среде (рН 4-6).
7. Особенности переваривания липидов у детей. Важную роль в пищеварении у детей играет расщепление триглицеридов в желудке, особенно грудного возраста. Слизистая оболочка корня языка и примыкающей к нему области глотки ребенка грудного возраста секретирует собственную липазу в ответ на сосательные и глотательные движения (при кормлении грудью). Эта липаза получила название лингвальной. Активность лингвальной липазы не успевает «проявиться» в полости рта, и основным местом ее воздействия является желудок. Оптимум рН лингвальной липазы в пределах 4,0–4,5; он близок к величине рН желудочного сока у таких детей. Лингвальная липаза наиболее активно действует на триглицериды, содержащие жирные кислоты с короткой и средней длиной цепи, что характерно для триглицеридов молока. Иными словами, жир молока – самый подходящий субстрат для этого энзима. У взрослых активность лингвальной липазы крайне низкая. |
8. Липопротеиды. Различают следующие классы липопротеиновых частиц: 1) хиломикроны - d<1,00г/мл кл. кишечника, перенос экзо. жира из кишечника в ткани, транспорт экзо-о хол-а из кишечника в печень; 2) липопротеины очень низкой плотности - d<1,006г/мл – печень, транспорт эндогенного жира, синтезированного в печени из углеводов, в жировую ткань; 3) липопротеины промежуточной плотности - d=1,006-1,020г/мл; 4) липопротеины низкой плотности - d=1,02-1,063г/мл – образуются в кровеносном русле из ЛОНП через стадию образования Липопротеинов Промежуточной Плотности (ЛППП), транспорт эндогенного холестерина в ткани; 5) липопротеины высокой плотности - d=1,063-1,210г/мл – печень, транспорт холестерина из тканей в печень и выводится с желчью. ЛПОНП называются пре -липопротеины, ЛПНП - -липопротеины, а ЛПВП - -липопротеины. Все липопротеины плазмы крови являются частицами сферической формы, состоящими из ядра, включающего в себя триацилглицеролы и эфиры холестерола, окруженного тонким липидным монослоем молекул свободного холестерола и фосфолипидов. Аполипопротеины внедрены в поверхностную липидную оболочку таким образом, что их гидрофобные домены - в сторону ядра, а гидрофильные - наружу. Такая конфигурация является высоко устойчивой и облегчает растворимость микрокапель неполярных липидов. ФУНКЦИИ АПОБЕЛКОВ. 1.Апобелки выполняют функцию эмульгаторов, потому что являются амфифильными веществами. 2. Некоторые из аполипопротеинов являются регуляторами активности ферментов липидного обмена. 3.Могут обладать собственной ферментативной активностью. 4.Могут выступать в качестве лигандов клеточных рецепторов для липопротеинов. 5.Многие апобелки осуществляют транспорт липидов из одного липопротеина в другой. |
|
|
9. Синтез хиломикронов (ХМ). В клетках слизистой кишечника (энтероцитах) идет эстерификация 2-МАГ и ХС жирными кислотами, образуются ТАГ и ЭХ, из которых затем формируются ХМ. Переход свободного холестерина из клеток на ЛПВП обусловлен разницей его концентраций на поверхности клеточных мембран и липопротеиновых частиц. Он продолжается до тех пор, пока не выровняется концентрация холестерина между поверхностью мембран и ЛПВП. Поддержание градиента концентрации обеспечивается постоянным превращением свободного холестерина, поступающего на ЛПВП, в эфиры холестерина, катализируется ЛХАТ. Триацилглицеролы для ЛПОНП синтезируются путем эстерификации жирных кислот, поступающих в гепатоциты из плазмы крови или синтезирующихся в печени. Уровень синтеза ЛПОНП регулируется также наличием холестерина, в особенности, образованием эфиров холестерина ЛХАТ-ом. Сборка ЛПОНП регулируется на уровне посттрансляции за счет контроля наработки апо В-100. Только комплекс апоВ с ФХ обладает способностью проходить через мембрану эндоплазматического ретикулума. Ассоциация апо В с ФХ сразу после трансляции обеспечивает возможность образования развернутой структуры белковой молекулы, необходимой для прохождения через мембрану. Другие липиды выступают в качестве регуляторов образования и секреции липопротеинов. ЛХАТ. Лецитин-холестерин-ацилтрансфераза (ЛХАТ) - в гепатоцитах, необходим для обратного транспорта холестерина; осуществляет эстерификацию холестерина за счет переноса жирной кислоты с лецитина на СХ. АХАТ. Уровень синтеза ЛПОНП регулируется также наличием холестерина, в особенности, образованием эфиров холестерина под действием ацил~КоА: олестеролацилтрансферазы (АХАТ). Этот фермент локализован в эндоплазматическом ретикулуме близко к месту синтеза ЛПОНП. Его функцией является образование эфиров холестерина.
10. Роль рецептора ЛПНП в развитии гиперхолестеринемии. Рецептор липопротеина низкой плотности играет важную роль в контроле уровня холестерина в плазме крови человека. Локализуясь на поверхности гепатоцитов и других клеток, рецептор связывает липопротеины низкой плотности, холестерин-транспортные протеины, обеспечивая их вхождение внутрь клетки путем эндоцитоза. Внутри клетки липопротеины низкой плотности деградируют внутри лизосом и высвобожденный холестерин может быть метаболизирован для синтеза мембран, стероидных гормонов и т.д. Рецептор ЛПНП представляет собой одноцепочечный трансмембранный белок, имеющий пять различных доменов: связывающий лиганд, гомологичный предшественнику эпидермального фактора роста, содержащий О-связанные сахара, пронизывающий мембрану и цитоплазматический. Домен связывающий лиганд включает семь повторяющихся обогащенных цистеином отрицательно заряженных последовательностей, которые взаимодействуют с положительно заряженными участками апо В, содержащими большое количество аргининов и лизинов. |
Цитоплазматический домен обеспечивает связывание рецептора с окаймленной ямкой. Рецепторы синтезируются рибосомами шероховатого эндоплазматического ретикулума и гликозилируются в аппарате Гольджи. Мутации гена, кодирующего рецептор ЛПНП и локализованного в коротком плече хромосомы 19, приводят к нарушению процесса деградации ЛПНП, что является причиной возникновения СГХС.
11. Атеросклероз. С позиции инфильтрационной теории основным действующим фактором, вызывающим образование и развитие атеросклеротических изменений в стенке сосуда является ХС ЛПНП. Этот класс ЛП подвергается значительным изменениям в зависимости от питания, условий внешней и внутренней среды. Меняется не только липидный, но и апопротеиновый состав, заряд, жесткость ЛП-частицы. При этом заметно нарастает содержание иммуноглобулина LgG. Апо-В содержащие ЛП (ЛПНП и ЛПОНП) образуют растворимые комплексы с ГАГ соединительнотканного матрикса артерий, приводя к структурным изменениям стенки сосуда. Такое изменение структуры и конформации ЛП вызывает активацию перекисного окисления липидов, входящих в состав ЛП. Экзогенные вещества, также как и перекиси липидов, могут с одной стороны вызывать конформационные изменения апопротеинов, а с другой служить гаптенами. Не исключено появление в составе ЛП фенотипов апопротеинов или их мутантных форм. Антитела к ЛП появляются в 2-х случаях: в ответ на модифицированные in vivo ЛП, которые приобретают аутогенные свойства, и, во-вторых в ответ на воздействие патогенных или других факторов, когда клетки иммунокомпетентной системы синтезируют антитела, образующие иммунные комплексы с нативными плазменными ЛП. В обоих случаях образуется иммунный комплекс ЛП-антитело, который рассматривается как модифицированный ЛП, иначе реагирующий с клеткой, чем нативный ЛП. Физиологический смысл формирования иммунного комплекса необходим для более быстрого удаления антигена из крови. Иммунный комплекс ЛПНП-LgG захватывается макрофагами на 23% активнее, чем нативные ЛП. Избыточный захват иммунных комплексов ЛП – антитело макрофагами приводит к превращению последних в пенистые клетки, играющие важную роль в развитии атеросклеротических поражений артерий (ксантоматоз, регрессирование и стадии атеросклероза). Появление пенистых клеток во внутренней оболочке артерий является характерным морфологическим признаком прогрессирующего |
атеросклеротического процесса. Ускоренному образованию пенистых клеток способствует специфический набор рецепторов (рецепторы к ЛПОНП и ЛППП, рецепторы к комплексу ЛПОНП с ГАГ). Гибель пенистых клеток приводит к выходу в межклеточное пространство липидов. Таким образом, липидоз интимы происходит одновременно как за счет ЛП, поступающих их плазмы, так и за счет освобождения из пенистых клеток ХС. Накопление последних сопровождается очаговым склерозом, образованием пятен и полос, являющихся основой для фиброзных бляшек.
12. Механизм мобилизации жира (роль гормонов, цАМФ и ионов Са+). Содержащиеся в организме человека массой 70 кг триацилглицеролы (ТАГ) могут дать 100.000 ккал энергии: белки – 60.000 ккал; гликоген – 6.000 ккал; глюкоза - 400 ккал. ТГ составляют 90% среди всех липидов, содержащихся в организме. Наиболее часто встречающимися жирными кислотами в их составе являются олеиновая (18:1), пальмитиновая (16:0) и линолевая (18:2) кислоты. На их долю приходится 75% всех жирных кислот. В норме более 95% ТГ находится в жировой ткани. Оставшиеся 5% локализованы преимущественно в печени и мышцах. При голодании, тяжелом СД, некоторых других состояниях, при которых жир мобилизуется из жировой ткани( ЛИПОЛИЗ) для энергетических целей, количество ТГ в печени увеличивается. Жировая ткань функционально специализируется на хранении (запасании) и мобилизации ТАГ. При этом за 2-3 недели в адипоците происходит полное их обновление. Предшественниками для синтеза ТАГ являются глицерол-3-фосфат и активированные жирные кислоты. В печени глицерол-3-фосфат может образовываться или в результате фосфорилирования глицерина, или из глюкозы как промежуточный продукт гликолиза. В жировой ткани отсутствует фермент глицеролкиназа; поэтому единственным источником образования глицерол-3-фосфата является гликолиз. Жировая ткань функционально специализируется на хранении (запасании) и мобилизации ТАГ. Фосфорилирование активирует гормон-чувствительную липазу, тем самым ускоряется гидролиз ТАГ. Адреналин, норадреналин, глюкагон и АКТГ так же активируют этот фермент, в то время как инсулин вызывает его дефосфорилирование, снижая активность. Депонирование жира в жировой ткани сопряжено с питанием и гормональным статусом, которые направлены на стимуляцию поглощения глюкозы. Активация жирных кислот происходит путем их превращения в ацил~КоА под влиянием фермента – ацил~КоАсинтетазы. Гидролиз триацилглицеролов опосредован липазными ферментами. Активность липазы в клетках жировой ткани находится под строгим регуляторным контролем (отсюда название - гормон-чувствительная липаза).
|
Фермент проявляет субстратную специфичность к ТАГ, 1,2-диацилглицеролам, 2-моноацилглицеролам и эфирам холестерина. Активность гормон-чувствительной липазы регулируется путем фосфорилирования-дефосфорилирования, которые опосредует фермент цАМФ-зависимая протеинкиназа. В результате полного гидролиза молекулы ТАГ образуется 3 молекулы жирных кислот и 1 молекула глицерола. Глицерол из жировой ткани попадает в печень и используется там как предшественник в синтезе глюкозы путем глюконеогенеза. Жирные кислоты выходят из адипоцитов в плазму крови. Они используются любыми тканями, клетки которых содержат митохондрии, способные окислять жирные кислоты с выделением энергии. Однако преимущественно эти жирные кислоты утилизируются в клетках сердечной, скелетных мышц и печени. Другим важным источником ТГ являются ЛП плазмы крови. Метаболизм ТАГ в жировой ткани скоординирован с анаболической и катаболической фазами метаболизма на уровне целого организма. Вслед за перевариванием пищи в плазме крови увеличивается концентрация глюкозы, инсулина, липопротеинов, богатых ТАГ. Наряду с этим стимулируется образование ТАГ в жировой ткани. В развитие этой анаболической фазы вовлечены переносчики глюкозы и гликолиз; стимулируется активность ЛПЛ для гидролиза ТАГ в составе липопротеинов и снижается активность жиромобилизующей липазы в жировой ткани. Натощак или при повышенной потребности в энергии во время физической работы, повышении уровня катехоламинов, гормона роста, АКТГ и глюкагона в плазме крови, снижении секреции инсулина эти процессы меняются на противоположные - увеличивается липолиз, высвобождаются жирные кислоты, используемые в качестве источника энергии, и глицерол - для глюконеогенеза Характерно, что все двойные связи в составе жирных кислот организма имеют цис-конфигурацию. Двумя преобладающими мононенасыщенными жирными кислотами животных липидов являются олеиновая и пальмитолеиновая. Олеиновая кислота наиболее широко распространена в природе и преобладает в количественном отношении. Среди полиненасыщенных жирных кислот в тканях млекопитающих наиболее часто встречается линолевая кислота, содержащая две двойные связи, линоленовая - с тремя двойными связями и арахидоновая - с четырьмя двойными связями. Ненасыщенность жирных кислот существенно влияет на их свойства. С увеличением числа двойных связей снижается температура плавления жирных кислот, возрастает их растворимость в неполярных растворителях. Все ненасыщенные жирные кислоты, встречающиеся в природе, при комнатной температуре являются жидкостями.
|
|
|
13. Эйкозаноиды как производные арахидоновой кислоты.Строение и биохимическая роль. Под этим термином различают3 группы соединений: простагландины(ПГ), тромбоксаны, лейкотриены(ЛТ).Они являются производными полиненасыщенный ЖК.Самым главным предшественником эйкозаноидов в орг.человека является арохидоновая кислота. Номенклатура и структура ПГ.своеобразным родоночальником ПГ является простоноевая кислота.ПГ различных групп(обозначаются буквами от А до I)отличаются степенью окисления циклической части молекулы и её компонентов.Основными являются 4 класса этих соединений(А,E,F,I).Серия(номерной нижний индекс у буквенного символа)указывает число двойных связей в боковой цепи,которая зависит от первоначальной(материнской0полиненасыщенной ЖК.У человека наиболее важной является серия 2. Синтез ПГ.Превращение арахидоновой кислоты в ПГ Н2 происходит посредством циклооксигеназной и пероксидазной реакций с последующим образованием целой группы других активных эйкозаноидов. Тромбоксаны.Отличаются от ПГ тем,что в циклическую часть их молекул входит атом кислорода.В результате образуется 6-членный цикл,а не 5-членный как в ПГ.Особо следует отметить ПГ I2(другое название простоциклин).В его молекуле между 5-членным циклом и одной из боковых цепочек находится циклическая структура.ПГ I2 предотвращает агрегацию тромбоцитов на эндотелии кровеносных сосудов и способствует расширению сосудов. |
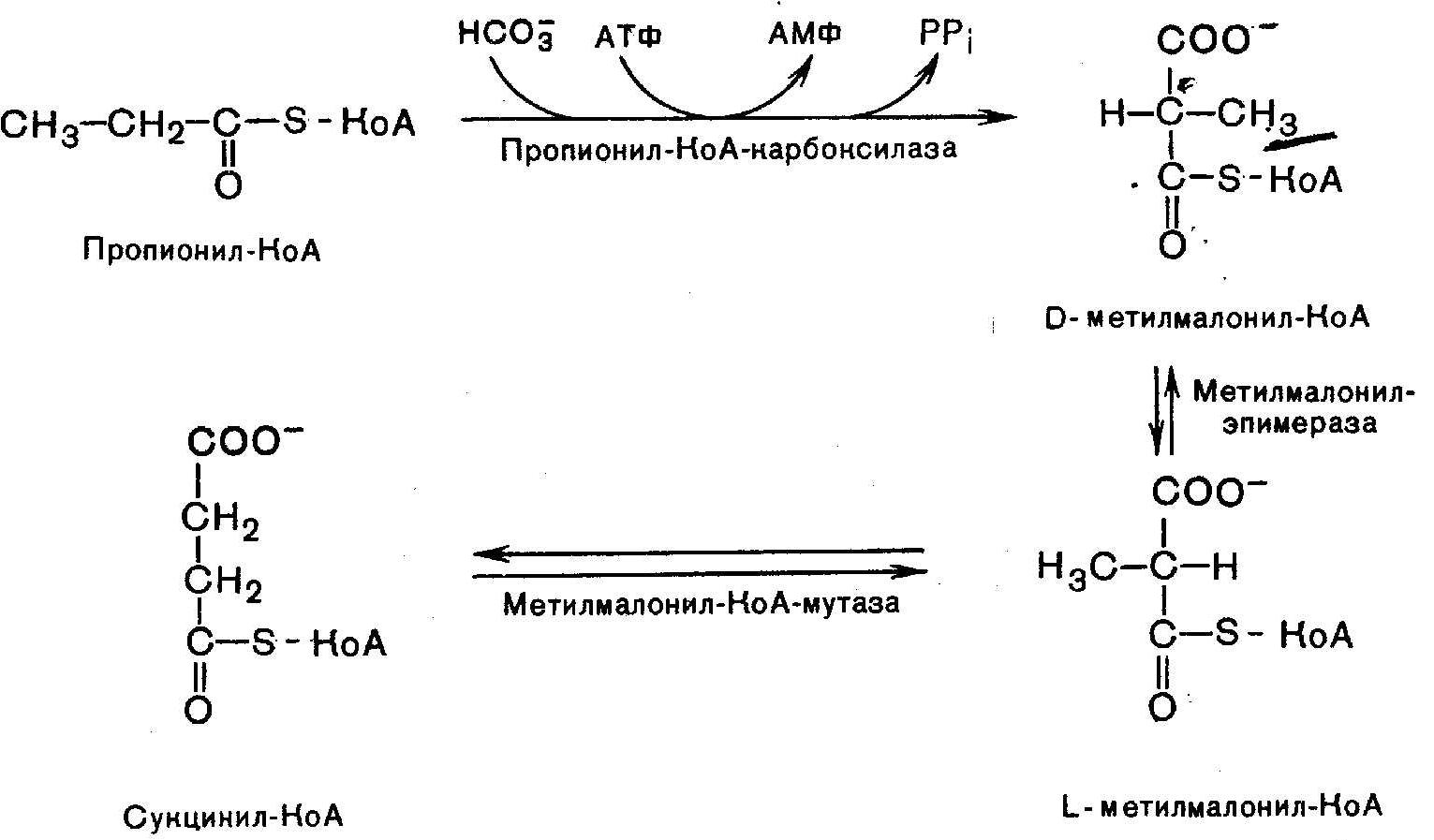
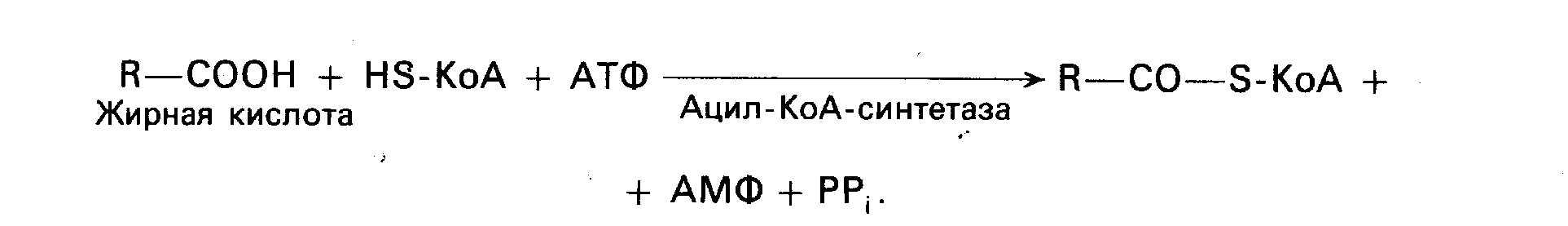
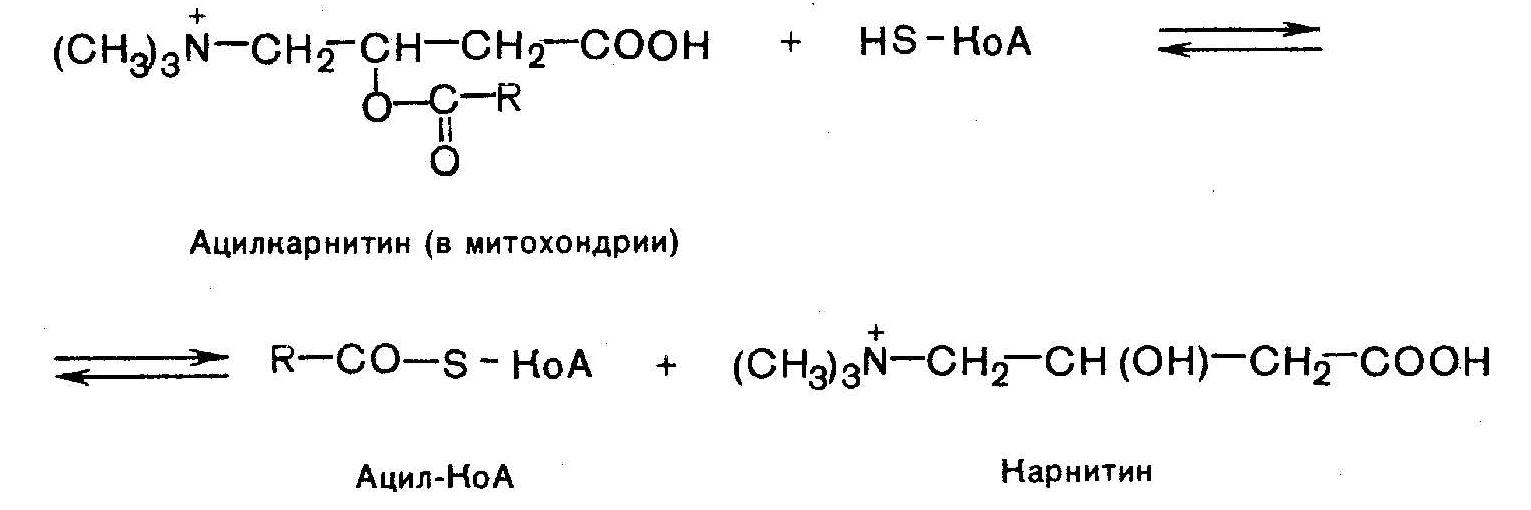
14. Механизм всасывания, активации и мембранного транспорта ЖК в митохондрии. В постабсорбционном состоянии основным энергетическим "топливом" для клеток являются высшие ЖК (поступающая в клетки глюкоза превращается в жирные кислоты). При поступлении глюкозы в клетки она в цитозоле окисляется до пирувата ,последний окисляется в матриксе митохондрий до ацетил-КоА. Образовавшийся ацетил-КоА конденсируется с оксалоацетатом (ЩУК) с образованием цитрата, а цитрат выходит из митохондрии в цитозоль. Поступивший в цитозоль цитрат, во-первых, служит источником ацетил-КоА и восстановительных эквивалентов для синтеза высших жирных кислот, а, во-вторых, активирует фермент ацетил-КоА-карбоксилазу, стимулируя тем самым образование малонил-КоА, также необходимого для синтеза высших жирных кислот. В результате при избытке глюкозы в клетке запускается синтез жирных кислот. Малонил-КоА в свою очередь угнетает перенос высших жирных кислот из цитозоля в матрикс митохондрий, ингибируя активность внешней ацетил-КоА: карнитин-ацилтрансферазы, выключая таким образом окисление высших жирных кислот. В итоге при поступлении глюкозы в клетку угнетается окисление высших жирных кислот, стимулируется их синтез, а потребность клетки в энергии покрывается за счет аэробного окисления глюкозы, чему способствует повышение концентрации ацетил-КоА и цитрата в матриксе митохондрий. Увеличение концентрации жирных кислот в клетке наряду с нарастанием концентрации в них триозофосфатав создает условия для синтеза резервных триглециридов. В этот процесс включаются также высшие жирные кислоты и глицерол, поступающие в клетку в результате гидролиза триглицеридов ХМ и ЛПОНП. Основная роль карнитина – активное расщепление жиров и обеспечение организма необходимой энергией: L-карнитин доставляет жирные кислоты в митохондрии клеток, где они достаточно быстро подвергаются окислительной реакции.
|
15
В-окисление: Активация ЖК: Транспорт ЖК внутрь митохондрий
Р-ция при участии специфич.цитоплазматич. ферм. – карнитин-ацилтрансферазы. Внутримитохондриальное окисление ЖК
|
1-4 +
Фермент
Окисление ЖК с четным числом. 1-6+ |
|
|
17. Пути обмена ацетил-КоА (образование и утилизация). Ацетон, который образуется при спонтанном (неферментативном) декарбоксилировании ацетоацетата, в организме не используется. Он выводится с выдыхаемым воздухом, секретом потовых желёз и мочой. В норме концентрация ацетона в крови мала и обычными реакциями не определяется. Кетоновые тела синтезируются в печени, легко проходят через митохондриальные и клеточные мембраны и поступают в кровь. Кровью они транспортируются во все другие ткани. Используются только ацетоацетат и бета-гидроксибутират.
18. Кетоновые тела. Строение, биосинтез,окисление, физиологическая роль, содержание в крови. Возникновение кетонурии и кетонемии. Механизм и причины. Пути использования образовавшегося из кетоновых тел Ацетил-КоА зависят от функционального состояния клетки (энергетический заряд) и ее специфики. В ткани, которая получила этот Ацетил-КоА, он может быть использован для разных целей, но чаще всего в ЦТК для получения энергии. В норме процессы синтеза и использования кетоновых тел уравновешены, поэтому концентрация кетоновых тел в крови и в тканях обычно очень низка, и составляет 0.12 - 0.30 ммоль/л. При сахарном диабете постепенное истощение запасов углеводов приводит к относительному отставанию утилизации кетоновых тел от кетогенеза. Причина отставания: не хватает сукцинил-КоА и ЩУК, которые, в основном, являются продуктом обмена углеводов. |
Поэтому верно выражение: "Жиры сгорают в пламени углеводов". Это означает, что для эффективного использования продуктов распада жира необходимы продукты углеводного обмена: сукцинил-КоА и ЩУК. Таким образом, при углеводном голодании концентрация кетоновых тел в крови увеличивается. На 3-й день голодания концентрация кетоновых тел в крови будет примерно 2-3 ммоль/л, а при дальнейшем голодании - гораздо более высокой. Это состояние называют ГИПЕРКЕТОНЕМИЯ. У здоровых людей при мышечной работе и при голодании наблюдается гиперкетонемия, но она незначительна. Все кетоновые тела являются органическими кислотами. Их накопление приводит к сдвигу pH в кислую сторону. В клинике повышение концентрации кетоновых тел в крови называется "ГИПЕРКЕТОНЕМИЯ", а сдвиг pH при этом в кислую сторону - "КЕТОАЦИДОЗ". Нарушается работа многих ферментативных систем. Увеличение концентрации ацетоацетата приводит к ускоренному образованию ацетона. Ацетон - токсичное вещество (органический растворитель). Он растворяется в липидных компонентах клеточных мембран и дезорганизует их. Страдают все ткани организма, а больше всего - клетки нервной ткани. Это может проявляться потерей сознания (ГИПЕРГЛИКЕМИЧЕСКАЯ КОМА). В очень тяжелых случаях может наступить гибель организма. Организм пытается защититься, поэтому часть кетоновых тел удаляется с мочой. Появление кетоновых тел в моче - это КЕТОНУРИЯ. Для распознавания гипер- и гипогликемической комы применяется экспресс-диагностика кетоновых тел. |
Основана на том, что гиперкетонемия приводит к выведению кетоновых тел с мочой (кетонурия). Поэтому проводят цветную реакцию на наличие кетоновых тел в моче. Раньше диагноз ставили по запаху ацетона изо рта больного при гипергликемической коме ("запах гнилых яблок"). УТИЛИЗАЦИЯ КЕТОНОВЫХ ТЕЛ Происходит в митохондриях (кроме клеток печени). Бета-гидроксибутират превращается в ацетоацетат, а ацетоацетат вступает в реакцию с промежуточным продуктом ЦТК - сукцинил-КоА.
16. Ненасыщенные ЖК. Строение, физиологическая роль. Окисление ненасыщенных ЖК. Ненасыщенные ЖК имеют в своей структуре двойные или тройные углерод-углеродные связи, причем тройные связи встречаются крайне редко. Ненасыщенные жирные кислоты, в свою очередь, делятся на моноеновые, т.е. содержащие 1 кратную связь, и полиеновые - содержащие несколько кратных связей (диеновые, триеновые и т.д.). Все природные ненасыщенные жирные кислоты имеют стереохимическую цис-конфигурацию. Природные ненасыщенные жирные кислоты обычно имеют тривиальные названия: олеиновая, линолевая, линоленовая, арахидоновая и др. кислоты. Функции ЖК: 1) энергетическая функция, так как именно при их окислении выделяется основная масса энергии; |
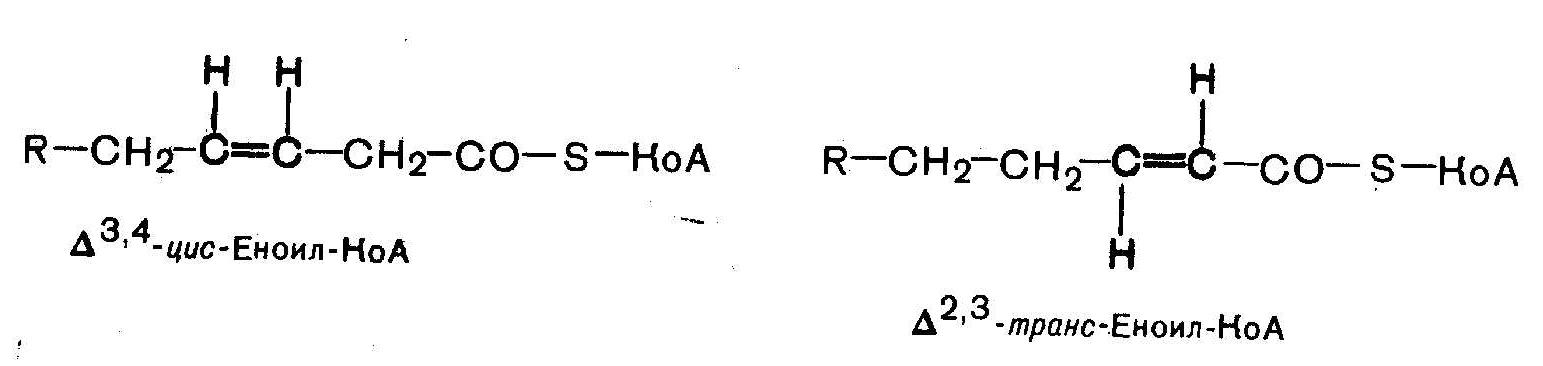
2)структурная функция, поскольку они входят в состав разнообразных более сложных по химическому строению липидов, таких как триацилглицерины или сфинголипиды; 3) пластическая; 4) ряд полиненасыщенных высших ЖК относятся к незаменимым компонентам пищи, поскольку они не синтезируются в организме. Обычно к эссенциальным высшим жирным кислотам относят линолевую, линоленовую и арахидоновую кислоты. При окислении ненасыщенных жирных кислот, например, олеиновой или пальмитоолеиновой, имеющаяся в их составе двойная углерод-углеродная связь постепенно смещается к карбоксильному концу молекулы и в результате нескольких циклов b -окисления образуется еноил-КоА в котором, во-первых, двойная связь находится между третьим и четвертым атомами углерода, а, во-вторых, эта двойная связь имеет цис-конфигурацию. Однако в клетках есть фермент из класса изомераз, который переводит двойную связь в углеродном радикале кислоты из положения 3,4 в положение 2,3 и изменяет цис-конфигурацию относительно двойной связи на транс-конфигурацию. За счет действия этой изомеразы преодолеваются стереохимические затруднения, возникающие при окислении ненасыщенных жирных кислот. |
|
|
22. Биосинтез триглицеридов. Синтез триглицеридов в тканях происходит с учетом двух путей образования глицерол-3-фосфата и возможности синтеза триглицеридов в стенке тонкой кишки из в-моноглицеридов, поступающих из полости кишечника в больших количествах после расщепления пищевых жиров. Существуют глицерофосфатный, дигидроксиацетонфосфатный и в-моноглицеридный пути синтеза триглицеридов. Большинство ферментов, участвующих в биосинтезе ТГ, находятся в эндоплазматическом ретикулуме, но некоторые, например глицерол-3-фосфатацилтрансфераза, находятся в митохондриях.
23. Гормональная регуляция липидного обмена. Липаза жировой ткани – является цАМФ-зависимым ферментом. Гормоны, увеличивающие концентрацию цАМФ, усиливают липолиз. Все гормоны, влияющие на мобилизацию жира, можно разделить на 2 группы Гормоны прямого действия (адреналин, соматотропный гормон гипофиза, инсулин). Гормоны косвенного действия (глюкокортикостероиды, половые гормоны, лептин). АДРЕНАЛИН Мембраны адипоцитов содержат адренорецепторы двух типов ( и ). Взаимодействие адреналина с рецепторами обоих типов вызывает изменение концентрации цАМФ. Однако, это влияние разнонаправленное. -адренорецептор связан с ингибирующим G-белком (Gi), связывающим понижение активности аденилатциклазы. Это приводит к уменьшению концентрации цАМФ, и, в конечном счете, торможению липолиза. -адренорецептор связан со стимулирующим G-белком (Gs) – эффектом будет стимуляция липолиза. Соотношение - и -адренорецепторов зависит от индивидуальных особенностей организма. Это касается как организма в целом, так и распределения этих рецепторов в разных частях тела – поэтому в процессе липолиза разные части тела у разных людей «худеют» неодинаково. Однако в целом у человека преобладают -адренорецепторы, поэтому суммарное действие адреналина приводит к активации липолиза. СОМАТОТРОПНЫЙ ГОРМОН – стимулирует липолиз, воздействуя через аденилатциклазную систему. Действие ИНСУЛИНА связано с повышением активности внутриклеточной фосфодиэстеразы, что приводит к снижению концентрации цАМФ и угнетению липолиза. Таким образом, он усиливает синтез жира и уменьшает скорость его мобилизации. |
ГЛЮКОКОРТИКОСТЕРОИДЫ: рецепторы к этим гормонам присутствуют в адипоцитах и содержат в своем составе белки теплового шока. После взаимодействия гормона с рецептором белки теплового шока отделяются, а сам комплекс транспортируется в ядро клетки, где влияет на синтез белков адипоцита. Конкретные механизмы влияния не до конца выяснены и находятся в стадии изучения. В итоге глюкокортикостероиды оказывают двоякое действие: на фоне мышечной работы они стимулируют липолиз, а в состоянии покоя – ингибируют его. Установлено, что при развитии опухоли коры надпочечников или при введении высоких доз препаратов глюкокортикостероидов, наблюдается рост жировых запасов на лице и в верхней части туловища (синдром Иценко-Кушинга). ПОЛОВЫЕ ГОРМОНЫ: точный механизм их воздействия на жировой обмен пока не выяснен, но известно, что действуют эти гормонов связано со стимуляцией синтеза определенных белков. Действие половых гормонов однонаправленное: стимуляция распада жира. Ярким примером является действие тестостерона. Кастрация приводит к увеличению запасов жира. ЛЕПТИН (от лат. Leptos – тонкий, худой). По химической природе – полипептид, синтезируется в адипоцитах. Лептин – гормон жировой ткани (поэтому жировую ткань можно отнести к эндокринным). Рецепторы к лептину расположены в гипоталамусе и в тканях репродуктивной системы. Лептин снижает выработку нейропептида Y, который вызывает повышение аппетита и усиливает синтез жира (точные механизмы воздействия пока неясны). Лептин также стимулирует выработку разобщающих белков бурого жира. Суммарный эффект лептина: снижение аппетита и усиление липолиза. Концентрация лептина в крови пропорциональна количеству жировых клеток. Поэтому, можно считать, что лептин передает в головной мозг информацию о количестве жира в организме. Лептин также усиливает репродуктивную функцию человека. В настоящее время ведутся работы над созданием рекомбинантного лептина для лечения ожирения.
|
24. Интеграция углеводного и липидного обмена В любой живой системе обмен липидов связан с обменом соединений других классов,например, обменом углеводов или аминокислот. Эти взаимосвязи можно проследить, воспользовавшись общей схемой обмена липидов: ┌─────── Пищевые липиды ───────┐ │ │ │ │ │ │ ┌─────│───> Высшие жирные кислоты <──│────────┐ Структурные │ │ │ Резервные липиды │ │ │ липиды ^ ^ │ │ ^ ^ │ └─────┼───────── Ацил-КоА ───────────┼────────┘ │ Глицерол │ │ ^ │ │ Аминоспирты <──┘ │ │ └───>Глицерол ^ │ │ ^ ├─────────────────> Ацетил-КоА <────────────────┤ │ ││ │ │ │ Глюкоза ││ │ │ Ацетоновые Глюкоза Аминокислоты СО + Н <─┘│ │ └─> тела Аминокислоты │ │ Стероиды <────┘ └─────> Полипреноиды
Из схемы следует, что пищевые липиды являются источниками высших жирных кислот, глицерола, аминоспиртов и некоторых других соединений, используемых организмом для синтеза свойственных для него структурных или резервных липидов. Свободные высшие жирные кислоты, наряду с глицеролом и аминоспиртами образуются в организме также при расщеплении резервных или структурных липидов. Еще одним источником высших жирных кислот может служить их синтез из ацетила-КоА, который в свою очередь может быть промежуточным продуктом обмена углеводов или аминокислот. Заметим, что жирные кислоты в клетках используются в различных метаболических путях клетки только в их активированной форме - в виде ацил-КоА. Одним из ключевых метаболитов липидного обмена является ацетил-КоА, поскольку, во-первых, именно через это соединение осуществляется окислительное расщепление высших жирных кислот; во-вторых, через ацетил-КоА атомы углерода жирных кислот могут быть использованы для пластических целей - для синтеза холестерола или полипреноидов; в третьих, через ацетил-КоА в гепатоцитах углеродные цепи жирных кислот преобразуются в ацетоновые тела гидрофильные "топливные" молекулы, легко транспортируемые в клетки различных органов и тканей; в четвертых, через ацетил-КоА осуществляются метаболические превращения углеродных скелетов аминокислот и моносахаридов в жирные кислоты, используемые в дальнейшем для синтеза более сложных липидных молекул.
|
Соединения других классов - аминокислоты и моносахариды – в ходе своего метаболизма образуют промежуточные продукты, которые могут в дальнейшем использоваться в клетке как для синтеза высших жирных кислот, так и для образования других мономерных единиц, необходимых для синтеза сложных липидов: глицерола, этаноламина, холина, сфингозина и пр. Таким образом, обмен липидов оказывается тесно связанным с обменом соединений других классов, а метаболические пути обмена липидов различных классов являются частью общей метаболической сети, функционирующей в организме. Известно, что в постабсорбционном состоянии основным энергетическим "топливом" для клеток являются высшие жирные кислоты, тогда как в период пищеварения, когда во внутреннюю среду организма поступают моносахариды и ресинтезированные в стенке кишечника триглицериды, основным энергетическим топливом становится глюкоза; более того, поступающая в клетки глюкоза превращается в жирные кислоты. Последний процесс особенно характерен для гепатоцитов и липоцитов. |
|
|
При поступлении глюкозы в клетки она в цитозоле окисляется до пирувата (см. следующую далее схему), последний проходит через внутреннюю мембрану митохондрий и окисляется в матриксе до ацетил-КоА. Образовавшийся ацетил-КоА конденсируется с оксалоацетатом (ЩУК) с образованием цитрата, а цитрат выходит из митохондрии в цитозоль. Поступивший цитрат, во-первых, служит источником ацетил-КоА и восстановительных эквивалентов для синтеза высших ЖК, а, во-вторых, активирует фермент ацетил-КоА-карбоксилазу, стимулируя тем самым образование малонил-КоА, также необходимого для синтеза высших жирных кислот. В результате при избытке глюкозы в клетке запускается синтез ЖК. Малонил-КоА в свою очередь угнетает перенос высших жирных кислот из цитозоля в матрикс митохондрий, ингибируя активность внешней ацетил-КоА: карнитин-ацилтрансферазы, выключая таким образом окисление высших ЖК. В итоге при поступлении глюкозы в клетку угнетается окисление высших жирных кислот, стимулируется их синтез, а потребность клетки в энергии покрывается за счет аэробного окисления глюкозы, чему способствует повышение концентрации ацетил-КоА и цитрата в матриксе митохондрий. Увеличение концентрации жирных кислот в клетке наряду с нарастанием концентрации в них триозофосфатов создает условия для синтеза резервных триглециридов. В этот процесс включаются также высшие ЖК и глицерол, поступающие в клетку в результате гидролиза триглицеридов ХМ и ЛПОНП. |
В постабсорбционном периоде, когда концентрация глюкозы в клетках снижается, поток цитрата из митохондрий в цитозоль уменьшается, в результате в цитозоле уменьшается концентрация ацетил-КоА и инактивируется ацетил-КоА-карбоксилаза. Снижается содержание малонил-КоА, что приводит как к прекращению синтеза высших жирных кислот, так и к снятию ингибирования ацил-КоА: карнитин-ацилтрансферазы и восстановления транспорта жирных кислот в матрикс митохондрий, где они начинают окисляться. Таким образом, в условиях недостатка глюкозы в клетках выключается синтез высших жирных кислот и включается их b-окисление, которое и становится основным источником свободной энергии в клетках.
|
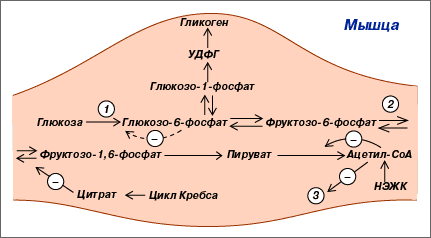
25. Жиро-углеводный цикл Рэндла. Цикл глюкоза — свободные жирные кислоты — цикл Рэндла — является одним из механизмов, обеспечивающих гомеостаз глюкозы. Повышенное окисление свободных жирных кислот в мышечной ткани приводит к истощению запасов НФД+, что способствует ингибированию цикла Кребса и увеличению внутриклеточного содержания цитрата и ацетил-СоА. Последний в свою очередь угнетает активность пируватдегидрогеназы, вследствие чего пируват конвертируется в лактат или аланин. Повышенное содержание цитрата, которое образуется в цикле Кребса из ацетил-СоА и оксалоацетата, угнетает активность фосфофруктокиназы, способствуя повышению концентрации глюкозо-6-фосфата, ингибируя гексокиназу, снижая утилизацию глюкозы и соответственно гликолиз.
Схема 7. Цикл глюкоза — свободные жирные кислоты (цикл Рэндла) в мышце. 1— гексокиназа; 2 — фосфофруктокиназа; 3 — пируватдегидрогеназа |
26. Цикл ТГ-жирные кислоты. Его механизм и физиологическая роль.
|
|
|
27. Стеаторея, причины ее вызывающие. При отсутствии желчи (или недостатке в ней желчных кислот) жиры перестают абсорбироваться и выделяются с калом, который вместо обычного коричневого, становится белого или серого цвета жирной консистенции. Такое состояние называется стеаторея, её следствием является отсутствие в организме важнейших жирных кислот, жиров и витаминов, а также патологии нижних отделов кишечника, которые не приспособлены к столь насыщенному непереваренными жирами химусу. При стеаторее время внутриполостной активности фермента липазы становится меньше, и недостаток ее не компенсируется внепанкреатическими механизмами. Как нарушение пищеварения, так и нарушение всасывания вызывают стеаторею. Нарушение пищеварения может быть следствием недостаточной секреции желчи или панкреатической липазы, нарушение всасывания обычно бывает вызвано поражением кишечника. При секреторной недостаточности поджелудочной железы нарушение переваривания жиров может быть следствием недостаточной продукции липазы, например, после резекции поджелудочной железы, при хроническом панкреатите, обструкции протока поджелудочной железы камнем или опухолью. |
28. Роль печени в липидном обмене. Ферментные системы печени способны катализировать все реакции или значительное большинство реакций метаболизма липидов. Совокупность этих реакций лежит в основе таких процессов, как синтез высших ЖК, триглицеридов, фосфолипидов, холестерина и его эфиров и т.д. 1) Основным местом образования плазменных пре-β-липопротеинов (ЛПОНП) и α-липопротеинов (ЛПВП) является печень. 2)Кетоновые тела образуются в печени в ходе β-гидрокси-β-метилглутарил-КоА пути. 3)В печени происходит интенсивный распад фосфолипидов, а также их синтез. При недостаточном образовании или недостаточном поступлении в печень холина синтез фосфолипидов из компонентов нейтрального жира становится либо невозможным, либо резко снижается и нейтральный жир откладывается в печени. В этом случае говорят о жировой инфильтрации печени, которая может затем перейти в ее жировую дистрофию. 4) Часть холестерина поступает в организм с пищей, но значительно большее количество его синтезируется в печени из ацетил-КоА. Биосинтез холестерина в печени подавляется экзогенным холестерином, т.е. получаемым с пищей. В печени холестерин может взаимодействовать с ЖК (в виде ацил-КоА) с образованием эфиров холестерина. Синтезированные в печени эфиры холестерина поступают в кровь, в которой содержится также определенное количество свободного холестерина. |
29 Жировая инфильтрация и дегенерация печени. Возникает при накоплении в гепатоцитах ТГ. Этиологическими факторами явл-ся: Алкоголизм, сахарный диабет, первичная гиперлипопротеинемия (ГЛП) типа IV и V, хроническая кислородная недостаточность, анемия, интоксикации, внутрипеченочный холестаз, вирусный гепатит. Предрасполагающими факторами являются избыточный вес, подагра, гликогенозы, порфирии, галактоземия. Отсутствие или недостаточность в гепатоцитах мет, холина, этаноламина, фактора метилирования- SAM (сульфоаденозинметионина) нарушает биосинтез фосфолипидов (ФЛ ), что и является причиной накопления ТГ.
|
30 Ожирение. Это состояние характерно, прежде всего, для жителей развитых стран, у которых на 100% выше вероятность преждевременной (раньше, чем средняя продолжительность жизни) смерти. У людей с избыточным весом эта вероятность выше на 10% - 25%. С проблемой ожирения тесно связаны вопросы гуморальной регуляции синтеза и распада ТГ в жировой ткани. Ожирение развивается тогда, когда поступление в организм энергосубстратов превышает расходование энергии. Среди причин развития этого состояния, включающих генетические и средовые факторы, Важнейшее значение имеют состав принимаемой пищи и специфические регуляторы энергетического баланса. Одним из таких соединений является продукт экспрессии так называемого гена ожирения (ob - гена) – лептин. Лептин является белком, состоящим из 167 аминокислот. Местом синтеза лептина являются адипоциты, в гораздо меньшей степени – эпителиальные клетки желудка и плаценты. Причем, чем больше в этих клетках накапливается ТГ, тем больше там образуется лептина. Действие лептина на депонирование ТГ в жировой ткани опосредовано его влиянием на гипоталамические центры, контролирующие поведение и чувство голода, температуру тела и энергозатраты. |
|
|
31. Гиперхолестеринемия. Гиперхолестеринемия (ГПЕ) – повышенный уровень холестерина в крови. Относится к первичным нарушениям липидного обмена. Пример заболевания ГПЕ: семейная гиперхолестеринемия – при этом заболевании в организме нарушен синтез рецепторов для ЛПНП, в результате чего нарушена утилизация этих липопротеидов. В крови таких больных повышено содержание ЛПНП и холестерина. Тяжесть заболевания в значительной мере зависит от того, один или оба гена белков-рецепторов ЛПНП дефектны. При дефекте одного из генов в клетках имеется половинное количество рецепторов для ЛПНП, если дефектны оба гена – рецепторов для ЛПНП вообще нет. Виды ГПЕ: а) неосложненный (физическое старение, старость, смерть)- накопление ХС в плазматических мембранах, как результат снижения стероидогенеза (секс-гормонов); б) осложненный (атеросклероз) в форме ИБС (инфаркт миокарда, кардиосклероз), ишемии мозга (инсульт, тромбоз), ишемии конечностей (гангрена), ишемии органов и тканей, дегенерации брадитрофных структур (катаракта, остеохондроз), связанный с уменьшением желчегенеза. Атеросклероз — это патологическое состояние, при котором происходит отложение липидов в стенке сосудов средних и больших размеров. Коэффициент атерогенности (Ка) - расчетный показатель степени риска развития атеросклероза у человека. Определяется по количеству в крови ЛПНП, ЛПВП, общего холестерина. В норме показатель менее 3-х. Ка = холестерин ЛПНП + холестерин ЛПОНП/холестерин ЛПВП.
|
32. Дислипопротеинемии – изменение соотношения классов ЛП в крови (нарушение липидного профиля плазмы) – это гипо- и гиперхолестеринемии. Классификация дислипопротеинемий: выделяют следующие типы: I тип — нормальный или несколько повышенный уровень ОХС, резко повышенный уровень ТГ; IIA тип — резко повышенный уровень ОХС, нормальное содержание ТГ; IIB тип — резко повышенный уровень ОХС и умеренно повышенный уровень ТГ; III тип — резко повышенные уровни ОХС и ТГ; IV тип — нормальное или умеренное содержание ОХС, повышенная концентрация ТГ; V тип — нормальный или несколько повышенный уровень ОХС, резко повышенный уровень ТГ на фоне сахарного диабета. Наиболее высокий индекс атерогенности отмечают при IIB типе. ДЛП III типа часто ассоциируется со смешанным атеросклерозом, ДЛП IIB и IV типа — с ожирением, снижением уровня тестостерона в крови, повышением содержания кортизола. ДЛП IIA, IIB, III и IV типа, как правило, сопровождаются гиперинсулинемией. Классификация по Фредриксону: первичные наследственные гипо- и приобретенные вторично состояния. Наиболее распространены гиперлипопротеидемии с повышением уровней общего холестерина, холестерина ЛПНП и триглицеридов. |
33. Липидозы, причины возникновения, прогноз. Липидозы (липоидозы) – наследственные заболевания НС, обусловленные расстройством обмена липидов. В основе патогенеза липидозов – генетически детерминированные разнообразные ферментативные дефекты, которые приводят к тяжелым нарушениям в организме. Условно эти заболевания подразделяются на болезни накопления (внутриклеточные липидозы, при которых преимущественно поражаются нервные клетки, и вторично – проводящие пути) и лейкодистрофии (прогрессирующий распад белого вещества). В основе Л. лежит полная или частичная недостаточность лизосомальных ферментов, участвующих в обмене липидов и обусловленная наследственным дефектом соответствующего гена. Большинство Л. наследуется по аутосомно-рецессивному типу, исключение составляет болезнь Фабри, которая наследуется по Х-сцепленному, рецессивному типу. К болезням накопления (внутриклеточным липидозам) относятся амавротическая идиотия, болезнь Ниманна-Пика, болезнь Гоше и болезнь Рефсума. Патология липидного обмена возникает по двум причинам: а) при нарушении переваривания и всасывания липидов; б) при нарушении метаболизма липидов и липопротеидов. В основе нарушения переваривания и всасывания липидов лежат три группы патологических процессов: 1) в поджелудочной железе, сопровождающиеся дефицитом панкреатической липазы; 2) в печени- при закупорке желчных протоков и фистуле желчного пузыря, приводящие к дефициту желчи; 3) в кишечнике, сопровождающиеся снижением метаболической активности слизистой оболочки, где локализованы ферменты синтеза ТГ. В соответствии с этим различают панкреатическую, гепатогенную и энтерогенные формы стеаторей. |
Стеаторея – нарушение переваривания жиров. Панкреатическая стеаторея вызывается дефицитом панкреатической липазы, что наблюдается при хроническом панкреатите, врожденной гипоплазии поджел. жел. и муковисцедозе, когда наряду с другими железами поражена и поджелудочная железа. Гепатогенная стеаторея наблюдается при врожденной атрезии желчных путей, механических желтухах, гепатитах, циррозе. Энтерогенная стеаторея отмечается при абеталипопротеинемии, интестинальной лимфангиэктазии, интестинальной липодистрофии, амилоидозе и обширной резекции тонкого кишечника. При переваривании пищевых жиров в пищеварительном тракте высвобождаются моноглицериды и высшие ВЖК, которые после всасывания образуют ТГ. Последние являются основными компонентом хиломикронов. Липиды, являясь гидрофобными, транспортируются кровью в виде особых надмолекулярных образований – липопротеидов(ЛП), в состав которых входят ХС, ТГ, ФЛ (фосфолипиды) и апобелки. Диагностическое значение имеет определение в крови содержания ТГ, СЖК, ХС, желчных кислот, ФЛ и ЛП а также состав последних. |
|
|
34. ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ МЕМБРАН. Механизм возникновения. Реакции, метаболиты в норме и при патологии. Незначительная
часть кислорода, поступающего из
воздуха в организм, превращается в
активные формы – свободные радикалы,
обладающие высокой химической
активностью, вызывающие окисление
белков, липидов, нуклеиновых кислот.
Чаще всего окислению подвергается
липидный слой биологических мембран.
Такое окисление называется перекисным
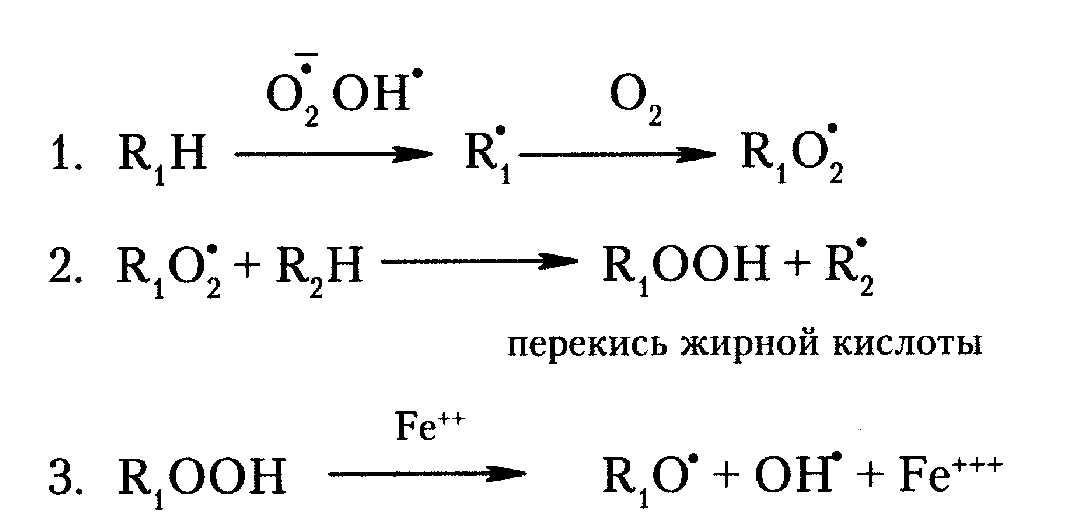
окислением липидов (ПОЛ). Процесс ПОЛ включает 3 стадии: 1. Зарождение цепи: образуется свободный радикал ЖК, который взаимодействует с молекулярным кислородом, приводит к образованию перекисного радикала ЖК (R1O2); 2. Продолжение цепи: Свободнорадикальной атаке подвергается рядом расположенная ненасыщенная к-та (R2), в результате чего она превращается в новый свободный радикал (R2*), а R1O2 восстанавливается в перекись ЖК – R1OOH; 3.Разветвление цепи – это процесс возникновения новых свободных радикалов ЖК и гидроксильного радикала (OH*). Для протекания р-ии требуется присутствие металлов переменной валентности (в первую очередь, железа, меди). |
Процесс ПОЛ протекает в норме на стационарном уровне, поддерживаем системами антиоксидантной защиты. Именно таким способом разрушаются клеточные мембраны погибающих, стареющих клеток и биомембраны в очагах воспаления. Важнейшее значение имеет реакции ПОЛ при ферментативном синтезе простагландинов с помощью цикло- и липооксигеназ. Высокореакционные свободные радикалы, перекиси жирных кислот и конечные продукты ПОЛ (напр., малоновый диальдегид; Они счит. эндогенными радиотоксинами (сниж. значительно радиорезистентность животных при их облучении) и канцерогенами) способствуют образованию межмолекулярных сшивок (белок-липид, липид-липид), ограничивающих подвижность мембранных белков и нарушают их функции. В мембране образуются гидрофобные поры, что приводит к высвобождению кальция (нарушение сократительной способности сердечной мышцы) и выходу лизосомных ферментов (аутолиз клетки). Уменьшение запасов антиоксидантов, витамин (токоферола, ретинола), происходит окисление SH-групп белков, пептидов (глутатиона) и важнейших небелковых соединений (липоевой к-ты, пантотеновых к-ты, Ko-SH и др.). Так же частично разобщается окислительное фосфорилирование, что приводит к энергетическому голоданию тканей. Деполимеризуется межуточное вещество соед. ткани. Все эти процессы в конеч. итоге приводят к гибели клеток. |
Свободные радикалы кислорода могут обладать полезными действием, участвуя в формировании клеточного иммунитета, индукции апоптоза, процессе самообновления биомембран и синтезе простагландинов. ПАТАЛОГИЯ. Кол-во свобод. радикалов резко возрастает при облучении (в том числе и УФ-лучами). Радиация сопровождается массовой ионизацией молекул на пути следования радиоактивной частицы за счет «выбивания» электрона с внешней орбитали молекулы. Электроны захватываются кислородом с образованием О2* и других свободных радикалов кислорода, включая каскад цепных реакций и ПОЛ. Инициация ПОЛ вызывается даже единичными радикалами. О2* реагирует с пероксидом водорода и другими пероксидами, приводя к образ-ю крайне агрессивных радикалов: После
воздействия летальных доз уже через
4 ч, но этому предшествует ингибирование
митохондриальных ферментов. Свободно радикальная патология – это курение, рак, ишемия, гипероксия, старения, диабет, т.е. при всех практически заболеваниях имеет место неконтролируемое образование свободных радикалов кислорода и интенсификации ПОЛ. |
35. Биосинтез ненасыщенных ЖК. Синтез ненасыщенных жирных кислот из насыщенных с параллельным удлинением цепи. Десатурация проходит под действием микросомального комплекса ферментов, состоящего из трех компонентов белковой природы: цитохрома b5, цитохром b5-редуктазы и десатуразы, которые содержат в своем составе негемовое железо. В качестве субстратов используются НАДФН и молекулярный кислород. Из этих компонентов образуется короткая цепь переноса электронов, с помощью которой на короткий период времени в молекулу жирной кислоты включаются гидроксильные группы. Затем они отщепляются в виде воды, в результате в молекуле жирной кислоты формируется двойная связь. Элонгация происходит путем добавления двухуглеродного фрагмента к карбоксильному концу жирной кислоты. Имеется две раздельных системы элонгации в микросомах и митохондриях.
|
|


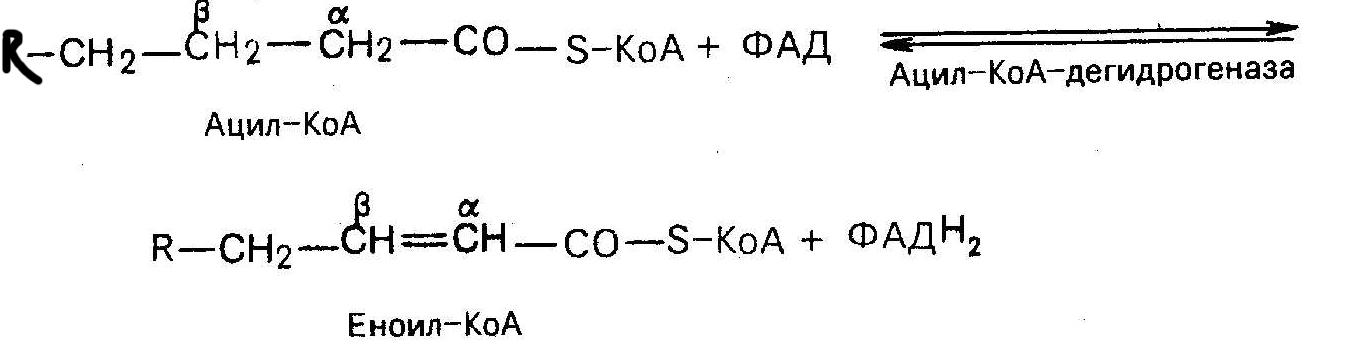
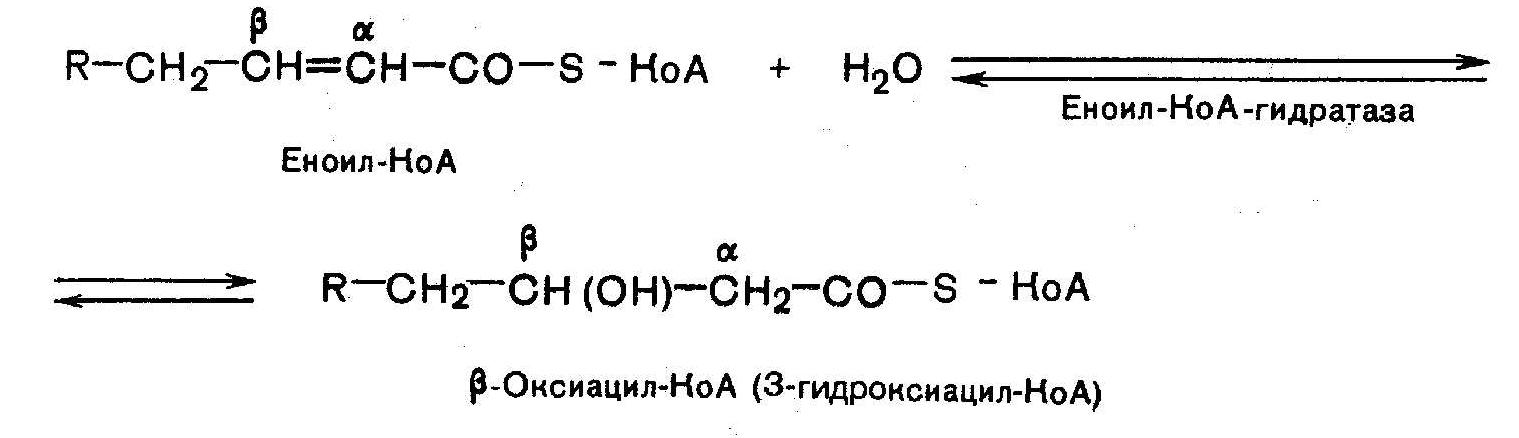

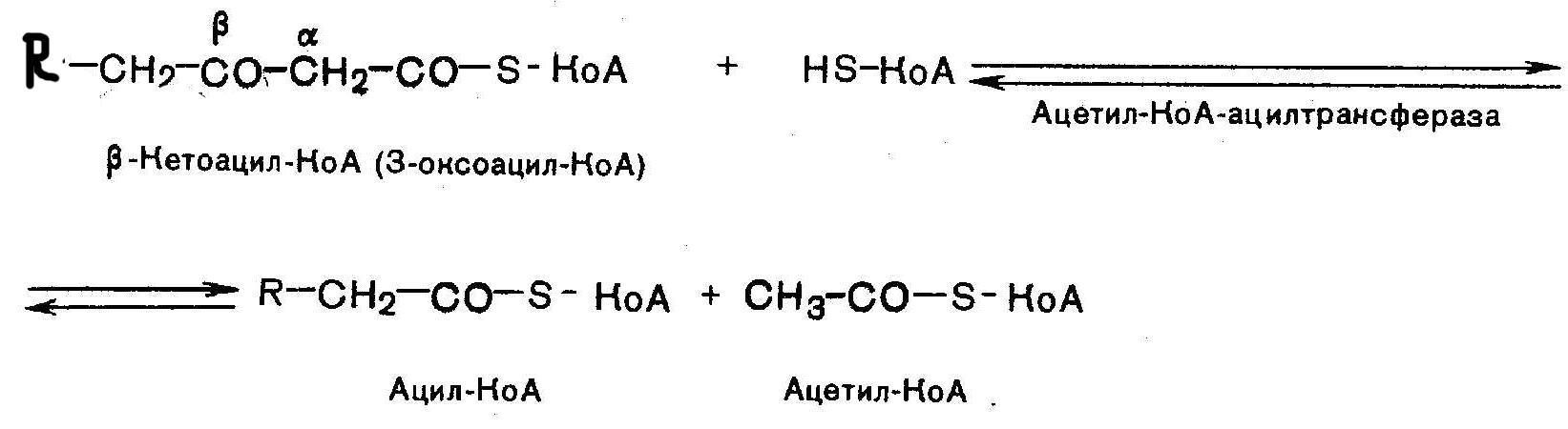
 Окисление
ненасыщенных ЖК
Окисление
ненасыщенных ЖК