
Лекция № 8 Оксосоединения
План
8.1. Общая характеристика оксосоединений (карбоксильных соединений)
8.2. Реакции нуклеофильного присоединения в ряду альдегидов и кетонов
8.3. Реакции окисления и восстановления органических соединений
8.1. Общая характеристика оксосоединений
К карбоксильным соединениям относят соединения, содержащие группу

С = О: альдегиды, кетоны, карбоновые кислоты.
= О: альдегиды, кетоны, карбоновые кислоты.
В альдегидах карбонильняа группа связана по крайней мере с одним атомом водорода
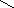 R — C
R — C
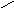
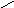 Н, в кетонах – с
двумя радикаламиR—C—R′,в
карбоновых кислотах она входит в состав
карбоксильной группы
Н, в кетонах – с
двумя радикаламиR—C—R′,в
карбоновых кислотах она входит в состав
карбоксильной группы
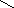 R— С
R— С
ОН
Альдегиды. Классификация.
В зависимости от радикала различают предельные и ароматические альдегиды.



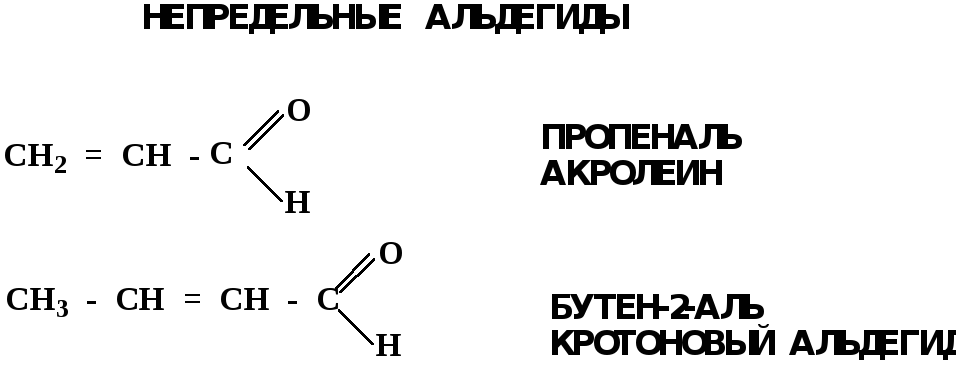
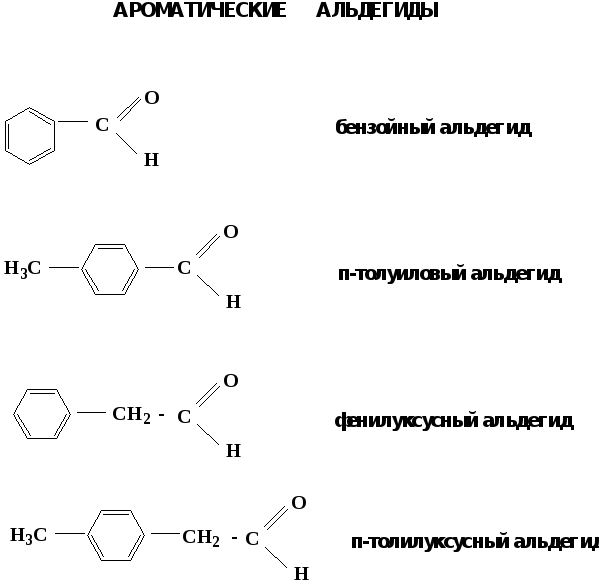
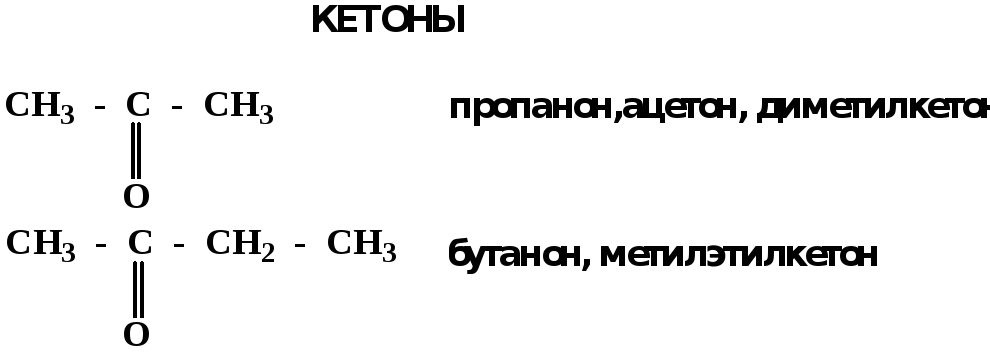
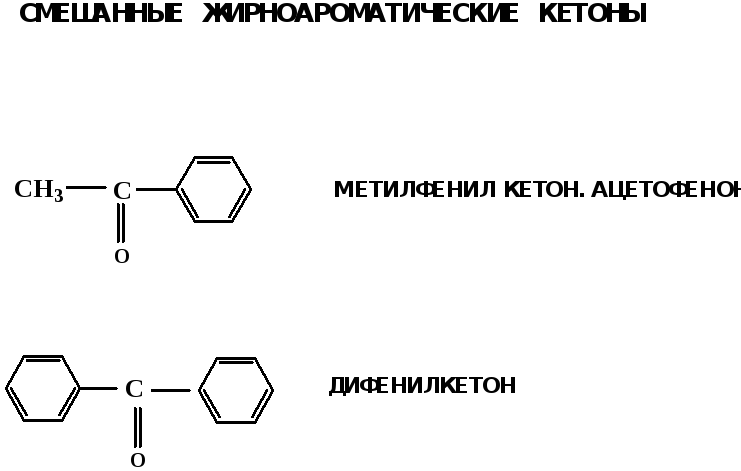
Электронное строение карбонильной группы характеризуется наличием 3δ и 1π связи. Двойная связь в оксогруппе существенно отличается от двойной связи в алкенах тем, что она сильно поляризована.
Для альдегидов и кетонов, имеющих атом углерода в sр2-гибридизации характерны реакции АN.
Рассмотрим реакционные центры в молекулах альдегидов и кетонов.
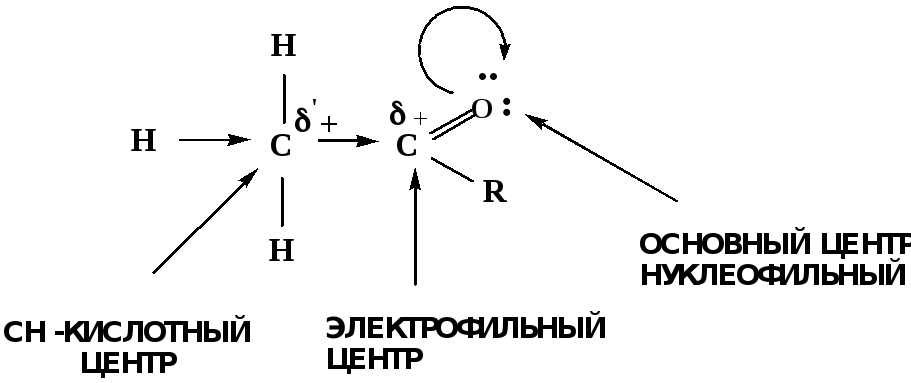
Атом углерода карбонильной группы является электрофильным центром и представляет собой удобный центр для атаки нуклеофилом.
Легкость нуклеофильной атаки зависит:
1) от величины эффективного положительного заряда на карбонильном атоме углерода;
2) от пространственной доступности атома углерода в карбонильной группе;
3) от кислотно-основных свойств среды.
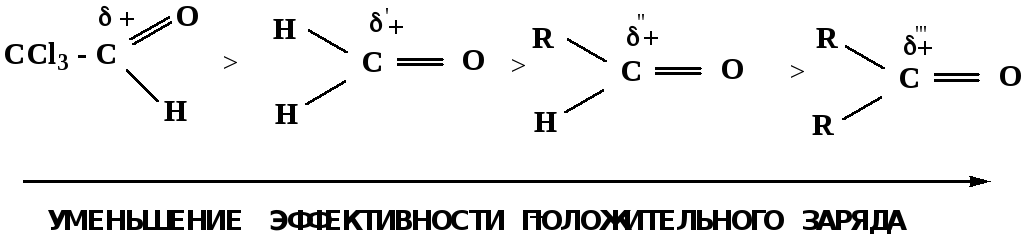
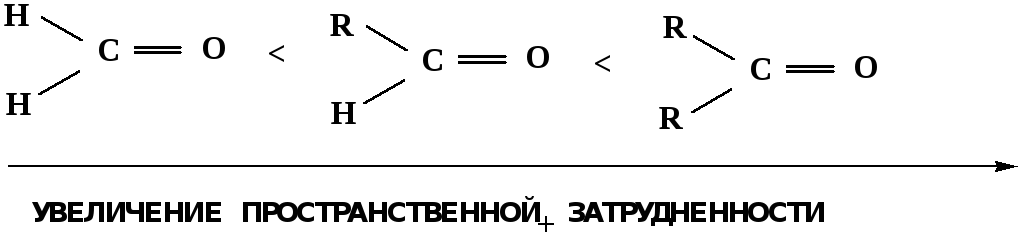
Исходя из этого понятно, что легче вступают в реакции АNальдегиды, а из них – формальдегид.
8.2. Реакции аn в ряду альдегидов и кетонов
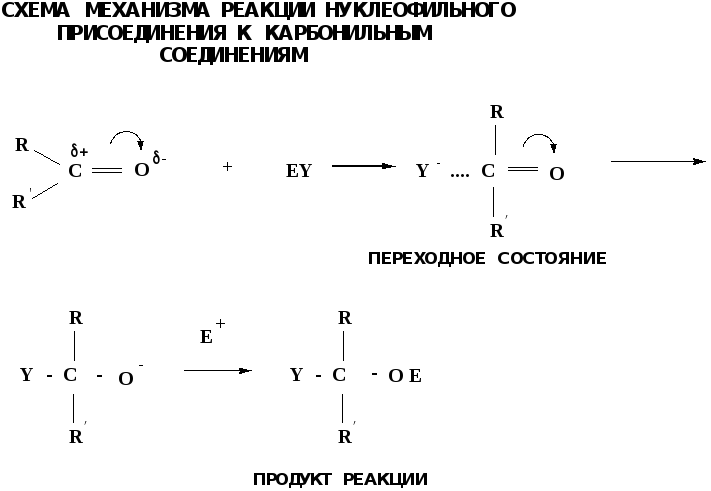
Примеры реакции АN
1) Гидратация
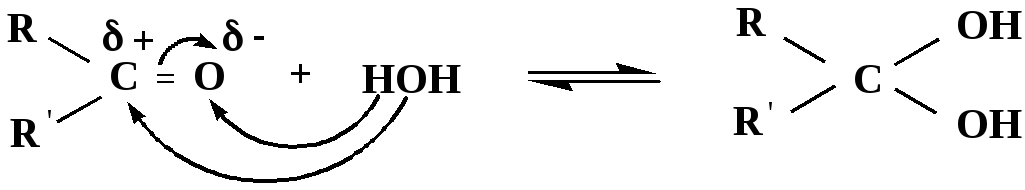
гидраты альдегидов и кетонов
Гидраты альдегидов и кетонов в свободном виде выделить, как правило, не удается, т.к. равновесие этой реакции сдвинуто влево. Однако, такой альдегид, как трихлоруксусный альдегид удалось прогидратировать.
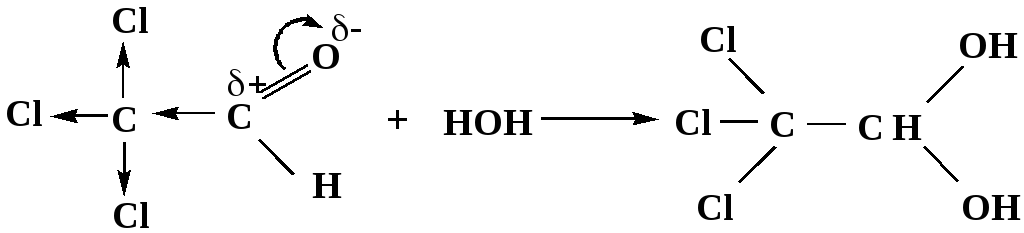
Хлораль
Хлораль гидрат используется в медицине в качестве успокаивающего, снотворного средства.
Аналогично возможно образование стабильного гидрата – нингидрина, который используется для обнаружения аминокислот, пептидов, белков в медико-биологических исследованиях.
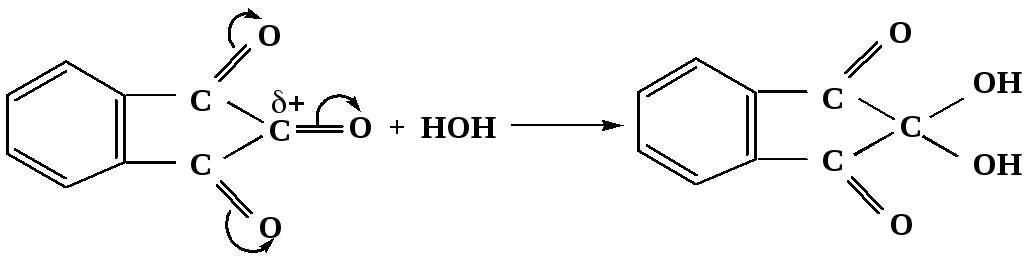
Индантрион-1,2,3 Нингидрин
2) Ацетализация – присоединение спиртов. Реакция протекает в кислой среде с образованием полуацеталей, при избытке спирта образуются ацетали.
 Ацеталь
Ацеталь
Механизм реакции образования полуацеталей
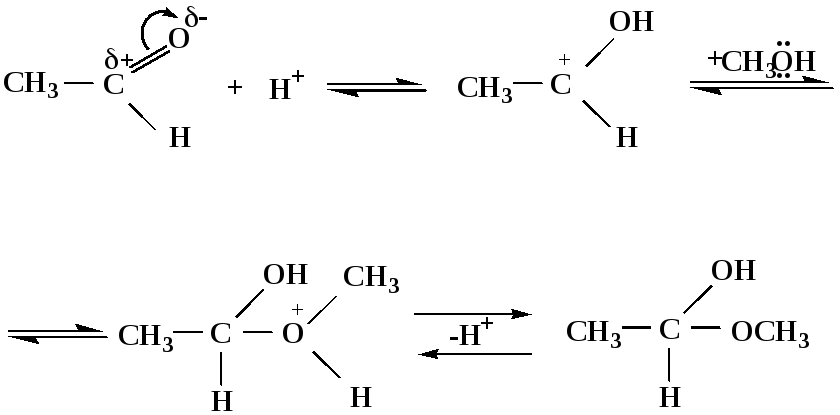
оксонитовый катион метилацеталь уксусного альдегида
Механизм реакции образования ацеталей
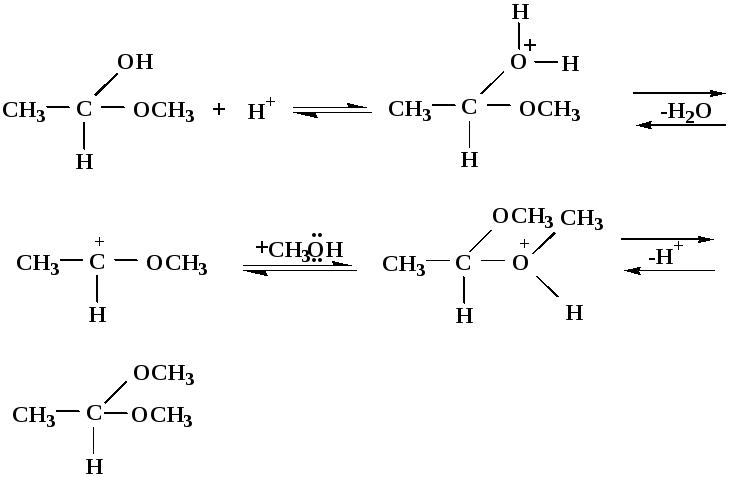 диметилацеталь
уксусного альдегида
диметилацеталь
уксусного альдегида
1,1-диметоксиэтан
Реакция образования полуацеталей и ацеталей обратима в кислой среде. В щелочной среде R – О―–с. 8…ион более трудноуходящая группа, чем гидроксид ион.
Гидролиз полуацеталей и ацеталей в кислой среде механизм реакции
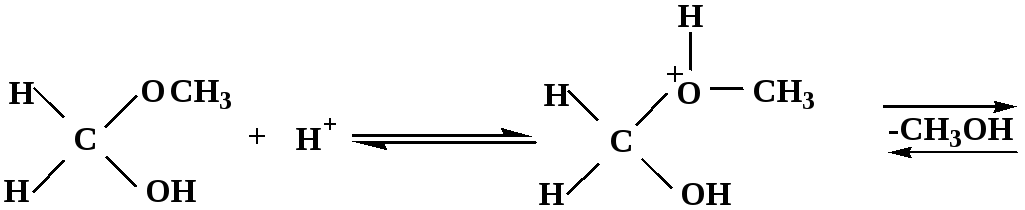
метилацеталь
муравьиного
альдегида
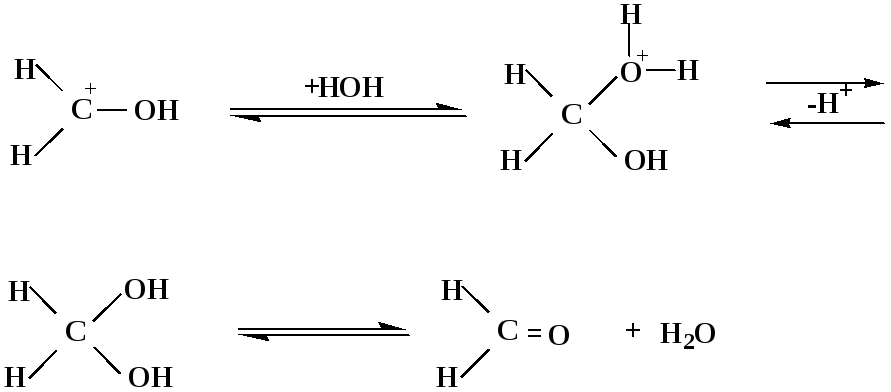
гидратная форма,
очень неустойчива
Если альдегидная и спиртовая группы находятся в одной молекуле, то за счет внутримолекулярной реакции может образовываться циклический полуацеталь.

циклический полуацеталь
4-оксибутаналя
Эта реакция имеет большое значение в химии углеводов.
3. Присоединение тиолов
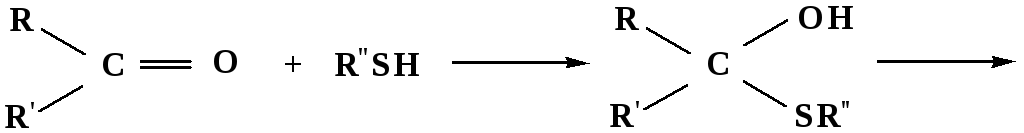
полуацеталь
тиоацеталь
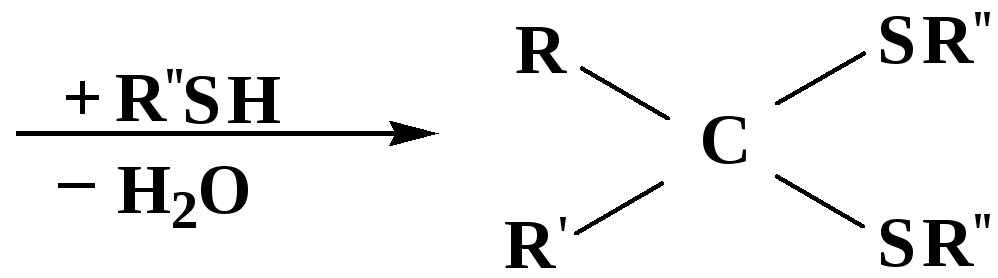
меркаптиль
дитиоацеталь
4. Присоединение аммиака, аминов и их производных протекает в 2 стадии: 1 стадия – нуклеофильное присоединение по карбонильной группе. 2 стадия – отщепление воды. Поэтому эти реакции получили название – реакции присоединения отщепления.
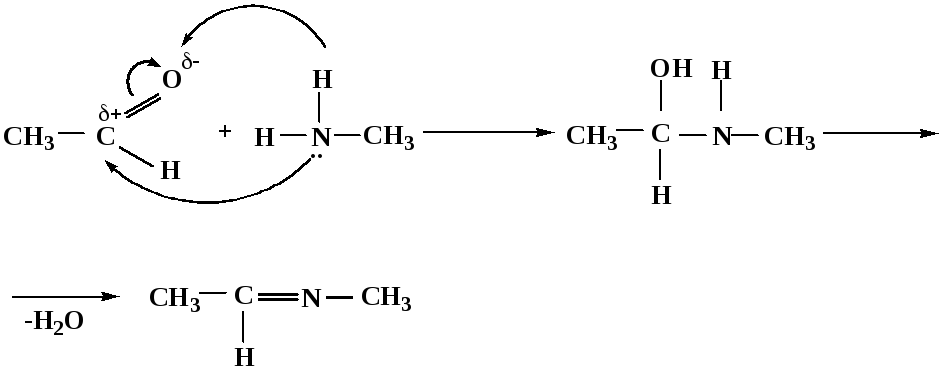
замещенный имин метилимин
уксусного альдегида
