
- •Методическая разработка
- •Коагуляция золя гидроксида железа (III) под влиянием электролитов
- •Коагуляция золя берлинской лазури под влиянием электролитов
- •Методы получения золей
- •Получение золей методом химической конденсации
- •Строение коллоидной мицеллы Рассмотрим строение мицеллы AgI в избытке ki:
- •Коагуляция лиофобных золей
Методы получения золей
Гидрофобные золи получают 2-мя методами:
I метод диспергирования или дисперсионный (дробление);
II метод конденсации (укрупнения).
Методы диспергирования осуществляются путем механического, электрического или ультразвукового дробления веществ до размеров коллоидных частиц. Для этих целей используют специальные коллоидные мельницы.
Конденсационные методы основаны на переходе молекулярных и ионных растворов в коллоидные путем образования труднорастворимых веществ в результате химических реакций или изменения физических условий среды.
К методам конденсации относятся:
1) химические методы (гидролиз, реакция двойного обмена, окисление-восстановление);
2) методы замены растворителя, когда дисперсионная среда, в которой вещество дисперсной фазы образует молекулярный раствор, заменяется средой, в которой вещество нерастворимо.
Получение золей методом химической конденсации
Реакции обмена:
AgNO3 + KI = AgI + KNO3
4 FeCl3 + 3 K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12 KCl
2) Гидролиз соли: FeCl3 + 3 H2O = Fe(OH)3 + 3 HCl
При получении золей методом химической конденсации соблюдаются следующие условия:
1) золи получают при смешивании очень разбавленных растворов реагирующих веществ (например, AgI), т.к. при более высокой концентрации в эквивалентных количествах образуются осадки;
2) для получения золя необходим стабилизатор. При химических методах получения коллоидных систем в качестве стабилизатора выступают продукты реакции.
Строение коллоидной мицеллы Рассмотрим строение мицеллы AgI в избытке ki:
AgNO3 + KI изб. → АgI ↓ + KNO3
Если одно из исходных веществ взято в небольшом избытке, то оно служит стабилизатором, т.е. сообщает устойчивость коллоидным частицам AgI. Коллоидная частица имеет сложную структуру и состоит из агрегата (совокупность большого количества молекул). Ионы I- будут продолжать достраивать кристаллическую решетку агрегата, сообщая ему электрический заряд. Этот ион называется потенциалопределяющим ионом (ПОИ). Затем начинают адсорбироваться противоионы К+ (ПРИ). Основная часть всех противоионов, адсорбированная на ядре коллоидной частицы, образует вместе с пои адсорбированный слой, а часть противоионов (10%) уходят в объем растворителя и образуют диффузный слой.
Схематически строение мицеллы AgI при избытке KI выразится так:
{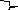 m
(AgI).
n I‾ .
(n – x) K+}xˉ
.
x K+
m
(AgI).
n I‾ .
(n – x) K+}xˉ
.
x K+
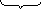
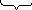
агрегат пои при диффузный
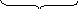 слой
слой
я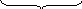 дро
дро
адсорбционный
с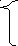
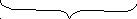 лой
лой
к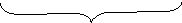 оллоидная
частица
оллоидная
частица
мицелла (электронейтральна)
Коллоидная частица с диффузным слоем образует мицеллу: m – число молекул иодида серебра в ядре
n – число потенциалопределяющих ионов I‾
(n – x) – число связанных противоионов К+, входящих в адсорбционный слой
х – число ионов К+, входящих в диффузный слой.
Коагуляция лиофобных золей
КОАГУЛЯЦИЯ – процесс укрупнения коллоидных частиц за счет слипания под влиянием молекулярных сил притяжения.
Этому процессу препятствует наличие у коллоидных частиц одноименного заряда. Чтобы вызвать коагуляцию золя, необходимо нейтрализовать заряд коллоидной частицы, тогда частицы будут сталкиваться и слипаться. Коагуляцию золя можно вызвать различными способами, легче всего при помощи электролитов.
При коагуляции золей электролитами происходит сжатие диффузного слоя, что позволяет коллоидным частицам подходить друг к другу на расстояние, на котором уже действуют силы межмолекулярного притяжения.
Различают 2 стадии коагуляции: скрытую и явную. При явно коагуляции изменяется окраска золя за счет укрупнения частиц, появляется муть, а дальше происходит седиментация – свободное оседание агрегатов коллоидных частиц под действием силы тяжести.
Для наступления явной коагуляции концентрация электролита должна быть равна или больше порога коагуляции золя.
Коагулирующая способность электролитов характеризуется ПОРОГОМ КОАГУЛЯЦИИ (γс), т.е. минимальной концентрацией электролита в милимолях на 1 л золя, при которой начинается явная коагуляция. Обратная величина порога коагуляции называется КОАГУЛИРУЮЩИМ ДЕЙСТВИЕМ (1/γс).
Коагулирующим действием обладает только тот ион электролита, который имеет заряд, противоположный заряду коллоидной частицы.
Например, на положительно заряженный золь железа гидроксида коагулирующее действие оказывают анионы, а на отрицательно заряженный золь Fe4[Fe(CN)6]3 (берлинской лазури) – катионы.
Коагулирующая способность иона тем больше, чем выше его валентность.
ПРАВИЛО ШУЛЬЦЕ-ГАРДИ (правило значности) гласит: из 2-х ионов электролита коагулирующим действием обладает тот, знак которого противоположен знаку заряда коллоидных частиц, причем это действие тем сильнее, чем выше валентность коагулирующего иона.
Зависимость между порогом коагуляции (γс) и валентностью (Z) коагулирующего иона выражается уравнением:
![]()
где γс – порог коагуляции
Z – валентность
а – коэффициент пропорциональности.
По теории Дерягина, порог коагуляции изменяется обратно пропорционально валентности коагулирующего иона в шестой степени:
![]()
6. вопросы ДЛЯ САМОконтроля знаний:
Записать формулы мицелл золей, полученных при реакциях обмена:
CaCl2 + Na2CO3 → CaCO3 + 2 NaCl
а) при избытке CaCl2;
б) при избытке Na2CO3.
Какие ионы электролита-коагулятора будут коагулировать данный золь: K+, Na+, Ca2+, Cl‾, Al3+, [Fe(CN)6]3‾, [Fe(CN)6]4‾? Расположить выбранные ионы в лиотропные ряды.
Определите, к какому электроду должны перемещаться частицы золя, полученного по реакции при небольшом избытке H2S:
2 H3AsO3 + 3 H2S → As2S3 + 6 H2O
Золь AgBr получен смешиванием 25 мл 0,008 н. раствора KBr и 18 мл 0,0096 н. раствора AgNO3. Определить знак заряда частиц и написать схему строения мицеллы золя. Назвать составные части мицеллы.
7. ЛИТЕРАТУРА
основная:
1. Конспект лекций.
2. Ю.А. Ершов и др. "Общая химия", М., "Высшая школа", 2005, с. 491-526;
3. Захарченко В.Н. "Коллоидная химия", М., "Высшая школа", 1989 г., с. 81-158;
ДОПОЛНИТЕЛЬНАЯ:
1. М.И. Равич-Щербо, В.В. Новиков "Физическая и коллоидная химия", М., 1975, стр. 175-187;
2. В.Н. Захаренко "Коллоидная химия", М., 1989, стр. 4-17, 102-106;
3. К.И. Евстратова "Практикум по физической и коллоидной химии", М., 1990, стр. 187-190, 199-200;
4. К.И. Евстратова и др. "Физическая и коллоидная химия", М., 1990, стр. 366-370, 396-440.
Авторы: Зав. кафедрой, доцент, к.х.н. Лысенкова А.В., доцент, к.х.н. Филиппова В.А., ст. преподаватели Прищепова Л.В., Чернышева Л.В., Одинцова М.В., ассистенты Короткова К.И., Перминова Е.А.
03.09.2010
