
- •Міністерство освіти і науки україни
- •Квантові числа
- •Розподіл електронів в атомі, електронні й електронно-графічні формули елементів
- •1S 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d.
- •1S2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10
- •1S22s22p63s23p64s13d5 замість 1s22s22p63s23p64s23d4
- •23Е, 1s22s22p63s23p64s23d3
- •Критерії періодичності й властивості хімічних елементів
- •Періодичний закон та періодична система елементів д.І.Менделєєва
- •Радіуси атомів та йонів елементів.
- •Закономірності зміни енергетичних характеристик елементів.
- •Енергія йонізації
- •Енергія спорідненості до електрона
- •Електронегативність атомів
- •Запитання для самоконтролю
- •Задачі для самоконтролю
- •Література
Радіуси атомів та йонів елементів.
У визначенні радіуса атома не спостерігається однозначності тому, що ізольований атом або йон не має чітко визначених зовнішніх меж. Тому залежно від типу хімічного зв'язку, структури речовини і ступеня окиснення елемента слід відрізняти такі види радіусів атомів: 1) ефективний радіус атома — радіус, розрахований на основі експериментальних даних між'ядерних відстаней у молекулах і кристалах; 2) ковалентний (атомний) радіус — половина між'ядерної відстані в молекулах або кристалах відповідних простих речовин; 3) металічний (атомний) радіус також дорівнює половині відстані між центрами двох сусідніх атомів у кристалічній гратці металу; 4) йонний радіус — ефективний радіус, розрахований для кристалів з переважно йонним типом зв'язку (аніонний — більший за атомний радіус, катіонний — менший від нього); 5) орбітальний радіус — теоретично розрахована відстань від ядра до головного максимуму електронної густини зовнішньої орбіталі; він є характеристикою ізольованого атома або йона, що не залежить від природи хімічного зв'язку.
Зміна радіусів атомів елементів у періодичній системі має періодичний характер (див. рис. 2.1, а):
у періодах зліва направо |—»| у міру збільшення зарядів ядер (тобто порядкових номерів) і чисел валентних електронів елементів радіуси зменшуються;
у групах зверху донизу |↓| заряди ядер атомів зростають стрибкоподібно, але одночасно збільшується і число електронних енергетичних рівнів, що призводить до збільшення радіусів атомів. При цьому в групах А таке збільшення відбувається більш різко, ніж у групах В.
Закономірності зміни енергетичних характеристик елементів.
Хімічна активність елемента визначається здатністю його атомів відщеплювати чи приєднувати електрони. Кількісно ця здатність атомів елементів оцінюється за допомогою двох енергетичних характеристик: 1) енергії (потенціалу) йонізації; 2) енергії спорідненості до електрона.
Енергія йонізації
Енергія йонізації (І, кДж/моль; еВ) — мінімальна енергія, потрібна для відщеплення найслабкіше зв'язаного електрона від незбудженого атома: R0 —> R+ +e, I1> 0, де R0 — символ будь-якого елемента, R+ — символ його йона. Потенціал (і енергія) йонізації є складною функцією деяких характеристик атома: заряду ядра, радіуса атома, конфігурації валентних електронних оболонок. Періодичність зміни величини I1 елементів залежно від їх порядкових номерів подано на рис. 2.1, б.
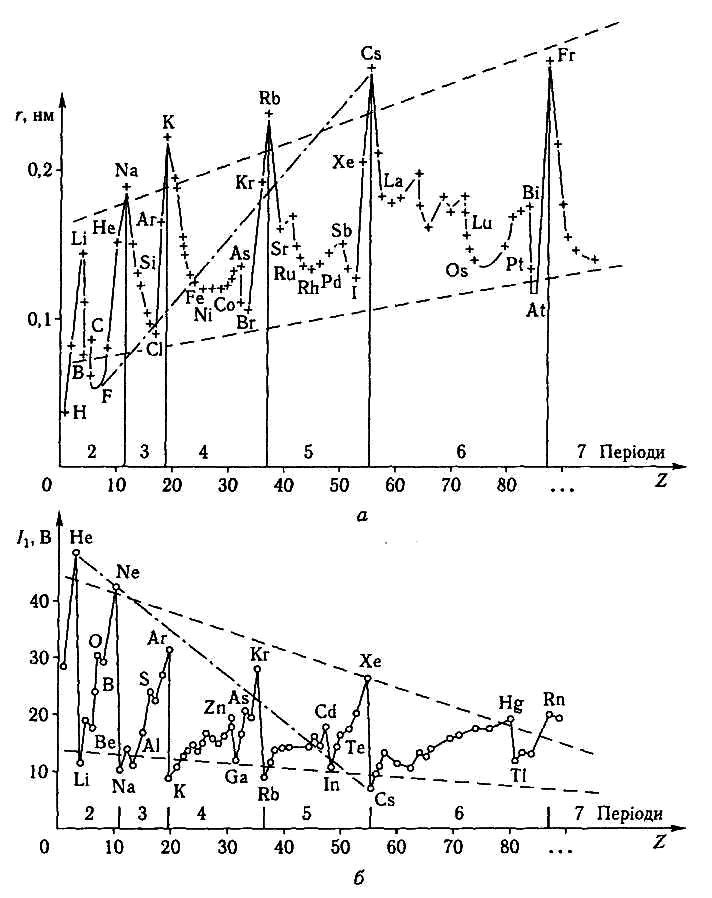
Аналізуючи данні рис.2.1,б, можна зробити відповідні висновки.
У групах елементів зверху вниз зі зростанням радіусів атомів зменшується сила утримування валентних електронів. Отже, значення енергії йонізації знижується, тобто в цьому напрямі здатність віддавати електрони (окиснюватися) стає енергетично все легшою.
У періодах елементів зліва направо |—»| у міру зменшення радіусів атомів і водночас зростання ступеня заповнення електронами (зокрема, парами електронів) валентних рівнів значення I1 зростають відповідно. Тобто в цьому напрямі відщеплення електронів атомами енергетично утруднюється.
• Враховуючи характер зміни величин I1 у групах і періодах, треба за значити, що зліва в системі елементів, і особливо в її нижній частині,знаходяться найактивніші метали-відновники, здатні енергетично легко окиснюватися. Тобто, енергія іонізації може бути кількісною мірою відновлювальної здатності елемента, його “металічності”.
