
- •Глава 1 Основні поняття термодинаміки
- •1.1 Термодинамічна система
- •1.2 Фаза
- •1.3 Компонент
- •1.4 Термодинамічні параметри стану системи
- •1.5 Термодинамічний потенціал системи
- •1.6 Хімічний потенціал атомів компонентів
- •1.7 Рівновага в гетерогенній системі
- •1.8 Правило фаз Гіббса
- •1.9 Фазовий простір Гіббса
- •Глава 2 аналіз діаграм фазових рівноваг у подвійних системах
- •2.1 Діаграми стану з необмеженою розчинністю компонентів у твердій і рідкій фазах
- •2.1.1 Двокомпонентна система
- •2.2 Діаграми фазових рівноваг в системах з обмеженою розчинністю компонентів у твердих фазах
- •2.2.1 Діаграма стану з евтектичною рівновагою фаз
- •2.2.2 Діаграма стану з перитектичною рівновагою фаз
- •2.3 Діаграми стану з поліморфізмом компонентів
- •2.3.1 Однокомпонентна система
- •2.3.2 Двокомпонентна діаграма стану з поліморфізмом одного компоненту
- •2.3.3 Діаграма стану з евтектоїдною рівновагою фаз
- •2.4 Діаграми стану з проміжними фазами
- •2.5 Використання принципів термодинаміки незворотних процесів до аналізу фазових переходів в реальних системах
2.2.2 Діаграма стану з перитектичною рівновагою фаз
Умовою рівноваги фаз на діаграмі, що обговорюється (рис. 10), є рівність хімічних потенціалів атомів компонентів у відповідних фазах (15).
Для
T=T1
маємо рівновагу
![]() ;
;
Іншими
словами,
![]() ,
,![]()
Геометрично це проявляється у тому, що криві ізобарно-ізотермного потенціалу b- і рідкої фази мають загальну дотичну у точках 1I і 1II, що описують рівноважні концентрації фаз:
![]() .
.
Слід звернути увагу на те, що крива ізобарно-ізотермного термічного потенціалу a-фази розташовується вище, ніж криві для b- і рідкої фаз. Це свідчить про нестійкість a-фази при високій температурі T1.
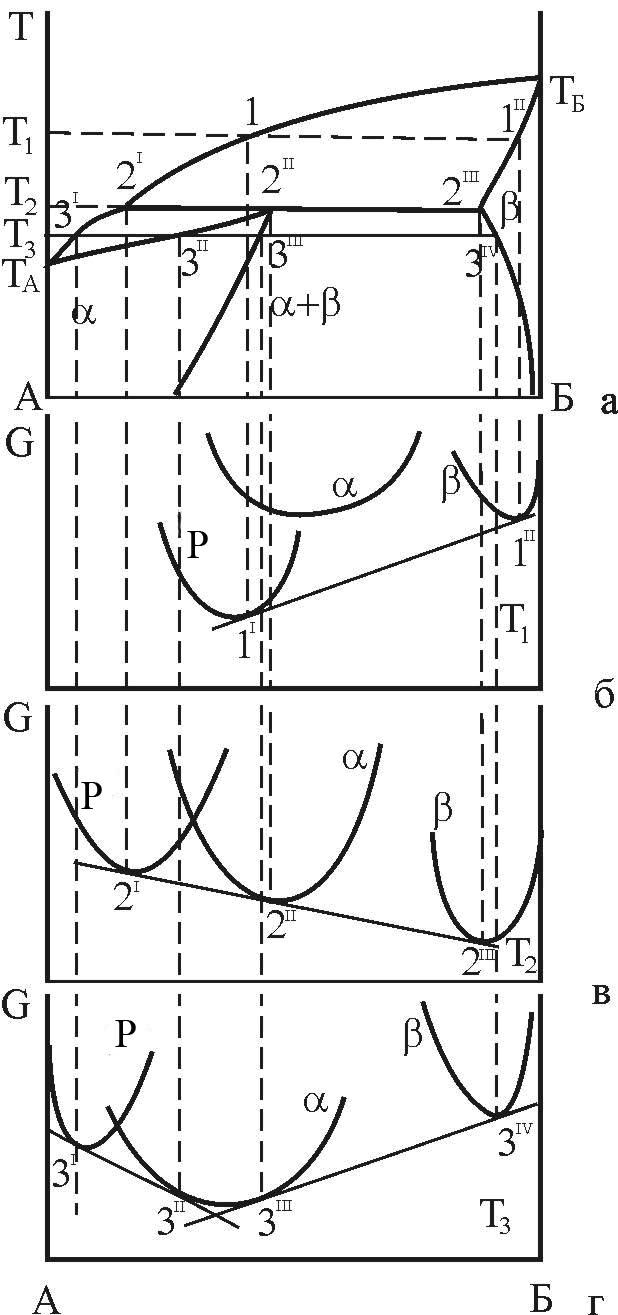
Рисунок 10 – Зв’язок кривих концентраційної залежності ізобарно-ізотермного потенціалу з діаграмою стану з трифазною рівновагою перитектичного типу
При
T=T2
в сплавах, склади яких знаходяться в
інтервалі концентрацій
![]() здійснюється трифазна нонваріантна
рівновага перитектичного типу:
здійснюється трифазна нонваріантна
рівновага перитектичного типу:
![]() .
.
Рівноважні концентрації фаз визначаються, як завжди, з умови (15):
![]() ;
;
![]() ;
;
геометрична інтерпретація якого надана на рис. 10, в.
Криві
ізобарно-ізотермного потенціалу для
усіх трьох фаз мають загальну дотичну
у точках
![]() ,
,![]() ,
,![]() .
Таким чином, можна уточнити запис фазової
рівноваги
.
Таким чином, можна уточнити запис фазової
рівноваги![]()
В сплавах, склади яких розташовуються лівіше від точки 2I і правіше від точки 2III, при T=T2 будуть здійснюватися однофазні рівноваги рідкої і β-фази відповідно.
При T=T3 в залежності від концентрації сплаву будуть реалізовуватися одно- або двохфазні рівноваги:
![]() :
в рівновазі рідка фаза;
:
в рівновазі рідка фаза;
![]() :
двофазна рівновага
:
двофазна рівновага
![]() (див. рис. 10, г);
(див. рис. 10, г);
![]() :
однофазна рівновага (a-фаза);
:
однофазна рівновага (a-фаза);
![]() :
двофазна рівновага
:
двофазна рівновага
![]() (див. рис. 10, г);
(див. рис. 10, г);
![]() :
однофазна рівновага (b-фаза).
:
однофазна рівновага (b-фаза).
Слід відзначити, що при зміні складу сплаву в інтервалі двофазних рівноваг змінюються частки фаз при незмінності їх рівноважних концентрацій при даній температурі.
2.3 Діаграми стану з поліморфізмом компонентів
2.3.1 Однокомпонентна система
В
однокомпонентній системі, як відомо,
умовою рівноваги a-
і b-фаз
є рівність вільних енергій цих фаз:
![]() .
.
Тому
зміна взаємного розташування цих кривих
при різному тиску (рис. 11, б – г)
визначає положення границь фазових
областей на відповідній діаграмі стану
(рис. 11, а). Рівність у точці 1I
![]() (рис. 11, б) обумовлює рівновагу
газоподібної і твердоїa-фази
при P1.
Зі збільшенням тиску ця точка ковзає
по лінії 1-2, тому остання описує умови
рівноваги газоподібної і a-фази.
(рис. 11, б) обумовлює рівновагу
газоподібної і твердоїa-фази
при P1.
Зі збільшенням тиску ця точка ковзає
по лінії 1-2, тому остання описує умови
рівноваги газоподібної і a-фази.
У точці 2' (див. рис. 11, в) здійснюється рівність величини вільної енергії трьох фаз: газоподібної і двох кристалічних: a і b. Це визначає на рис. 11, а точку 2 як умову трифазної рівноваги. Фази a- і b-поліморфні модифікації компоненту, що вивчається.
Вони
відрізняються типом упаковки атомів в
кристалічній гратці. Розмірковуючи
аналогічно, знаходимо (см. рис. 11, г),
що точка 3' – умова рівноваги
![]() при Р3,
а точка 3 описує термодинамічні параметри
цієї рівноваги у фазовому просторі
діаграми стану. Природно, що лінія, що
містить відрізок
при Р3,
а точка 3 описує термодинамічні параметри
цієї рівноваги у фазовому просторі
діаграми стану. Природно, що лінія, що
містить відрізок
![]() і продовжує його, описує умову рівноваги
і продовжує його, описує умову рівноваги![]() при різних P і Т.
при різних P і Т.
Відзначимо,
що як виходить з рис. 11, а при P=P3
реалізується ще одна фазова рівновага:
![]() .
Вона відбувається при Т=Т4.
.
Вона відбувається при Т=Т4.
Ступені свободи системи розподілені наступним чином. В однофазній області С=2, система є двоваріантною. На лінії двофазної рівноваги С=1 система є моноваріантною. У точці трифазної рівноваги система є нонваріантною, С=0.
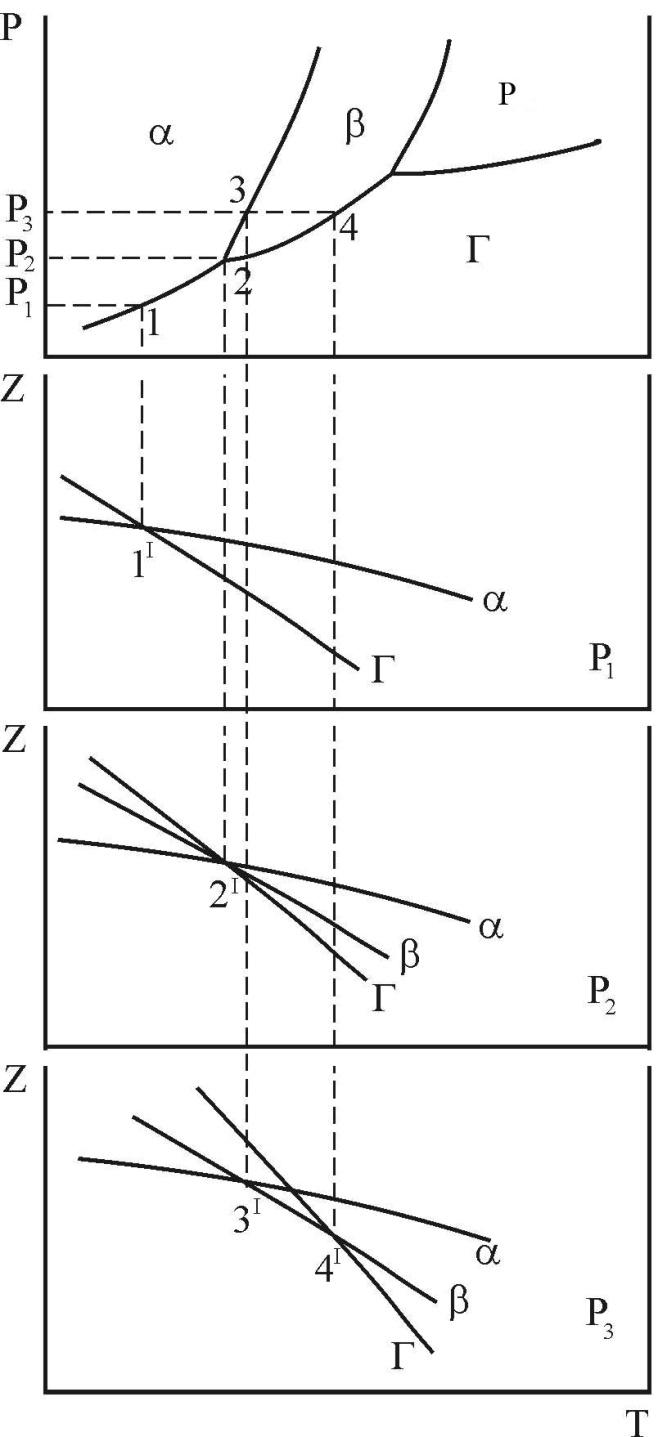
Рисунок 11 – Зв’язок кривих температурної залежності термодинамічного потенціалу з параметрами фазових рівноваг в однокомпонентній системі з поліморфізмом
Таким чином, у випадку, що розглядається, чотирифазна рівновага є неможливою, тому що у такому випадку система повинна була мати негативний ступінь свободи.
