
- •Глава 1 Основні поняття термодинаміки
- •1.1 Термодинамічна система
- •1.2 Фаза
- •1.3 Компонент
- •1.4 Термодинамічні параметри стану системи
- •1.5 Термодинамічний потенціал системи
- •1.6 Хімічний потенціал атомів компонентів
- •1.7 Рівновага в гетерогенній системі
- •1.8 Правило фаз Гіббса
- •1.9 Фазовий простір Гіббса
- •Глава 2 аналіз діаграм фазових рівноваг у подвійних системах
- •2.1 Діаграми стану з необмеженою розчинністю компонентів у твердій і рідкій фазах
- •2.1.1 Двокомпонентна система
- •2.2 Діаграми фазових рівноваг в системах з обмеженою розчинністю компонентів у твердих фазах
- •2.2.1 Діаграма стану з евтектичною рівновагою фаз
- •2.2.2 Діаграма стану з перитектичною рівновагою фаз
- •2.3 Діаграми стану з поліморфізмом компонентів
- •2.3.1 Однокомпонентна система
- •2.3.2 Двокомпонентна діаграма стану з поліморфізмом одного компоненту
- •2.3.3 Діаграма стану з евтектоїдною рівновагою фаз
- •2.4 Діаграми стану з проміжними фазами
- •2.5 Використання принципів термодинаміки незворотних процесів до аналізу фазових переходів в реальних системах
2.2 Діаграми фазових рівноваг в системах з обмеженою розчинністю компонентів у твердих фазах
Обмежена
розчинність компонентів у твердих фазах
суттєво ускладнює вигляд діаграми
стану. У найпростішому випадку це
обумовлено існуванням як мінімум трьох
фаз: рідкої і двох твердих розчинів –
на базі компонентів А і Б. Природно, що
рівновага цих трьох фаз у двокомпонентній
системі має нонваріантний характер і
в залежності від особливостей електронної
структури атомів компонентів і
співвідношення величин енергії парних
взаємодій атомів (![]() )
може приводити до реалізації нонваріантних
– евтектичного або перитектичного, або
екстектичного типів рівноваг.
)
може приводити до реалізації нонваріантних
– евтектичного або перитектичного, або
екстектичного типів рівноваг.
Розглянемо більш докладно особливості відповідних діаграм стану.
2.2.1 Діаграма стану з евтектичною рівновагою фаз
Розглянемо взаємне розташування кривих ізобарно-ізотермічного потенціалу для фаз системи при температурі Т1<TE (рис. 6, б).
Загальні
дотичні до кривих для a,
b
і рідкої фази проходять через точки 1I
і 1II
(рівновага Р![]() a)
і через точки 1III
і 1IV
(рівновага Р
a)
і через точки 1III
і 1IV
(рівновага Р![]() b).
При проектуванні вказаних точок на
відповідні гілки кривих ліквідус і
солідус отримуємо концентрації фаз, що
знаходяться у рівновазі при T=T1.
b).
При проектуванні вказаних точок на
відповідні гілки кривих ліквідус і
солідус отримуємо концентрації фаз, що
знаходяться у рівновазі при T=T1.
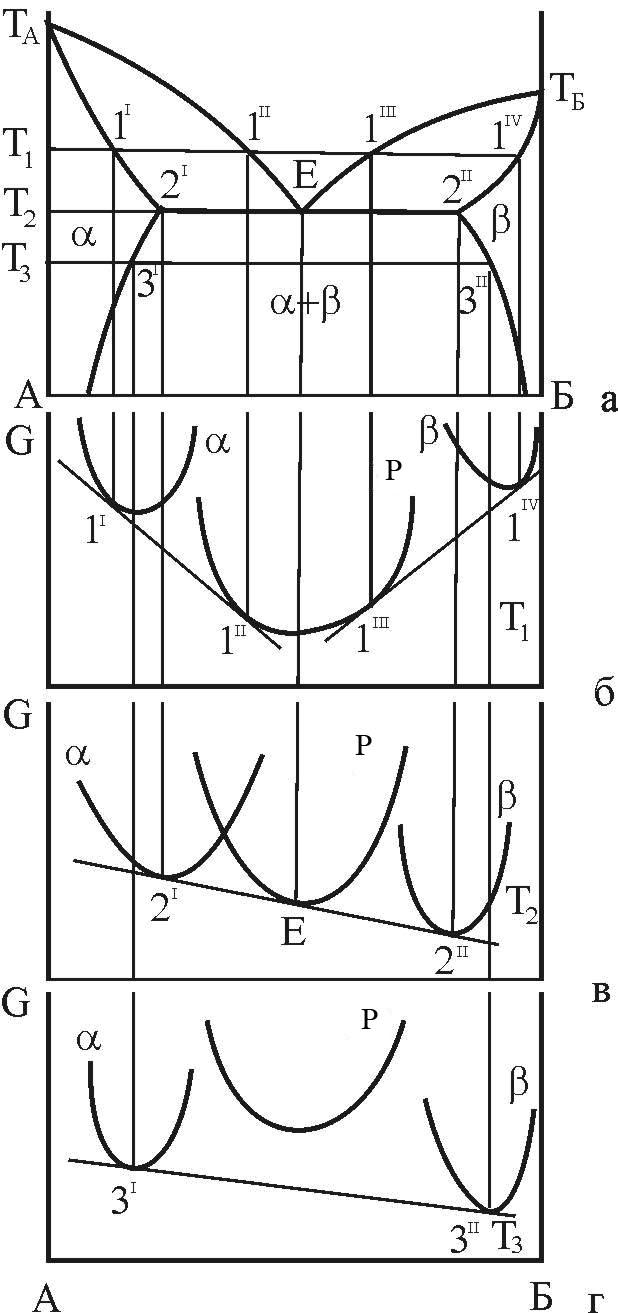
Рисунок 6 – Зв’язок кривих концентраційної залежності ізобарно-ізотермічного потенціалу з діаграмою стану з трифазною рівновагою евтектичного типу
При
T=TE
загальна дотична 2I-E-2II
до усіх трьох кривих ізобарно-ізотермічного
потенціалу показує, що усі три фази
знаходяться у рівновазі. Точки дотику
вказують на рівноважні концентрації
кожної фази:
![]() -
дляa-фази;
-
дляa-фази;
![]() -
дляb-фази
і
-
дляb-фази
і
![]() - для рідкої фази.
- для рідкої фази.
При T=T3<TE крива ізобарно-ізотермічного потенціалу для рідкої фази знаходиться вище, ніж аналогічні криві для твердих a- і b-фаз, що свідчить про нестійкість рідкої фази при низьких температурах.
Загальна
дотична 3'-З" до кривих для a-
и b-фаз
вказує, що обидві фази знаходяться в
рівновазі, причому a-фаза
має склад
![]() ,
ab-фаза
-
,
ab-фаза
-
![]() .
Корисно зауважити, що будь-яка зміна
складівa-
і b-фаз
автоматично виводе систему зі стану
рівноваги, оскільки провести загальну
дотичну до кривих ізобарно-ізотермічного
потенціалу для a-
і b-фаз
інакше, ніж через точки 3' і 3", не можна.
Іншими словами, для виконання умов
фазової рівноваги (15):
.
Корисно зауважити, що будь-яка зміна
складівa-
і b-фаз
автоматично виводе систему зі стану
рівноваги, оскільки провести загальну
дотичну до кривих ізобарно-ізотермічного
потенціалу для a-
і b-фаз
інакше, ніж через точки 3' і 3", не можна.
Іншими словами, для виконання умов
фазової рівноваги (15):
![]()
![]()
при T=T3 (див. рис. 6) склади a- і b-фаз повинні відповідати точкам 3I і 3II.
Як виходить з ходу кривих сольвус - ліній межової розчинності компонентів у a- і b-фазах зміна температури може суттєво вплинути на рівноважну концентрація фаз – рис. 7, б. Максимальна концентрація твердих розчинів, як правило, відповідає евтектичній температурі. У випадку розчинності компонентів у твердих розчинах, якою можна знехтувати, діаграма стану набуває вигляду, що показаний на рис. 7, а. у цьому випадку кажуть, що евтектика (А+Б) утворена майже чистими компонентами.
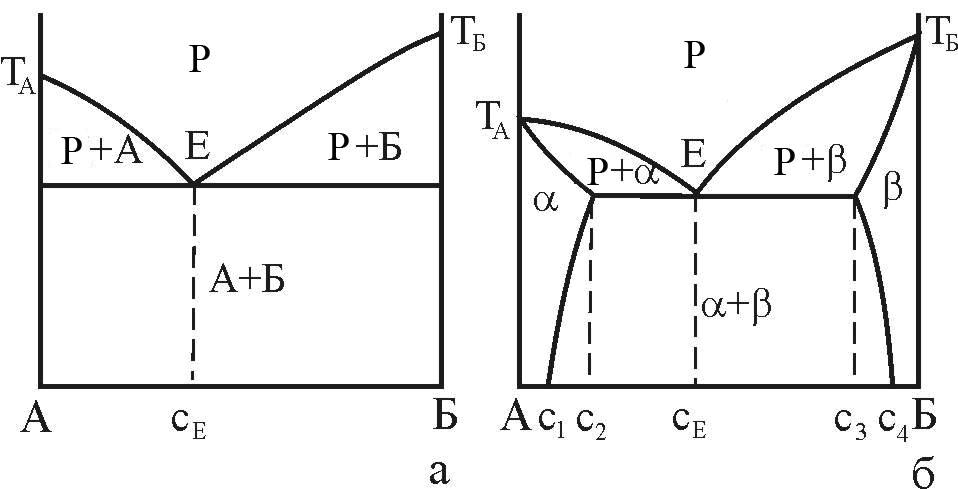
а - при відсутності розчинності компонентів у твердих фазах (гіпотетична); б – з обмеженою розчинністю компонентів у твердих фазах
Рисунок 7 – Діаграми стану з евтектичною рівновагою фаз
У деяких випадках, що залучають металічний компонент і компонент з типово ковалентним міжатомним зв’язком, наприклад, Al-Si, максимальна розчинність атомів металу у неметалевому компоненті виявляється при більш високій температурі (c1), ніж евтектична (c2) - рис. 8. У цьому випадку кажуть, що має місце ретроградна розчинність і, відповідно, ретроградний b-солідус.
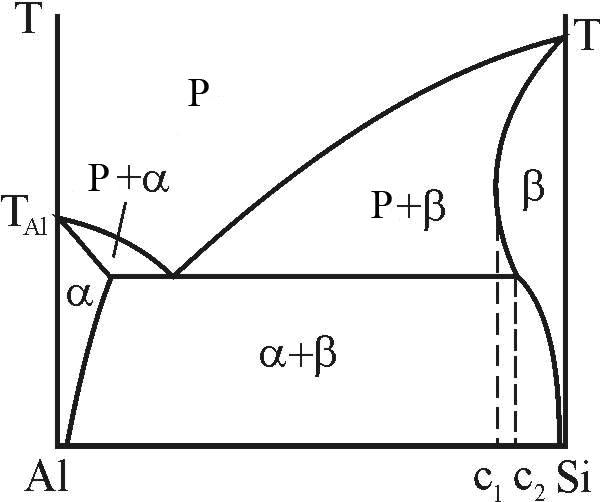
Рисунок 8 – Ретроградний b–солідус в системі Al-Si
Концентрації фаз, що знаходяться у рівновазі і їх питома кількість (об’єм і маса) визначають у відповідності з методикою, що розглянута раніше, для випадку діаграми стану з необмеженою взаємною розчинністю.
Конкретизуємо це для діаграми стану з евтектичною рівновагою, що розглядається (рис. 9).
Для
сплаву складу I рівноважний стан при
T=T1
характеризується двома фазами: рідкою
фазою складу 1I
(скорочений запис:
![]() )
іb-фазою
складу 1II
(
)
іb-фазою
складу 1II
(![]() ).
Співвідношення мас фаз:
).
Співвідношення мас фаз:
![]() ;
;
![]() .
.
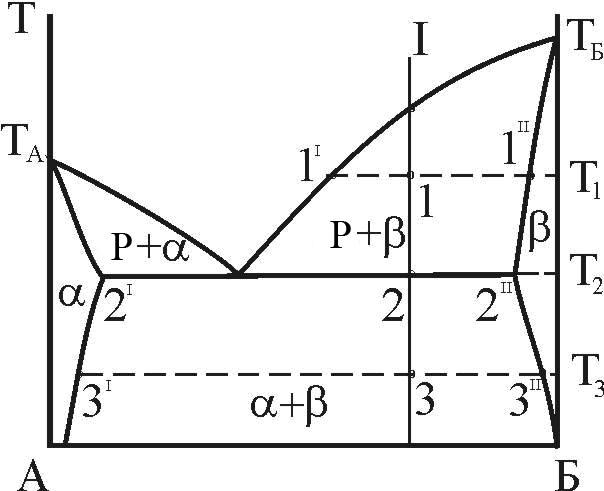
Рисунок 9 – До визначення рівноважних концентрацій фаз і співвідношення структурних складових
При
евтектичній температурі (T=T2=TE)
у трифазній нон варіантній рівновазі
приймають участь
![]() .
Співвідношення мас фаз в евтектиці:
.
Співвідношення мас фаз в евтектиці:
![]() ;
;
![]()
Співвідношення первинних кристалів b-фази і евтектичної складової:
![]() .
.
Іноді
кажуть про ступінь евтектичності злитка.
При цьому мають на увазі долю евтектичної
складової в об’ємі злитка. Для сплаву
I ступінь евтектичності (e)
виражається пропорцією
![]() .
.
З
викладеного виходить, що ступінь
евтектичності наближається до одиниці
при наближенні складу I до
![]() .
.
