
ZbirnykZadach
.pdf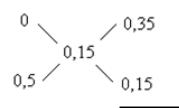
Найточніше зафіксувати цю точку можна за допомогою метилоранжу.
За умовою задачі титрування проводили за фенолфталеїном. В цьому випадку f(К2CO3) = 1. Тому, концентрацію нітратної кислоти розраховуємо за формулою 2.4:
C(HNO3) = |
m(K2CO3) 1000 |
= |
0,5112 |
1000 |
= 0,2058 М |
||
V (HNO3) M (K2CO3) f (K2CO3) |
18,00 |
138 1 |
|||||
|
|
|
|||||
3. Скільки см3 25,48 %-го розчину НNO3 з густиною 1,15 г/cм3 необхідно додати до 0,5 дм3 0,3562 н розчину НNO3, щоб одержати 0,5000 н розчин?
За даними густини і масової частки розрахуємо нормальну концентрацію нітратної кислоти:
Cн(HNO3 ) = |
ω(HNO3 ) ρ(HNO3 ) 10 |
= |
25,48 1,15 |
10 |
= 4,65н |
|
M (HNO3 ) f (HNO3 ) |
63 |
1 |
|
|||
|
|
|
|
|||
Позначимо через х об’єм нітратної кислоти з концентрацією 4,65 н, який необхідно додати до 0,5 дм3 0,3562 н розчину НNO3, щоб одержати 0,5000 н розчин. Тоді:
4,65 x + 0,3562 0,5 =0,5(x + 0,5) 4,65 x + 0,1781 =0,5x + 0,25)
4,15 x =0,0719
x =0,01733 дм3 = 17,33 cм3.
4. Які об’єми (cм3) води та 0,5 М розчину НCООН необхідно взяти для приготування 200 cм3 0,15 М розчину мурашиної кислоти?
Для розв’язання задачі використаємо правило хреста:
масових част. Н2О
+
масових част. 0,5 М р-ну
0,50 масових част. 0,15 М р-ну
З отриманої залежності видно, що: 0,5 масових част. 0,15 М розчину має містити 0,35 масових част. H2O, а 200 cм3 0,15 М розчину має містити V(H2O).
Звідси визначаємо об’єм води, необхідний для приготування розчину:
V (H2O) = 200 0.35 =140 cм3. 0.5
Тоді об’єм 0,5 М розчину НCООН дорівнює:
V(НCООН ) = 200 - 140 = 60 cм3.
21
5. Зразок вапняку масою 3,1500 г розчинено в 150,00 см3 2,0000 М розчину НС1. На титрування залишку кислоти витрачено 23,00 см3 0,1500 М розчину NаОН. Визначити масову частку (%) СаСО3 у зразку.
Процес визначення СаСО3 описується рівняннями:
CaCO3 + 2HClнадл. →CaCl2 + H2O +CO2 + HClзал.
HClзал. + NaOH → NaCl + H2O
Масову частку (%) СаСО3 у зразку розраховують за методом зворотнього титрування:
|
[C(HCl) V (HCl) −C(NaOH ) V (NaOH )] M (1 CaCO ) |
|||||
ω(CaCO3) = |
|
|
|
|
2 |
3 |
|
|
10 mнаважки |
|
|
||
|
|
|
|
|
||
|
|
[2 150 −0,1500 23] 1 |
100 |
|
|
|
ω(CaCO3) = |
|
2 |
|
= 47,07 %. |
|
|
10 |
31,5 |
|
|
|||
|
|
|
|
|
||
6. Через 100,00 см3 розчину НС1 з титром 0,07243 г/см3 пропущено газ, що містить NН3. На титрування залишку кислоти витрачено 9,7 см3 0,0157 М розчину NаОН. Визначити масу (г) поглинутого аміаку.
Процес визначення аміаку можна описати рівняннями:
NH3 + HClнадлишок = NH 4Cl + HClзалишок,
HClзалишок + NaOH = NaCl + H2O .
За значенням титру кислоти розраховуємо її молярну концентрацію:
C(HCl) = T (HCl) 1000 |
= 0,07243 1000 |
=1,9866 М |
||
|
M (HCl) |
36,46 |
|
|
Для визначення маси поглинутого аміаку використали метод зворотнього |
||||
титрування (формула 2.9), тому: |
|
|
|
|
m(NH3 ) = |
[C(HCl) V (HCl) −C(NaOH ) V (NaOH )] M (NH3 ) |
|||
|
1000 |
|
|
|
|
|
|
|
|
m(NH3 ) = [1,9866 100 −0,0157 9,7] 17 |
=3,3746 г. |
|||
|
1000 |
|
|
|
7. Розрахуйте процентний вміст N2О5 в нітратній кислоті, якщо для нейтралізації 4,0880 г цієї кислоти використано 28,0 cм3 розчину NaОН з
титром 0,0005101 г/cм3.
Визначення N2О5 в нітратній кислоті можна зобразити схемою: 2HNO3 → N2O5 + H2O .
Для даного процесу f (N2O5 ) = 12 .
За значенням титру розраховуємо молярну концентрацію лугу:
22

C(NaOH ) = T (NaOH ) 1000 = 0,0005101 1000 =0,01275 М
M (NaOH ) 40
Для визначення масової частки N2О5 в нітратній кислоті необхідно розрахувати його масу за результатами прямого титрування:
m(N2O5 ) = |
C(NaOH ) V (NaOH ) M (N2O5 ) f (N2O5 ) |
|||||||
|
|
|
1000 |
|
|
|||
|
|
|
|
|
|
|
||
|
|
|
|
0,01275 28 108 1 |
||||
|
m(N O ) = |
|
2 |
= 0,01928 г. |
||||
|
|
|
||||||
|
|
2 |
5 |
|
1000 |
|
|
|
Тоді: |
|
|
|
|
|
|
||
|
|
m(N2O5 ) |
100% = 0,01928 100% =0,47 % |
|||||
ω(N O ) = |
||||||||
|
||||||||
2 |
5 |
|
mкислоти |
4,088 |
|
|||
|
|
|
|
|||||
8. Наважку 1,2414 г зразку, який містить сірку, спалили і гази згоряння пропустили через розчин, у якому оксиди сірки перетворилися у сульфатну кислоту. Розрахувати % вміст сірки у зразку, якщо на титрування одержаної сульфатної кислоти витратили 22,4 cм3 0,0555 М розчину NaОH.
Схему отримання сульфатної кислоти можна записати так:
+O2 |
+O2 |
+H 2O |
S →SO2 |
→SO3 |
→H 2SO4 . |
Процес визначення сірки базується на реакції нейтралізації отриманої сульфатної кислоти розчином NaОH:
H2SO4 +2NaOH = Na2SO4 +2H2O .
Вданому випадку f (H2SO4 ) = f (S) = 12 , тому вміст сірки можна
розрахувати за формулою:
ω(S) = |
C(NaOH ) V (NaOH ) M (S) f (S) |
= |
0,0555 |
22,4 32 12 |
=1,60 % |
|
10 |
1,2414 |
|||
|
10 mзразка |
|
|||
9. Розрахувати індикаторну похибку при титруванні 0,1500 н розчину НCl 0,1500 н розчином NaОH з фенолфталеїном (рТ= 9,1).
Приймемо, що вихідний об’єм розчину кислоти дорівнює 100 cм3. Визначення грунтується на реакції:
HCl + NaOH → NaCl + H2O
Оскільки в точці еквівалентності утворюється натрій хлорид – сіль, яка не гідролізує, то pHт.е. = 7.
Для перевірки придатності фенолфталеїну для даного титрування розрахуємо стрибок титрування:
V(NaOH) = 99,9 cм3. До точки еквівалентності рН розчину буде визначатись надлишком HCl. Тому:
23

[H +] = C(HCl) V (HCl) −C(NaOH ) V (NaOH ) V (HCl) +V (NaOH )
[H +] = 0,15 100 −0,15 99,9 = 7,5 10−5 M 100 +99,9
pH = −lg[H +] = −lg 7,5 10−5 = 4,125
V(NaOH) = 100,1 cм3. Після точки еквівалентності рН розчину буде визначатись надлишком NaOH. Тому:
[OH −] = C(HCl) V (HCl) −C(NaOH ) V (NaOH ) V (HCl) +V (NaOH )
[OH −] = 0,15 (100,1−100) = 7,5 10−5 М 100 +100,1
pOH = −lg[OH −] = −lg7,5 10−5 = 4,125 pH =14 − 4,125 =9,875
pH =9,875 − 4,125 =5,75
З отриманих результатів видно, що рТ фенолфталеїну входить в межі стрибка титрування, тобто індикатор може бути використаний для фіксування точки еквівалентності.
Оскільки pT > pHт.е. , титрування закінчиться, коли в розчині буде
надлишок NaОH. Тому для фенолфталеїну розраховуємо гідроксильну похибку
(формула 2.15):
δ(OH −) = |
10 pT −14 V2 |
100% = |
109,1−14 200 |
100% = 0,01679 %. |
|
0,15 100 |
|||
|
C V |
|
||
|
1 |
|
|
|
Похибка менше 0,1 %, тобто індикатор підходить для титрування. |
||||
10. Розрахувати |
ступінь гідролізу, |
[H+], [OH-] |
і рН 0,001 н розчину |
|
СН3СООК.
Калій ацетат – сіль, утворена сильною основою та слабкою кислотою, гідролізує за аніоном, рН>7. Рівняння гідролізу СН3СООК:
CH 3COOK + HOH ↔ CH 3COOH + KOH .
CH 3COO − + HOH ↔ CH 3COOH + OH −
В Додатку 2 знаходимо значення константи йонізації СН3СООН. KCH3COOH =1,74 10−5 . Тоді ступінь гідролізу визначається за формулою 2.22:
h = |
KW |
= |
|
10−14 |
= 0,75 10−3 |
KCH 3COOH СCH 3COOK |
|
10−5 1 10−3 |
|||
|
1,75 |
|
|||
Концентрацію [OH–] розраховують за формулою (таблиця 1.2):
24

[OH |
− |
|
KW C(CH 3COOK) |
|
10−14 10−3 |
−6 |
3 |
||
|
] = |
|
= |
|
|
= 0,75 10 |
|
моль/дм . |
|
|
KCH 3COOH |
1,75 10−5 |
|
||||||
На основі отриманого значення концентрації гідроксильних іонів розраховуємо [H+] і рН розчину:
[H |
+ |
|
|
KW |
|
10−14 |
|
−8 |
3 |
|
|
] = |
|
= |
|
=1,32 |
10 |
|
моль/дм . |
||
|
|
[OH −] |
0,75 10−6 |
|
||||||
|
|
pH = −lg[H + ] = −lg(1,32 10 |
−8 ) = 7,9 |
|||||||
Для розрахунку рН можна використати і таку формулу (таблиця 1.2): pH = 7 + 12 pK HA + 12 lg CKtA = 7 + 12 pKCH 3COOH + 12 lg C(CH 3COOK)
pH =7 + 12 1,75 10−5 + 12 lg10−3 =7,9 .
2.7. Задачі для самостійної підготовки
Значення констант йонізації кислот і основ, необхідні для розв’язування задач, наведені в Додатку 2, а інтервали переходу індикаторів – у Додатку 3.
1.Розрахуйте рН в точці еквівалентності, величину стрибка титрування і виберіть три індикатори при титруванні:
а) 0,02 М розчину барій гідроксиду Ва(OН)2 0,02 М розчином НCl;
б) 0,05 М розчину трихлорацетатної кислоти ССl3COOH 0,05 М розчином
NaОН;
в) 0,1 М розчину антранілової кислоти NH2C6Н4COOH 0,1 М розчином
NaОH (рКNH2C6Н4COOH = 4,95);
г) 0,2 М розчину К3ВО3 0,2 М розчином НCl (K1Н3ВО3=9,15).
д) 0,15 М розчину фенілгідразиній хлориду C6H5NH3Cl 0,15 М розчином
NaОH (pK C6H5NH3OH = 8,8);
е) 0,15 М розчину аміаку 0,15 М розчином НCl.
2.Скільки грамів соди, що містить 95 % Nа2СО3 і 5 % індиферентних домішок, треба відважити, щоб приготувати 1 дм3 розчину з титром
0,00250 г/см3? (Відповідь: 2,6316 г).
3.Скільки см3 92%-ного розчину H2SO4 з густиною1,824 г/cм3 треба взяти для приготування 5 дм3 0,1 н розчину? (Відповідь: V(H2SO4 ) = 14,6 см3).
4.До розчину H3РO4 додали 22,1 cм3 0,25 н NaОН і після цього середовище стало нейтральне. Скільки грамів H3РO4 було в розчині? (Відповідь: 0,2707 г).
25
5.На нейтралізацію 15 cм3 розчину НСl використано 18,6 cм3 0,5450 н NаОН. Яка нормальність розчину НСl? (Відповідь: C(HCl) = 0,6758 н).
6.Скільки грамів Са(ОН)2 міститься в 25,0 cм3 розчину, якщо його титр становить 0,01635 г/cм3? (Відповідь: 0,4088 г).
7.Обчислити молярну концентрацію і титр розчину NaОH, якщо на титрування 25,0 cм3 його витрачено 23,2 cм3 0,2958 М розчину НCl. (Відповідь:
C(NaOH) = 0,2745 моль/дм3; ТNaOH = 0,01098 г/см3).
8.На титрування розчину НCООН використано 32,5 cм3 0,0510 моль/дм3 розчину NaОH. Обчисліть масу НCООН в розчині. (Відповідь: 0,07625 г).
9.В 200 cм3 0,2 н NH4OН міститься 2,14 г безводного NH4NO3. Яким є рН цього розчину? (Відповідь: рН = 9,425).
10.В 100 cм3 0,1 н СН3CООН міститься 0,82 г безводного ацетату калію. Яким є рН цього розчину? (Відповідь: рН = 4,6).
11.Скільки см3 НС1 з густиною 1,24 г/см3 треба взяти для приготування
15,0 дм3 0,5000 М розчину? (Відповідь: 851,2 см3).
12.Скільки см3 води треба додати до 250,0 см3 0,5 М розчину НС1, щоб приготувати 0,1500 М розчин? (Відповідь: 583,3 см3).
13.Скільки см3 1,5 н розчину NaОH необхідно додати до 1,2 дм3 0,3550 н NaОH щоб одержати 0,5000 н розчин? (Відповідь: 174 см3).
14.Скільки cм3 розчину NH4OН (ρ = 0,904 г/см3, ω(NH4OН) = 26 %) необхідно взяти для приготування 500 cм3 розчину з Т = 0,00250 г/cм3? (Відповідь: 5,32 см3).
15.Який об’єм води необхідно додати до 800 cм3 розчину НCl з титром 0,0256 г/cм3, щоб приготувати 0,15 М розчин цієї кислоти? (Відповідь:2,94 дм3).
16.Для приготування 0,7 дм3 розчину взято 23,0 cм3 розчину NaОH
(ρ =1,38 г/см3, ω(NaОH) = 0,35). Якою буде нормальна концентрація і титр одержаного розчину. (Відповідь: C(NaOH)=0,3968 н; TNaOH=0,01587 г/см3).
17.З 2,2250 г бури (Nа2В4О7·10Н2О) приготували 100 см3 розчину, 20,0 см3 якого реагує з 34,2 см3 розчину НCl. Розрахуйте нормальність бури і хлоридної кислоти. (Відповідь: С(Nа2В4О7·10Н2О) = 0,1167 н; С(HCl)=0,0682 н).
18.Скільки грамів Ва(ОН)2 міститься в розчині, якщо на титрування за фенолфталеїном (рТ = 9,1) витрачено 18,50 см3 0,1500 М розчину НС1? (Відповідь: 0,4745 г).
19.25,00 cм3 розчину розбавили у вимірювальній колбі місткістю 500 cм3. На титрування аліквотної частини 10,00 cм3 витрачено 18,4 cм3 0,1567 М розчину НCl. Обчислити масову концентрацію NаОН (г/дм3) в розчині. (Відповідь: C(NaOH) = 230,66 г/дм3).
20.Яку масову частку (%) НCl містить концентрована соляна кислота, якщо після розчинення 1,3313 г її в мірній колбі місткістю 50,00 см3, на
26
титрування 10,00 см3 0,0504 М NаОН витрачено 24,5 см3 одержаного розчину кислоти? (Відповідь: 28,17 %).
21. Для стандартизації розчину NаОН приготували розчин тетраборату натрію Nа2В4О7·10Н2О шляхом розчинення наважки масою 1,2525 г в мірній колбі місткістю 200,00 см3. Визначити молярну концентрацію і молярну концентрацію еквівалента розчину тетраборату натрію. (Відповідь:
С(Nа2В4О7·10Н2О)=0,01642 моль/дм3; С(½Nа2В4О7·10Н2О)=0,03284 н).
22. Визначити молярну концентрацію і молярну концентрацію еквівалента
Н2SО4 з масовою часткою 20 % (ρ = 1,14 г/см3). (Відповідь: С(½Н2SО4) = 4,66 н; С(Н2SО4) = 2,33 М).
23.Визначити масу барію (мг) у розчині баритової води, на титрування якої витрачено 12,30 cм3 0,2527 М розчину НС1. (Відповідь: 212,9 мг).
24.Визначити масову частку (%) NаОН у технічному зразку, якщо після розчинення його наважки 1,5634 г у вимірювальній колбі об’ємом 250 cм3 на титрування 20 cм3 цього розчину витрачено 17,7 cм3 0,2323 н розчину хлоридної кислоти. (Відповідь: 78,90 %).
25.Порахуйте нормальність і молярність розчину H2SO4, титр якого –
0,05002 г/cм3. (Відповідь: С(½Н2SО4) = 1,0208 н; С(Н2SО4) = 0,5104 моль/дм3).
26.С(КОН) = 0,9540 моль/дм3. Обчислити ТКОН, ТКОН/НCl і масову частку
(%) КОН в розчині, якщо його густина 1,045 г/см3. (Відповідь:
ТКОН = 0,0534 г/см3, ТКОН/НCl = 0,0348 г/см3; ω(КOH) = 5,11 %).
27. В 250 cм3 розчину сульфатної кислоти міститься 0,3150 г H2SO4.
Обчислити молярну концентрацію, титр і рН цього розчину. (Відповідь:
С(H2SO4)=0,0129 моль/дм3; ТH2SO4 = 1,26.10–3 г/см3, рН = 1,59).
28. Зразок масою 0,2560 г, що містить NаН2РО4, відтитрували розчином NаОН. Визначити масову частку (%) NаН2РО4, якщо на титрування витрачено
17,00 см3 0,1500 М розчину NаОН. (Відповідь: ω(NаН2РО4) = 59,77 %).
29.Визначити молярну концентрацію NH4Cl у розчині, якщо після додавання до 15,0 cм3 цього розчину 25,0 cм3 0,1122 М розчину КОН на титрування залишку КОН витрачено 16,1 cм3 0,1234 М розчину НCl.
(Відповідь: С(NH4Cl) = 0,05455 моль/дм3).
30.Масова доля ацетатної кислоти в харчовому оцті 9 %. Який об’єм 0,1500 моль/дм3 розчину гідроксиду натрію витратиться на титрування 15,0 cм3
розведеного в 5 разів оцту (ρ = 1,000 г/см3)? (Відповідь: 30,0 см3).
31. Визначити масову частку (%) ВаСО3 в зразку, якщо після обробки наважки 2,8765 г зразка 40,0 cм3 0,1232 М розчину НCl на титрування залишку
НCl витрачено 17,7 cм3 0,1222 М розчину NaОH. (Відповідь: 9,47 %).
27
32. Визначити молярну концентрацію фталевого ангідриду в зразку, якщо після взаємодії 20,0 cм3 його розчину з 25,0 cм3 0,1897 М розчину КОН за реакцією:
C6Н4C2О3 + 2 КОН =C6Н4(COOК)2 +Н2О
на титрування залишку КОН витрачено 22,7 cм3 0,1135 н розчину НCl. (Відповідь: 0,0542 моль/дм3).
33.Розрахуйте значення рТ для індикатора, з яким можна відтитрувати
0,2000 н розчин бензоатної кислоти C6Н5COOH 0,2000 М розчином NaОH, щоб δНАn-похибка не перевищувала 0,1 %. (Відповідь: рТ = 7,2).
34.При якому значенні рН необхідно закінчити титрування 0,15 н бутиратної кислоти C3H7COOH 0,20 М розчином NaОH? (Відповідь: рНт.е.= 8,88).
35.Запишіть молекулярні і молекулярно-йонні рівняння гідролізу таких
солей: K2S, CuSO4, Na3PO4, Na2CO3, K2SO3, Fe2(SO4)3, AlCl3, Al2S3, Fe2(CO3)3.
36. Константа дисоціації форміатної кислоти дорівнює 1,77.10-4, а амоній
гідроксиду - 1,77.10-5. Розрахуйте константи гідролізу таких солей: HCOONa; HCOONH4; NH4NO3. (Відповідь: КHCOONa = 5,64.10-11; КHCOONH4 = 3,20.10-6; КNH4NO3 = 5,65.10-10).
37.Визначіть ступінь гідролізу і рН 0,005 н розчину KCN (KHCN =4,9 .10-10). (Відповідь: h = 0,063; pH = 10,5).
38.pH 0,003 н розчину гіпохлориту калію дорівнює 9,5. Розрахуйте ступінь гідролізу цієї солі. (Відповідь: h = 1,06.10-2).
39.Порівняйте значення ступеня гідролізу Na2HPO3 і NaH2PO3 у розчинах однакової концентрації. (Відповідь: h(НPO32-) > h(Н2PO3-) у 50,5 разів).
3.ОКИСНО-ВІДНОВНЕ ТИТРУВАННЯ
3.1. Процеси окиснення-відновлення
Окисно-відновні реакції – це реакції, які супроводжуються переходом електронів від одних атомів чи йонів до інших.
Рівняння повної окисно-відновної реакції складаються шляхом комбінації рівнянь двох півреакцій таким чином, щоб кількість відданих електронів дорівнювала кількості прийнятих:
-записують рівняння двох півреакцій;
-урівнюють кількість електронів;
-сумують два рівняння.
Якщо реакцiя відбуваєтья в кислому середовищi, то в ній приймають участь йони H+, якщо ж в лужному – OH–, які потрібно враховувати в рiвнянні. В нейтральних середовищах можуть приймати участь молекули води. Правила
28
складання півреакцій такі ж, що і для звичайних реакцій: число атомів кожного компонента, а також їх сумарний заряд в обох частинах рівняння повинен бути однаковим.
3.2. Окисно-відновні потенціали. Напрям окисно-відновних реакцій
Потенціал електрода, виміряний при стандартних умовах відносно стандартного водневого електрода, називають стандартним (нормальним) електродним потенціалом φ0. Пара з більшим значенням потенціалу відіграє роль окисника відносно пари з меншим значенням потенціалу. Чим вище значення φ0, тим більшою є окисна здатність речовини.
Окисно-відновна реакція буде проходити в заданому напрямку, якщо
ϕок0 −ϕвідн0 > 0 .
Окисно-відновна реакція завжди йде в сторону утворення слабших, ніж вихідні, окисників і відновників.
3.3. Рівняння Нернста
Рівняння Нернста характеризує залежність величини окисно-відновного потенціалу від природи речовини, температури, концентрації окисненої та відновленої форм і рН середовища:
ϕ(Ок/ Відн) =ϕо(Ок/ Відн) + |
RT ln |
аок |
|
|
|
(3.1) |
|
авідн |
|
|
|||||
|
nF |
аок |
|
|
|||
або ϕ(Ок/ Відн) =ϕо(Ок/ Відн) + 0,059 lg |
, |
(3.2) |
|||||
|
|||||||
|
|
n |
авідн |
|
|||
де R – унiверсальна газова постiйна; Т – абсолютна температура, К; F – число Фарадея; n – число електронiв; аок, авідн– активностi окисненої та вiдновленої форм речовини.
Напрям окисно-вiдновних реакцiй можна встановити за величинами стандартних окисно-вiдновних потенцiалів пар. Якщо φ01 > φ02, реакція проходить зліва направо, φ01 < φ02 – справа наліво, φ01 = φ02 – стан рівноваги.
Для розрахунку повноти проходження реакцiї потрiбно користуватися значеннями констант рiвноваги. Для будь-якої окисно-вiдновної реакцiї
aОк1 + bВiдн2 ↔ aВiдн1 + bОк2
стан рiвноваги описується виразом: KC = |
[Відн1]a[Ок2 |
]b |
, |
(3.3) |
|
[Ок1]a[Відн2 ]b |
|||||
|
|
|
|||
де KC – концентраційна константа рівноваги.
29
На практиці використовують вираз десяткового логарифму KC:
lg KC = |
(ϕокo −ϕвіднo )a b |
, |
(3.4) |
|
0,059 |
||||
|
|
|
де a .b = n – число електронiв, що передаються при окисно-відновній реакцiї. Якщо КС > 1.103, то реакцiя проходить майже до кiнця злiва направо. Якщо
КС < 1, то реакцiя злiва направо практично не проходить. При промiжних значеннях KС реакцiя до кiнця не відбувається (оборотня).
3.4. Криві окисно-відновного титрування
Теоретичні криві титрування будують в координатах φсист - Vтитранту. Потенціал системи можна визначити за величиною потенціалу будь-якої пари
(визначуваної речовини чи титранту), результат буде однаковим. Однак, до точки еквівалентності простіше вести розрахунки φсист за півреакцією з участю визначуваної речовини, а після точки еквівалентності – за півреакцією з участю стандартного розчину.
Значення потенціалу в точці еквівалентності розраховують за формулою:
|
a ϕОк0 |
/ Відн |
2 |
+b ϕОк0 |
/ Відн |
|
ϕт.е. = |
2 |
|
1 |
1 |
(3.5) |
|
|
a +b |
|
||||
|
|
|
|
|||
Окисно-відновні індикатори – це органічні речовини, здатні обернено окиснюватися чи відновлюватися, причому окиснена і відновлена форми мають різне забарвлення.
Інтервал зміни забарвлення iндикатора розраховують за формулою:
ϕ(Indок / Indвідн) =ϕо(Indок / Indвідн) ± |
0,059 . |
(3.6) |
|
n |
|
3.5.Питання для самостійної підготовки
1.Характеристика методів окиснення-відновлення.
2.Оцінка окисно-відновної здатності речовини за її окисно-відновним потенціалом.
3.Рівняння Нернста. Характеристика величин, які входять у нього.
4.Константа рівноваги реакцій окиснення-відновлення.
5.Будова та принцип дії водневого електроду.
6.Фактори, від яких залежить швидкість окисно-відновних реакцій.
7.Як визначають напрям і повноту протікання окисно-відновних реакцій?
8.Окисно-відновні індикатори. Інтервал переходу і рТ цих індикаторів.
30
