
Методичка з Фіз.хімії з Лр
..pdf
Поверхнева активність залежить від будови молекули ПАР. Вона зменшується з ростом полярності молекули і зростає з ростом вуглеводневого ланцюга. В межах гомологічного ряду органічних речовин поверхнева активність зростає у 3-3,5 рази при збільшенні вуглеводневого радикалу на одну -CH2- групу (правило Дюкло-Траубе).
В 1908, досліджуючи розчини жирних кислот, польський вчений Богдан Шишковський. (Szyszkowski, 1873-1931), що працював на той час у Київському університеті, встановив залежність між зменшенням поверхневого натягу водного розчину та концентрацією жирних кислот:
= 0 – = Aln(Kc + 1) ( 15)
де - зменшення поверхневого натягу,0- поверхневий натяг розчину та чистої води; A, K - емпіричні константи.
В 1917 р. американський фізико-хімік Ірвінг Ленгмюр (Langmuir, 18811957) вивів рівняння ізотерми адсорбції, що носить його ім’я:
|
|
|
|
Kc |
( 16) |
|
|
|
|||
|
|
Kc |
|||
|
|
1 |
|||
де |
Г∞ - гранична адсорбція; |
|
|
|
|
К - константа адсорбційно-десорбційної рівноваги; с - концентрація ПАР.
Рівняння Ленгмюра (16) описує ізотерму адсорбції представлену на рис.9. Для знаходження констант рівняння Ленгмюра користуються його лінійною формою:
1 |
|
1 |
|
1 |
|
|
|
|
K |
c |
|||
|
|
|||||
|
|
|
|
|
|
Для цього будують графік у координатах 1
( 17)
1
f (рис.10)
c
Гранична адсорбція залежить від площі, яку займає молекула ПАР в насиченому мономолекулярному шарі:
|
|
|
1 |
|
( 18) |
|
|
|
|||
|
|
|
|||
|
|
|
S0 |
N |
|
|
|
|
|
||
де |
S0 - площа, яку займає |
одна |
молекула ПАР в насиченому |
||
мономолекулярному шарі;
N - число Авогадро.
21
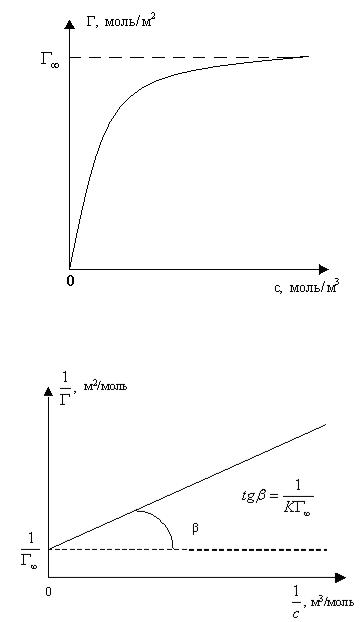
Рис. 9. Ізотерма адсорбції Ленгмюра
Рис. 10. Знаходження констант рівняння Ленгмюра.
Знаючи площу яку займає молекула ПАР в насиченому мономолекулярному шарі знаходять товщину цього шару за формулою:
l∞ = Г∞Vm ( 19)
де Vm = M/d - мольний об’єм ПАР; M - молярна маса;
d - густина ПАР.
За сучасними уявленнями константа рівняння Шишковського A = Г∞RT; а константа К така ж, як і в рівнянні Ленгмюра, причому, в межах гомологічного ряду органічних сполук зростає в 3-3,5 рази при зростанні молекули на одну -СН2-групу.
22
Міцелоутворення у розчинах поверхнево-активних речовин
Поверхнево-активні речовини (ПАР) за класифікацією Ребіндера поділяють на дві групи: істинно розчині у воді та колоїдні. До першої групи відносяться речовини з коротким вуглеводневим радикалом. Вони є лише слабкими змочувачами та піноутворювачами і не мають емульгуючої, солюбілізуючої та миючої дії.
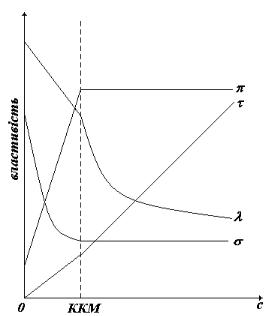
Молекули другої групи ПАР відрізняються високою полярністю гідрофільних груп і досить довгим вуглеводневим радикалом (С8 і більше). У дуже розведених розчинах ці ПАР ведуть себе як звичайні електроліти, та, при досягненні певної концентрації їхні фізичні властивості – електропровідність (λ), осмотичний тиск (π), мутність (τ), поверхневий натяг
(σ) та ін., різко змінюються (рис. 11).
Рис. 11. Концентраційна залежність фізичних властивостей розчинів колоїдних ПАР
Аномальна поведінка колоїдних ПАР пояснюється утворенням іонних агрегатів – міцел, в котрих олеофільні вуглеводневі ланцюги орієнтовані всередину міцели, а гідрофільні групи назовні – до водного середовища. Концентрація, при якій утворення міцел стає значним, називають критичною концентрацією міцелоутворення (ККМ).
Процес утворення міцел протікає самочинно. У розчині встановлюється рівновага між міцелами і істинно розчинними молекулами чи іонами. При
23
розведенні розчину нижче ККМ міцели розпадаються з утворенням істинного розчину. При підвищенні концентрації міцелярний розчин ПАР проходить ряд рівноважних стадій, що характеризуються певним числом агрегації, розміром і формою міцел. В залежності від концентрації розчину міцели мають різну будову. При невеликих концентраціях вони сферичні (міцели Гартлі), містять від 20 до 100 молекул і мають діаметр, що дорівнює подвоєній довжині молекули ПАР. При досягненні певної концентрації сферичні міцели взаємодіють між собою, деформуються і приймають циліндричну та дископодібну форму (пластинчаті міцели Мак-Бена) і аж до утворення рідкокристалічної желеподібної структури.
Будову міцели олеїнової кислоти (цис-9-октадеценової – С17Н33СООН) стабілізованої олеатом калію у водному розчині схематично можна зобразити формулою:
{[mOlH]∙nOl¯∙ (n-x)K+}x-∙xK+
У розчинах колоїдних ПАР кількість речовини у міцелярній формі може у багато разів перевищувати її кількість у молекулярному виді, що має велике значення для застосування ПАР у різних областях техніки.
Міцелярні розчини ПАР мають здатність до солюбілізації – розчинності неполярних речовин, наприклад вуглеводнів, жирів, у водних розчинах ПАР, оскільки вони поглинаються неполярними ядрами міцел. При солюбілізації утворюються прозорі, термодинамічно стійкі системи, які не розшаровуються з часом. Неводні міцелярні розчини можуть зв’язувати велику кількість води. В органічних розчинниках міцели побудовані таким чином, що полярні групи орієнтовані всередину і в них солюбілізуються (розчиняться) полярні молекули води.
Колоїдні ПАР мають миючі властивості. Механізм миючої дії включає кілька стадій. Миючий засіб знижує поверхневий натяг розчину, а це покращує змочування забруднених предметів і сприяє проникненню розчину між волокнами, у пори та капіляри. Адсорбція ПАР на частинках бруду і поверхні матеріалу, який обробляється, спричиняє відрив частинок бруду від предмета та стабілізації їх у розчині. Утворення піни забезпечує флотацію і видалення забруднень, хоча ця стадія необов’язкова, а деколи і небажана.
Поверхнево-активні речовини знаходять широке застосування у різних галузях: для отримання консистентних мастил (літол, нігрол, солідол…), загущених горючих речовин (напалм) і мастильно-охолоджуючих рідин, для захисту металів від корозії, для збільшення пластичності бетонних сумішей, для отримання піни при гасінні пожеж, для ліквідації нафтових плям, що
24
утворились у водоймах в результаті аварій. Також їх застосовують у гальваніці, у флотаційному збагаченні руд, у виробництві емульсійних фарб, харчових продуктів, лікарських засобів… Найбільша кількість ПАР використовується для отримання синтетичних миючих засобів – детергентів. З іншого боку, розширення областей застосування ПАР та постійне зростання їх асортименту і обсягів виробництва створює дуже важливі екологічні проблеми.
При вивченні властивостей колоїдних ПАР постає питання визначення їх поверхневої активності та ККМ.
Адсорбційне рівняння Гіббса (12) справедливе і для колоїдних ПАР але оскільки концентрація цих речовин, як правило дуже мала, то його краще представляти у вигляді:
|
d |
|
1 |
( 20) |
|
d ln c |
RT |
||||
|
|
||||
|
|
|
|||
або |
|
|
|
|
|
-d = ГRTdlnc |
( 21) |
||||
При повному заповненні мономолекулярного шару на межі розділу водний розчин-повітря Г=Г∞, концентрація істинно розчинних молекул ПАР дорівнює ККМ і не змінюється при їх подальшому додаванні, а тому поверхневий натяг розчину також не змінюється. На ізотермі поверхневого натягу з’являється точка перегину, яка більш різко виявляється коли ізотерма побудована у напівлогарифмічних координатах =f(lnc) (рис.12) у
відповідності до рівняння (21). |
|
|
|
|
|
|
|
За тангенсом кута нахилу прямолінійної ділянки, що передує точці |
|
||||||
перегину знаходять граничну адсорбцію: |
|
|
|
|
|
|
|
|
d |
|
1 |
|
tg |
|
( 22) |
|
|
|
|||||
|
d ln c |
|
RT |
|
RT |
||
|
|
|
|
||||
Поверхневу активність g=-d /dc колоїдних ПАР знаходять, як за тангенсом кута нахилу дотичної до ізотерми поверхневого натягу = f(c) (рис.8), так і за наближеною формулою:
g |
|
0 |
ккм |
( 23) |
|
ККМ |
|||
|
|
|
||
25
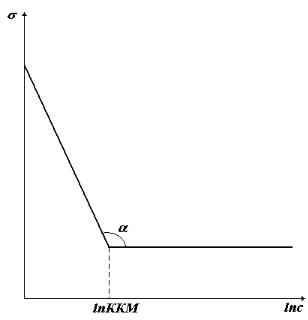
Рис. 12. Ізотерма поверхневого натягу розчину колоїдної ПАР у напівлогарифмічних координатах
Критичну концентрацію міцелоутворення визначають за зміною перерахованих вище фізичних властивостей розчину.
Лабораторна робота №4. Адсорбція поверхнево-активних речовин на межі розділу водний розчин – повітря.
Мета роботи: Визначити поверхневу активність ПАР у водних розчинах та підтвердити правило Траубе-Дюкло.
Для дослідження закономірностей адсорбції поверхнево-активних речовин на межі водного розчину з повітрям можна використати 1,5 М розчин н-пропілового або ізо-пропілового спирту, 0,5 М розчин н-бутилового спирту; 0,2 М розчин ізо-амілового спирту або 0,1 М розчин н-амілового спирту; 2 М розчин оцтової кислоти, 1 М розчин пропіонової кислоти або 0,5 М розчин масляної кислоти.
Порядок виконання роботи
1. Визначити поверхневий натяг розчинів двох ПАР, що відрізняються на одну –СН2– групу, та чистої води методом «відриву кільця». Для цього виміряти з допомогою торсійної ваги зусилля відриву кільця від поверхні чистої води F0 та від поверхні розчинів, що досліджуються, F.
26

Вимірювання почати з чистої води, потому дослідити розчини ПАР йдучи від найменшої концентрації до більшої.
Поверхневий натяг розчинів розрахувати за формулою:
|
|
|
0 |
F , |
Дж/м2 |
( 24) |
||||
|
|
F0 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
де |
σ0 = 72,75 .10-3 Дж/м2 – поверхневий натяг води при 200С. |
|||||||||
2. Побудувати ізотерми поверхневого натягу = f(c) |
(рис.8). |
|||||||||
|
|
|
|
|
|
|
|
|
Таблиця 3 |
|
|
|
Результати вимірювань |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
Речовина |
c, |
|
F, |
|
103, |
|
g 103, |
|
||
моль/м3 |
|
|
мг |
|
Дж/м2 |
|
Дж∙м/моль |
|
||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.Провести дотичні до побудованих кривих в точці с=0 (в точці перетину ізотерми поверхневого натягу з віссю ординат) .
4.За тангенсом кута нахилу дотичних до осі абсцис знайти поверхневу активність досліджених речовин:
g d tg dc
5. Знайти відношення g2/g1 і зробити висновок про його відповідність правилу Траубе-Дюкло.
Контрольні питання
1.Який параметр є критерієм направленості процесів, що протікають в поверхневому шарі?
2.В результаті яких процесів може змінюватись потенціал Гіббса поверхні?
3.Запишіть та проаналізуйте фундаментальне рівняння Гіббса, яке описує процес адсорбції.
4.Що розуміють під терміном “поверхнева активність”?
27
5.Що є мірою здатності речовини адсорбуватись на поверхні розділу рідина - газ? Сформулюйте правило Дюкло-Траубе.
6.Які речовини називають поверхнево-активними? Який вигляд має крива залежності поверхневого натягу від концентрації ПАР у розчині?
7.Чому поверхневий натяг розчину не є адитивною характеристикою поверхневих натягів його компонентів?
8.Поясніть будову молекули ПАР. Що є мірою поверхневої активності ПАР?
9.Наведіть приклади катіоноактивних, аніоноактивних та неіоногенних ПАР.
10.Які речовини називають поверхнево-інактивними? Наведіть графік залежності поверхневого натягу від концентрації поверхнево-інактивної речовини.
Лабораторна робота №5. Визначення критичної концентрації міцелоутворення колоїдних ПАР.
Мета роботи Визначити поверхневу активність та критичну концентрацію міцелоутворення декількох колоїдних поверхнево-активних речовин.
Для дослідження можна використати олеат калію (вихідна концентрація 0,01М), стеарат калію (0,01 М), пальмітат калію (0,05 М), додецилсульфат натрію (0,5 М), та неіонні ПАР – сульфоетоксилат , неонол , ОП-20 та ін.
Порядок виконання роботи
1.Отримати у викладача завдання і приготувати 6-8 розчинів поверхнево-активної речовини (по 25 мл) , послідовно зменшуючи концентрацію вихідного розчину у 5÷10 разів.
2.Визначити поверхневий натяг розчинів методом «відриву кільця» (Див. попередню роботу)
3.Побудувати ізотерму поверхневого натягу = f(c) (рис.8) та знайти поверхневу активність розчину за тангенсом кута нахилу дотичної до кривої
уточці с = 0.
4.Побудувати ізотерму поверхневого натягу у напівлогарифмічних
координатах = f(lnc) (рис.12). 5. Визначити ККМ.
28
5.Знайти кутовий коефіцієнт прямолінійної ділянки ізотерми і розрахувати граничну адсорбцію за формулою (22).
5.Розрахувати поверхневу активність за формулою (23) та порівняти із знайденою в п.2.
6.Розрахувати площу, яку займає одна молекула ПАР в насиченому мономолекулярному шарі S0.
7.Розрахувати товщину насиченого мономолекулярного шару l∞.
8.Отримані експериментальні дані та розраховані величини подати у вигляді таблиць 5 і 6.
9.В протокол досліду включити графіки залежностей: =f(c) та =f(lnc)
Таблиця 4
Результати вимірювань
№, |
c, |
F, |
103, |
lnc |
з/п |
моль/м3 |
мг |
Дж/м2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблиця 5 |
|
|
|
Результати розрахунків |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
ККМ, |
d /dc |
|
d /dc |
|
∞, |
S0, |
|
l, |
моль/м3 |
(за графіком.), |
|
(за формулою), |
|
моль/м |
м2 |
|
м |
|
Дж∙м/моль |
|
Дж∙м/моль |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Контрольні питання
1.В чому полягають відмінності між істинно розчинними та колоїдними ПАР?
2.Що називають критичною концентрацією міцелуотворення?
3.Як знаходять ККМ?
4.Що таке поверхнева активність і як її знаходять для розчинів колоїдних ПАР?
5.Яка будова міцел колоїдних ПАР у водному розчині та в органічному неполярному розчиннику?
29
6.Як змінюється будова міцел ПАР у залежності від концентрації розчину?
7.Що таке солюбілізація?
8.В чому полягає миюча дія ПАР?
9.Як знайти площу, що займає молекула в насиченому мономолекулярному шарі та товщину цього шару?
10.Які області застосування колоїдних ПАР?
30
