
- •Вещество
- •Атомно-молекулярная теория
- •Атомно - молекулярное учение.
- •Химические формулы
- •Физические и химические процессы
- •Химические реакции
- •Основные законы в химии
- •Строение вещества
- •Периодическая система д.И. Менделеева
- •Химическая связь
- •Ковалентная связь
- •Гибридзация атомных орбиталей.
- •Ионная связь
- •Водородная связь
- •Химическая кинетика и равновесие
- •Закон действующих масс
- •Химические реакции делятся на обратимые и необратимые
- •В общем виде для реакции
- •Влияние температуры на состояние равновесия
Гибридзация атомных орбиталей.
Рассмотрим образование молекулы метана СН4. Атом углерода в возбужденном состоянии обладает четырьмя неспаренными электронами: одним s-электроном и тремя p-электронами — 1s22s22p3.
Рассуждая аналогично тому, как в случае Н2О или NН3, можно было бы предполагать, что атом углерода будет образовывать три связи С-Н, направленные под прямым углом друг к другу (р-электроны), и одну связь, образованную s-электроном, направление которой было бы произвольным, поскольку s-орбиталь имеет сферическую симметрию.
Тогда следовало ожидать, что три связи С-Н в СН4 окажутся направленными р-связями и совершенно одинаковыми, а четвертая связь есть ненаправленная s-s-связь и отличается от первых трех.
Однако экспериментальные данные показали, что все четыре связи С-Н в молекуле метана СН4 одинаковы и направлены к вершинам тетраэдра (угол между ними составляет 109,5°).
Объяснение этого факта впервые было дано американским химиком Л. Полингом. Ввиду относительной близости значений энергии 2s- и 2р-электронов, эти электроны могут взаимодействовать между собой в ходе образования химической связи с электронами другого атома, давая четыре новых равноценных гибридных электронных облака.
Четыре совершенно одинаковые sp3-гибридные орбитали атома углерода расположены под углом 109,5° друг к другу и направлены к вершинам тетраэдра, в центре которого находится атом углерода.
На рисунке видно, что
гибридная орбиталь сильно вытянута в
одну сторону от ядра.
Это обусловливает более сильное перекрывание гибридных орбиталей с орбиталями электронов других атомов по сравнению с перекрыванием «обычных» s- и р-орбиталей и приводит к образованию более прочных связей.
Гибридизация оказывается характерной не только для соединений атома углерода. Гибридизация орбиталей происходит всегда, когда в образовании связей участвуют электроны, надлежащие к различным типам орбиталей.
Рассмотрим примеры различных
видов гибридизации s- и p-орбиталей.
Гибридизация одной s-
и одной р-орбиталей (sp-гибридизация)
происходит при образовании молекул
галогенидов элементов II группы (Be,
Mg,
Zn
и др.). Атомы этих элементов в основном
состоянии имеют на внешнем слое два
спаренных s-электрона.
В результате возбуждения один из
электронов s-орбитали
переходит на близкую по энергии
р-орбиталь, т.е. появляются два неспаренных
электрона, один из которых занимает s-,
а другой р-орбиталь. При возникновении
химической связи эти две различные
орбитали превращаются в две одинаковые
гибридные орбитали (тип гибридизации
- sp),
направленные под углом 180° друг к другу,
т.е. эти две связи имеют противоположное
направление.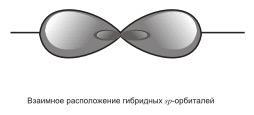
Экспериментальное определение структуры молекул ВеХ2, ZnХ2, HgX2 и т.д.(Х — галоген) показало, что эти молекулы действительно являются линейными.
Остановимся подробнее на структуре молекулы ацетилена С2Н2. В молекуле ацетилена каждый атом углерода находится в sp-гибридном состоянии, образуя две гибридные связи, направленные под углом 180° друг к другу. Как в случае связей С-С, так и в случае связей С-Н возникает общее двухэлектронное облако, образующее σ-связи. σ-связью называют связь, возникающую при обобществлении электронных облаков двух атомов, если облака перекрываются по линии, соединяющей атомы.
Но в молекуле ацетилена в каждом из атомов углерода содержится еще по два р-электрона, которые не принимают участия в образовании σ-связей. Молекула ацетилена имеет плоский линейный «скелет», поэтому оба р-электронных облака в каждом из атомов углерода выступают из плоскости молекулы в перпендикулярном к ней направлении. При этом происходит также некоторое взаимодействие электронных облаков, но менее сильное, чем при образовании σ-связей. В итоге, в молекуле ацетилена образуются еще две ковалентные углерод-углеродные связи, называемые π-связями .
В общем случае π-связью
можно назвать ковалентную
связь, образованную при перекрывании
атомных орбиталей вне линии, соединяющей
атомы.
σ-cвязи являются более прочными, чем π-связи, чем объясняется большая реакционная способность непредельных углеводородов по сравнению с предельными.
Еще один вид гибридизации s- и р-орбиталей осуществляв в соединениях бора, алюминия или углерода (этилен, бензол). Возбужденный атом бора имеет три неспаренные электрона - один s- и два p-электрона. В этом случае при образовании соединений бора происходит гибридизация одной s- и двух р-орбиталей (sp2-гибридизация), при этом образуются три одинаковые sp2 - гибридные орбитали, расположенные под углом 120° друг к другу .

Действительно, эксперименты показали, что такие соединения, как ВF3, АlCl3, а также этилен и бензол имеют плоское строение, и все три связи В-F, например, в молекуле ВF3 расположены под углом 120° друг к другу.
Посредством образования sp2-гибридных орбиталей как раз и объясняются структуры непредельных углеводородов с двойными связями. Например, для такой молекулы, как этилен, схематично можно изобразить следующую структуру .

Как видно, у каждого атома углерода есть σ-связи, образованные sp2-гибридными облаками, кроме того, между атомами углерода образуется π-связь за счет перекрывания p-орбиталей. Таким образом, двойные углерод-углеродные связи состоят из одной σ- и одной π-связи.
