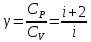16. Внутренняя энергия. Количество теплоты. Работа в термодинамике. Первый закон термодинамики. Теплоёмкость вещества.
Внутренняя энергия– энергия хаотического (теплового) движения микрочастиц системы и энергия взаимодействия этих частиц.
Внутренняя энергия – однозначная функция термодинамического состояния системы, т.е. в каждом состоянии система обладает вполне определенной внутренней энергией (она не зависит от того как энергия пришла в данное состояние). Это означает, что при переходе системы из одного состояния в другое измерение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода.
Число
степеней свободы
– число независимых переменных
(координат), полностью определяющих
положение системы в пространстве.
Двухатомный газ обладает 5 степенями
свободы. Трехатомный газ имеет 6 степеней
свободы (3 поступательных и 3 вращательных).
Независимо от общего числа степеней
свободы молекул три степени свободы
всегда поступательные. Ни одна из
поступательных степеней свободы не
имеет преимущества перед другими,
поэтому на каждую из них приходится в
среднем одинаковая энергия, равная
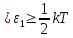
В
классической статистической физике
выводится закон
Больцмана о равномерном распределении
энергии по степеням свободы молекул:
для
статистической системы, находящейся в
состоянии термодинамического равновесия,
на каждую поступательную и вращательную
степени свободы приходится в среднем
кинетическая энергия, равная
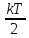 ,
,
А
на каждую колебательную степень свободы
– в среднем энергия, равная
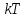 .
Таким образом, средняя энергия молекулы
.
Таким образом, средняя энергия молекулы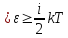 , где
, где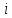 - сумма числа поступательных, числа
вращательных и удвоенного числа
колебательных степеней свободы молекулы.
- сумма числа поступательных, числа
вращательных и удвоенного числа
колебательных степеней свободы молекулы.
В
классической теории рассматривают
молекулы с жесткой связью между атомами,
для них
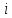 совпадает
с числом степеней свободы молекулы.
совпадает
с числом степеней свободы молекулы.
Внутренняя энергия для произвольной массы m газа
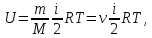
где М – молярная масса, v – количество вещества.
Количество теплоты - энергия, переданная системе внешними телами путем теплообмена(процесс обмена внутренними энергиями при контакте тел с разными температурами). Можно говорить о двух формах передачи энергии от одних тел к другим: работе и теплоте. Энергия механического движения может превращаться в энергию теплового движения и наоборот. При этих превращениях соблюдается закон сохранения и превращения энергии, применительно к термодинамическим процессам этим законом и является первое начало термодинамики, установленное в результате обобщения многовековых опытных данных.
Первое
начало термодинамики : теплота, сообщаемая
системе, расходуется на изменение ее
внутренней энергии и на совершение ею
работы против внешних сил. В дифференциальной
форме уравнение будет иметь вид :
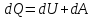
Или
в более корректной форме:
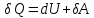 ,
,
где
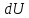 – бесконечно малое изменение внутренней
энергии системы,
– бесконечно малое изменение внутренней
энергии системы,
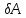 – элементарная работа,
– элементарная работа,
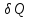 - бесконечно малое количество теплоты.
- бесконечно малое количество теплоты.
В СИ количество теплоты измеряется в джоулях (Дж).
Если
система периодически возвращается в
первоначальное состояние, то изменение
её внутренней энергии
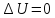 .
Тогда, согласно первому началу
термодинамики,
.
Тогда, согласно первому началу
термодинамики,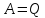 .
.
Удельная
теплоемкость
вещества
– величина, равная количеству теплоты,
необходимому для нагревания одного
килограмма на один Кельвин:
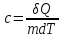 ,
,
Единица удельной теплоемкости: джоуль на кг-кельвин (Дж/(кг*К)).
Молярная
теплоемкость
– величина, равная количеству теплоты,
необходимому для нагревания 1 моль
вещества на 1 К:
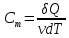 ,
,
где
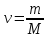 количество вещества.
количество вещества.
Единица молярной теплоемкости: джоуль на моль-кельвин (Дж/(моль*К)).
Удельная
теплоемкость
с
связана с молярной Сm
отношением:
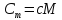 ,
где
,
где
М – молярная масса в-ва.
Молярная
теплоемкость газа при постоянном объеме
равна изменению внутренней энергии 1
моль газа при повышении его температуры
на 1 К. Тогда:
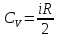
Уравнение Майера: оно показывает, что СP всегда больше СV на величину молярной газовой постоянной.
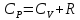
Использовав
уравнение:
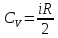 ,
,
Уравнение Майера можно записать в виде:
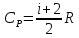
При
рассмотрении термодинамических процессов
важно знать характерное для каждого
газа отношение CP
к CV
: