
- •А.В. Кирис, в.В. Лисин
- •1. Введение. Основные понятия и определения….........................................6
- •Техническая термодинамика
- •Светлой памяти профессора
- •Основы термодинамики
- •1. Введение. Основные понятия и определения
- •1.1 Рабочее тело
- •1.2 Термодинамическая система
- •1.3 Параметры состояния Термодинамическим состоянием тела называется совокупность физических свойств, присущих данного телу.
- •1.4 Основные законы идеальных газов
- •2. Состояние термодинамической системы
- •2.1 Уравнение состония. Объединенный газовый закон
- •2.2 Физический смысл газовой постоянной r
- •2.3 Универсальное уравнение состояния идеального газа
- •2.4 Газовые смеси
- •2.5 Способы задания смеси
- •2.6 Расчет газовой смеси. Основные расчетные соотношения
- •2.7 Уравнение состояния для смеси
- •3.2 Закон Майера
- •3.3 Первый закон термодинамики
- •3.4 Аналитическое определение и графическое изображение работы
- •3.5 Теплота и работа в термодинамическом процессе
- •3.6 Внутренняя энергия
- •3.7 Энтальпия
- •3.8 Контрольные вопросы
- •4. Основные термодинамические процессы
- •4.1 Методика исследования термодинамических процессов
- •4.2 Изохорный процесс
- •4.3 Изобарный процесс
- •4.4 Изотермный процесс
- •4.5 Адиабатный процесс
- •4.6 Политропный процесс
- •4.7 Теплоемкость политропного процесса
- •4.8 Определение численного значения показателя n
- •4.9 Взаиморасположение термодинамических процессов в p-V
- •Все рассмотренные нами процессы имели n0 и процессы располага-лись в II и IV четвертях. В данном случае при расширении давление
- •4.10 Контрольные вопросы
- •5. Второй закон термодинамики
- •5.1 Круговые процессы
- •5.2 Второй закон термодинамики
- •5.3 Некоторые формулировки второго закона термодинамики
- •5.4 Обратимость термодинамических процессов
- •5.5 Цикл Карно
- •5.7 Энтропия
- •5.8 Работоспособность (эксергия)
- •5.9 Пределы применимости второго закона
- •5.10 Контрольные вопросы
- •6. Изменение энтропии в процессах.
- •6.1 Координатная система t - s
- •6.2 Обобщенный (регенеративный) цикл Карно
- •6.3 Среднеинтегральная температура
- •6.4 Энтропийные уравнения
- •6.5 Изображение термодинамических процессов в t-s координатной системе
- •7.2 Диаграмма Эндрюса
- •7.3 Механизм парообразования
- •7.5 Процесс парообразования в р-V диаграмме. Виды пара
- •7.6 График парообразования в t-s диаграмме
- •7.7 Таблицы термодинамических свойств воды и пара
- •7.8 Теплота парообразования
- •7.9 Анализ параметров трех фаз парообразования. Критические
- •7.10 Измерения энтропии по трем фазам парообразования
- •7.11 Диаграмма I – s
- •7.12 Контрольные вопросы
- •8. Воздух
- •8.1 Влажный воздух
- •8.2 Диаграмма I – d для влажного воздуха
- •8.3 Контрольные вопросы
- •Техническая термодинамика
- •9. Циклы паросиловых установок
- •9.1 Паровой цикл Карно
- •9.2 Цикл Ренкина
- •9.3 Повышение
- •9.4 Цикл с двойным перегревом пара
- •9.5 Регенеративный цикл
- •9.6 Коэффициенты полезного действия
- •10. Циклы двигателей внутреннего сгорания
- •10.1 Цикл Отто (цикл быстрого горения с подводом теплоты при постоянном объеме)
- •10.2 Цикл Дизеля (цикл медленного горения, с подводом теплоты при постоянном давлении)
- •10.3 Цикл Тринклера (цикл со смешанным подводом теплоты)
- •10.4 Сравнение циклов двс
- •10.5 Контрольные вопросы
- •11. Циклы газотурбинных установок и реактивных двигателей
- •11.1 Газотурбинные установки. Общая характеристика
- •11.2 Цикл простейшей гту
- •11.3 Принцип работы реактивного двигателя
- •11.4 Способы повышения гту
- •11.5 Контрольные вопросы
- •12. Циклы холодильных установок
- •12.1 Холодильные установки морских судов
- •12.2 Циклы воздушных, пароэжекторных и абсорбционных холодильных установок
- •12.3 Контрольные вопросы
- •13. Компрессоры
- •13.1 Компрессоры
- •13.2 Определение работы ступени идеального компрессора
- •13.3 Цикл одноступенчатого компрессора
- •13.4 Контрольные вопросы
- •14. Истечение
- •14.1 Определение работы истечения газа или пара
- •Тогда работа против внешних сил при перем ещении составит p1v1 - p2 v2.
- •14.2 Определение скорости при истечении
- •14.3 Массовый секундный расход газа или пара при адиабатном расширении
- •14.4 Форма струи при адиабатном истечении газа и пара
- •14.6 Построение сопла для использовании полного теплоперепада (сопла переменного сечения – сопла Лаваля)
- •14.7 Истечение через короткое цилиндрическое сопло
- •14.8 Графики скорости, расхода и удельного объема
- •14.9 Изохорное истечение газа и пара
- •14.10 Адиабатное истечение с трением
- •14.11 Дросселирование (мятие) пара
- •14.12 Контрольные вопросы
- •Термодинаміка і теплотехніка
- •Навчальний посібник у двох частинах
- •Частина 1
- •Термодинаміка
2.2 Физический смысл газовой постоянной r
Для
произвольного количества газа с массой
m
кг уравнение состояния имеет вид
,
где V-
объем произвольного количества газа,
м3.
Пусть
для первого состояния газа
,для
второго состояния при том же давлении
.
,
откуда
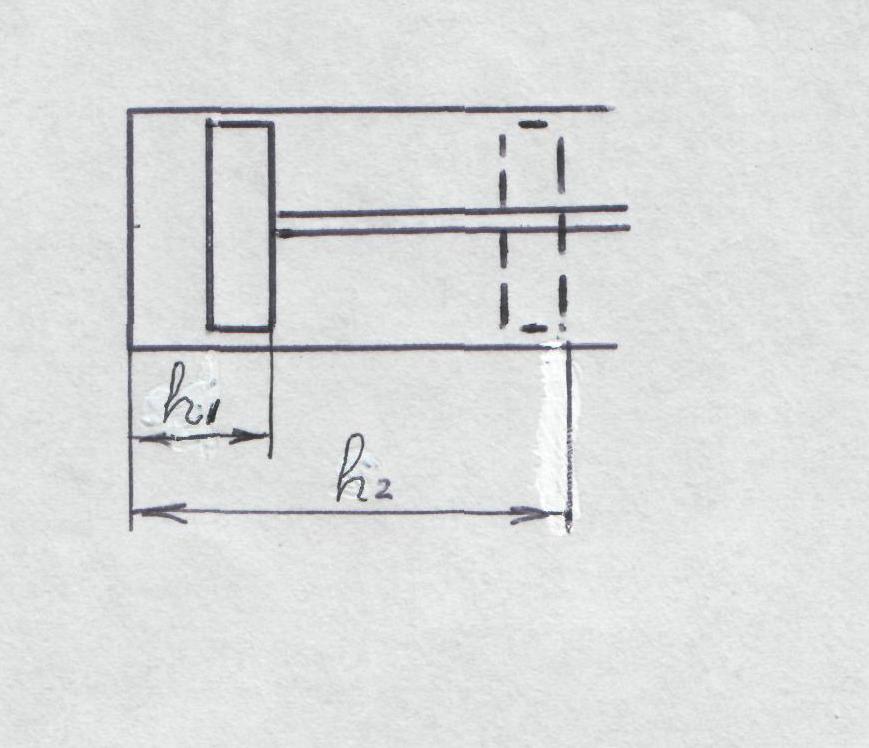
Представим рабочее тело в цилиндре под поршнем, которое находится под давлением р. При подводе
Рис. 4 тепла это рабочее тело будет расширяться, а так как поршень не противодействует расширению, давление рабочего тела останется прежним.
Сила,
которая действует на поршень, определится
произведением pS.
Работа, произведенная поршнем, будет
равна pS(h2-h1)
(рис. 4). Раскрыв скобки, получим pS(h2-h1)=
pSh2
-
pSh1,
однако Sh1=
-
объем рабочего тела в положении 1, а
Sh2=V2-
объем в положении 2, так как S
– площадь поршня, а h
- расстояние от крышки цилиндра до
плоскости поршня.
Следовательно,
представляет
собой работу при р
=
const.
Размерность газовой постоянной
=
.
Недостатком
уравнения (13) является его «неуниверсальность»,
так как значение газовой постоянной
зависит от молярной массы
.
2.3 Универсальное уравнение состояния идеального газа
Вспомним, что количество газа, масса которого в кг равна числу единиц в молекулярном весе, называется килограммолекулой или киломолем (кмоль) К.
Уравнению Клапейрона можно придать универсальную форму, если газовую постоянную отнести не к 1 кг газа, а к одному киломолю.
Масса киломоля, по определению, численно равна молярной массе и измеряется в кг/кмоль.
Молярной
массой
называется
отношение массы m
вещества к его количеству К
[
]
. (14)
Объем
киломоля каждого газа равен
и
измеряется в м3/кмоль.
Из закона Авогадро вытекает, что плотности газов при одинаковых р и Т прямо пропорциональны их молярным массам
Отношение плотностей можно заменить обратным отношением удельных объемов
,
откуда
.
(16)
Т.е.
произведение удельного объема газа на
его молярную массу при одинаковых
физических условиях величина постоянная
и от природы газа не зависит,
.
Уравнение
состояния для 1 кмоль газа получим в
виде
,
откуда
где
-
универсальная газовая постоянная.
При
нормальных физических условиях (р=101325
Н/м2,
Т=273оК)
объем 1 кмоль v
=
=22,41
м3/кмоль.
Тогда
представляет
собой работу 1 кмоль идеального газа в
процессе при
Универсальное уравнение состояния, отнесенное к 1 кмоль газа, называется уравнением состояния Клапейрона-Менделеева, т.к. оно впервые предложено в 1874 г. Д. И.Менделеевым, и имеет вид
рv
=8314.
Т. (19)
