
- •А.В. Кирис, в.В. Лисин
- •1. Введение. Основные понятия и определения….........................................6
- •Техническая термодинамика
- •Светлой памяти профессора
- •Основы термодинамики
- •1. Введение. Основные понятия и определения
- •1.1 Рабочее тело
- •1.2 Термодинамическая система
- •1.3 Параметры состояния Термодинамическим состоянием тела называется совокупность физических свойств, присущих данного телу.
- •1.4 Основные законы идеальных газов
- •2. Состояние термодинамической системы
- •2.1 Уравнение состония. Объединенный газовый закон
- •2.2 Физический смысл газовой постоянной r
- •2.3 Универсальное уравнение состояния идеального газа
- •2.4 Газовые смеси
- •2.5 Способы задания смеси
- •2.6 Расчет газовой смеси. Основные расчетные соотношения
- •2.7 Уравнение состояния для смеси
- •3.2 Закон Майера
- •3.3 Первый закон термодинамики
- •3.4 Аналитическое определение и графическое изображение работы
- •3.5 Теплота и работа в термодинамическом процессе
- •3.6 Внутренняя энергия
- •3.7 Энтальпия
- •3.8 Контрольные вопросы
- •4. Основные термодинамические процессы
- •4.1 Методика исследования термодинамических процессов
- •4.2 Изохорный процесс
- •4.3 Изобарный процесс
- •4.4 Изотермный процесс
- •4.5 Адиабатный процесс
- •4.6 Политропный процесс
- •4.7 Теплоемкость политропного процесса
- •4.8 Определение численного значения показателя n
- •4.9 Взаиморасположение термодинамических процессов в p-V
- •Все рассмотренные нами процессы имели n0 и процессы располага-лись в II и IV четвертях. В данном случае при расширении давление
- •4.10 Контрольные вопросы
- •5. Второй закон термодинамики
- •5.1 Круговые процессы
- •5.2 Второй закон термодинамики
- •5.3 Некоторые формулировки второго закона термодинамики
- •5.4 Обратимость термодинамических процессов
- •5.5 Цикл Карно
- •5.7 Энтропия
- •5.8 Работоспособность (эксергия)
- •5.9 Пределы применимости второго закона
- •5.10 Контрольные вопросы
- •6. Изменение энтропии в процессах.
- •6.1 Координатная система t - s
- •6.2 Обобщенный (регенеративный) цикл Карно
- •6.3 Среднеинтегральная температура
- •6.4 Энтропийные уравнения
- •6.5 Изображение термодинамических процессов в t-s координатной системе
- •7.2 Диаграмма Эндрюса
- •7.3 Механизм парообразования
- •7.5 Процесс парообразования в р-V диаграмме. Виды пара
- •7.6 График парообразования в t-s диаграмме
- •7.7 Таблицы термодинамических свойств воды и пара
- •7.8 Теплота парообразования
- •7.9 Анализ параметров трех фаз парообразования. Критические
- •7.10 Измерения энтропии по трем фазам парообразования
- •7.11 Диаграмма I – s
- •7.12 Контрольные вопросы
- •8. Воздух
- •8.1 Влажный воздух
- •8.2 Диаграмма I – d для влажного воздуха
- •8.3 Контрольные вопросы
- •Техническая термодинамика
- •9. Циклы паросиловых установок
- •9.1 Паровой цикл Карно
- •9.2 Цикл Ренкина
- •9.3 Повышение
- •9.4 Цикл с двойным перегревом пара
- •9.5 Регенеративный цикл
- •9.6 Коэффициенты полезного действия
- •10. Циклы двигателей внутреннего сгорания
- •10.1 Цикл Отто (цикл быстрого горения с подводом теплоты при постоянном объеме)
- •10.2 Цикл Дизеля (цикл медленного горения, с подводом теплоты при постоянном давлении)
- •10.3 Цикл Тринклера (цикл со смешанным подводом теплоты)
- •10.4 Сравнение циклов двс
- •10.5 Контрольные вопросы
- •11. Циклы газотурбинных установок и реактивных двигателей
- •11.1 Газотурбинные установки. Общая характеристика
- •11.2 Цикл простейшей гту
- •11.3 Принцип работы реактивного двигателя
- •11.4 Способы повышения гту
- •11.5 Контрольные вопросы
- •12. Циклы холодильных установок
- •12.1 Холодильные установки морских судов
- •12.2 Циклы воздушных, пароэжекторных и абсорбционных холодильных установок
- •12.3 Контрольные вопросы
- •13. Компрессоры
- •13.1 Компрессоры
- •13.2 Определение работы ступени идеального компрессора
- •13.3 Цикл одноступенчатого компрессора
- •13.4 Контрольные вопросы
- •14. Истечение
- •14.1 Определение работы истечения газа или пара
- •Тогда работа против внешних сил при перем ещении составит p1v1 - p2 v2.
- •14.2 Определение скорости при истечении
- •14.3 Массовый секундный расход газа или пара при адиабатном расширении
- •14.4 Форма струи при адиабатном истечении газа и пара
- •14.6 Построение сопла для использовании полного теплоперепада (сопла переменного сечения – сопла Лаваля)
- •14.7 Истечение через короткое цилиндрическое сопло
- •14.8 Графики скорости, расхода и удельного объема
- •14.9 Изохорное истечение газа и пара
- •14.10 Адиабатное истечение с трением
- •14.11 Дросселирование (мятие) пара
- •14.12 Контрольные вопросы
- •Термодинаміка і теплотехніка
- •Навчальний посібник у двох частинах
- •Частина 1
- •Термодинаміка
1.3 Параметры состояния Термодинамическим состоянием тела называется совокупность физических свойств, присущих данного телу.
Величины, характеризующие физические свойства тела в данный момент, называются параметрами состояния.
Непосредственному измерению поддаются три параметра состояния:
давление p, удельный объем v и температура T, которые называются основными или термическими параметрами.
К параметрам состояния относятся также внутренняя энергия u, энтальпия i и энтропия s, называемые калорическими параметрами состояния.
Рассмотрим подробно основные параметры состояния.
Давление – это результат силового воздействия молекул рабочего тела на стенки сосуда, в который оно помещено, или на поверхность тел, погруженных в рабочее тело. Давление вычисляется по выражению
(1)
S – площадь поверхности, м2.
В системе СИ давление измеряется в паскалях 1 Па = 1 Н/м2. Эта единица очень мала, поэтому пользуются кПа и МПа (1 кПа = 103 Па, 1 МПа = 106 Па).
В
технике часто пользуются внесистемной
единицей – баром. 1 бар = =1
Н/м2
= 1
Па
= 0,1 МПа (что соответствует 750 мм.рт.ст.).
Кроме
этого, часто пользуются кгс/м2
и кгс/см2.
Давление, равное одной атмосфере: 1 ат
= 1 кгс/см2
= 104
кгс/м2
= 0,980665
Па
= 0,980665 бар (735,6 мм. рт.ст.).
р
=
h∙
∙g
= h
,
(2)
h
=
,
(3)
-
плотность, кг/м3;
-
удельный вес, Н/м3;
Давление, создаваемое атмосферным воздухом, зависит от высоты. В среднем на уровне моря оно равно 1 атм. Эта величина называется физической атмосферой. Это давление соответствует 760 мм.рт.ст, 101332 Па при измерении манометром или 10,33 м водяного столба.
Барометрическое
(или атмосферное) давление создается
весом столба воздуха, простирающегося
от уровня земли до высоты
300
км. За пределом этого столба воздуха
давление считают равным нулю.
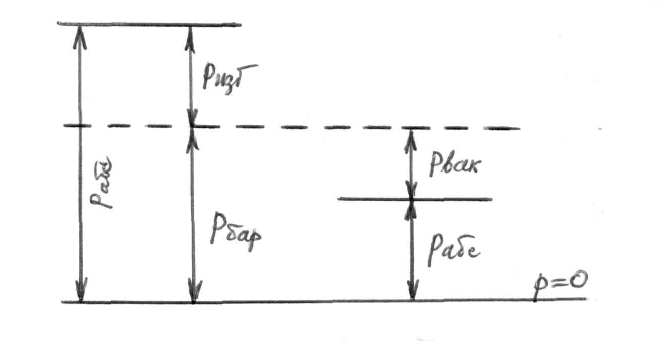
Применяемые в технике манометры (и
Рис. 1.
вакуумметры) фиксируют разность между абсолютным давлением рабс в месте измерения и внешним атмосферным (барометрическим) давлением (рис.1). Если давление в системе больше барометрического, то манометр измеряет разность давлений, которое называется избыточным (или манометрическим) дав-
лением
ризб = рабс – рбар. (4)
Если давление в системе меньше барометрического, то имеет место вакуум, и вакуумметр показывает давление
рвак = рбар – рабс. (5)
Следует иметь в виду, что во все формулы технической термодинамики входит значение абсолютного давления рабс=рбар + ризб либо рабс=рбар- рвак.
Температура определяет направление перехода теплоты, т.е. выступает прежде всего как мера нагретости тела и согласно молекулярно-кинетической теории определяется как величина, соответствующая средней кинетической энергии поступательного движения молекул
где Т – температура, К;
m – масса молекул, кг; W – скорость молекул, м/с;
к – постоянная Больцмана.
Т.к. непосредственно измерять кинетическую энергию нельзя, для измерения температуры пользуются зависимостью какого-либо свойства вещества (тепловое расширение, э.д.с. соприкасающихся металлов, электросопротивление, интенсивность излучения и др.) от температуры. Первый термометр был изготовлен Г.Галилеем в 1597 г. Действие всех термометрических устройств основано на том, что два соприкасающихся тела через некоторое время приходят к состоянию теплового равновесия, т.е. принимают одинаковую температуру.
Существуют две основные температурные шкалы:
- термодинамическая температурная шкала характеризуется тем, что нулевая точка этой шкалы представляет собой наинизшую термодинамически возможную температуру – абсолютный 0;
- международная практическая температурная шкала 1948 г. основывается на шести реперных точках с фиксированными значениями температуры (точка кипения кислорода, тройная точка воды, точки кипения воды и серы, точки затвердевания серебра и золота).
Удельный объем – объем, занимаемый единицей массы вещества
где V– объем вещества, м3;
m – масса вещества, кг.
Обратная величина называется плотностью
=
кг/м3.
(8)
