
ХНС
.pdf
Ще один метод ідентифікації фосфатта гідрофосфат-іонів – це
реакція з магнезіальною сумішшю:
Mg2+ + HPO42– + NH4OH → MgNH4PO4↓ + H2O – осад білого кольору
16. Іони SO42–
SO42– + Ba2+ → BaSO4↓ – білий кристалічний осад, нерозчинний в HCl, HNO3
17. Іони Cl–
Cl– + Ag+ → AgCl↓ – білий сирнистий осад, розчинний в аміаку
AgCl↓ + 2NH3 → [Ag(NH3)2]+ + Cl–
Наступне підкислення знов веде до появи осаду: [Ag(NH3)2]+ + Сl– + 2H+ →
AgCl↓ + 2NH4+
18. Хлор активний
Cl2 + 2KI → 2KCl + I2 – – синє забарвлення з крохмалем і фіолетове у вазеліновому маслі
19. Іони NO3– виявляють з дифеніламіном за появою синього кольору
2 |
NH |
NH |
NH |
2H+ + 2e + |
N |
N |
Ідентифікацію і кількісне визначення можна також проводити за допомогою іон-селективного електроду:
Е = Е° – 0,059 lg a(NO3–)
20. Іони СН3СОО–:
СН3СООNa + H2SO4 → 2CH3COOH + Na2SO4 – запах оцту
При додаванні етилового спирту утворюється леткий ефір з характерним запахом (етилацетат).
Для визначення ацетат-іонов можна використовувати реакцію з хлоридом заліза(III):
FeCl3 + 3CH3COONa → Fe(CH3COO)3 + 3NaCl 3Fe(CH3COO)3 + 2H2O → [Fe3(CH3COO)6(OH)2]CH3COO +2CH3COOH,
випадає червоно-бурий осад комплексної сполуки при нагріванні розчину.
31

1.Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В 2-х книгах. – М.:
Химия, 1990. – Кн. 2. – С. 537-562.
2.Пономарев В.Д. Аналитическая химия. В 2-
хчастях. – М.: Высшая школа, 1982. – Ч. 1. –
С. 149-168, 189-193, 202-206, 224-238, 240-250, 252-271.
3.Харитонов Ю.Я. Аналитическая химия. Аналитика. В 2-х книгах. – М.: Высшая школа, 2001. – Кн. 1. – С. 288-301, 320-592.
4.Алексеев В.Н. Курс качественного химического полумикроанализа. –
М.: Химия, 1973. – С.13-32, 121-147, 187-205, 316-371, 409-419, 444-452.
5.Крешков А.П. Основы аналитической химии. Т. 1. – М.: Химия, 1970. –
С.145-147, 180-181, 200-201, 246-247, 302-305, 327, 339-341, 342-344, 345385, 386–428.
ПИТАННЯ ДЛЯ КОНТРОЛЮ САМОСТІЙНОЇ РОБОТИ
1.На чому ґрунтується аналітична класифікація іонів на групи? Які класифікації катіонів застосовують в якісному хімічному аналізі?
2.Розподіліть катіони на аналітичні групи згідно кислотно-основної класифікації. В яких групах періодичної системи знаходяться елементи, катіони яких утворюють ці аналітичні групи?
3.Які реагенти являються груповими? Які основні вимоги ставляться до групових реагентів?
4.Охарактеризуйте поняття «систематичний» та «дробний» аналіз.
5.Чому систематичний хід аналізу суміші катіонів починають з осадження катіонів Pb2+, Ag+, Hg22+?
6.Як можна відокремити PbCl2 від AgCl, Hg2Cl2 та AgCl від Hg2Cl2?
7.Чому при осадженні катіонів Pb2+, Ag+, Hg22+ слід уникати надлишку хлороводневої кислоти?
8.Чому при дії іону Cl– на комплексний іон [Ag(NH3)2]+ осад не утворюється, а при дії іону І– осад випадає?
9.Як і для чого переводять сульфати катіонів Ca2+, Sr2+, Ba2+ в карбонати і чому необхідно повторно зливати маточний розчин?
10.Чому одержаний осад сульфатів катіонів Ca2+, Sr2+, Ba2+ при систематичному ході аналізу необхідно обробити розчином CH3COONH4?
11.Чому при відділенні іону Ba2+ від іонів Ca2+ і Sr2+ за допомогою K2Cr2O7 необхідна присутність ацетатного буферного розчину?
12.Чим пояснити необхідність аналізу центрифугату після відділення катіонів Ca2+, Sr2+, Ba2+ на присутність іону кальцію?
32
13.Використовуючи таблицю добутку розчинності, визначіть, який
із реактивів – сульфат, карбонат чи оксалат натрію – при умові [SO42–] = [CO32–] = [C2O42–] найбільш повно осаджує іони кальцію?
14.Як визначати іони К+ в розчині, в якому присутні NH4+-іони?
15.Чому визначення катіонів калію гідротартратом натрію можна
проводити в нейтральному середовищі? Напишіть рівняння реакцій.
16.Для визначення яких іонів: Na+, K+, NH4+, Ag+, Pb2+, Hg22+, Ba2+, Sr2+, Ca2+ використовують реакції окислення-відновлення? Напишіть рівняння реакцій.
17.Які органічні реагенти використовують для визначення
вищеназваних катіонів? Напишіть рівняння реакцій.
18.Для визначення яких іонів: Na+, K+, Ag+, Pb2+, Ba2+, Sr2+, Ca2+ рекомендують мікрокристалоскопічні реакції? Напишіть рівняння реакцій. Яка форма кристалів одержаних сполук?
19.Яке забарвлення ліній в спектрі говорить про наявність в аналізованому об’єкті солей натрію, калію, кальцію, барію, стронцію?
20.Напишіть рівняння реакцій, якими можна визначити катіони: Na+, K+, NH4+, Ag+, Pb2+, Hg22+, Ba2+, Sr2+, Ca2+.
21.Який висновок можна зробити, якщо одержаний розчин для
аналізу на вміст вищеназваних катіонів має кисле, нейтральне або лужне середовище?
22.Охарактеризуйте дію групового реактиву на катіони Al3+, Zn2+, Sn2+, Sn(IV), Cr3+. Напишіть рівняння реакцій взаємодії групового реагенту
зцими катіонами.
23.Як визначити присутність іонів цинку в розчині?
24.Як відокремити іони алюмінію від іонів цинку та хрому?
25.Якими реакціями визначають алюміній?
26.Відділення катіонів Al3+, Zn2+, Sn2+, Sn(IV), Cr3+ проводять надлишком розчину лугу в присутності пероксиду водню. Які властивості проявляє кожен катіон цієї групи?
27.Які органічні реагенти використовують для визначення названих раніше катіонів?
28.Напишіть рівняння реакцій катіонів Al3+, Zn2+, Sn2+, Sn(IV), Cr3+, As3+, As(V) при дії гідроксидів натрію та амонію, гідрофосфатів,
карбонатів.
29.Який реактив є груповим для катіонів Fe2+, Fe3+, Mn2+, Mg2+, Bi3+, Sb3+, Sb(V)?
30.Як взаємодіють вище вказані катіони з розчинами гідроксиду
амонію, гідрофосфату та карбонату натрію, окисників та відновників?
31.Для визначення яких катіонів: Fe2+, Fe3+, Mn2+, Mg2+, Bi3+, Sb3+, Sb(V) використовують реакції окислення? Напишіть рівняння реакцій.
32.Якими реакціями можна визначити в розчині присутність іонів заліза(ІІІ) та заліза(ІІ)? Рівняння реакцій.
33
33.Як можна відокремити іони магнію від катіонів Fe2+, Fe3+, Mn2+, Bi3+, Sb3+, Sb(V)?
34.Які реакції використовують для визначення іонів магнію?
35.Як виконується мікрокристалоскопічна реакція визначення іонів
магнію?
36.Як відділяють катіони Cu2+, Co2+, Cd2+, Ni2+, Hg2+ від катіонів інших груп?
37.Напишіть рівняння реакцій взаємодії розчинів гідроксида натрію, гідрофосфата та карбоната натрію з катіонами Cu2+, Co2+, Cd2+, Ni2+, Hg2+.
38.Для визначення яких із катіонів, названих раніше, використовують реакції окислення-відновлення?
39.Запишіть рівняння реакції катіонів міді(ІІ) з йодидом калію. Який аналітичний сигнал спостерігається? Як можна підвищити чутливість цієї реакції?
40.Якими реакціями можна визначити катіони кобальту? Запишіть рівняння реакції і назвіть умови їх виконання.
41.Напишіть рівняння реакції взаємодії катіонів нікелю з
диметилгліоксимом. До якого типу сполук відносять одержану сполуку?
42.Який із аніонів: SO42–, CO32–, PO43–, F–, C2O42–, BO2–, SO32–
утворює з катіонами барію сіль, що нерозчинна в кислотах?
43.Які реакції використовують для визначення аніонів: SO42–, CO32–, PO43–, F–, C2O42–, BO2–, SO32–?
44.Які аніони визначають за ослабленням забарвлення цирконій-
алізаринового лаку?
45.Як діють окислювачі на аніони Cl–, Br–, I–, SCN–?
46.Після дії на розчин хлорної води шар вазелінового масла забарвлюється в малиново-фіолетовий колір. Про присутність якого іону це говорить?
47.Після дії на розчин хлорної води шар вазелінового масла має жовте забарвлення. Який аніон має бути в розчині?
48.Напишіть рівняння реакцій визначення кожного із аніонів: Cl–, Br–, I–, SCN–.
49.Чим відрізняються аніони NO2–, NO3–, CH3COO– від аніонів інших
груп?
50.Які особливості визначення нітрат-іонів за допомогою сульфату заліза(ІІ)?
51.Чи можливо визначити нітрат-іон реакцією з дифеніламіном в присутності нітрит-іону?
52.Як визначити ацетат-іон за допомогою хлориду заліза(ІІІ)? Напишіть рівняння реакції.
53.Які аніони можна визначити за допомогою іоноселективних електродів? Що являється аналітичним сигналом при цьому визначенні?
34
54. Які повинні бути міри безпеки з точки зору екології при виконанні аналізу невідомого об’єкта?
Розділ 3 МЕТОДИ РОЗДІЛЕННЯ І КОНЦЕНТРУВАННЯ В
АНАЛІЗІ
Методами маскування не завжди вдається підвищити специфічність аналітичних сигналів. В таких випадках вдаються до методів розділення речовин. Крім того, враховуючи існуючу межу виявлення сигналу, при аналізі мікродомішок їх необхідно сконцентрувати – збільшити їх концентрацію. Для цього вдаються до методів концентрування. Часто розділення і концентрування здійснюється одночасно, поєднано в один метод. У цьому розділі буде розглянуто ряд методів розділення і концентрування, які використовуються в аналітичній хімії, за винятком методу хроматографії, якому присвячений окремий розділ підручника.
3.1.Осадження і співосадження
Воснові всіх розділень методом осадження лежить відмінність в розчинності сполук визначуваного і небажаних елементів. Теоретична можливість і умови успішного розділення визначаються головним чином величинами добутків розчинності. Використовують органічні і неорганічні осаджувачі. Типи осадів:
1. Кислоти і гідроксиди (H2SiO3, H2SnO3, H2WO4, Al(OH)3, Fe(OH)3). 2. Малорозчинні сполуки деяких кислот (MeS, MeSO4, MeCO3,
MePO4, MeClx та ін.).
3. Осади з органічними реагентами (малорозчинні хелати і іонні асоціати).
4. Речовини, що виділяються в елементному стані (Hg, Se, Te, Au). Наприклад, в сильнокислому середовищі можна відокремити
кремнієву, танталову, ніобієву і вольфрамову кислоти практично від усіх елементів.
Специфічність (селективність) осадження можна збільшити, варіюючи pH розчину. У табл. 3.1 приведені значення рН початку осадження деяких гідроксидів з водних розчинів:
Таблиця 3.1. Значення pH осадження гідроксидів
pH |
Іон металу |
3 |
Fe3+, Zr(IV), Sn(II) |
4 |
Th(IV), U(VI) |
35
|
|
5 |
Al3+ |
6 |
Zn2+, Be2+, Cu2+, Cr3+ |
7 |
Fe2+, Pb2+ |
8 |
Co2+, Ni2+, Cd2+ |
9 |
Ag+, Mn2+, Hg2+ |
11 |
Mg2+ |
З даних табл. 3.1 видно, що, підтримуючи рН на відповідному рівні, методом осадження можна розділити різні катіони. Прикладом дробного (фракційного) осадження може також служити розділення іонів металів осадженням сульфідів катіонів III і IV груп за сірководневою класифікацією при рН 0,5 и рН 9 – 10.
Але осадження можна використовувати як метод концентрування. В основі цього лежить явище співосадження (тобто сумісного осадження). Ефективність співосадження, як методу розділення, дуже висока. Мікрокомпонент можна виділити з розчину при його співвідношенні до макрокомпонента 1:1015.
Співосадженням називається розподіл мікрокомпонента між розчином і твердою фазою (осадом), причому сам мікрокомпонент в даних умовах осаду не утворює. Осад, на якому відбувається співосадження, називається колектор.
Так, іони радію Ra2+, свинцю Pb2+, заліза Fe3+, міді Cu2+ вилучаються з розчину осадом сульфату барію BaSO4, що формується. При утворенні аморфного осаду гідроксиду заліза Fe(OH)3 з водного розчину, що містить катіони хрому(III) і алюмінію(III), разом з осадом осідають і ці катіони.
Колектори – це малорозчинні неорганічні і органічні сполуки, які повинні повністю захоплювати потрібні і не захоплювати мікрокомпоненти, що заважають, і компоненти матриці.
Колектори можуть бути:
1.Неорганічні – гідроксиди, сульфіди, фосфати, сульфати, галогеніди металів. Поширені колектори Fe(OH)3 і МnО2.
2.Органічні колектори:
2.1.Малорозчинні асоціати. Наприклад, колектором може бути
асоціат, утворений об'ємним органічним катіоном кристалічного фіолетового КФ+ або метиленового синього МФ+ і аніоном SCN– або I–.
2.2.Хелати (дитизонати, дитіокарбамінати, β-дикетонати).
2.3.Індиферентні органічні сполуки без комплексоутворюючих груп.
Розрізняють поверхневе (зовнішнє) і внутрішнє співосадження.
При поверхневому співосадженні речовина, що співосаджується,
адсорбується на поверхні колектора і видаляється разом з ним з розчину. Поверхневе співосадження характерне для аморфних осадів, що відрізняються розвиненою неврегульованою поверхнею.
Адсорбція на поверхні осаду відбувається внаслідок:
36
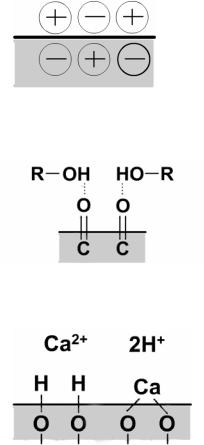
1)електростатичних взаємодій
2)міжмолекулярних взаємодій
3)іонообмінних взаємодій
Закономірності адсорбції іонів на поверхні осаду мають свої особливості, пов'язані з вибірковою адсорбцією іонів іонним кристалом і зарядом іонів. Відповідно до правила Панета-Фаянса-Гана осад адсорбує з розчину ті іони, які утворюють найменш розчинну або найменш дисоційовану сполуку з одним із іонів осаду. Наприклад, на осаді AgCl найсильніше адсорбуються I– и Вr–-іони, оскільки вони утворюють с Ag+ нерозчинні сполуки AgI и AgBr. Внаслідок спорідненості з Ag+ ці іони енергійніше сорбуються. В першу чергу на поверхні осаду адсорбуються іони, що входять до складу осаду і наявні в розчині в надлишку. Переважно на осадах сорбуються іони з більшою зарядністю. Адсорбція тим більше, чим більше концентрація іонів.
Число адсорбованих іонів зростає також із збільшенням поверхні осаду, тобто дрібнокристалічні і аморфні осади адсорбують більше іонів, ніж крупнокристалічні. Із збільшенням температури адсорбція зменшується.
Внутрішнє співосадження характерне для кристалічних осадів. Воно може бути викликане процесом, який називається оклюзія. Оклюзія – це захоплення домішок з розчину всередину кристалу. Сторонні речовини знаходяться всередині кристалу осаду. Особливість оклюзії – важкість вилучення поглинених компонентів з глибини кристалу. Однією з
37
основних причин оклюзії є нерівноважна адсорбція, коли швидкість росту частинок осаду перевищує швидкість встановлення адсорбційної рівноваги. Окрім нерівноважної адсорбції, причиною оклюзії може також бути механічне захоплення домішок або розчинника всередину кристалу при утворенні осаду. Внутрішнє співосадження може бути також обумовлене ізоморфізмом. Ізоморфізм – властивість іонів заміщати один одного в кристалі з утворенням фаз змінного складу: змішаних кристалів або твердих розчинів. До складу ізоморфних сполук входять близькі за розмірами іони і розчинник при однаковому типі кристалічної решітки. Ізоморфними кристалами є, наприклад, BaSO4 и RaSO4.
У процесів співосадження є свої негативні і позитивні сторони. В результаті співосадження відбувається забруднення осаду, що негативно впливає на точність гравіметричного аналізу. В той же час на процесах співосадження засновано виділення мікродомішок з розчину і їх концентрування.
3.2. Сорбція
Сорбція – процес поглинання газів, парів і розчинених речовин твердими і рідкими поглиначами (сорбентами). Класифікація сорбційних методів ґрунтується на відмінності механізму взаємодії речовин з сорбентами. Розрізняють адсорбцію (фізична адсорбція і хемосорбція), розподіл речовин між двома фазами (розчинником і фазою на сорбенті), що не змішуються, і капілярну конденсацію – утворення рідкої фази в порах і капілярах твердого сорбенту. У чистому вигляді кожний з перерахованих механізмів, як правило, не реалізується і зазвичай спостерігаються змішані механізми.
При фізичній адсорбції молекули речовин, що сорбуються, взаємодіють з поверхнею сорбенту головним чином за рахунок дисперсійних Ван-дер-ваальсових сил (у молекулах з'являються диполі, наведені зарядами поверхні). Такий механізм характерний для сорбції на активному вугіллі. Для деяких сорбентів (А12О3, цеоліти) важливі електростатичні сили:
•орієнтаційні сили, що проявляються при адсорбції полярних молекул на поверхні, яка несе постійний електростатичний заряд;
•індукційні сили, обумовлені появою в молекулах, що сорбуються, дипольних моментів, наведених зарядами поверхні або появою дипольних моментів в сорбенті, наведених диполями молекул, що сорбуються.
Фізична адсорбція легкооборотна.
Окрім дисперсійних взаємодій при сорбції води, спиртів, кетонів, амінів на сорбентах, поверхня яких покрита гідрокси- і оксигрупами (наприклад А12О3, кремнезем), додатково відбувається утворення
38

комплексів з міжмолекулярним водневим зв'язком. В цьому випадку може здійснюватися змішаний механізм.
Нарешті, сорбція може супроводжуватися виникненням між сполукою, що сорбується, і поверхнею міцного хімічного зв'язку і утворенням нової хімічної сполуки на поверхні (хемосорбція). Приклад – синтетичні сорбенти з іоногенними і хелатуючими групами. Їх використовують для селективного розділення макро- і мікрокомпонентів, для групового і селективного концентрування мікрокомпонентів.
Основні кількісні характеристики сорбції – коефіцієнт розподілу і ступінь вилучення. Коефіцієнт розподілу є відношення концентрації речовини Ств у фазі сорбенту до концентрації Св його у водній фазі:
D = Cтв
Св
Якщо відомі коефіцієнти розподілу, то можна вирішити питання про розділення речовин на даному сорбенті. Процес сорбції здійснюють двома методами: статичним і динамічним. В аналізі використовують різноманітні сорбенти: активоване вугілля, іонообмінні і хелатоутворюючі синтетичні смоли, звичайні і хімічно модифіковані кремнеземи і целюлозу, сорбенти на неорганічній основі.
Наприклад, активоване вугілля отримують при дії на неактивоване вугілля газів-носіїв, наприклад Н2О або СО2 при 850 – 950°С. Активоване вугілля пронизане тонкими порами радіусом не менше 1 нм. Поверхня покрита оксидними групами. Тому фізична адсорбція може супроводжуватися як катіоно-, так і аніонообмінними процесами. Особливе місце займає окислене активоване вугілля, що є селективним поліфункціональним катіонообмінником:
C |
|
|
|
C |
O |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
|
C |
O |
Me |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
||||||||
|
|
|
COOH |
|
|
|
|
|
C |
O |
|
|
|
|
+ |
Me2+ + 2OH- |
|
|
|
+ 2H2O |
|||
|
|
|
|
|
|
||||||
|
|
|
OH |
|
|
|
O |
O |
|||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
Me |
|
||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|||||||
|
|
|
OH |
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
Приклади використання сорбційних методів розділення та концентрування: свинець ефективно сорбують з атмосферного повітря; кальцій, барій, стронцій – з концентрованих розчинів лугів, солей; хром, молібден, ванадій – з води і розсолів ртутного електролізу. Визначення елементів проводять безпосередньо в концентраті (спалювання в каналі спектрального вугільного електроду) або концентрат опромінюють потоком нейтронів, або після десорбції азотною кислотою визначають досліджувані елементи відповідним вибраним методом.
39
3.3. Екстракція
Екстракцією називається переведення речовини з однієї фази в іншу, що не змішується з нею. Коли говорять про екстракцію, то найчастіше мають на увазі дві рідкі фази – водну і органічну. При екстракції одночасно протікають процеси: утворення сполук, що екстрагуються, розподіл сполук, що екстрагуються, між водною і органічною фазами, реакції в органічній фазі (дисоціація, асоціація, полімеризація). Сполуку (зазвичай в органічній фазі), відповідальну за утворення сполуки, що екстрагується, називають екстрагентом. Інертні органічні розчинники (хлороформ, чотирихлористий вуглець, бензол), що вживають для поліпшення фізичних і екстракційних властивостей екстрагента, називають розріджувачами. Відокремлену від водної фази органічну фазу, що містить екстраговані сполуки, називають екстрактом. Переведення речовини після екстракції з органічної фази у водну називають реекстракцією, а розчин, використовуваний для реекстракції, –
реекстрагентом.
Типи сполук, що екстрагуються:
1. Неіонізовані:
1.1.Координаційно-несольватовані сполуки з ковалентним зв'язком
(I2, HgCl2, SbCl3, AsBr3, Hgl2, RuO4 і OsO4). Ці сполуки екстрагуються різними розчинниками, а чотирихлористим вуглецем і бензолом – вибірково.
1.2.Внутрішньокомплексні сполуки. Наприклад, оксихінолінат алюмінію екстрагується хлороформом при рН = 4,5-11.
1.3.Координаційно-сольватовані нейтральні комплекси MClnLx, M(NO3)nLy , де L – нейтральний екстрагент, наприклад, трибутилфосфат;
М– Sc(III), Zr(IV), Hf(IV), Th(IV), Au(III), UO22+.
2. Іонні асоціати:
2.1.Координаційно-несольватовані асоціати [В+][А–]. Наприклад,
KФ+SbCl6–, R4N+AuCl4–, КФ+A–, де КФ+ – катіон барвника кристалічного фіолетового; А– – С1О4–, ReO4–, MnO4–, IO4–.
2.2.Комплексні кислоти Hp-qMXp. Наприклад, HFeCl4, H2CdI4,
HSbCl6. Екстрагенти – основні і нейтральні (діетиловий ефір, аміни). Наприклад, амін вилучає комплексну кислоту R3NН+FeCl4–.
Екстрагуються тільки електронейтральні частинки. Іони металу можна зв'язати в незаряджений комплекс; комплекси, що мають заряд, можна екстрагувати у вигляді іонних асоціатів. При екстракції іонних асоціатів важливі заряд і розмір іонів: екстракція погіршується із збільшенням заряду і зменшенням розміру іонів. Крім того, слід враховувати розчинність речовини у воді і в органічному розчиннику: чим нижче розчинність речовини у воді, тим вище ступінь його вилучення. Розчинність речовини в полярних і неполярних розчинниках залежить від
40
