
- •Загальна
- •Одеса онахт 2010
- •Глава 1. Основні поняття та закони хімії
- •1.1. Основні поняття хімії
- •1.2. Фундаментальні та стехіометричні закони хімії
- •1.2.1. Закон збереження маси речовини
- •1.2.2. Закон сталості складу речовин
- •1.2.3. Закон кратних відношень
- •1.2.4. Закон еквівалентів.
- •1.3. Закони газового стану
- •1.3.1. Закон об’ємних відношень гей-люсака
- •1.3.2. Закон авогадро
- •1.3.3. Закон бойля – маріотта
- •Контрольні завдання
- •Б) Із закону Авогадро випливає, що об’єм 0,025 моль h2s за нормальних умов
- •В) Відомо, що 1 моль будь-якої речовини містить 6,02 · 1023 молекул. Молярний об’єм газу за нормальних умов складає 22,4 л. Тому справедливо
- •Приклад 3. Який об’єм за нормальних умов займуть 4 10-4 м3 газу, що знаходиться при 50оС й тиску 9,54 104 Па?
- •Приклад 4. При згорянні 5 г металу утворилося 9,44 г оксиду металу. Визначити еквівалентну масу металу.
- •Приклад 5. Деяка кількість металу, еквівалентна маса якого дорівнює 28 г/моль, витісняє з кислоти 1,4 л водню, виміряного за нормальних умов. Визначити масу металу.
- •Розв’язання. Відповідно до закону еквівалентів (1.1), маси взаємодіючих речовин пропорційні їхнім еквівалентним масам:
- •Зі співвідношення (1.8) знаходимо еквівалентну масу h3ро4:
- •Приклад 8. Обчислити точну атомну масу металу, якщо питома теплоємність металу дорівнює 0,23 кДж/(кг к), а хлорид цього металу містить 61,2% металу.
- •Приклад 10. Визначити формулу речовини, якщо відомо, що її густина за воднем дорівнює 29, а масові частки елементів наступні: с – 82,76%, н – 17,24%.
- •Глава 2. Класи неорганічних сполук
- •2.1. Оксиди.
- •2.1.1. Способи одержання оксидів
- •2.1.2. Класифікація та хімічні властивості оксидів
- •2.2. Гідроксиди металів
- •2.2.1. Способи одержання гідроксидів
- •2.2.2. Хімічні властивості гідроксидів металів
- •2.3. Кислоти
- •2.3.1. Способи одержання кислот
- •2.3.2. Хімічні властивості кислот
- •2.4.1.Основні способи одержання солей
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач
- •3.2. Корпускулярно-хвильова природа електрона
- •3.3. Принцип невизначеності
- •3.4. Періодичний закон
- •3.5. Періодична система елементів
- •3.6. Електронні хмари
- •3.7. Квантові числа
- •3.8. Принцип паулі
- •3.9. Послідовність заповнення електронами енерґетичних рівнів у багатоелектронних атомах
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач
- •Приклад 8. Які найвищий та найнижчий ступені окислення у фосфору, сульфуру та хлору? Скласти формули сполук даних елементів, що відповідають цим ступеням окислення.
- •Приклад 12. Як залежать кислотно-основні властивості оксидів і гідроксидів від ступеня окиснення атомів елементів, що їх утворюють?
- •Приклад 13. Відомо, що кремній є неметалом з напівпровідниковими властивостями. Які властивості будуть виявляти алюміній і фосфор?
- •Приклад 15. Як змінюються властивості вищих оксидів елементів третього періоду?
- •4.1.1. Характерні властивості ковалентного зв’язку
- •4.1.1.1. Насиченість ковалентного зв’язку
- •Мал. 4.3. Різновиди σ-зв’язків.
- •Мал. 4.3. Різновиди π-зв’язків.
- •4.1.1.3. Полярність і поляризованість ковалентного зв’язку.
- •4.3. Водневий зв’язок
- •4.5. Міжчастинкові взаємодії
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач Приклад 1. Довжина диполя молекули дорівнює 2,2 10-11 м. Обчисліть дипольний момент молекули.
- •Приклад 2. Обчислити довжину зв’язку в молекулі hBr, якщо між’я-дерні відстані у молекулах h2 та Br2 відповідно дорівнюють 7,4 · 10-11 м та 2,28 10-10 м.
- •Приклад 3. Яка гібридизація електронних хмар має місце в атомі карбону при утворенні молекули cf4? Якою є просторова конфігурація цієї молекули?
- •Приклад 4. Якими є валентні можливості атома фосфору в основному та збудженому станах?
- •Приклад 5. Визначте, що є донором електронної пари при утворенні йона bh4-.
- •Глава 5. Основи хімічної термодинаміки
- •5.2. Перший закон термодинаміки
- •5.3. Закони термохімії
- •5.4. Поняття про ентропію
- •5.5. Другий закон термодинаміки
- •5.6.Третій закон термодинаміки
- •5.7. Вільна енергія Гіббса
- •Приклад 1. Складіть термохімічне рівняння реакції горіння 1 моль ацетилену, якщо при цьому виділяється 1255,61 кДж теплоти.
- •Приклад 3. Не здійснюючи обчислень, поясніть, як змінюється ентропія системи (s): а) при переході води в пару; б) у реакції:
- •Приклад 4. Обчисліть зміну енерґії Ґіббса у хімічній реакції
- •І зробіть висновки про можливість мимовільного перебігу даної реакції за стандартних умов.
- •Стандартні зміни енерґій Ґіббса простих речовин прийнято вважати рівними нулю. Для даної системи:
- •6.1. Поняття про швидкість хімічної реакції
- •6.2. Основний закон хімічної кінетики – закон діючих мас.
- •Межі застосування закону діючих мас.
- •6.3. Молекулярність реакції.
- •6.4. Порядок реакції.
- •6.5. Особливості кінетики гетероґенних реакцій.
- •6.6. Механізм хімічних реакцій.
- •6.7. Вплив температури на швидкість реакції. Правило Вант-Гоффа.
- •6.8. Рівняння Арреніуса. Енерґія активації
- •Вихідні Активов. Продукти
- •Мал.6.3. Енерґетична діаграма Мал.6.4. Розподіл молекул за
- •Глава 7. Хімічна рівновага.
- •7.1. Константа хімічної рівноваги
- •7.2. Зсув хімічної рівноваги. Принцип Ле-Шательє
- •7.3. Рівновага у гетероґенних системах
- •Константа рівноваги.
- •Глава 8. Поняття про каталіз.
- •8.1. Автокаталіз
- •8.2.Промотори та каталітичні отрути
- •8.3. Селективність каталізаторів
- •8.4. Механізми гомоґенного та гетероґенного каталізу
- •Підставляючи дані нашої задачі, одержуємо:
- •Глава 9. Розчини
- •9.1. Процес розчинення. Типи розчинів
- •9.2. Способи виразу концентрації речовин
- •9.3. Хімічна (гідратна) теорія розчинів д.І. Менделєєва
- •9.4. Теплові ефекти розчинення
- •9.5. Розчинність
- •Глава 10. Властивості розчинів
- •10.1. Тиск пари розчинника над розчином
- •10.2. Температури замерзання та кипіння розчинів
- •10.3. Осмотичний тиск
- •Глава 11. Електролітична дисоціація.
- •11.1. Основні положення теорії електролітичної дисоціації
- •11.2. Ступінь дисоціації
- •11.3. Слабкі електроліти. Константа дисоціації слабких електролітів
- •11.4. Вплив однойменних іонів на дисоціацію слабких електролітів
- •11.5. Розчини сильних електролітів
- •11.6. Електролітична дисоціація води. Йонний добуток води. Водневий показник
- •11.7. Поняття про індикатори
- •11.8. Іонні реакції
- •11.8. Гідроліз солей
- •Типові випадки гідролізу.
- •11.8.1. Ступінь і константа гідролізу
- •Глава 12. Комплексні сполуки
- •12.1. Основні положення координаційної теорії а.Вернера
- •12.2. Класифікація комплексних сполук
- •12.3. Номенклатура комплексних сполук
- •12.3.1. Назви катіонних комплексних сполук
- •12.3.2. Назви аніонних комплексних сполук
- •12.3.3. Назви нейтральних комплексних сполук
- •12.4. Ізомерія комплексних сполук
- •12.5. Дисоціація комплексних сполук
- •Якщо у гібридизації беруть участь d-орбіталі передостаннього рівня, тоді йон називається внутрішньоорбітальним. Іноді у комплексах проявляється йонно-дипольний зв’язок, наприклад в аквакомплексах.
- •Глава 13. Електрохімічні процеси
- •13.1. Хімічні процеси на електродах
- •13.2. Електродний потенціал
- •13.3. Електрохімічний ряд напруг металів
- •13.4. Гальванічний елемент
- •13.5. Окисні й відновні потенціали
- •13.6. Рівняння Нернста
- •13.7. Акумулятори
- •13.8. Паливні елементи
- •13.9. Електроліз
- •13.9.1. Закони Фарадея
- •1. Кількість речовини, що виділяється на електроді під час електролізу, пропорційна кількості електрики, яка пройшла крізь електроліт.
- •2. Однакова кількість електрики виділяє на електродах під час електролізу еквівалентну кількість різних речовин.
- •13.10. Корозія металів
- •0,01 Моль/л 0,1 моль/л
- •Глава 14. Окисно-відновні реакції складання рівнянь окисно-відновних реакцій
- •Контрольні завдання
- •Додатки
- •Додаток 6 – Перехідні коефіцієнти
- •Предметний покажчик
- •Відновлення 18-19, 77, 81, 124, 126, 128, 135-139
- •Водень 14, 17, 37, 75, 125, 130-132, 139
- •Ізомерія 119
- •Лантаноїди 25
- •Натрій 20-21, 69, 89
- •Термодинамічні 8, 54
- •Атомів 33, 50
- •Список рекомендованої літератури
- •Глава 1. Основні поняття та закони хімії ........................ 5
11.8.1. Ступінь і константа гідролізу
Кількісно процес гідролізу характеризується константою гідролізу (Кг) та ступенем гідролізу (αг). Ступінь гідролізу показує яка часина молекул розчиненої солі піддається гідролізу. Вона може набувати значень від 0 до 1. Це відношення числа молекул, які піддались гідролізу, до загального числа молекул солі у розчині.
Ступінь гідролізу залежить від природи солі (природи катіону та аніону), температури, концентрації. У відповідності з принципом Ле-Шательє зі зменшенням концентрації солі, тобто з розведенням ступінь гідролізу збільшується. Процес гідролізу – це ендотермічний процес, тому у відповідності з принципом Ле-Шательє з підвищенням температури гідроліз підсилюється.
Отже для послаблення гідролізу треба готувати концентровані розчини та зберігати їх при низькій температурі, додавати у розчин солі один із продуктів гідролізу.
Константа гідролізу характеризує здатність даної солі піддаватися гідролізу. Чим слабкіше кислота (основа), сіль якої піддається гідролізові, тим більше Кг, тим у більшій мірі перебігає гідроліз. Наприклад:
KCN + HOH ↔ KOH + HCN
Кг
=
![]() .
.
Питання для самоперевірки
1. Що називається ступенем іонізації (електролітичної дисоціації)?
2. Яка залежність існує між ступенем дисоціації та константою дисоціації слабкого бінарного електроліту в розведених розчинах?
3. Чому дорівнює йонний добуток води?
Які величини називаються водневим показником рH і гідроксильним показником рOH?
Які три випадки гідролізу солей вам відомі? Як зсувається рівновага гідролізу солей зі зміною температури?
Які ознаки перебігу йонних реакцій у розчинах Ви знаєте?
Що таке добуток розчинності малорозчинного електроліту?
КОНТРОЛЬНІ ПИТАННЯ ТА ЗАВДАННЯ
1. Виразіть іонними рівняннями реакції, що перебігають у розчинах між: а) манґан (ІІ) сульфідом і хлоридною кислотою; б) нітритною кислотою та натрій гідроксидом; в) натрій сульфідом і нікол (ІІ) хлоридом.
2. Розчини яких речовин треба злити разом для одержання осадів: PbSO4, CaCO3, AgCl, CuS? Напишіть формульні та йонні рівняння відповідних реакцій.
3. Виразіть іонними рівняннями реакції: а) розчинення заліза і Fe(OH)3 у сульфатній кислоті; б) взаємодії Al(OH)3 з натрій гідроксидом; в) нейтралізації HNO2 натрій гідроксидом.
4. До розчину кожної з речовин – NaCl, NiSO4, BeCl2, HNO3, додали надлишок розчину натрій гідроксиду. У яких випадках і чому відбудуться реакції? Виразіть їх формульними й іонними рівняннями реакцій.
5. Складіть формульні рівняння для реакцій, які виражено йонними рівняннями: а) Ca2+ + CO32- = CaCO3; в) H2PO4- + 2OH- = PO43- + 2H2O;
б) 2Ag+ + S2- = Ag2S; г) CdOH+ + H+ = Cd2+ + H2O.
6. Які з речовин – KHCO3, CH3COOH, NiSO4, Na2S – взаємодіють із розчином сульфатної кислоти. Запишіть формульні й іонні рівняння цих реакцій.
7. Складіть формульні та йонні рівняння реакцій у розчинах між: а)Na3PO4 й CaCl2; б) K2CO3 та BaCl2; в) Zn(OH)2 та KOH.
8. Складіть формульні та йонні рівняння реакцій у розчинах між: а) CdS і HCl; б) Cr(OH)3 і NaOH; в) Ba(OH)2 і CoCl2.
9. Складіть формульні рівняння для реакцій, які виражено йонними рівняннями: а) Be(OH)2 + 2OH- = [Be(OH)4]2-;
б) CH3COO- + H+ = CH3COOH; в) Ba2+ + SO42- = BaSO4.
10. Змішують попарно розчини: а) Cu(NO3)2 та Na2SO4; б) BaCl2 та K2SO4; в)Ca(OH)2 та HCl; г) NaNO3 та K2SO4; д) K2Cr2O7 і CoCl2. У якому з поданих випадків реакції підуть до кінця? Складіть для них формульні та йонні рівняння реакцій.
11. До кожного з речовин – Al(OH)3, H2SO4, Ba(OH)2, додали розчин калій гідроксиду. У яких випадках відбулися реакції? Виразіть їх формульними й іонними рівняннями.
12. Складіть формульні й іонні рівняння реакцій розчинення: а) гідроксиду берилію в розчині їдкого натру; б) купрум (ІІ) гідроксиду в розчині нітратної кислоти.
13. Складіть формульні й іонні рівняння реакцій взаємодії наступних речовин: а) NaHCO3 + NaOH = ; б) BiCl3 + H2S = ;
в) Zn(OH)Cl + HCl = ; г) Cr(OH)3 + NaOH = .
14. Складіть формульні й іонні рівняння реакцій взаємодії наступних речовин: а) Ca(OH)2 + H2CO3 = ; б) Fe(OH)3 + H2SO4 = ;
в) Al(OH)2Cl + HCl = ; г) Fe(OH)3 + NaOH = .
15. Складіть формульні й іонні рівняння реакцій, що відбуваються при змішуванні розчинів: а) K2S і HCl; б) CuSO4 і H2S;
в) Ba(OH)2 і FeCl3; г) NaHCO3 і NaOH.
16. Чи можна приготувати розчин, що містить одночасно наступні пари речовин: а) Zn(OH)2 та KOH; б) Ba(OH)2 та HCl; в) Fe(OH)3 та NaOH. Напишіть можливі рівняння реакцій в іонному вигляді.
17. Змішують попарно розчини: а) Mg(NO3)2 та Na2CO3; б) AlCl3 та Na2SO4; в) SnCl2 та KNO3. У якому з поданих випадків реакція пройде практично до кінця? Складіть для нього формульні й іонні рівняння реакцій.
18. Чи можна приготувати розчин, що містить одночасно наступні пари речовин: а) NaOH та Сa(OH)2; б) Sn(OH)2 та NaOH; в) Sn(OH)2 й HNO3. Напишіть можливі рівняння реакцій у формульному й іонному вигляді.
19. Складіть формульні й іонні рівняння реакцій, взаємодії наступних речовин: а) СН3СООН + КОН = ; б) Zn(OH)2 + HCl = ;
в) CuSO4 + H2S = ; г) Zn(OH)2 + NaOH = .
20. Виразіть іонними рівняннями реакції, що перебігають у розчинах між: а) барій карбонатом і сульфатною кислотою; б) гідроксомаґній нітратом й нітратною кислотою; в) магній гідроксидом і амоній хлоридом.
21. Для нейтралізації 100 мл насиченого при 25 оС розчину кальцій гідроксиду знадобилося 40 мл розчину хлоридної кислоти з еквівалентною молярною концентрацією 0,1 моль/л. Обчисліть добуток розчинності Са(ОН)2 при зазначеній температурі.
Відповідь : 3,2 10-5.
22. Скільки води знадобиться для розчинення при кімнатній температурі 1 г ВаСО3, якщо його добуток розчинності 1,9 10-9?
Відповідь : 117 л.
23. Добуток розчинності стронцій сульфату 2,8 10-7. Чи утвориться осад цієї солі, якщо змішати рівні об’єми розчинів SrCl2 і K2SO4 з еквівалентними молярними концентраціями 2 10-3 моль/л ?
Відповідь : ні.
24. Що називається йонним добутком води? Обчисліть рН і рОН розчину оцтової кислоти з молярною концентрацією 10-2 моль/л. Ступінь дисоціації кислоти в цьому розчині α = 4,2 %.
Відповідь : 3,38, 10,62.
25. Обчисліть рН розчину, у літрі якого міститься 0,0051 г іонів ОН-.
Відповідь : 10,48.
26. Обчисліть рН розчину хлоридної кислоти з масовою часткою HCl 3,12%. Густина розчину 1,051 г/см3 при = 1.
Відповідь : 0,06.
27. Два мілілітри розчину нітратної кислоти з масовою часткою речовини 72 % ( = 1,43 г/см3) розвели до 2 л. Обчисліть рН розчину при = 1.
Відповідь : 1,79.
28. Складіть іонні та формульні рівняння гідролізу солей: CrCl3, Na2SO3 і Na2S. Які з даних розчинів мають рН < 7? рН 7?
29. Чи можуть рН і рОН дорівнювати нулю, бути менше нуля? Чόму дорівнюють рН і рОН розчину, концентрація йонів водню в якому 10-4 моль/л ?
30. Чому розчини NaF і Na2S мають лужну, а розчини ZnSO4 і NH4NO3 – кислу реакцію? Відповідь підтвердіть, склавши йонні та молекулярні рівняння гідролізу солей.
31. Як залежить ступінь гідролізу від температури? Чому? У який бік зсунеться рівновага гідролізу NаCN, якщо до розчину додати: а) луґу; б) кислоти; в) амоній хлориду?
32. Що утвориться при змішуванні розчинів: а) алюміній сульфату та натрій сульфіду; б) ферум (ІІІ) хлориду та калій карбонату? Відповідь мотивуйте, склавши рівняння відповідних реакцій.
33. Завершіть рівняння реакцій: а) Al2(SO4)3 + Na2S + H2О = ;
б) FeСl3 + Na2СО3 + H2О = ; в) MgСl2 + Na2СО3 + H2О =.
Складіть формульні й іонні рівняння реакцій.
34. Завершіть рівняння реакцій: а) КСr(SO4)2 + Na2S + H2О = ;
б) CuSO4 + Na2СО3 + H2О = ; в) AlСl3 + Na2S + H2О =.
Складіть формульні й іонні рівняння реакцій.
35. Обчисліть константу гідролізу амоній хлориду. Який ступінь гідролізу солі в розчині з молярною концентрацією 0,1 моль/л і рН цього розчину, якщо Кдис.(NН4OH) = 1,8 10-5?
Відповідь : 5,5 10-10; 7,08 10-5; 5,15.
36. Обчисліть рН розчину СН3СОONа, що містить 8,2 г солі в 1 л розчину. Визначте ступінь гідролізу цієї солі, якщо Кдис.(СН3СООН) = 1,8 10-5.
Відповідь : 8,82; 0,0074 %.
37. Напишіть у формульному й іонному виді рівняння гідролізу солей: ZnCl2, КСN і NН4Н2РО4.
38. Підберіть по два рівняння у формульному вигляді до кожного зі скорочених іонних рівнянь: а) Fe3+ + 2H2О = Fe(ОН)2+ + 2H+;
б) СО32- + H2О = НCО3- + ОН- ; в) NН4+ + Н2О = NН4ОН + Н+.
39. При змішуванні розчинів СrСl3 і Na2СО3 одержується осад хром (ІІІ) гідроксиду. Поясніть причину цього явища та напишіть відповідні рівняння реакцій у формульному й іонному вигляді.
40. До розчину Na2СО3 додали наступні речовини: а) HCl; б) NaOH; в)Cu(NO3)2; г) Сr2(SO4)3. У яких випадках гідроліз карбонату підсилиться? Чому? Складіть формульні й іонні рівняння гідролізу солей.
41. Складіть формульні й іонні рівняння гідролізу солей CuCl2, Cs2CO3, Сr(NO3)3. Які значення рН мають розчини даних солей?
42. Додавання яких із перелічених реагентів: а) NH4Cl; б) HCl; в) Na2CO3; г) Н2O – до розчину хлорного заліза підсилить гідроліз солі? Відповідь поясніть.
43. Обчисліть ступінь дисоціації і [H+] у розчині гіпохлоритної кислоти з молярною концентрацією 0,1 моль/л, якщо Кдис.(НClО) = 5,0 10-8.
Відповідь : 7 10-4; 7 10-5.
44. Константа дисоціації амоній гідроксиду 1,8 10-5. Обчисліть константу гідролізу NН4CN, якщо Кдис.(НСN) = 7,9 10-10.
Відповідь : 7,15 1015.
45. Обчисліть ступінь дисоціації НClО в розчині з еквівалентною молярною концентрацією 0,2 моль/л, якщо Кдис. = 5,0 10-8.
Відповідь : 0,045 %.
46. Яка концентрація йонів гідрогену у водному розчині мурашиної кислоти (НСООН), якщо ступінь дисоціації кислоти та константа дисоціації відповідно становлять 5 % і 2 10-4?
Відповідь : 4 10-3 моль/л.
47. Чому для сильних електролітів доводиться вводити терміни “ефективна концентрація”, “удаваний ступінь дисоціації”? Що називається активністю?
48. Які електроліти вважаються сильними, а які – слабкими? Наведіть приклади. Напишіть рівняння східчастої дисоціації наступних речовин: H3AsО4, Са(ОН)2, NаН2РО4, (ZnОН)2SO4, Аl(NО3)2.
49. Константа дисоціації масляної кислоти (С3Н7СООН) 1,5 10-5. Обчисліть ступінь її дисоціації в розчині з молярною концентрацією 0,005 моль/л.
Відповідь : 0,055.
50. Ступінь дисоціації мурашиної кислоти у розчині Сeq(НСООН) = 0,2 моль/л дорівнює 0,03. Визначте константу дисоціації кислоти та значення рК.
Відповідь : 1,8 10-4; 3,75.
51. При якій молярній концентрації розчину нітритної кислоти ступінь її дисоціації буде складати 0,2, якщо Кдис.(НNO2) = 5,0 10-4.
Відповідь : 0,01 моль/л.
Приклади виконання завдань і розв’язання задач
Приклад 1. Скласти рівняння електролітичної дисоціації наступних електролітів: HNO3; H2SO4; KOH; Cu(OH)2; ZnCl2; Al2(SO4)3; KHCO3; Cu(OH)Cl.
Відповідь. а) Одноосновні кислоти, однокислотної основи і середньої солі дисоціюють на катіони й аніони в одну стадію:
HNO3 Н+ + NO3-; KOH K+ + OH-;
Al2(SO4)3 2Al3+ + 3SO42-; ZnCl2 Zn2+ + 2Cl-.
б) Багатоосновні кислоти, багатокислотні основи, а також кислі й основні солі дисоціюють східчасто (у кілька стадій):
H2SO4 Н+ + НSO4- – І стадія; HSO4- Н+ + SO42- – ІІ стадія;
Cu(OH)2 CuOH+ + ОH- – І стадія; CuOH+ Cu2+ + ОH- – ІІ стадія;
КHСО3 K+ + НСО3- – І стадія; HСО3- Н+ + CO32- – ІІ стадія;
Cu(OH)Cl CuOH+ + Cl- – І стадія; CuOH+ Cu2+ + ОH- – ІІ стадія;
Приклад 2. Ступінь дисоціації H2S за першою стадією в розчині з молярною концентрацією 0,1 моль/л дорівнює 0,07%. Нехтуючи дисоціацією за другою стадією, обчислити концентрацію йонів гідроґену в розчині.
Розв’язання. Концентрація йонів у розчині електроліту залежить від молярної концентрації електроліту (C), його ступеня дисоціації () та числа іонів (n) даного виду, на які дисоціює 1 формульна одиниця електроліту, тобто:
Сйонів = Сел-ту n.
Для того, щоб довідатися n, напишемо рівняння дисоціації H2S за першою стадією: H2S Н+ + НS-. З рівняння видно, що з однієї молекули H2S виходить один іон Н+, отже, у даному випадку n = 1. Ступінь дисоціації треба виразити в частках одиниці, тобто = 0,0007. Підставивши дані задачі у формулу, знайдемо концентрацію йонів гідроґену: C(Н+) = 0,1 0,0007 1 = 7 10-5 моль/л.
Приклад 3. Знайдіть молярну концентрацію йонів Н+ у водному розчині, у якому концентрація гідроксид-іонів становить 0,02 моль/л.
Розв’язання. Йонний добуток води при 22оС КW = [Н+] [ОН-] = 10-14. Звідси знайдемо концентрацію іонів Н+:
[Н+] = КW : [ОН-] = 10-14 : 0,02 = 5 10-13 моль/л.
Приклад 4. Концентрація гідроксид-іонів у розчині дорівнює 10-3 моль/л. Знайдіть рН цього розчину. Який це розчин – кислий чи лужний?
Розв’язання. КW = [Н+] [ОН-] = 10-14, звідси:
[Н+] = КW : [ОН-] = 10-14 : 10-3 = 10-11 моль/л.
рН = – lg[Н+] = – lg10-11 = 11. Це лужний розчин, бо рН > 7.
Приклад 5. Обчисліть молярну концентрацію K3РО4, знаючи, що ступінь дисоціації солі в розчині дорівнює 65%, а ефективна концентрація йонів калію складає 0,065 моль/л.
Розв’язання. Сйонів = Ссолі n, звідси Ссолі = Сйонів : ( n).
Напишемо рівняння дисоціації K3РО4 і знайдемо n: K3РО4 3K+ + РО43-. З рівняння видно, що з однієї формульної одиниці K3РО4 виходить 3 іони K+, отже n=3. У такий спосіб: Ссолі = Сйонів : ( n) = 0,065 : (0,65 3) = 0,033 моль/л.
Приклад 6. Визначте концентрацію йонів водню та гідроксид-іонів у розчині, рН якого дорівнює 3.
Розв’язання. рН = – lg[Н+]; – lg[Н+] = 3; звідки [Н+] = 10-3 моль/л.
[Н+] [OН-] = 10-14; [OН-] = КW : [Н+] = 10-14 : 10-3 = 10-11 моль/л.
Приклад 7. При якій концентрації НCl (моль/л) розчин буде мати рН = 2, якщо ступінь дисоціації соляної кислоти в цьому розчині дорівнює 90%.
Розв’язання. Знайдемо концентрацію йонів Н+ і n:
рН = – lg[Н+]; – lg[Н+] = 2, => [Н+] = 10-2 моль/л. НCl Н+ + Cl-; n = 1.
Сйонів = Ск-ти ( n);Ск-ти = Сйонів : ( n); = 0,01 : (0,9 1) = 0,011 моль/л.
Приклад 8. У 500 мол розчину міститься 0,202 г КNO3. Обчисліть концентрації йонів K+ і NO3- у моль/л, вважаючи дисоціацію 100%-ою.
Розв’язання. Напишемо рівняння дисоціації КNO3: КNO3 K+ + NO3-, з якого видно, що n(K+) = n(NO3-) = 1. Визначимо молярну концентрацію солі, знаючи, що М(КNO3) = 101 г/моль:
C(КNO3) = m/(MV) = 0,202 : (101 0,5) = 0,004 моль/л.
Адже C(K+) = C(NO3-) = Сйонів ( n) = 0,004 1 1 = 0,004 моль/л.
Приклад 9. Константа дисоціації циановодневої кислоти НСN дорівнює 7,9 10-10. Знайти ступінь дисоціації кислоти в розчині з молярною концентрацією рівної 10-3 моль/л.
Розв’язання. Оскільки константа дисоціації НСN дуже мала, для розрахунку можна скористатися наближеною формулою: K = 2С; звідси
=![]()
Приклад 10. Чи буде перебігати реакція між розчинами NаCl і КNO3?
Відповідь. NаCl і КNO3 існують у розчині у вигляді йонів, і відповідь на питання можна дати, розглянувши, які нові сполуки дадуть ці йони:
Nа+ + Cl- + K+ + NO3-;
NаNO3 і КCl також існують у розчині у вигляді йонів, тобто вони розчинні та є сильними електролітами. Таким чином, реакція фактично не відбувається:
NаCl + КNO3 .
Приклад 11. Скласти формульне та йонне рівняння реакції, що відбувається між K2S і НCl.
Відповідь. K2S + 2НCl = 2КCl + Н2S;
Н2S – газ, тому його записують в іонному рівнянні у вигляді молекули. Всі інші речовини – розчинні у воді сильні електроліти. Тому повне рівняння в іонному вигляді 2K+ + S2- + 2Н+ + 2Cl- = 2K+ + 2Cl- + Н2S;
а скорочене: S2- + 2Н+ = Н2S.
Приклад 12. Скласти три формульні рівняння, що відповідають наступному йонно-молекулярному рівнянню: СN- + Н+ = НСN.
Відповідь. У лівій частині цього рівняння зазначені йони СN- і Н+, що могли утворитися при дисоціації будь-яких розчинних сильних електролітів. Іони СN- можуть одержуватися, наприклад, при дисоціації ціанідів лужних металів, а йони Н+ одержуються при дисоціації будь-якої сильної кислоти. Тому формульні рівняння реакції можуть бути наступними:
NаCN + НCl = NаCl + НСN;
2КСN + Н2SО4 = K2SО4 + 2НСN;
2СsCN + Н3PО4 = Cs2HPО4 + 2НСN.
Приклад 13. Скласти формульні та йонні рівняння гідролізу солей: а)ZnCl2; б) K2CO3; в) NH4CN; г) Al2S3. Визначити реакцію середовища у розчинах цих солей.
Відповідь. Гідроліз солей – процес, у підсумку якого одержуються слабкі електроліти: чи кислоти підстави, чи одні й інші одночасно. Солі, утворені сильними електролітами (кислотами та основами) не гідролізують, оскільки, при їхній взаємодії з водою не одержуються слабко дисоційовані сполуки.
а) Хлорид цинку ZnCl2 – сіль, утворена слабкою двокислотною основою Zn(OН)2 та сильною кислотою НCl, отже, сіль буде гідролізованою за катіоном. Іонно-молекулярне рівняння гідролізу:
Zn2+ + НОН ZnОН+ + Н+;
чи у формульному вигляді:
ZnCl2 + Н2O Zn(OН)Cl + НCl.
У звичайних умовах гідроліз відбувається лише за першою стадією. У розчині з’являється надлишок іонів водню, тому розчин ZnCl2 має кислу реакцію середовища: рН < 7.
б) Карбонат калію K2CO3 – сіль, утворена сильною основою КOН і слабкою двоосновною кислотою Н2CO3, таким чином, сіль буде гідролізованою за аніоном. Іонно-молекулярне рівняння гідролізу:
CO32- + НОН НСО3- + OН-;
чи у формульному вигляді:
K2CO3 + Н2O КНСО3 + КOН.
У розчині з’являється надлишок іонів OН-, тому розчин K2CO3 має лужну реакцію середовища: рН > 7.
б) Ціанід амонію NH4CN – сіль, утворена слабкою основою NH4OН і слабкою кислота НСN, таким чином, гідроліз солі відбувається як за катіоном, так і за аніоном. Іонно-молекулярне рівняння гідролізу:
NH4+ + CN- + НОН NH4ОН + НСN;
чи формульному вигляді: NH4CN + Н2O NH4OН + НСN.
Розчини солей, утворених обома слабкими електролітами, можуть мати будь-яку реакцію середовища, що буде визначатися більш сильним електролітом: якщо більш дисоційованою є кислота, то реакція розчину буде кислою, якщо основа – лужною. У даному випадку Кдис(NH4OН)=1,7510-5; а Кдис(НСN)= = 7,910-10, отже, реакція середовища буде лужною.
г) Сульфід алюмінію Al2S3 – сіль, утворена слабкою основою Al(ОН)3 та слабкою кислотою Н2S, таким чином, гідроліз солі відбувається як за катіоном, так і за аніоном з утворенням малорозчинного Al(ОН)3 та газоподібного Н2S, і перебігатиме повністю та необоротно:
Al2S3 + 6Н2О 2Al(ОН)3 + 3Н2S.
У даному випадку реакція середовища буде близькою до нейтральної: рН 7.
Приклад 14. Визначити ступінь гідролізу та рН розчину ацетату калію (СН3СООК), еквівалентна молярна концентрація якого Сeq = 10-3 моль/л, якщо константа дисоціації оцтової кислоти – 1,75 10-5.
Розв’язання. Ступінь і константа гідролізу пов’язані між собою наступним співвідношенням: Кгiдр. = С2/(1– ),
де С – концентрація солі, моль/л, – ступінь гідролізу.
Звичайно ступінь гідролізу значно менший одиниці, тому подане рівняння можна спростити: Кгідр. = C2, але Кгідр. = K(H2O)/Кдис., де К(H2O) – йонний добуток води, а Кдис. – константа дисоціації слабкого електроліту.
Таким чином, С2 = K(H2O)/Кдис., звідки:
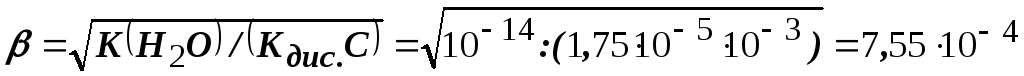 .
.
Рівняння реакції гідролізу:
СН3СOОК + Н2О СН3СООН + КОН.
Застосувавши закон дії мас до цієї реакції, одержимо:
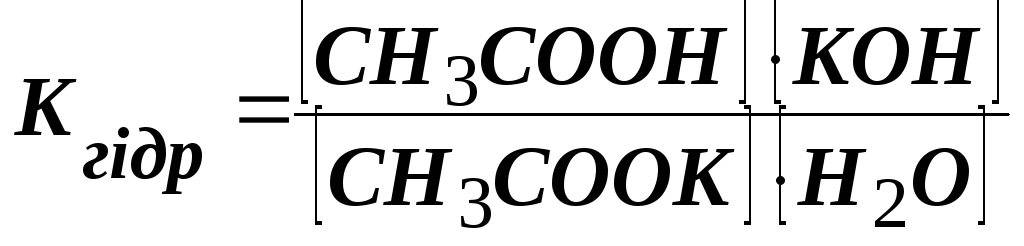 ,
у розведених розчинах [Н2О]
= const,
тоді
,
у розведених розчинах [Н2О]
= const,
тоді
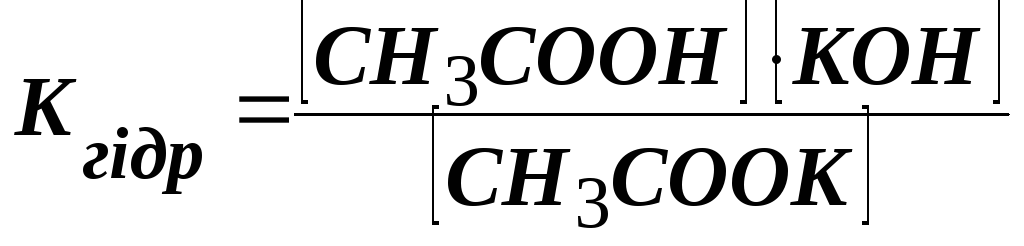 .
.
З рівняння гідролізу випливає, що [СН3СООН] = [ОН-], тоді
Кгідр. = [ОН-]2/[СН3СООК], звідси
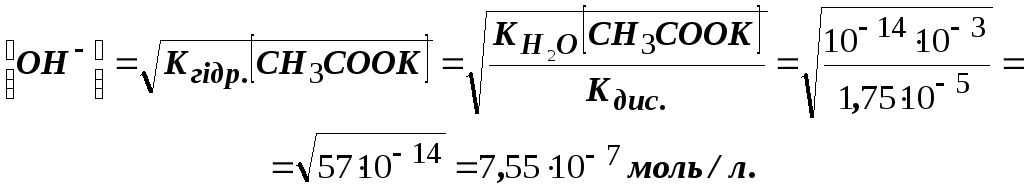
Відомо, що [Н+] [ОН-] = 10-14, звідси [Н+] = 10-14 : 7,55 10-7 = 1,32 10-8. рН = – lg[Н+] = – lg(1,32 10-8) = 7,9.
Приклад 15. Обчисліть константу гідролізу NН4Сl, знаючи, що константа дисоціації Кдис(NН4ОН) = 1,77 10-5.
Розв’язання. NН4Сl – сіль, утворена слабкою основою та сильною кислотою НCl. Константу гідролізу такої солі обчислюють за формулою:
Кгідр. = К(Н2О)/Кдис.(NН4ОН); Кгідр. = 10-14 : 1,77 10-5 = 5,65 10-8.
Приклад 16. Добуток розчинності броміду срібла ДР(AgBr) = 6,3 · 10-13. Обчисліть розчинність броміду срібла у воді.
Відповідь. У розчині малорозчинного, сильного електроліту AgBr існує рівновага: AgBr Ag+ + Br-; ДР(AgBr) = [Ag+][Br-]. Оскільки бромід срібла дисоціює на один катіон і один аніон, концентрація його у розчині дорівнює концентрації кожного з іонів, тобто:
[AgBr]
= [Ag+]
= [Br-]
=
![]() моль/л.
моль/л.
Отже, розчинність AgBr у воді за певних умов дорівнює 8 10-7 моль/л.
