
- •Фізико-хімічні методи аналізу
- •Оптичні методи аналізу
- •Атомно-емісійна спектроскопія
- •Загальна схема спектральних приладів
- •Фотометрія полум’я
- •Люмінесцентний аналіз
- •Походження люмінесценції
- •Характеристики і закономірності люмінесценції
- •Якісний і кількісний аналіз
- •Можливості і практичне застосування
- •Абсорбційні методи аналізу
- •Електрохімічні методи аналізу
- •Кількісний аналіз проводять :
- •Практичне використання
- •Вольтамперометрія (полярографія)
- •Кулонометрія
- •Сорбційні (хроматографічні) методи аналізу
- •Рідинна хроматографія
- •Іонообмінна хроматографія
- •Гель-проникаюча хроматографія (молекулярне сито)
- •Газова хроматографія
- •Список літератури
Електрохімічні методи аналізу
Ці методи засновані на вимірюванні та реєстрації електричних параметрів систем, що аналізуються (кількость електрики, яка пройшла через розчин електроліту; електрична провідність або електричний опір; потенціал електроду, який знаходиться в аналізуємому розчині та ін.). Їх можна поділити на дві групи: 1) без застосування зовнішнього джерела електричного струму (потенціометрія, іонометрія). 2) з застосуванням зовнішнього джерела електричного струму (низькочастотна і високочастотна кондуктометрія, кулонометрія, вольтамперометрія (полярографія), амперометрія);
ПОТЕНЦІОМЕТРІЯ (ІОНОМЕТРІЯ)
Потенціометрія - електрохімічний метод дослідження та аналізу, який базується на на залежності електрохімічного потенціалу електроду від концентрації (активності) іонів які визначаються. Зв,язок потенціалу електроду Е з активністю (концентрацією) речовин, які приймають участь в електродних процесах, описується рівнянням Нернста
![]()
де Е0 – стандартний потенціал редокс-системи; R - універсальна газова стала, яка дорівнює 8,312 Дж / моль ; Т - абсолютна температура, 0 К; F - стала Фарадея, яка дорівнює 96500 Кл/моль; n - число електронів, що приймають участь в електродній реакції; аох, аred – активності окисленої і відновленої форм редокс-системи, відповідно, моль/л; [ох], [red] - молярні концентрації окисленої і відновленої форм редокс-системи, моль/л; γох, γred – коефіцієнти активності.
В
розбавлених розчинах коефіцієнти
активності іонів близькі до одиниці і
відповідно активність близька до
молярної концентрації, тому можна
користуватися рівнянням Нернста в
концентраційній формі, а саме:
![]()
![]()
Схема методу наступна: в аналізуємий розчин занярюють два електроди і вимірюють різницю їх потенціалів (ЕРС гальванічного елементу). Один з електродів має сталий потенціал незалежно від природи розчину, в який його занурено (електрод порівняння). Потенціал другого електроду залежитьвід концентрації електроліту в розчині (індикаторний електрод).
φ = Е1 – Е2
де φ –електрорушійна сила гальванічного елементу (ЕРС); Е1 і Е2 – потенціали індикаторного електроду та електроду порівняння. Оскільки потенціал електроду порівняння сталий, то зміна ЕРС визначається потенціалом індикаторного електрода.
Якщо індикаторний електрод сам є одним з компонентів окисно-відновної системи, то величина потенціалу електрода буде визначатися лише концентрацією іонів металу в розчині. Наприклад, деякі метали, занурені в розчин солі цього ж металу, здатні осаджувати іони з розчину і таким чином утворювати окисно-відновну систему:
![]()
Вважаючи, що концентрація (активність) металу дорівнює одиниці, рівняння Нернста для цієї системи матиме вигляд:
![]() .
.
З рівняння бачимо, що в даному випадку потенціал електроду залежить лише від концентрації катіона металу в розчині. Електроди такого типу називають електродами першого роду; до них належать, наприклад, срібний, ртутний, водневий електроди.
Поряд з електродами першого роду існують електроди чутливі до концентрації аніонів, що утворюють малорозчинні осади з катіонами металу електрода. Подібни електроди, потенціал яких визначається концентрацією відповідних аніонів, називаються електродами другого роду. Вони представляють собою метал, вкритий шаром малорозчинної солі цього ж металу. Потенціал електроду другого роду визначаеться рівнянням:
![]() .
.
Електродами другого роду є хлорсрібний і каломельний.
Широко розповсюджені електроди третього роду - мембранні або іоно-селективні електроди. Мембраннні електроди - це електрохімічні напівелемен ти, в яких різниця потенціалів на межі розділу фаз “електродний матеріал – розчин електроліту” залежить від концентрації (активності) іона, що визнача-ється, в розчині. Електродний матеріал являє собою тверду або рідку мембрану, в яку введена речовина, здатна відщеплювати або приєднувати іони, що визна-чаються. Ці іони при зіткненні з водою або з водяним розчином електроліту здатні переходити в нього. Іноді, навпаки, іони з розчину проникають у мембра-ну. У результаті поверхня мембрани здобуває заряд, протилежний заряду іонів, що перейшли в розчин, і на межі розділу фаз виникає потенціал, величина якого залежить від активності даних іонів у розчині. Тобто найважливішою складовою частиною такого електроду є напівпроникна мембрана. Оскільки потенціал мембранних електродів створюють іони певного виду, то їх називають іоноселективними.електродами. Іоноселективні електроди відповідно до природи електродно-активного матеріалу можуть містити: тверду рідку, газову або ферментну мембрани.
Індикаторні електроди
В методі кислотно-основної взаємодії широко використовують скляний електрод, який виготовляють із скла певних сортів, підбираючи їх так, щоб мембрана проявляла підвищену селективність до іона, що визначається. Першим електродом зі скляною мембраною був електрод, селективний відносно Н+-іонів, який витіснив всі інші електроди, що застосовувалися для вимірювання рН. Його дія заснована на виникненні різниці потенціалів між тонкою скляною плівкою й водяними розчинами з певною концентрацією (активністю водневих іонів). Воднева функція скляного електроду, тобто залежність різниці потенціалів від активності іонів водню в розчині, обумовлена їхньою дифузією в скло. Пізніше були створені скляні електроди для визначення інших іонів ( К+, Nа+, Аg+ ). Cучасний скляний електрод для вимірювання рН зображений на рис. 21.



















 6
6
Рис.21. Скляний електрод
5
- скляна рН-чутлива

 мембрана;
мембрана;
 2 – 0,1 моль/л розчин НСl, насиче-4
2 – 0,1 моль/л розчин НСl, насиче-4
ний АgСl , 3 –срібний дріт;
4 - скляна трубка;
 5 – ізоляція; 6 - струмовідвід
. 3
5 – ізоляція; 6 - струмовідвід
. 3
2
 1
1
Головна його частина – тонка скляна мембрана зі спеціального сорту скла у формі кульки (1), припаяна до скляної трубки (4). Внутрішню частину кульки заповнюють 0,1 моль/л розчином хлористо-водневої кислоти, насичений хлоридом срібла (2), вставляють срібний дріт (3), що служить внутрішнім електродом порівняння.
Скляний електрод придатний для виміру рН в області від 0÷13. Він нечутливий до різних домішок у розчині, не отруюється. Рівновага між електродом і розчином встановлюється дуже швидко. Недоліком є крихкість скляної кульки (плівки).
Скляні іоноселективні електроди широко використовують також для визначення катіонів лужних металів в різних біологічних пробах - крові, плазмі, сироватках і т.д., в об'єктах навколишнього середовища - водах, рослинах, різних екстрактах і т.д. Визначення за допомогою іонселективних електродів успішно конкурують із полум’яно-фотометричними методами за точністю й експресністю.
В методах осадження і комплексоутворення як індикаторні використовують електроди, потенціал яких залежить від концентрації іонів, що беруть участь в реакції осадження чи комплексоутворення. Наприклад, для визначення срібла потенціометричним методом можна використати срібний електрод. Його ж можна використовувати для визначення іонів, що дають з іонами срібла малорозчинні осади або стійкі комплексні сполуки.
В
методах окислення-відновлення
як індикаторні електроди використовують
індиферентні у відношенні до іона, що
визначється, метали – платину Pt, золото
Au, паладій Pd та інш. Індикаторні електроди
не беруть участь в окисно-відновній
реакції, вони служать лише для вимірювання
величини потенціалу даної окисно-відновної
пари по відношенню до стандарт-ного
електрода. Наприклад, якщо при
окисно-відновному титруванні іонів
двовалентного заліза діхроматом калію
в розчин, який титрується опустити
платиновий електрод і з’єднати його з
електродом порівняння, то до точки
еквівалентності платиновий електрод
буде показувати зміну потенціалу системи
![]() ,
а після точки еквівалентності –
потенціалу системи
,
а після точки еквівалентності –
потенціалу системи![]() .
.
Електроди порівняння.
Основна вимога до будь-якого електрода порівняння – це сталость його потенціалу. Незалежно від того, чи занурений електрод порівняння в досліджу-вавний розчин, чи зєднаний з досліджуваним розчином електролітичним містком, він не повинен реагувати на зміну концентрації іона, що визначається. Як електроди порівняння найчастіше використовують водневий, каломельний і хлорсрібний електроди.
Водневий електрод- представляє собою платиновий дріт чи пластину, на поверхню яких нанесена тонкодисперсна платина, насичена газоподібним воднем, на поверхні такого електрода в розчині протікає реакція
![]() .
.
Водневий
електрод, в якому при температурі
25,150С
активність Н+-
іонів дорівнює 1 моль/л, тиск водню
дорівнює 1 атм, називається нормальним
водневим
електродом
(НВЕ).
Стандартний потенціал нормального
водневого електрода прийнято за нуль
(![]() ).
Тоді потенціал водневого електрода
можна обчислити за формулою:
).
Тоді потенціал водневого електрода
можна обчислити за формулою:
![]() звідки
звідки
![]() .
.
Водневий
електрод тепер рідко використовується
як індикатор на
![]() іони.
Як електрод порівняння його використовують
для визначення величин потенціалу інших
електродів. Відносно нього виміряні
стандартні потенціали інших електродів.
іони.
Як електрод порівняння його використовують
для визначення величин потенціалу інших
електродів. Відносно нього виміряні
стандартні потенціали інших електродів.
Насичений каломельний електрод (Нg|Hg2Cl2||KCl) - типовий електрод другого роду, Він складається з металічної ртуті, вкритої осадом каломелі Hg2Cl2 в контакті з насиченим розчином КСl. Потенціал такого електроду Е залежить лише від концентрації аніону:
![]() ,
,
де
стандартний потенціал Е0=
0.2412 В. В насиченому розчині КСl
концентрація іонів хлору стала, тому,
враховуючи добуток розчинності
ДР(Hg2Cl2)
=
![]() ,
можна стверджувати, що концентрація
іонів ртуті в цій рівновазі буде також
сталою, а відповідно сталим буде і
потенціал ртуті в такому розчині.
,
можна стверджувати, що концентрація
іонів ртуті в цій рівновазі буде також
сталою, а відповідно сталим буде і
потенціал ртуті в такому розчині.
Хлорсрібний електрод (Аg|AgCl||KCl) також належить до електродів другого роду. Хлорсрібний електрод являє собою срібний дріт, вкритий осадом хлоріду срібла і занурений в насичений розчин КСl .
Потенціал Е хлорсрібного електрода є фунцією логарифму концентрації іонів хлору в розчині:
![]() ,
,
де
стандартний потенціал
![]() =
0.197 В.
Як електрод порівняння він найчастіше
використовується в парі зі скляним чи
платиновим електродом. Хлорсрібні
електроди входять в комплекти рН-метрів,
іономерів, потенціометрів, полярографів
та інших лабораторних приладів.
=
0.197 В.
Як електрод порівняння він найчастіше
використовується в парі зі скляним чи
платиновим електродом. Хлорсрібні
електроди входять в комплекти рН-метрів,
іономерів, потенціометрів, полярографів
та інших лабораторних приладів.
Методи потенціометричного аналізу
Якісний потенціометричний аналіз засновано на селективності електродів.
Методи кількісногопотенціометричного аналізу розділяють напряму потенціометріюіпотенціометричне титрування.
Методипрямої потенціометріїзасновані на прямому визначенні активності (концентрації) іонів по потенціалу індикаторного електрода (визначення іонів водню (рН), визначення катіонів та аніонів за допомогою іоноселективних електродів)
![]() ,
,
де Еінд, Епорівн, - потенціали електродів індикаторного і порівняння, відповідно; Е0– стандартний електродний потенціал, ЕРС – електрорушійна сила гальванічного елементу.
В прямій потенціометрії також можна використовувати градуйовочний графік, побудований в координатах “ЕРС – lg c(B)”.
Потенціометричне титрування - об΄емно-аналітичний метод, точку еквівалентності в якому фіксують за різкою зміною (стрибком) потенціалу індикаторного електрода чи ЕРС гальванічного елемента. Таким чином, потенціометричне титрування, як і титрування з індикатором, базується на різкій зміні концентрації іона, що визначається, поблизу точки еквівалентності при додаванні до розчину невеликої кількості титранту.
В потенціометричному титруванні застосовують реакції кислотно-основної взаємодії, окислення-відновлення,комплексоутворення, осадження.
Знаходження точки еквівалентності.
Точку еквівалентності знаходять по кривій титрування (рис. 11). ЇЇ використовують в інтегральному і диференціальному варіантах. Як видно, в точці еквівалентності відбувається різкий стрибок ЕРС, викликаний різкою
зміною потенціалу індикаторного електроду. Визначення точки еквівалентеквівалентності по диференційній кривій значно точніше, ніж по інтегральній.

Рис. 11. Криві потенціометричного титрування
а – інтегральна; диференційнів.т.е. точка еквівалентності.
-
Основними достоїнствами потенціометричного методу є його висока точність, низька границя визначення і можливість використання розбавлених розчинів і неводних розчинників. Методами потенціометри- чного титрування можна аналізувати суміші речовин без попереднього розділення їх, напрозорі і забарвлені розчини. Потенціометричне титрування легко піддається автоматизації.
Кондуктометрія
Даний
метод засновано на залежності електричної
провідності (електричного опору) розчину
від концентрації електроліту в ньому.
Схема методу наступна: за допомогою
електродів, підключених до зовнішнього
джерела змінного струму, в аналізуємому
розчині електроліту створюється
електричне поле. Під дією цього поля
іони здійснюють коливально-поступальні
рухи в напрямку поля. Швидкість руху
іонів залежить від їх розмірів, заряду
, розмірів сольватної оболонки навколо
них, властивостей розчинника, присутності
інших іонів, параметрів електричного
поля. Для її характеристики користуються
величиною рухомості
іону
λ0+-
= υ0+-
F
, де
υ0+-
-
абсолютна швидкість руху іону;
F
= 96500 Кл/моль, константа Фарадея. Аномально
високу рухомість (табл.. 5) мають іони Н+
(
![]() =
349,8 См · см2
· моль-1)
та
ОН-
(
=
349,8 См · см2
· моль-1)
та
ОН-
(![]() =198,3 См
· см2
· моль-1).
Це
пояснюється
специфічним
=198,3 См
· см2
· моль-1).
Це
пояснюється
специфічним
Таблиця 5. Гранична еквівалентна електрична провідність (рухомість)
іонів
(![]() )
в водних
розчинах
при 25˚ С
)
в водних
розчинах
при 25˚ С
-
Катіон
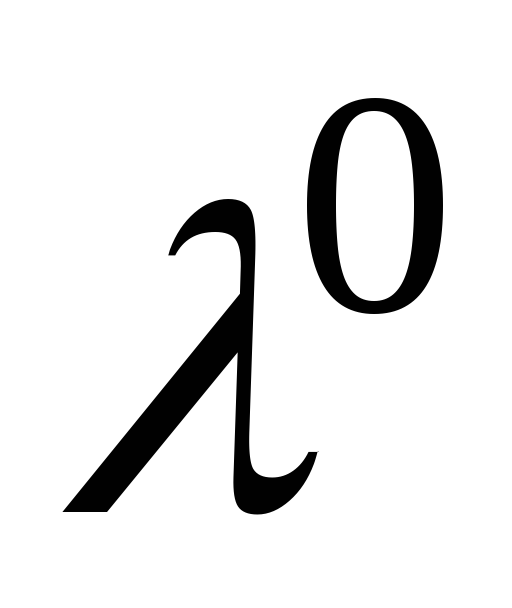
Аніон


349,8

198,3

73,6

110,5

73,5

100,9

70,0

85,0

68,0

80,0

63,6
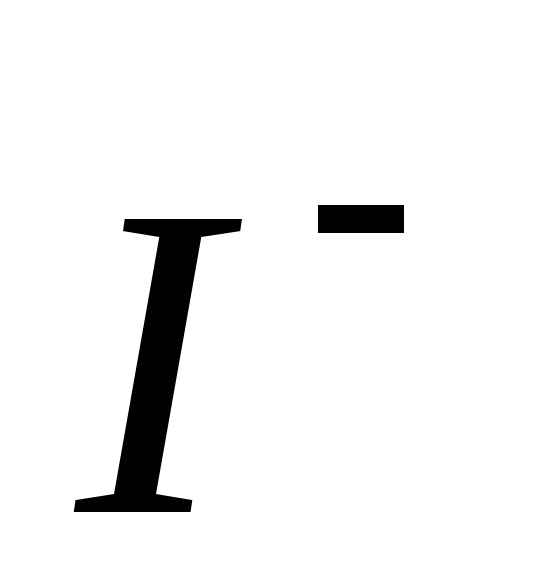
78,8

63,0
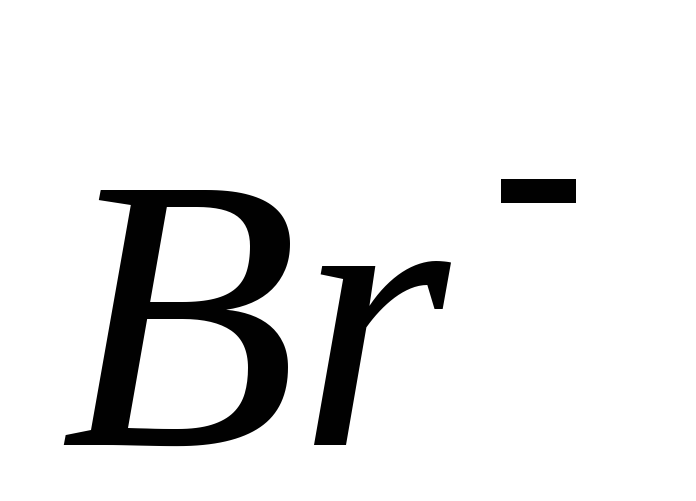
78,1

61,9

76,4

59,5

74,0

59,5

71,5



56,6

69,3

54,0

67,4

53,5


65,0

53,5

55,4

53,1

44,5

50,1

40,9

38,7

32,4
механізмом їх руху в розчині – «естафетним шляхом» (передача заряду від однієї молекули води до іншої). Рухомості інших іонів в водних розчинах відрізняються порівняно мало (в межах 30-70 одиниць). В зв’язку з досить близькими значеннями рухомостей іонів кондуктометричні вимірювання дають інформацію, головним чином, тільки про загальну концентрацію іонів в розчині. Мала селективність кондуктометричного методу є одним з його суттєвих обмежень.
В залежності від частоти струму зовнішнього джерела розрізняють низькочастотну і високочастотну кондуктометрію. Кондуктометричний метод, в якому використовують: струми низької частоты, засновано на вимірювані електричної провідності аналізуємих розчинів (або газів);-струми високої частоти (мегагерц та десятки мегагерц), засновано на вимірюванні двох струмів – струму провідності та струму зміщення. Перший з них, в основному, обумовлений переміщенням іонів в напрямку електрич-ного поля (застосовується в методі високочастотного титрування – ВЧТ), а другий – їх обернено-коливальним рухом (застосовується в методі діэлькометричного титрування).
Кондуктометричні методи класифікують в залежності від принципу вимірювання електричної провідності:
-пряма кондуктометрія, яка заснована на безпосередньому вімірюванні
електричної провідності розчину індивідуальної речовини, що аналізується;
-кондуктометричне і високочастотне титрування (ВЧТ), яке засноване на вимірюванні електричної провідності, що змінюється в процесі титрування; при цьому про вміст речовини судять по зламу кривої титрування;
-хронокондуктометричне титрування, яке засновано на визначенні вмісту речовини по часу титрування при подачі розчину титранту з постійною швидкістю.
В низькочастотній кондуктометрії в розчин електроліту поміщають два електроди однакової площі S, відстань між якими ι. Електроди підключа-ють до зовнішнього джерела змінного електричного струму низької частоти (50 Гц) і вимірюють величину електричної провідності або електричний опір розчину. Величини електричної провідності і електричного опору розчину залежать від властивостей іонів, їх концентрації, параметрів кондуктометричної ячейки і ці залежності описуються наступними формулами:
еквівалентна
електрична провідність розчину
![]() ,
,
де![]() λ0+,
λ0-- рухомості
катіону і аніону, відповідно, См· см2· моль-1;α– ступінь дисоціації
електроліту;c(B)eq– молярна концентрація еквіваленту
аналізуємої речовини, моль/л. Питома
електрична провідність розчину залежить
від природи речовини і параметрів
кондуктометричної ячейкиγ =1
/ ρ=
λ0+,
λ0-- рухомості
катіону і аніону, відповідно, См· см2· моль-1;α– ступінь дисоціації
електроліту;c(B)eq– молярна концентрація еквіваленту
аналізуємої речовини, моль/л. Питома
електрична провідність розчину залежить
від природи речовини і параметрів
кондуктометричної ячейкиγ =1
/ ρ=
= ι / S · R =G · ι / S.Поєднавши наведені вище закономірності отримуємо рівняння, за яким можна обчислити концентрацію розчину, скориставшись експериментальними даними (величиниR,G,ι,S) і табульованими сталими (λ0+іλ0-)

