- •2. Аминокислоты, входящие в состав белков, их строение и свойства. Пептиды.
- •4. Вторичная структура белков. Связи, стабилизирующие вторичную структуру.
- •5. Третичная структура белков. Типы химических связей, участвующих в
- •8. Физико-химические свойства белков. Молекулярная масса, размеры и форма, растворимость, ионизация и гидратация. Денатурация, признаки и факторы ее вызывающие.
- •1. Различия белков по форме молекул
- •2. Различия белков по молекулярной массе
- •3. Суммарный заряд белков
- •4. Соотношение полярных и неполярных групп на поверхности нативных молекул белков
- •5. Растворимость белков
- •1. Методы разрушения тканей и экстракции белков
- •2. Методы очистки белков
- •3. Очистка белков от низкомолекулярных примесей
- •10. Принципы классификации белков. Классификация по составу и биологическим функциям, примеры представителей отдельных классов.
- •11. Иммуноглобулины, классы иммуноглобулинов, особенности доменного строения и функционирования.
- •12. Ферменты, определение. Особенности ферментативного катализа. Специфичность действия ферментов, виды.
- •13.Классификация и номенклатура ферментов, примеры.
- •1. Оксидоредукпшзы
- •2.Трансферты
- •V. Механизм действия ферментов
- •1. Формирование фермент-субстратного комплекса
- •3. Роль активного центра в ферментативном катализе
- •1. Кислотно-основной катализ
- •2. Ковалентный катализ
- •15. Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от температуры, рН среды, концентрации фермента и субстрата. Уравнение Михаэлиса-Ментен, Кm.
- •16. Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр и в2 на примере трансаминаз и дегидрогеназ.
- •1. Роль металлов в присоединении субстрата в активном центре фермента
- •2. Роль металлов в стабилизации третичной и четвертичной структуры фермента
- •3. Роль металлов в ферментативном катализе
- •4. Роль металлов в регуляции активности ферментов
- •1. Механизм "пинг-понг"
- •2. Последовательный механизм
- •17. Ингибирование ферментов: обратимое и необратимое; конкурентное и неконкурентное. Лекарственные препараты как ингибиторы ферментов.
- •1. Конкурентное ингибирование
- •2. Неконкурентное ингибирование
- •1. Специфические и неспецифические ингибиторы
- •2. Необратимые ингибиторы ферментов как лекарственные препараты
- •19. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования (на примере ферментов синтеза и распада гликогена).
- •20. Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции каталитической активности ферментов.
- •21. Изоферменты, их происхождение, биологическое значение, привести примеры. Определение ферментов и изоферментного спектра плазмы крови с целью диагностики болезней.
- •22. Энзимопатии наследственные (фенилкетонурия) и приобретенные (цинга). Применение ферментов для лечения болезней.
- •23. Общая схема синтеза и распада пиримидиновых нуклеотидов. Регуляция. Оротацидурия.
- •24. Общая схема синтеза и распада пуриновых нуклеотидов. Регуляция. Подагра.
- •27. Азотистые основания, входящие в структуру нуклеиновых кислот – пуриновые и пиримидиновые. Нуклеотиды, содержащие рибозу и дезоксирибозу. Структура. Номенклатура.
- •27. Гибридизация нуклеиновых кислот. Денатурация и ренативация днк. Гибридизация (днк-днк, днк-рнк). Методы лабораторной диагностики, основанные на гибридизации нуклеиновых кислот.(пцр)
- •29. Репликация. Принципы репликации днк. Стадии репликации. Инициация. Белки и ферменты, принимающие участие в формировании репликативной вилки.
- •30. Элонгация и терминация репликации. Ферменты. Асимметричный синтез днк. Фрагменты Оказаки. Роль днк-лигазы в формировании непрерывной и отстающей цепи.
- •31. Повреждения и репарация днк. Виды повреждений. Способы репарации. Дефекты репарационных систем и наследственные болезни.
- •32. Транскрипция Характеристика компонентов системы синтеза рнк. Структура днк-зависимой рнк-полимеразы: роль субъединиц (α2ββ′δ). Инициация процесса. Элонгация, терминация транскрипции.
- •33. Первичный транскрипт и его процессинг. Рибозимы как пример каталитической активности нуклеиновых кислот. Биороль.
- •35. Сборка полипептидной цепи на рибосоме. Образование инициаторного комплекса. Элонгация: образование пептидной связи (реакция транспептидации). Транслокация. Транслоказа. Терминация.
- •1. Инициация
- •2. Элонгация
- •3. Терминация
- •36. Особенности синтеза и процессинга секретируемых белков (на примере коллагена и инсулина).
- •37. Биохимия питания. Основные компоненты пищи человека, их биороль, суточная потребность в них. Незаменимые компоненты пищи.
- •38. Белковое питание. Биологическая ценность белков. Азотистый баланс. Полноценность белкового питания, нормы белка в питании, белковая недостаточность.
- •39. Переваривание белков: протеазы жкт, их активация и специфичность, оптимум рН и результат действия. Образование и роль соляной кислоты в желудке. Защита клеток от действия протеаз.
- •1. Образование и роль соляной кислоты
- •2.Механизм активации пепсина
- •3.Возрастные особенности переваривания белков в желудке
- •1. Активация панкреатических ферментов
- •2. Специфичность действия протеаз
- •41. Витамины. Классификация, номенклатура. Провитамины. Гипо-, гипер- и авитаминозы, причины возникновения. Витаминзависимые и витаминрезистентные состояния.
- •42. Минеральные вещества пищи, макро- и микроэлементы, биологическая роль. Региональные патологии, связанные с недостатком микроэлементов.
- •3. Жидкостностъ мембран
- •1. Структура и свойства липидов мембран
- •45. Механизмы переноса веществ через мембраны: простая диффузия, пассивный симпорт и антипорт, активный транспорт, регулируемые каналы. Мембранные рецепторы.
- •1. Первично-активный транспорт
- •2. Вторично-активный транспорт
- •Мембранные рецепторы
- •46. Эндэргонические и экзэргонические реакции в живой клетке. Макроэргические соединения. Дегидрирование субстратов и окисление водорода как основной источник энергии для синтеза атф.
- •3.Эндергонические и экзергонические реакции
- •4. Сопряжение экзергонических и эндергонических процессов в организме
- •2. Строение атф-синтазы и синтез атф
- •3.Коэффициент окислительного фосфорилирования
- •4.Дыхательный контроль
- •50. Образование активных форм кислорода (синглетный кислород, пероксид водорода, гидроксильный радикал, пероксинитрил). Место образования, схемы реакций, их физиологическая роль.
- •51. . Механизм повреждающего действия активных форм кислорода на клетки (пол, окисление белков и нуклеиновых кислот). Примеры реакций.
- •1) Инициация: образование свободного радикала (l•)
- •2) Развитие цепи:
- •3) Разрушение структуры липидов
- •1. Строение пируватдегидрогеназного комплекса
- •3. Связь окислительного декарбоксилирования пирувата с цпэ
- •53.Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Роль цикла в метаболизме.
- •1. Последовательность реакций цитратного цикла
- •54. Цикл лимонной кислоты, схема процесса. Связь цикла с целью переноса электронов и протонов. Регуляция цикла лимонной кислоты. Анаболические и анаплеротические функции цитратного цикла.
- •55. Основные углеводы животных, биологическая роль. Углеводы пищи, переваривание углеводов. Всасывание продуктов переваривания.
- •Методы определение глюкозы в крови
- •57. Аэробный гликолиз. Последовательность реакций до образования пирувата (аэробный гликолиз). Физиологическое значение аэробного гликолиза. Использование глюкозы для синтеза жиров.
- •1. Этапы аэробного гликолиза
- •58. Анаэробный гликолиз. Реакция гликолитической оксидоредукции; субстратное фосфорилирование. Распространение и физиологическое значение анаэробного распада глюкозы.
- •1. Реакции анаэробного гликолиза
- •59. Гликоген, биологическое значение. Биосинтез и мобилизация гликогена. Регуляция синтеза и распада гликогена.
- •61. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, непереносимость фруктозы и дисахаридов. Гликогенозы и агликогенозы.
- •2. Агликогенозы
- •62. Липиды. Общая характеристика. Биологическая роль. Классификация липидов.Высшие жирные кислоты, особенности строения. Полиеновые жирные кислоты. Триацилглицеролы..
- •64. Депонирование и мобилизация жиров в жировой ткани, физиологическая роль этих процессов. Роль инсулина, адреналина и глюкагона в регуляции метаболизма жира.
- •66. Распад жирных кислот в клетке. Активация и перенос жирных кислот в митохондрии. Β-окисление жирных кислот, энергетический эффект.
- •67. Биосинтез жирных кислот. Основные стадии процесса. Регуляция обмена жирных кислот.
- •2. Регуляция синтеза жирных кислот
- •68. Кетоновые тела, биосинтез и использование в качестве источников энергии. Причины развития кетонемии и кетонурии при голодании и сахарном диабете.
- •69. Холестерин. Пути поступления, использования и выведения из организма. Уровень холестерина в сыворотке крови. Биосинтез холестерина, его этапы. Регуляция синтеза.
- •Фонд холестерола в организме, пути его использования и выведения.
- •1. Механизм реакции
- •2. Органоспецифичные аминотрансферазы ант и act
- •3. Биологическое значение трансаминирования
- •4. Диагностическое значение определения аминотрансфераз в клинической практике
- •1. Окислительное дезаминирование
- •74. Непрямое дезаминирование аминокислот. Схема процесса, субстраты, ферменты, кофакторы.
- •3. Неокислительное дезамитровате
- •75. Основные источники аммиака в организме человека. Токсичность аммиака. Роль глутамина и аспарагина в обезвреживании аммиака. Глутаминаза почек, образование и выведение солей аммония.
- •76. Оринитиновый цикл мочевинообразования. Химизм, место протекания процесса. Энергетический эффект процесса, его регуляция. Количественное определение мочевины сыворотки крови, клиническое значение.
- •2. Образование спермидина и спермина, их биологическая роль
- •78. Обмен фенилаланина и тирозина. Особенности обмена тирозина в разных тканях.
- •79. Эндокринная, паракринная и аутокринная системы межклеточной коммуникации. Роль гормонов в системе регуляции метаболизма. Регуляция синтеза гормонов по принципу обратной связи.
- •80. Классификация гормонов по химическому строению и биологическим функция.
- •1. Классификация гормонов по химическому строению
- •2. Классификация гормонов по биологическим функциям
- •1. Общая характеристика рецепторов
- •2. Регуляция количества и активности рецепторов
- •82. Циклические амф и гмф как вторичные посредники. Активация протеинкиназ и фосфорилирование белков, ответственных за проявление гормонального эффекта.
- •3. Передача сигналов через рецепторы, сопряжённые с ионными каналами
- •85. Гормоны гипоталамуса и передней доли гипофиза, химическая природа и биологическая роль.
- •2. Кортиколиберин
- •3. Гонадолиберин
- •4. Соматолиберин
- •5.Соматостатин
- •1. Гормон роста, пролактин
- •2. Тиреотропин, лютеинизирующий гормон и фолликулостимулирующий гормон
- •3. Группа гормонов, образующихся из проопиомеланокортина
- •4. Гормоны задней доли гипофиза
- •86. Регуляция водно-солевого обмена. Строение, механизмдействия и функции альдостерона и вазопрессина. Роль системы ренин-ангиотензин-альдостерон. Предсердный натриуретический фактор.
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •2. Роль системы ренин-ангиотензин- альдостерон в регуляции водно-солевого обмена
- •3. Восстановление объёма крови при обезвоживании организма
- •4. Гиперальдостеронтм
- •87. Регуляция обмена ионов кальция и фосфатов. Строение, биосинтез и механизм действия паратгормона, кальцитонина и кальцитриола.Причины и проявления рахита, гипо- и гиперпаратиреоидизма.
- •1. Синтез и секреция птг
- •2. Роль паратгормона в регуляции обмена кальция и фосфатов
- •3. Гиперпаратиреоз
- •4. Гипопаратиреоз
- •1. Строение и синтез кальцитриола
- •2. Механизм действия кальцитриола
- •3. Рахит
- •2. Биологические функции инсулина
- •3. Механизм действия инсулина
- •1. Инсулинзависимый сахарный диабет
- •2. Инсулинонезависимый сахарный диабет
- •1. Симптомы сахарного диабета
- •2. Острые осложнения сахарного диабета. Механизмы развития диабетической комы
- •3. Поздние осложнения сахарного диабета
- •1. Биосинтез йодтиронинов
- •2. Регуляция синтеза и секреции йодтиронинов
- •3. Механизм действия и биологические функции йодтиронинов
- •4. Заболевания щитовидной железы
- •90. Гормоны коры надпочечников (кортикостероиды). Их влияние на метаболизм клетки. Изменения метаболизма при гипо- и гиперфункции коры надпочечников.
- •3. Изменения метаболизма при гипо- и гиперфункции коры надпочечников
- •91. Гормоны мозгового слоя надпочечников. Секреция катехоламинов. Механизм действия и биологические функции катехоламинов. Патология мозгового вещества надпочечников.
- •1. Синтез и секреция катехоламинов
- •2. Механизм действия и биологические функции катехоламинов
- •3. Патология мозгового вещества надпочечников
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •93.Распад гема. Схема процесса, место протекания. «Прямой» и «непрямой» билирубин, его обезвреживание в печени.Диагностическое значение определения билирубина в крови и моче.
- •94. . Нарушения катаболизма гема. Желтухи: гемолитическая, желтуха новорожденных, печеночно-клеточная, механическая, наследственная (нарушения синтеза удф-глюкуронилтрансферазы).
- •1. Гемолитическая (надпечёночная) желтуха
- •2. Печёночно-клеточная (печёночная) желтуха
- •3. Механическая, или обтурационная (подпечёночная) желтуха
- •1. Участие трансфераз в реакциях конъюгации
- •2. Роль эпоксидгидролаз в образовании диолов
- •96. Гемоглобины человека, структура. Транспорт кислорода и диоксида углерода. Гемоглобин плода и его физиологическое значение. Гемоглобинопатии.
- •98. Белки сыворотки крови, биологическая роль основных фракций белков, значение их определения для диагностики заболеваний. Содержание и функции некоторых белков плазмы крови
- •98. Ферменты плазмы крови, энзимодиагностика. Количественное определение активности аминотрансфераз (АлАт, АсАт).
- •Аминотрансферазы
- •Аланинаминотрансфераза (алат)
- •99. Коллаген: особенности аминокислотного состава, первичной и пространственной структуры. Особенности биосинтеза и созревания коллагена. Роль аскорбиновой кислоты в созревании коллагена.
- •104. Значение воды для жизнедеятельности организма. Распределение воды в тканях , понятие о внутриклеточной и внеклеточной жидкостях. Водный баланс, регуляция водного обмена.
76. Оринитиновый цикл мочевинообразования. Химизм, место протекания процесса. Энергетический эффект процесса, его регуляция. Количественное определение мочевины сыворотки крови, клиническое значение.
Мочевина - основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота . Экскреция мочевины в норме составляет ∼25 г/сут.
При повышении количества потребляемых с пищей белков экскреция мочевины увеличивается. Мочевина синтезируется только в печени, что было установлено ещё в опытах И.Д. Павлова. Поражение печени и нарушение синтеза мочевины приводят к повышению содержания в крови и тканях аммиака и аминокислот (в первую очередь, глутамина и аланина).
В 40-х годах XX века немецкие биохимики Г. Кребс и К. Гензелейт установили, что синтез мочевины представляет собой циклический процесс, состоящий из нескольких стадий, ключевым соединением которого, замыкающим цикл, является орнитин. Поэтому процесс синтеза мочевины получил название "орнитиновый цикл", или "цикл Кребса-Гензелейта"
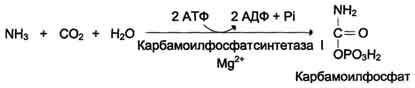
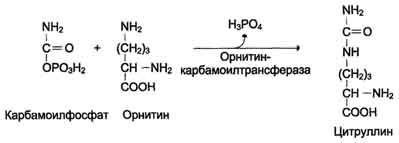
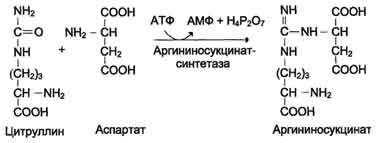
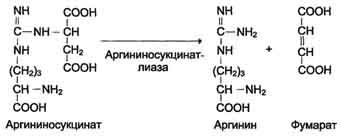
Первые две реакции процесса происходят в митохондриях гепатоцитов. Затем цитруллин, являющийся продуктом этих реакций, транспортируется в цитозоль, где и осуществляются дальнейшие превращения
Энергетический баланс процесса
В реакциях орнитинового цикла расходуются четыре макроэргических связи трёх молекул АТФ на каждый оборот цикла. Однако процесс превращения аминокислот в безазотистые остатки и мочевину имеет пути компенсации энергозатрат:
при включении фумарата в ЦТК на стадии дегидрирования малата образуется NADH, который обеспечивает синтез 3 молекул АТФ (рис. 9-18);
при окислительном дезаминировании глутамата в разных органах также образуется NADH, соответственно - ещё 3 молекулы АТФ.
Затраты энергии происходят также и при трансмембранном переносе веществ, связанном с синтезом и экскрецией мочевины. Первые две реакции орнитинового цикла происходят в митохондриях, а последующие три - в цитозоле. Цитруллин, образующийся в митохондрии, должен быть перенесён в цитозоль, а орнитин, образующийся в цитозоле, необходимо транспортировать в митохондрию. Кроме того, в почках перенос мочевины из крови в мочу происходит путём активного транспорта за счёт градиента ионов натрия, создаваемого К+,Nа+-АТФ-азой, что тоже сопряжено с энергозатратами.
Орнитиновый цикл в печени выполняет 2 функции:
превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака;
синтез аргинина и пополнение его фонда в организме.
Регуляторные стадии процесса - синтез карбамоилфосфата, синтез цитруллина и заключительная стадия, катализируемая аргиназой. Эффективность работы орнитинового цикла при нормальном питании человека и умеренных физических нагрузках составляет примерно 60% его мощности. Запас мощности необходим для избежания гипераммониемии при изменениях количества белка в пище. Увеличение скорости синтеза мочевины происходит при длительной физической работе или длительном голодании, которое сопровождается распадом тканевых белков. Некоторые патологические состояния, характеризующиеся интенсивным распадом белков тканей (сахарный диабет и др.), также сопровождаются активацией орнитинового цикла. При избыточном белковом питании количество ферментов орнитинового цикла в печени увеличивается, что приводит к интенсификации синтеза мочевины.
Определение концентрации мочевины в крови широко используется в диагностике, применяется для оценки тяжести патологического процесса, для наблюдения за течением заболевания и оценки эффективности проводимого лечения. Однако не следует забывать, что на уровень мочевины в крови могут влиять не только патологические, но и физиологические факторы (характер питания, физическая нагрузка и т. д.), а также прием лекарственных препаратов. Уровень мочевины может изменяться как в сторону повышения, так и снижения. При физиологических процессах степень отклонения уровня мочевины от нормы, как правило, незначительна, в то время как при патологии наблюдаются значительные сдвиги, причем степень изменения уровня мочевины зависит от тяжести патологического процесса.
Концентрация мочевины в сыворотке крови здоровых взрослых людей составляет 2,5 — 8,3 ммоль/л (660 мг/л). У женщин, по сравнению со взрослыми мужчинами, концентрация мочевины в сыворотке крови обычно ниже. У пожилых людей (старше 60 лет) наблюдается некоторое увеличение концентрации мочевины в сыворотке крови (примерно на 1 ммоль/л по сравнению с нормой здоровых взрослых людей), что обусловлено снижением у пожилых способности почек концентрировать мочу.
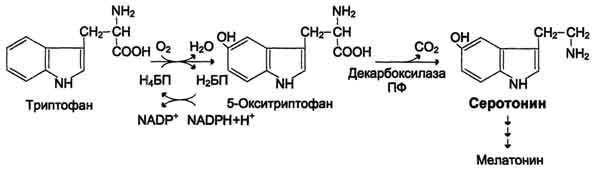
77. Декарбоксилирование аминокислот. Биогенные амины: гистамин, серотонин, ГАМК, , путресцин. Реакции их образования , ферменты , кофактор. Биороль биогенных аминов. Дезаминирование и метилирование аминов как пути их обезвреживания.
Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению ос-карбоксильной группы. В тканях млекопитающих декарбоксилированию может подвергаться целый ряд аминокислот или их производных: Три, Тир, Вал, Гис, Глу, Цис, Apr, Орнитин, SAM, ДОФА, 5-окситриптофан и др. Продуктами реакции являются СО2 и амины, которые оказывают выраженное биологическое действие на организм (биогенные амины):
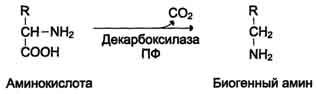
Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами. Простетическая группа декарбоксилаз в клетках животных - пиридоксальфосфат. Некоторые декарбоксилазы микроорганизмов могут содержать вместо ПФ остаток пирувата - гистидиндекарбоксилаза Micrococcus и Lactobacilus, SAM-декарбоксилаза Е. coli и др. Механизм реакции напоминает реакцию трансаминирования с участием пиридоксальфосфата и также осуществляется путём формирования шиффова основания ПФ и аминокислоты на первой стадии.
Амины, образовавшиеся при декарбоксилировании аминокислот, часто являются биологически активными веществами. Они выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК и др.), гормонов (норадреналин, адреналин), регуляторных факторов местного действия (гистамин, карнозин, спермин и др.).

В. Роль аргинина и орнитина в синтезе биологически активных молекул
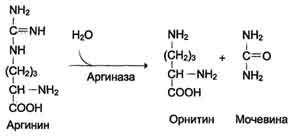
Обмен аминокислоты аргинина связан с реакциями орнитинового цикла, которые можно рассматривать как путь синтеза аргинина. Под действием аргиназы в цикле происходит и распад аргинина на орнитин и мочевину.
Аргинин выполняет в организме важные функции:
используется в синтезе креатина, который в виде креатинфосфата способен служить источником энергии для работы мышц человека и млекопитающих. В мышцах беспозвоночных аналогичную энергетическую функцию способен выполнять аргининфосфат.
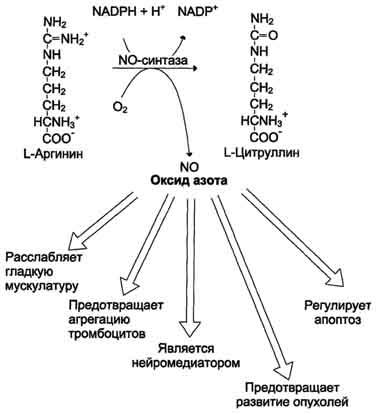
служит источником NO в организме;
служит предшественником орнитина, из которого синтезируются полиамины.
Аргинин - источник NO в организме