
- •2. Аминокислоты, входящие в состав белков, их строение и свойства. Пептиды.
- •4. Вторичная структура белков. Связи, стабилизирующие вторичную структуру.
- •5. Третичная структура белков. Типы химических связей, участвующих в
- •8. Физико-химические свойства белков. Молекулярная масса, размеры и форма, растворимость, ионизация и гидратация. Денатурация, признаки и факторы ее вызывающие.
- •1. Различия белков по форме молекул
- •2. Различия белков по молекулярной массе
- •3. Суммарный заряд белков
- •4. Соотношение полярных и неполярных групп на поверхности нативных молекул белков
- •5. Растворимость белков
- •1. Методы разрушения тканей и экстракции белков
- •2. Методы очистки белков
- •3. Очистка белков от низкомолекулярных примесей
- •10. Принципы классификации белков. Классификация по составу и биологическим функциям, примеры представителей отдельных классов.
- •11. Иммуноглобулины, классы иммуноглобулинов, особенности доменного строения и функционирования.
- •12. Ферменты, определение. Особенности ферментативного катализа. Специфичность действия ферментов, виды.
- •13.Классификация и номенклатура ферментов, примеры.
- •1. Оксидоредукпшзы
- •2.Трансферты
- •V. Механизм действия ферментов
- •1. Формирование фермент-субстратного комплекса
- •3. Роль активного центра в ферментативном катализе
- •1. Кислотно-основной катализ
- •2. Ковалентный катализ
- •15. Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от температуры, рН среды, концентрации фермента и субстрата. Уравнение Михаэлиса-Ментен, Кm.
- •16. Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр и в2 на примере трансаминаз и дегидрогеназ.
- •1. Роль металлов в присоединении субстрата в активном центре фермента
- •2. Роль металлов в стабилизации третичной и четвертичной структуры фермента
- •3. Роль металлов в ферментативном катализе
- •4. Роль металлов в регуляции активности ферментов
- •1. Механизм "пинг-понг"
- •2. Последовательный механизм
- •17. Ингибирование ферментов: обратимое и необратимое; конкурентное и неконкурентное. Лекарственные препараты как ингибиторы ферментов.
- •1. Конкурентное ингибирование
- •2. Неконкурентное ингибирование
- •1. Специфические и неспецифические ингибиторы
- •2. Необратимые ингибиторы ферментов как лекарственные препараты
- •19. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования (на примере ферментов синтеза и распада гликогена).
- •20. Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции каталитической активности ферментов.
- •21. Изоферменты, их происхождение, биологическое значение, привести примеры. Определение ферментов и изоферментного спектра плазмы крови с целью диагностики болезней.
- •22. Энзимопатии наследственные (фенилкетонурия) и приобретенные (цинга). Применение ферментов для лечения болезней.
- •23. Общая схема синтеза и распада пиримидиновых нуклеотидов. Регуляция. Оротацидурия.
- •24. Общая схема синтеза и распада пуриновых нуклеотидов. Регуляция. Подагра.
- •27. Азотистые основания, входящие в структуру нуклеиновых кислот – пуриновые и пиримидиновые. Нуклеотиды, содержащие рибозу и дезоксирибозу. Структура. Номенклатура.
- •27. Гибридизация нуклеиновых кислот. Денатурация и ренативация днк. Гибридизация (днк-днк, днк-рнк). Методы лабораторной диагностики, основанные на гибридизации нуклеиновых кислот.(пцр)
- •29. Репликация. Принципы репликации днк. Стадии репликации. Инициация. Белки и ферменты, принимающие участие в формировании репликативной вилки.
- •30. Элонгация и терминация репликации. Ферменты. Асимметричный синтез днк. Фрагменты Оказаки. Роль днк-лигазы в формировании непрерывной и отстающей цепи.
- •31. Повреждения и репарация днк. Виды повреждений. Способы репарации. Дефекты репарационных систем и наследственные болезни.
- •32. Транскрипция Характеристика компонентов системы синтеза рнк. Структура днк-зависимой рнк-полимеразы: роль субъединиц (α2ββ′δ). Инициация процесса. Элонгация, терминация транскрипции.
- •33. Первичный транскрипт и его процессинг. Рибозимы как пример каталитической активности нуклеиновых кислот. Биороль.
- •35. Сборка полипептидной цепи на рибосоме. Образование инициаторного комплекса. Элонгация: образование пептидной связи (реакция транспептидации). Транслокация. Транслоказа. Терминация.
- •1. Инициация
- •2. Элонгация
- •3. Терминация
- •36. Особенности синтеза и процессинга секретируемых белков (на примере коллагена и инсулина).
- •37. Биохимия питания. Основные компоненты пищи человека, их биороль, суточная потребность в них. Незаменимые компоненты пищи.
- •38. Белковое питание. Биологическая ценность белков. Азотистый баланс. Полноценность белкового питания, нормы белка в питании, белковая недостаточность.
- •39. Переваривание белков: протеазы жкт, их активация и специфичность, оптимум рН и результат действия. Образование и роль соляной кислоты в желудке. Защита клеток от действия протеаз.
- •1. Образование и роль соляной кислоты
- •2.Механизм активации пепсина
- •3.Возрастные особенности переваривания белков в желудке
- •1. Активация панкреатических ферментов
- •2. Специфичность действия протеаз
- •41. Витамины. Классификация, номенклатура. Провитамины. Гипо-, гипер- и авитаминозы, причины возникновения. Витаминзависимые и витаминрезистентные состояния.
- •42. Минеральные вещества пищи, макро- и микроэлементы, биологическая роль. Региональные патологии, связанные с недостатком микроэлементов.
- •3. Жидкостностъ мембран
- •1. Структура и свойства липидов мембран
- •45. Механизмы переноса веществ через мембраны: простая диффузия, пассивный симпорт и антипорт, активный транспорт, регулируемые каналы. Мембранные рецепторы.
- •1. Первично-активный транспорт
- •2. Вторично-активный транспорт
- •Мембранные рецепторы
- •46. Эндэргонические и экзэргонические реакции в живой клетке. Макроэргические соединения. Дегидрирование субстратов и окисление водорода как основной источник энергии для синтеза атф.
- •3.Эндергонические и экзергонические реакции
- •4. Сопряжение экзергонических и эндергонических процессов в организме
- •2. Строение атф-синтазы и синтез атф
- •3.Коэффициент окислительного фосфорилирования
- •4.Дыхательный контроль
- •50. Образование активных форм кислорода (синглетный кислород, пероксид водорода, гидроксильный радикал, пероксинитрил). Место образования, схемы реакций, их физиологическая роль.
- •51. . Механизм повреждающего действия активных форм кислорода на клетки (пол, окисление белков и нуклеиновых кислот). Примеры реакций.
- •1) Инициация: образование свободного радикала (l•)
- •2) Развитие цепи:
- •3) Разрушение структуры липидов
- •1. Строение пируватдегидрогеназного комплекса
- •3. Связь окислительного декарбоксилирования пирувата с цпэ
- •53.Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Роль цикла в метаболизме.
- •1. Последовательность реакций цитратного цикла
- •54. Цикл лимонной кислоты, схема процесса. Связь цикла с целью переноса электронов и протонов. Регуляция цикла лимонной кислоты. Анаболические и анаплеротические функции цитратного цикла.
- •55. Основные углеводы животных, биологическая роль. Углеводы пищи, переваривание углеводов. Всасывание продуктов переваривания.
- •Методы определение глюкозы в крови
- •57. Аэробный гликолиз. Последовательность реакций до образования пирувата (аэробный гликолиз). Физиологическое значение аэробного гликолиза. Использование глюкозы для синтеза жиров.
- •1. Этапы аэробного гликолиза
- •58. Анаэробный гликолиз. Реакция гликолитической оксидоредукции; субстратное фосфорилирование. Распространение и физиологическое значение анаэробного распада глюкозы.
- •1. Реакции анаэробного гликолиза
- •59. Гликоген, биологическое значение. Биосинтез и мобилизация гликогена. Регуляция синтеза и распада гликогена.
- •61. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, непереносимость фруктозы и дисахаридов. Гликогенозы и агликогенозы.
- •2. Агликогенозы
- •62. Липиды. Общая характеристика. Биологическая роль. Классификация липидов.Высшие жирные кислоты, особенности строения. Полиеновые жирные кислоты. Триацилглицеролы..
- •64. Депонирование и мобилизация жиров в жировой ткани, физиологическая роль этих процессов. Роль инсулина, адреналина и глюкагона в регуляции метаболизма жира.
- •66. Распад жирных кислот в клетке. Активация и перенос жирных кислот в митохондрии. Β-окисление жирных кислот, энергетический эффект.
- •67. Биосинтез жирных кислот. Основные стадии процесса. Регуляция обмена жирных кислот.
- •2. Регуляция синтеза жирных кислот
- •68. Кетоновые тела, биосинтез и использование в качестве источников энергии. Причины развития кетонемии и кетонурии при голодании и сахарном диабете.
- •69. Холестерин. Пути поступления, использования и выведения из организма. Уровень холестерина в сыворотке крови. Биосинтез холестерина, его этапы. Регуляция синтеза.
- •Фонд холестерола в организме, пути его использования и выведения.
- •1. Механизм реакции
- •2. Органоспецифичные аминотрансферазы ант и act
- •3. Биологическое значение трансаминирования
- •4. Диагностическое значение определения аминотрансфераз в клинической практике
- •1. Окислительное дезаминирование
- •74. Непрямое дезаминирование аминокислот. Схема процесса, субстраты, ферменты, кофакторы.
- •3. Неокислительное дезамитровате
- •75. Основные источники аммиака в организме человека. Токсичность аммиака. Роль глутамина и аспарагина в обезвреживании аммиака. Глутаминаза почек, образование и выведение солей аммония.
- •76. Оринитиновый цикл мочевинообразования. Химизм, место протекания процесса. Энергетический эффект процесса, его регуляция. Количественное определение мочевины сыворотки крови, клиническое значение.
- •2. Образование спермидина и спермина, их биологическая роль
- •78. Обмен фенилаланина и тирозина. Особенности обмена тирозина в разных тканях.
- •79. Эндокринная, паракринная и аутокринная системы межклеточной коммуникации. Роль гормонов в системе регуляции метаболизма. Регуляция синтеза гормонов по принципу обратной связи.
- •80. Классификация гормонов по химическому строению и биологическим функция.
- •1. Классификация гормонов по химическому строению
- •2. Классификация гормонов по биологическим функциям
- •1. Общая характеристика рецепторов
- •2. Регуляция количества и активности рецепторов
- •82. Циклические амф и гмф как вторичные посредники. Активация протеинкиназ и фосфорилирование белков, ответственных за проявление гормонального эффекта.
- •3. Передача сигналов через рецепторы, сопряжённые с ионными каналами
- •85. Гормоны гипоталамуса и передней доли гипофиза, химическая природа и биологическая роль.
- •2. Кортиколиберин
- •3. Гонадолиберин
- •4. Соматолиберин
- •5.Соматостатин
- •1. Гормон роста, пролактин
- •2. Тиреотропин, лютеинизирующий гормон и фолликулостимулирующий гормон
- •3. Группа гормонов, образующихся из проопиомеланокортина
- •4. Гормоны задней доли гипофиза
- •86. Регуляция водно-солевого обмена. Строение, механизмдействия и функции альдостерона и вазопрессина. Роль системы ренин-ангиотензин-альдостерон. Предсердный натриуретический фактор.
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •2. Роль системы ренин-ангиотензин- альдостерон в регуляции водно-солевого обмена
- •3. Восстановление объёма крови при обезвоживании организма
- •4. Гиперальдостеронтм
- •87. Регуляция обмена ионов кальция и фосфатов. Строение, биосинтез и механизм действия паратгормона, кальцитонина и кальцитриола.Причины и проявления рахита, гипо- и гиперпаратиреоидизма.
- •1. Синтез и секреция птг
- •2. Роль паратгормона в регуляции обмена кальция и фосфатов
- •3. Гиперпаратиреоз
- •4. Гипопаратиреоз
- •1. Строение и синтез кальцитриола
- •2. Механизм действия кальцитриола
- •3. Рахит
- •2. Биологические функции инсулина
- •3. Механизм действия инсулина
- •1. Инсулинзависимый сахарный диабет
- •2. Инсулинонезависимый сахарный диабет
- •1. Симптомы сахарного диабета
- •2. Острые осложнения сахарного диабета. Механизмы развития диабетической комы
- •3. Поздние осложнения сахарного диабета
- •1. Биосинтез йодтиронинов
- •2. Регуляция синтеза и секреции йодтиронинов
- •3. Механизм действия и биологические функции йодтиронинов
- •4. Заболевания щитовидной железы
- •90. Гормоны коры надпочечников (кортикостероиды). Их влияние на метаболизм клетки. Изменения метаболизма при гипо- и гиперфункции коры надпочечников.
- •3. Изменения метаболизма при гипо- и гиперфункции коры надпочечников
- •91. Гормоны мозгового слоя надпочечников. Секреция катехоламинов. Механизм действия и биологические функции катехоламинов. Патология мозгового вещества надпочечников.
- •1. Синтез и секреция катехоламинов
- •2. Механизм действия и биологические функции катехоламинов
- •3. Патология мозгового вещества надпочечников
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •93.Распад гема. Схема процесса, место протекания. «Прямой» и «непрямой» билирубин, его обезвреживание в печени.Диагностическое значение определения билирубина в крови и моче.
- •94. . Нарушения катаболизма гема. Желтухи: гемолитическая, желтуха новорожденных, печеночно-клеточная, механическая, наследственная (нарушения синтеза удф-глюкуронилтрансферазы).
- •1. Гемолитическая (надпечёночная) желтуха
- •2. Печёночно-клеточная (печёночная) желтуха
- •3. Механическая, или обтурационная (подпечёночная) желтуха
- •1. Участие трансфераз в реакциях конъюгации
- •2. Роль эпоксидгидролаз в образовании диолов
- •96. Гемоглобины человека, структура. Транспорт кислорода и диоксида углерода. Гемоглобин плода и его физиологическое значение. Гемоглобинопатии.
- •98. Белки сыворотки крови, биологическая роль основных фракций белков, значение их определения для диагностики заболеваний. Содержание и функции некоторых белков плазмы крови
- •98. Ферменты плазмы крови, энзимодиагностика. Количественное определение активности аминотрансфераз (АлАт, АсАт).
- •Аминотрансферазы
- •Аланинаминотрансфераза (алат)
- •99. Коллаген: особенности аминокислотного состава, первичной и пространственной структуры. Особенности биосинтеза и созревания коллагена. Роль аскорбиновой кислоты в созревании коллагена.
- •104. Значение воды для жизнедеятельности организма. Распределение воды в тканях , понятие о внутриклеточной и внеклеточной жидкостях. Водный баланс, регуляция водного обмена.
27. Азотистые основания, входящие в структуру нуклеиновых кислот – пуриновые и пиримидиновые. Нуклеотиды, содержащие рибозу и дезоксирибозу. Структура. Номенклатура.
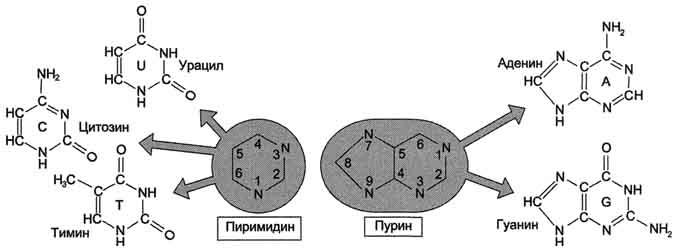
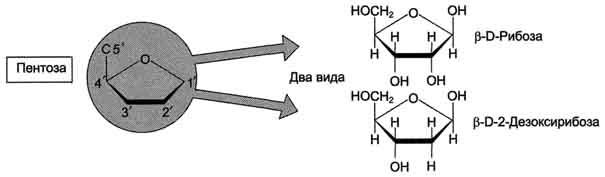
27. Первичная структура нуклеиновых кислот. ДНК и РНК–черты сходства и различия состава, локализации в клетке, функции. Вторичная структура ДНК (модель Уотсона и Крика). Связи, стабилизирующие вторичную структуру ДНК. Комплементарность. Правило Чаргаффа. Полярность. Антипараллельность.
Первичная структура ДНК - порядок чередования дезоксирибонуклеозидмонофосфатов (дНМФ) в полинукпеотидной цепи.
Каждая фосфатная группа в полинукпеотидной цепи, за исключением фосфорного остатка на 5'-конце молекулы, участвует в образовании двух эфирных связей с участием 3'- и 5'-углеродных атомов двух соседних дезоксирибоз, поэтому связь между мономерами обозначают 3', 5'-фосфодиэфирной.
Концевые нуклеотиды ДНК различают по структуре: на 5'-конце находится фосфатная группа, а на 3'-конце цепи - свободная ОН-группа. Эти концы называют 5'- и 3'-концами. Линейная последовательность дезоксирибонуклеотидов в полимерной цепи ДНК обычно сокращённо записывают с помощью однобуквенного кода, например -A-G-C-T-T-A-C-A- от 5'- к 3'-концу.
В каждом мономере нуклеиновой кислоты присутствует остаток фосфорной кислоты. При рН 7 фосфатная группа полностью ионизирована, поэтому in vivo нуклеиновые кислоты существуют в виде полианионов (имеют множественный отрицательный заряд). Остатки пентоз тоже проявляют гидрофильные свойства. Азотистые основания почти нерастворимы в воде, но некоторые атомы пуринового и пиримидинового циклов способны образовывать водородные связи.
Первичная структура РНК - порядок чередования рибонуклеозидмонофосфатов (НМФ) в полинуклеотидной
Концы полинуклеотидных цепей РНК неодинаковы. На одном конце находится фосфорилированная ОН-группа 5'-углеродного атома, на другом конце - ОН-группа 3'-углеродного атома рибозы, поэтому концы называют 5'- и 3'-концами цепи РНК. Гидроксильная группа у 2'-углеродного атома рибозы делает молекулу РНК нестабильной. Так, в слабощелочной среде молекулы РНК гидролизуются даже при нормальной температуре, тогда как структура цепи ДНК не изменяется.
|
Признаки |
ДНК |
РНК |
|
Местонахождение в клетке |
Ядро, митохондрии, хлоропласты |
Ядро, рибосомы, цитоплазмы, митохондрии, хролопласты |
|
Местонахождение в ядре |
Хромосомы |
Ядрышко |
|
Строение макромолекулы |
Двойной неразветвленный линейный полимер, свернутый правозакрученной спиралью |
Одинарная полинуклеотидная цепочка |
|
Мономеры |
Дезоксирибонуклеотиды |
Рибонуклеотиды |
|
Состав нуклеотид а |
Азонистое основание (пуриновое-аденин, гуанин, пиримидиновое – тимин, цитозин); дезоксирибоза (углевод); остаток фосфорной кислоты |
Азонистое основание (пуриновое-аденин, гуанин, пиримидиновое-урацил, цитозин);рибоза (углевод); остаток фосфорной кислоты |
|
Типы нуклеидов |
Адениловый (А), гуаниловый(Г), тимидиловый (Т), цитидиловый (Ц) |
Адениловый (А), гуаниловый (Г), уридиловый (Т),цитидиловый (Ц) |
|
Свойства |
Способная к самоудвоению по принципу комплементарности А=Т, Т=А, Г=Ц, Ц=Г Стабильна. |
Не способна к самоудвоению. Лабильна. |
|
Функции |
Химическая основа хромосомного генетического материала (гена); синтез ДНК, синтез РНК, информация о структуре белков. |
Информационная (иРНК) – передает код наследственной информации о первичной структуре белковой молекулы, рибосомальная (рРНК) – входит в состав рибосом; транспортная (тРНК) – переносит аминокислоты к рибосомам; митохондриальная и платидная РНК – входят в состав рибосом этих органелл |
Вторичная структура ДНК. В 1953 г. Дж. Уотсоном и Ф. Криком была предложена модель пространственной структуры ДНК. Согласно этой модели, молекула ДНК имеет форму спирали, образованную двумя полинуклеотидными цепями, закрученными относительно друг друга и вокруг общей оси. Двойная спираль правозакрученная, полинуклеотидньхе цепи в ней антипараллельны, т.е. если одна из них ориентирована в направлении 3'→5', то вторая - в направлении 5'→3'. Поэтому на каждом из концов
Все основания цепей ДНК расположены внутри двойной спирали, а пентозофосфатный остов - снаружи. Полинуклеотидные цепи удерживаются относительно друг друга за счёт водородных связей между комплементарными пуриновыми и пиримидиновыми азотистыми основаниями А и Т (две связи) и между G и С (три связи). При таком сочетании каждая пара содержит по три кольца, поэтому общий размер этих пар оснований одинаков по всей длине молекулы. Водородные связи при других сочетаниях оснований в паре возможны, но они значительно слабее. Последовательность нуклеотидов одной цепи полностью комплементарна последовательности нуклеотидов второй цепи. Поэтому, согласно правилу Чаргаффа (Эрвин Чаргафф в 1951 г. установил закономерности в соотношении пуриновых и пиримидиновых оснований в молекуле ДНК), число пуриновых оснований (А + G) равно числу пиримидиновых оснований (Т + С).
Комплементарые основания уложены в стопку в сердцевине спирали. Между основаниями двухцепочечной молекулы в стопке возникают гидрофобные взаимодействия, стабилизирующие двойную спираль.
Такая структура исключает контакт азотистых остатков с водой, но стопка оснований не может быть абсолютно вертикальной. Пары оснований слегка смещены относительно друг друга. В образованной структуре различают две бороздки - большую, шириной 2,2 нм, и малую, шириной 1,2 нм. Азотистые основания в области большой и малой бороздок взаимодействуют со специфическими белками, участвующими в организации структуры хроматина.
