
- •Техническая тЕрмодинамика
- •Содержание
- •Введение
- •Основные понятия и определения
- •Предмет технической термодинамики и ее методы
- •Рабочее тело. Основные параметры состояния.
- •Термодинамическая система и окружающая среда.
- •Уравнение состояния
- •Термодинамический процесс. VP-диаграмма и термодинамические процессы в ней /равновесные и неравновесные, обратимые и необратимые, круговой процесс/.
- •Теплота и работа как формы передачи энергии.
- •Идеальные и реальные газы
- •2.1 Определения и основные законы идеальных газов.
- •Уравнение состояния идеальных газов. Газовая постоянная.
- •Газовая постоянная одного килограмма газа:
- •Смеси идеальных газов
- •Основные определения. Способы задания газовых смесей
- •Вычисление параметров состояния смеси
- •Реальные газы
- •Первый закон термодинамики
- •Сущность первого закона термодинамики
- •Основные формулировки 1 закона
- •3.2 Внутренняя энергия. Аналитическое выражение 1 закона термодинамики.
- •3.3 Энтальпия. Энтропия.
- •4 Теплоемкость газов
- •4.1 Основные определения. Массовая, объемная и молярная теплоемкости
- •4.2 Теплоемкость при постоянном давлении и при постоянном объеме. Уравнение Майера.
- •Теплоемкость смеси газов
- •Основные термодинамические процессы идеальных газов.
- •Общие принципы исследования термодинамических процессов.
- •Вычисление энтропии идеального газа.
- •Изохорный процесс
- •Изобарный процесс
- •Изотермический процесс
- •Адиабатный процесс
- •Политропный процесс
- •6. Второй закон термодинамики
- •Термодинамические циклы тепловых машин. Прямые и обратные циклы, обратимые и необратимые
- •Термический кпд и холодильный коэффициент циклов
- •Прямой и обратный циклы Карно и их свойства
- •Прямой цикл Карно
- •Обратный цикл Карно
- •Аналитическое выражение iIзакона термодинамики.
- •Определение термического кпд цикла через среднеинтегральные температуры.
- •Методы сравнения термических кпд обратимых циклов
- •Обобщенный цикл Карно
- •Водяной пар
- •Фазовые переходы веществ
- •Диаграммы воды и водяного пара в vPиvTкоордината. Пограничные кривые. Критические точки
- •7.3 Определение параметров состояния воды и водяного пара
- •Основные параметры сухого насыщенного пара
- •Основные параметры перегретого пара
- •Основные параметры влажного насыщенного пара
- •Диаграмма sTдля водяного пара
- •7.8 Термодинамические процессы изменения состояния водяного пара
- •7.8.1.1Изохорный процесс
- •Изобарный процесс
- •Изотермический процесс
- •7.8.4Адиабатный процесс
- •8.Влажный воздух
- •Основные понятия и определения
- •Расчет основных параметров влажного воздуха
- •Течение газов
- •Уравнения движения
- •Уравнение первого закона термодинамики для потока газа
- •Располагаемая работа газа в потоке
- •Уравнение неразрывности
- •Скорость истечения
- •Секундный расход идеального газа через сопло
- •Истечение газа из сосуда неограниченной емкости
- •Основные условия течения идеального газа по каналам переменного сечения
- •Сопло Лаваля
- •При дозвуковом и сверхзвуковом течении
- •Истечение газов и паров с учетом трения
- •Дросселирование газов и паров
- •Дросселирование водяного пара
- •Компрессоры
- •Классификация и принципы действия компрессоров
- •Одноступенчатый поршневой компрессор
- •Ротационный (пластинчатый) компрессор
- •10.1.3 Центробежный компрессор
- •Компрессора
- •10.2 Теоретическая индикаторная диаграмма поршневого компрессора
- •Компрессора
- •10.3 Влияние процесса сжатия на величину работы одноступенчатого компрессора
- •В компрессоре в зависимости от способа сжатия:
- •Действительная индикаторная диаграмма компрессора
- •Многоступенчатое сжатие
- •Охлаждением рабочего тела
- •Циклы поршневых двигателей внутреннего сгорания (двс)
- •1Цикл двс с подводом теплоты при постоянном объеме (цикл Отто)
- •Теплоты при постоянном объеме:
- •С подводом теплоты при и
- •11.2 Цикл двс с подводом теплоты при постоянном давлении (цикл Дизеля)
- •С подводом теплоты при постоянном давлении:
- •Цикл со смешанным подводом теплоты (цикл Тринклера)
- •Сравнение циклов двс
- •Сравнение циклов поршневых двс с подводом теплоты при и
- •При одинаковой степени сжатия
- •С различной степенью сжатия .
- •При и регенерацией теплоты:
- •Циклы паросиловых установок
- •Обратные термодинамические циклы
- •14.1 Цикл воздушной холодильной установки
- •14.2 Цикл парокомпрессорной холодильной установки
- •Список использованной и рекомендуемой литературы
Теплота и работа как формы передачи энергии.
При протекании термодинамического процесса в общем случае тела, участвующие в этом процессе, обмениваются между собой энергией. В результате этого обмена энергия одних тел увеличивается, а других - уменьшается. Передача энергии в процессе от одного тела к другому может происходить двумя способами.
Первый способ передачи энергии реализуется при непосредственном контакте тел, имеющих различную температуру, путем обмена кинетической энергией между молекулами соприкасающихся тел. При этом энергия передается от более нагретого тела к менее нагретому. Поскольку передача энергии этим способом происходит на молекулярном уровне без видимого движения тел, ее называют микрофизической формой передачи энергии.
Количество энергии, переданной первым способом от одного тела к другому, называется количеством теплоты, или просто теплотой, а сам способ - передачей энергии в форме теплоты. Количество энергии, полученное телом в форме теплоты, называется подведенной теплотой, а количество энергии, отданное телом в форме теплоты, - отведенной теплотой. Теплота, так же как и любая другая энергия, измеряется в джоулях или килоджоулях /кДж/. Принято обозначать произвольное количество теплоты через Q, а удельное /отнесенное к 1кг/ - через q. Подведенная теплота считается положительной, а отведенная - отрицательной.
Второй способ передачи энергии связан с наличием силовых полей или внешнего давления. Для передачи энергии этим способом тело должно либо передвигаться в силовом поле, либо изменять свой объем под действием внешнего давления. Иначе говоря, в этом случае передача энергии происходит при условии перемещения всего тела или его части в пространстве. Поэтому второй способ является макрофизической формой передачи энергии. Этот способ называется передачей энергии в форме работы, а количество переданной энергии в процессе - работой.
Количество энергии, полученное телом в форме работы, будем называть совершенной над телом работой, а отданную энергию в форме работы - затраченной телом работой. Работа также измеряется в Дж или кДж. Затраченная телом работа считается положительной, а совершенная над телом работа - отрицательной.
Произвольное количество энергии, переданное в форме работы, обозначают через L, а удельное - через l.
В общем случае передача энергии в форме теплоты и в форме работы может происходить одновременно. При этом важно, что в различных термодинамических процессах, в зависимости от условий их протекания, количество теплоты и работы будет также различно. Следовательно, теплота и работа являются функциями процесса. Если процесса нет, то нет ни теплоты, ни работы.
Таким образом, в термодинамическом процессе изменения состояния теплота и работа представляют собой два единственно возможных способа передачи энергии от одного тела к другому.
Идеальные и реальные газы
2.1 Определения и основные законы идеальных газов.
Под идеальными понимают такие газы, в которых силы междумолекулярного притяжения и отталкивания отсутствуют, а сами молекулы, имея массу, не имеют объема.
Любой реальный газ, давление которого мало (Р0), а удельный объем велик (v), близок по свойству к идеальному газу. В этом состоянии силы, действующие между молекулами реального газа, так же как и объем молекул по сравнению с объемом занимаемого газом пространства, весьма малы. Следует отметить, что не только при весьма малых давлениях, но и при обычных нормальных давлениях ряд газов (гелий, водород, азот, кислород) близки по своим свойствам к идеальным.
Введение понятия об идеальном газе позволило составить простые математические зависимости, характеризующие состояние тела, и на основе законов для идеальных газов создать стройную теорию термодинамических процессов.
К основным законам идеальных газов относятся законы Бойля-Мариотта, Гей-Люссака и Шарля. Идеальные газы полностью подчиняются этим законам.
В 1664 году английским физиком Бойлем и в 1676 году французским химиком Мариоттом независимо друг от друга была установлена зависимость между удельным объемом и абсолютным давлением идеального газа в процессе, протекающем при постоянной температуре: T = const. При постоянной температуре объем, занимаемый идеальным газом, изменяется обратно пропорционально его давлению:
![]() (2.1)
(2.1)
или при T = const произведение удельного объема и давления есть величина постоянная:
P1v1 = P2v2 , Pv = const (2.2) Графически в системе координат vP закон Бойля-Мариотта изображается равнобокой гиперболой. Эта кривая получила название изотермы (рис. 2.1), а процесс, протекающий при постоянной температуре, называется изотермическим.
В 1802 году французским физиком Гей-Люссаком был открыт экспериментальным путем закон, устанавливающий зависимость между удельным объемом и абсолютной температурой в процессе, протекающем при постоянном давлении Р = const.
При
постоянном давлении объемы одного и
того же количества идеального
газа изменяются
прямо пропорционально абсолютным
температурам:
![]()
![]()
![]() (2.3)
(2.3)
Графически в системе координат vP закон Гей-Люссака изображается прямой, параллельной оси абсцисс. Эту прямую называют изобарой, а сам процесс, протекающий при постоянном давлении - изобарным.
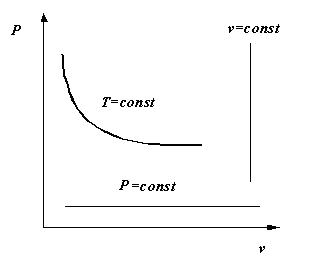
Рис. 2.1. Изотермический и изобарный процессы в vP-диаграмме
