
- •Техническая тЕрмодинамика
- •Содержание
- •Введение
- •Основные понятия и определения
- •Предмет технической термодинамики и ее методы
- •Рабочее тело. Основные параметры состояния.
- •Термодинамическая система и окружающая среда.
- •Уравнение состояния
- •Термодинамический процесс. VP-диаграмма и термодинамические процессы в ней /равновесные и неравновесные, обратимые и необратимые, круговой процесс/.
- •Теплота и работа как формы передачи энергии.
- •Идеальные и реальные газы
- •2.1 Определения и основные законы идеальных газов.
- •Уравнение состояния идеальных газов. Газовая постоянная.
- •Газовая постоянная одного килограмма газа:
- •Смеси идеальных газов
- •Основные определения. Способы задания газовых смесей
- •Вычисление параметров состояния смеси
- •Реальные газы
- •Первый закон термодинамики
- •Сущность первого закона термодинамики
- •Основные формулировки 1 закона
- •3.2 Внутренняя энергия. Аналитическое выражение 1 закона термодинамики.
- •3.3 Энтальпия. Энтропия.
- •4 Теплоемкость газов
- •4.1 Основные определения. Массовая, объемная и молярная теплоемкости
- •4.2 Теплоемкость при постоянном давлении и при постоянном объеме. Уравнение Майера.
- •Теплоемкость смеси газов
- •Основные термодинамические процессы идеальных газов.
- •Общие принципы исследования термодинамических процессов.
- •Вычисление энтропии идеального газа.
- •Изохорный процесс
- •Изобарный процесс
- •Изотермический процесс
- •Адиабатный процесс
- •Политропный процесс
- •6. Второй закон термодинамики
- •Термодинамические циклы тепловых машин. Прямые и обратные циклы, обратимые и необратимые
- •Термический кпд и холодильный коэффициент циклов
- •Прямой и обратный циклы Карно и их свойства
- •Прямой цикл Карно
- •Обратный цикл Карно
- •Аналитическое выражение iIзакона термодинамики.
- •Определение термического кпд цикла через среднеинтегральные температуры.
- •Методы сравнения термических кпд обратимых циклов
- •Обобщенный цикл Карно
- •Водяной пар
- •Фазовые переходы веществ
- •Диаграммы воды и водяного пара в vPиvTкоордината. Пограничные кривые. Критические точки
- •7.3 Определение параметров состояния воды и водяного пара
- •Основные параметры сухого насыщенного пара
- •Основные параметры перегретого пара
- •Основные параметры влажного насыщенного пара
- •Диаграмма sTдля водяного пара
- •7.8 Термодинамические процессы изменения состояния водяного пара
- •7.8.1.1Изохорный процесс
- •Изобарный процесс
- •Изотермический процесс
- •7.8.4Адиабатный процесс
- •8.Влажный воздух
- •Основные понятия и определения
- •Расчет основных параметров влажного воздуха
- •Течение газов
- •Уравнения движения
- •Уравнение первого закона термодинамики для потока газа
- •Располагаемая работа газа в потоке
- •Уравнение неразрывности
- •Скорость истечения
- •Секундный расход идеального газа через сопло
- •Истечение газа из сосуда неограниченной емкости
- •Основные условия течения идеального газа по каналам переменного сечения
- •Сопло Лаваля
- •При дозвуковом и сверхзвуковом течении
- •Истечение газов и паров с учетом трения
- •Дросселирование газов и паров
- •Дросселирование водяного пара
- •Компрессоры
- •Классификация и принципы действия компрессоров
- •Одноступенчатый поршневой компрессор
- •Ротационный (пластинчатый) компрессор
- •10.1.3 Центробежный компрессор
- •Компрессора
- •10.2 Теоретическая индикаторная диаграмма поршневого компрессора
- •Компрессора
- •10.3 Влияние процесса сжатия на величину работы одноступенчатого компрессора
- •В компрессоре в зависимости от способа сжатия:
- •Действительная индикаторная диаграмма компрессора
- •Многоступенчатое сжатие
- •Охлаждением рабочего тела
- •Циклы поршневых двигателей внутреннего сгорания (двс)
- •1Цикл двс с подводом теплоты при постоянном объеме (цикл Отто)
- •Теплоты при постоянном объеме:
- •С подводом теплоты при и
- •11.2 Цикл двс с подводом теплоты при постоянном давлении (цикл Дизеля)
- •С подводом теплоты при постоянном давлении:
- •Цикл со смешанным подводом теплоты (цикл Тринклера)
- •Сравнение циклов двс
- •Сравнение циклов поршневых двс с подводом теплоты при и
- •При одинаковой степени сжатия
- •С различной степенью сжатия .
- •При и регенерацией теплоты:
- •Циклы паросиловых установок
- •Обратные термодинамические циклы
- •14.1 Цикл воздушной холодильной установки
- •14.2 Цикл парокомпрессорной холодильной установки
- •Список использованной и рекомендуемой литературы
Адиабатный процесс
Адиабатный
процесс- это процесс без теплообмена с
внешней средой. При адиабатном процессе
энергообмен рабочего тела с окружающей
средой происходит только в форме работы,
энергообмена в форме теплоты нет. Эти
условия выражаются соотношением:
![]() .
Тогда уравнение первого закона
термодинамики для адиабатного процесса
имеет вид:
.
Тогда уравнение первого закона
термодинамики для адиабатного процесса
имеет вид:
![]() .
(5.4)
.
(5.4)
Из этого уравнения видно, что работа адиабатного процесса расширения совершается вследствие уменьшения внутренней энергии газа и, следовательно, температура газа уменьшается. Работа адиабатного сжатия полностью идет на увеличение внутренней энергии газа, то есть на повышение его температуры. Таким образом, изменение внутренней энергии и работа в адиабатном процессе эквивалентны по величине и противоположны по знаку.
Выведем уравнение адиабаты для идеального газа. Воспользуемся уравнением первого закона термодинамики:
![]()
т.к.
![]() ,
то
,
то
![]() (5.5)
(5.5)
Разделив переменные, получим:
![]() (5.6)
(5.6)
Интегрируя
(5.6) при k
= const,
получим
![]() ,
откуда
,
откуда
![]() (5.7)
(5.7)
Уравнение (5.7) является уравнением адиабаты.
На
рис. 5.10 приведен адиабатный процесс
расширения газа в
![]() -диаграмме.
-диаграмме.
Из уравнения (5.7) следует:
 , (5.8)
, (5.8)
то есть при адиабатном расширении давление падает, а при сжатии возрастает.
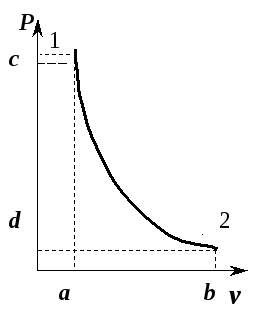
Рис. 5.10. Адиабата идеального газа
Учитывая, что в адиабатном процессе изменяются все три параметра состояния, необходимо выявить зависимости между v и T, p и T.
Зависимость между температурой T и объемом v можно получить из уравнения (5.8) и уравнений состояния, записанных для точек процесса 1 и 2: Р1v1 = RT1 и Р2v2=RT2, откуда
![]() (5.9)
(5.9)
Из
уравнений (5.8) и (5.9) следует:

 (5.10)
(5.10)
Далее
из уравнений (5.8) и (5.10) следует:
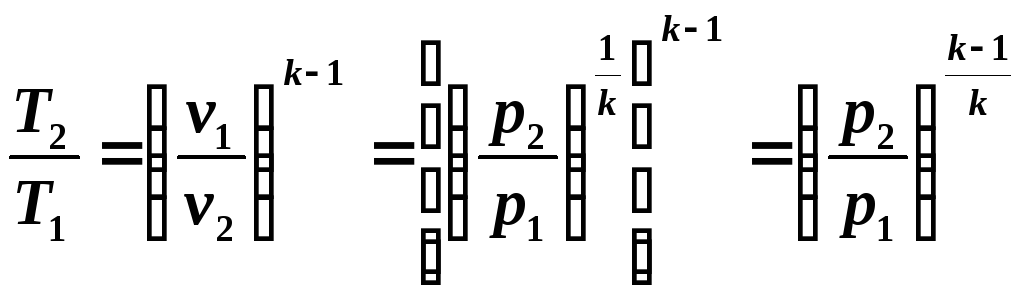
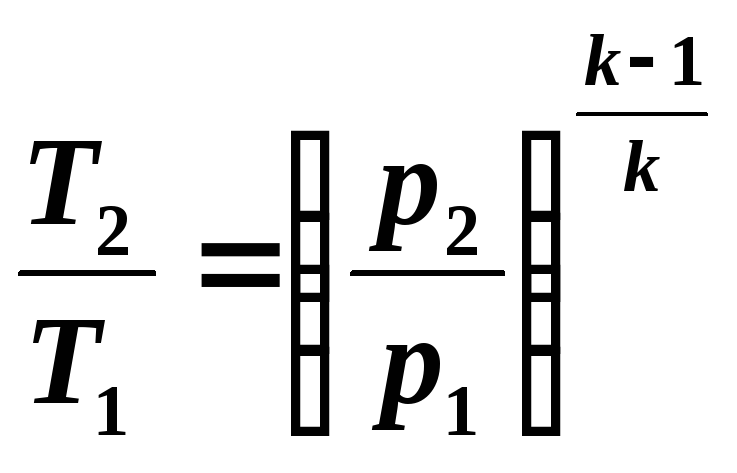 (5.11)
(5.11)
При
k
= const
для вычисления работы адиабатного
процесса можно записать несколько
формул. Из уравнения
![]() приcv
= const
имеем:
приcv
= const
имеем:
 (5.12)
(5.12)
Учитывая соотношения (5.10) и (5.11), уравнение (5.12) запишем в виде:

(5.13)

Располагаемая работа в адиабатном процессе определим из соотношения
![]() ,
то есть
,
то есть
![]() (5.14)
(5.14)
Для
обратимого адиабатного процесса
![]() ,
поэтому
,
поэтому
![]() ,
то есть обратимый адиабатный процесс
будет изоэнтропным и в
,
то есть обратимый адиабатный процесс
будет изоэнтропным и в
![]() -диаграмме
изображается прямой линией, параллельной
оси
-диаграмме
изображается прямой линией, параллельной
оси![]() (рис. 5.11). Процесс адиабатного расширения
изображается вертикальной прямой 2-1,
идущей вниз, а процесс адиабатного
сжатия 1-2 – вертикальной прямой, идущей
вверх.
(рис. 5.11). Процесс адиабатного расширения
изображается вертикальной прямой 2-1,
идущей вниз, а процесс адиабатного
сжатия 1-2 – вертикальной прямой, идущей
вверх.

Рис.
5.11. Адиабатный процесс в
![]() -диаграмме
-диаграмме
Теплоемкость
в адиабатном процессе равна нулю:
![]() .
.
-

a

a
Рис. 5.12. Схема распределения энергии в адиабатном процессе:
а- при расширении газа; б – при сжатии газа
Политропный процесс
Политропный процесс – любой произвольный процесс изменения состояния рабочего тела, протекающий при постоянной теплоемкости сx, то есть c = cx = const. Линия процесса называется политропой.
Из определения политропного процесса следует, что основные термодинамические процессы (изохорный, изобарный, изотермический, адиабатный, если они протекают при постоянной удельной теплоемкости, являются частными случаями политропного процесса.
Другими словами, политропный процесс характеризуется одной и той же долей количества подводимой теплоты, расходуемой на изменение внутренней энергии системы.
Уравнение политропного процесса можно получить из уравнений первого закона термодинамики для идеального газа:
![]()
![]()
далее имеем:
![]()
Разделим первое уравнение на второе
![]()
и обозначим
![]() ,
,
тогда
![]()
Интегрируя полученное соотношение в пределах от начала до конца процесса, находим:
![]() ,
,
или после потенцирования

получаем
уравнение политропного процесса
![]()
Поскольку уравнение политропы отличается от уравнения адиабаты только значением показателя n, то все соотношения между основными параметрами могут быть представлены формулами, аналогичными формулам для адиабатного процесса:

Удельная теплоемкость политропного процесса может быть определена из выражения для показателя политропы
![]() ,
откуда
,
откуда
![]() ,
,
где k – показатель адиабаты.
Последнее уравнение позволяет определить удельную теплоемкость политропного процесса для любого значения n. Если в это уравнение подставить значения для частных случаев, то можно получить:
|
Изохорный процесс: |
n = ; |
c = cv; |
v = const. | |
|
Изобарный процесс: |
n = 0; |
c = kcv = cp; |
p = const. | |
|
Изотермический процесс: |
n = 1; |
c = ; |
T = const. | |
|
Адиабатный процесс: |
n = k; |
c = 0; |
pvk = const. | |
Характер
зависимости
![]()
![]() от показателя политропыn
графически показан на рис. 5.13.
от показателя политропыn
графически показан на рис. 5.13.

Рис.5.13. Зависимость теплоемкости от показателя политропы.
Уравнение удельной работы изменения объема, совершаемой телом при политропном процессе, имеет аналогичный вид с уравнением удельной работы в адиабатном процессе
![]()
или
 .
.
Располагаемая
работа равна:
![]()

Изменение удельной внутренней энергии газа и теплота в политропном процессе определяются из уравнений:
![]()
![]() .
.
Изменение удельной энтальпии определяется по формуле, справедливой для всех процессов идеального газа, включая политропный процесс:
![]() .
.
Изменение удельной энтропии газа в политропном процессе равно:
![]()
или для конечного изменения состояния
![]() .
.
Значение показателя политропы в любом политропном процессе может быть определено по координатам любых двух точек графика:
 ;
;
 ;
; .
.
Если в vP- и sT – координатах выбрать некоторую произвольную точку и провести из нее все рассмотренные термодинамические процессы, то все поле построенной таким образом диаграммы делится на восемь областей, характеризующихся определенными признаками (рис. 5.14).

Рис. 5.14. Взаимное расположение политроп в зависимости от величины показателя n
