
- •Одержання оксидів
- •1. Взаємодія простих речовин із киснем:
- •2. Взаємодія складних речовин із киснем:
- •Хімічні властивості оксидів
- •Класифікація кислот
- •Одержання кислот
- •Хімічні властивості кислот
- •Класифікація основ
- •Одержання нерозчинних основ
- •Одержання розчинних основ
- •Хімічні властивості основ
- •Хімічні властивості амфотерних гідроксидів
- •Класифікація солей
- •Одержання середніх солей
- •Хімічні властивості середніх солей
- •Одержання кислих солей
- •Хімічні властивості кислих солей
- •Одержання основних солей
- •Хімічні властивості основних солей
- •Основні положення координаційної теорії Вернера (1893 р.)
- •Назви аніонів і лігандів
- •Молярні маси еквівалентів складних речовин
- •Основні принципи розподілу електронів в атомі
- •Розділ 1.4. Періодичний закон I періодична система елементів д. I. Менделєєва
- •Періодичність зміни хімічних та фізичних властивостей елементів
- •Розділ 1.5. Хімічний зв’язок і будова молекул
- •1.5.1. Ковалентний зв’язок
- •1.5.2. Здатність молекул до поляризації
- •1.5.3. Йонний зв’язок
- •1.5.4. Металічний зв’язок
- •1.5.5. Міжмолекулярна взаємодія
- •1.5.6. Водневий зв’язок
- •Розділ 1.6. Кристалічний стан речовин і типи кристалічних ґраток
- •Типи кристалічних ґраток
Розділ 1.6. Кристалічний стан речовин і типи кристалічних ґраток
Кристалічний стан характеризується чітко визначеним і впорядкованим розміщенням структурних частинок (атомів, йонів, молекул) в усьому об’ємі елементарної комірки, що є складовою кристалічної ґратки. Точки, у яких знаходяться структурні частинки, що утворюють кристал, називають вузлами ґратки. Регулярне розміщення вузлів ґратки у двовимірному просторі являє собою кристалографічну площину, а певне число площин кристала зумовлює його елементарну комірку.
Кристали – тверді, однорідні, анізотропні тіла, здатні нарощувати грані за рахунок відкладання нових частинок та викликати дифракцію рентгенівських променів. Однорідність кристалів виявляється в тому, що вони в усіх своїх частинах у паралельних напрямках мають однакові властивості. Анізотропність (векторіальність) – це неоднаковість фізичних властивостей кристалів у непаралельних напрямках. Анізотропність зумовлена внутрішньою будовою кристалів, а саме різною відстанню між частинками в різних напрямках. Здатність тієї самої речовини утворювати залежно від умов різні кристалічні форми називають поліморфізмом. Різні кристалічні форми тієї самої речовини називають поліморфними модифікаціями. Наприклад, для Карбону існують такі поліморфні форми (рис. 4): природні – алмаз, графіт, лонсдейліт, фулерен,вуглецеві нанотрубки і штучні: карбін, аморфний вуглець у вигляді сажі і деревного вугілля.
Протилежним поліморфізму явищем є ізоморфізм – існування різних речовин у тій самій кристалічній формі, а самі речовини називають ізоморфними.
Кристалічні речовини можуть існувати у вигляді моно- або полікристалів. Полікристали – це агрегати значної кількості дрібних, по-різному орієнтованих монокристалів неправильної форми, регулярні ділянки структури яких існують у певних межах.



Рис. 4. Поліморфні модифікації Карбону: 1) алмаз, 2) графіт, 3) лонсдейліт, 4) фулерен, 5) аморфний вуглець, 6) вуглецеві нанотрубки
Кристалічна структура твердої речовини визначається трьома факторами: хімічним складом речовини, розмірами структурних складових і природою сил, що утримують ці складові в кристалі. Форму кристалів вивчає геометрична кристалографія. Вивчення кристалічних структур і їх зв’язку із властивостями речовин є предметом хімічної кристалографії (кристалохімії).
Типи кристалічних ґраток
Залежно від природи частинок, розміщених у вузлах кристалічної ґратки, і від характеру зв’язку між ними розрізняють йонні, атомні, молекулярні та металічні ґратки. Атомні та молекулярні ґратки характерні для сполук із ковалентним зв’язком, йонні – для йонних сполук, металічні – для металів та їхніх сплавів.
Й онні
ґратки складаються з йонів протилежних
зарядів, з’єднаних між собою силами
електростатичної взаємодії. До сполук
із йонними ґратками належить більшість
солей і деякі оксиди. На рис. 5 зображена
кристалічна ґратка натрій хлориду,
кожний йон якого оточений шістьма
найближчими йонами протилежного знака.
Таким чином, координаційне число (КЧ)
для йонів як Натрію, так і Хлору в кристалі
NaCl дорівнює шести. Йонні сполуки мають
порівняно високу температуру плавлення
(600-1400°С), велику твердість і малу леткість.
Їхні ґратки поступаються міцністю перед
атомними, але міцніші, ніж молекулярні.
онні
ґратки складаються з йонів протилежних
зарядів, з’єднаних між собою силами
електростатичної взаємодії. До сполук
із йонними ґратками належить більшість
солей і деякі оксиди. На рис. 5 зображена
кристалічна ґратка натрій хлориду,
кожний йон якого оточений шістьма
найближчими йонами протилежного знака.
Таким чином, координаційне число (КЧ)
для йонів як Натрію, так і Хлору в кристалі
NaCl дорівнює шести. Йонні сполуки мають
порівняно високу температуру плавлення
(600-1400°С), велику твердість і малу леткість.
Їхні ґратки поступаються міцністю перед
атомними, але міцніші, ніж молекулярні.
Рис. 5. Кристалічна ґратка натрій хлориду: йони Натрію Na+ – маленькі кулі, йони Хлору Cl– – великі кулі
У вузлах атомних ґраток розміщені окремі атоми, які зв’язані між собою ковалентними зв’язками. Прикладами речовин з атомною ґраткою є алмаз, силіцій, бор, силіцій (ІV) оксид, деякі карбіди та силіциди.
Ці речовини мають велику твердість, тугоплавкість і практично нерозчинні. Такі властивості зумовлені міцністю зв’язків. Наприклад, у кристалі алмазу кожний з атомів Карбону зв’язаний із чотирма сусідніми атомами (рис. 4).
У вузлах молекулярних ґраток розміщені
молекули, між якими діють ненапрямлені
слабкі сили міжмолекулярної взаємодії
(рис. 6). Тому сполуки з молекулярними
ґратками характеризуються низьким КЧ,
мають невелику твердість, легкоплавкі
та леткі. Молекулярні ґратки властиві
більшості неметалів, багатьом неорганічним
та органічним речовинам.
вузлах молекулярних ґраток розміщені
молекули, між якими діють ненапрямлені
слабкі сили міжмолекулярної взаємодії
(рис. 6). Тому сполуки з молекулярними
ґратками характеризуються низьким КЧ,
мають невелику твердість, легкоплавкі
та леткі. Молекулярні ґратки властиві
більшості неметалів, багатьом неорганічним
та органічним речовинам.
Рис. 6. Молекулярна ґратка йоду I2
У вузлах металічних ґраток, які мають більшість металів і багато сплавів, розміщені окремі позитивно заряджені йони та нейтральні атоми металів, між якими переміщуються узагальнені електрони. Металічні кристали внаслідок нелокалізованого зв’язку характеризуються високим КЧ, електро- і теплопровідністю, блиском, пластичністю й ковкістю. Для них найхарактерніші три типи ґраток (рис. 7): кубічна гранецентрована (КЧ 12) для Cu, Ni, Pb, Fe, гексагональна (КЧ 12) для Mg, Be, Zn та кубічна об’ємноцентрована (КЧ 8) для W, Na, K.
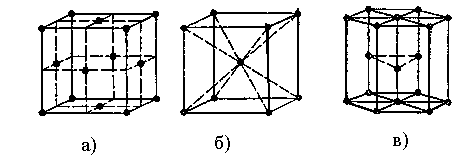
Рис. 7. Кристалічні ґратки металів: а) кубічна гранецентрована,б) кубічна об’ємноцентрована, в) гексагональна
І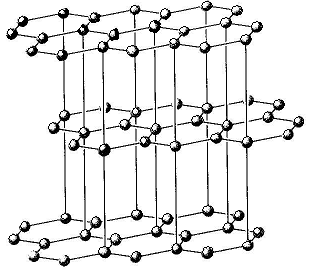 снують
речовини, кристалічні ґратки яких можна
розглядати як проміжні. Наприклад, у
графіті (рис. 8), який має шарувату
гексагональну структуру, атоми Карбону
у межах одного шару утворюють три
ковалентні зв’язки з трьома іншими
атомами. Четвертий зв’язок атомів
делокалізований у межах усього кристала.
Вуглецеві шари об’єднуються в кристалічну
ґратку за рахунок міжмолекулярних сил.
Міцність зв’язків у площині значно
більша, ніж між шарами. Тому ґратку
графіту можна розглядати і як атомну,
і як металічну, що пояснює електропровідність
графіту, його м’якість і металічний
блиск.
снують
речовини, кристалічні ґратки яких можна
розглядати як проміжні. Наприклад, у
графіті (рис. 8), який має шарувату
гексагональну структуру, атоми Карбону
у межах одного шару утворюють три
ковалентні зв’язки з трьома іншими
атомами. Четвертий зв’язок атомів
делокалізований у межах усього кристала.
Вуглецеві шари об’єднуються в кристалічну
ґратку за рахунок міжмолекулярних сил.
Міцність зв’язків у площині значно
більша, ніж між шарами. Тому ґратку
графіту можна розглядати і як атомну,
і як металічну, що пояснює електропровідність
графіту, його м’якість і металічний
блиск.
Рис. 8. Кристалічна ґратка графіту
