
- •2. Уравнение правила фаз.
- •3. Геометрический образ уравнения состояния.
- •4. Однокомпонентные системы.
- •5. Двухкомпонентные системы.
- •5.1. Системы с неограниченной растворимостью
- •5.2. Системы с неограниченной растворимостью компонентов в жидком состоянии и ограниченной в твердом.
- •6. Трехкомпонентные системы.
- •VII Растворы.
- •1. Общая характеристика растворов и их классификация.
5.1. Системы с неограниченной растворимостью
Рис. 6.3. Система
координат для построения диаграмм
двухкомпонентных систем.
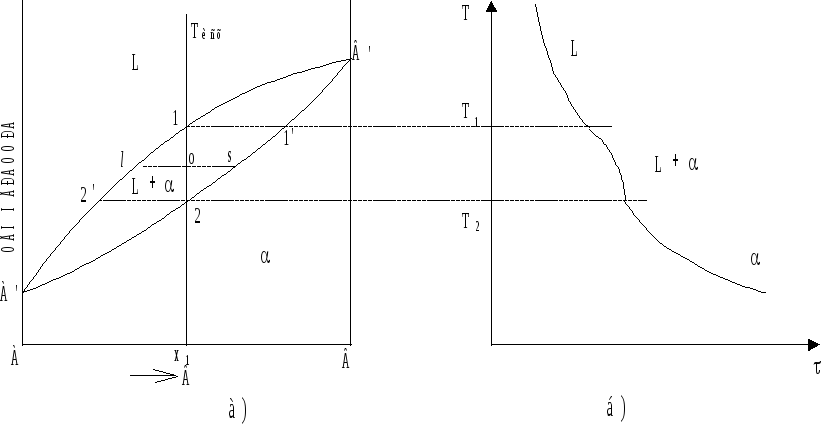
Диаграммы этих систем бывают с точками экстремумов на линиях диаграммы (точки минимума и максимума) и без таковых. Наиболее часто в металлических системах встречаются диаграммы без максимумов и минимумов (рис. 6.4).
Рис. 6.4. Диаграмма
состояния системы с неограниченной
растворимостью компонентов (с образованием
непрерывного ряда твердых растворов)
(а) и кривая охлаждения сплава x1
(б).
![]() )
и область двухфазного равновесия (L +
)
и область двухфазного равновесия (L +![]() ).
).
Сплав состава x1 при ТИСХ представляет собой однородную жидкость, ненасыщенную относительно твердой фазы. Для этой температуры правило фаз дает:
с = k - f + 1 = 2 - 1 + 1 = 2,
т. е. Т и С - два независимых параметра состояния.
При температуре
точки 1 начинается процесс кристаллизации
сплава: жидкость насыщается относительно
кристаллов
![]() - твердого раствора состава точки 1’,
которые из нее и выделяются. Линия 1 -
1’, соединяющая составы равновесных
фаз, называетсяконодой.
- твердого раствора состава точки 1’,
которые из нее и выделяются. Линия 1 -
1’, соединяющая составы равновесных
фаз, называетсяконодой.
Число степеней свободы системы для точки 1:
с = k - f + 1 = 2 - 2 + 1 = 1,
т. е. Т = f (C).
Действительно, уравнение Т = f (C) это уравнение линии ликвидус.
Температурный интервал (Т1 - Т2) - интервал кристаллизации. Процесс кристаллизации сопровождается изменением состава равновесных фаз и может быть описан уравнением вида:
![]() .(6.6)
.(6.6)
Уравнение (6.6) - уравнение процесса первичной кристаллизации. Для точки 2 число степеней свободы составит:
с = k - f + 1 = 2 - 2 + 1 = 1,
т. е. Т = f (C) и определяет положение линии солидус.
Таким образом, состав первых кристаллов определяется проекцией точки 1’ на ось концентраций, а последних капель жидкости - проекцией точки 2’.
Относительные массовые доли фаз (О. М. Д.) кристаллизующегося сплава при температуре точки О определяется из соотношений (правило рычага):
![]() ,
,
![]() .
(6.7)
.
(6.7)
Изменение температуры сплава x1 в процессе его охлаждения изображается соответствующей кривой охлаждения (рис. 6.4), построенной в координатах “температура - время”.
5.2. Системы с неограниченной растворимостью компонентов в жидком состоянии и ограниченной в твердом.
Таких систем примерно на порядок больше, чем ранее рассмотренных.
Рис. 6.5. Диаграмма
состояния системы эвтектического
типа (а) и кривая
охлаждения сплава x1
(б).
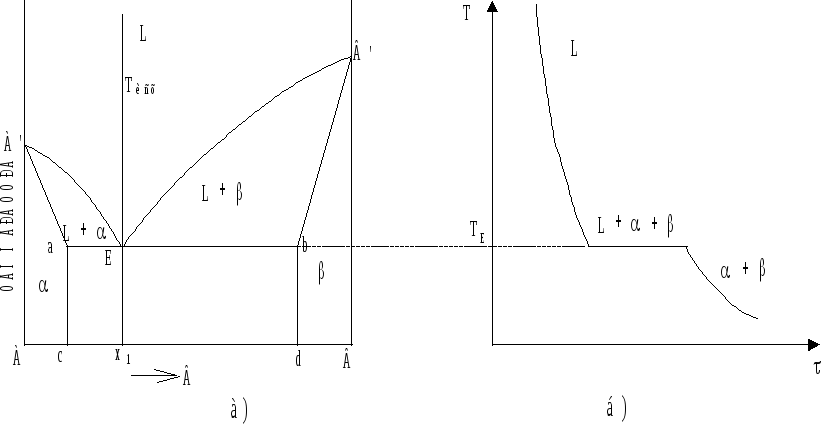
Линия A’EB’ - линия ликвидус, линия A’аEbB’ - солидус, линия аEb - эвтектическая горизонталь. Эвтектика в переводе с греческого - легкоплавящаяся.
Линии ас и bd - линии сольвус или линии предельной растворимости компонентов друг в друге.
Области
![]() и
и![]() - области твердых растворов. Твердыми
растворами называются однородные
кристаллические фазы сплавов, у которых
атомы растворяемого компонента замещают
атомы растворителя в его кристаллической
решетке.
- области твердых растворов. Твердыми
растворами называются однородные
кристаллические фазы сплавов, у которых
атомы растворяемого компонента замещают
атомы растворителя в его кристаллической
решетке.
При ТИСХ
сплав состава x1
представлен однородной жидкостью,
которая по достижении температуры
эвтектической горизонтали (ТЕ)
насыщается одновременно по отношению
к двум твердым растворам:
![]() - раствору состава точки (а) и
- раствору состава точки (а) и![]() - раствору состава точки b, которые из
нее и выделяются. Происходит так
называемое эвтектическое превращение,
которое можно описать уравнением вида:
- раствору состава точки b, которые из
нее и выделяются. Происходит так
называемое эвтектическое превращение,
которое можно описать уравнением вида:
![]() .(6.8)
.(6.8)
В результате
эвтектического превращения образуется
эвтектическая смесь двух фаз:
![]() и
и![]() .
Вариантность системы при ТЕ
определится:
.
Вариантность системы при ТЕ
определится:
с = k - f + 1 = 2 - 3 + 1 = 0,
т. е. нонвариантное
равновесие в двухкомпонентной системе
реализуется при постоянной температуре
(ТЕ)
и постоянных составах фаз (![]() ,
,![]() ).
).
При дальнейшем охлаждении составы равновесных фаз не изменяются.
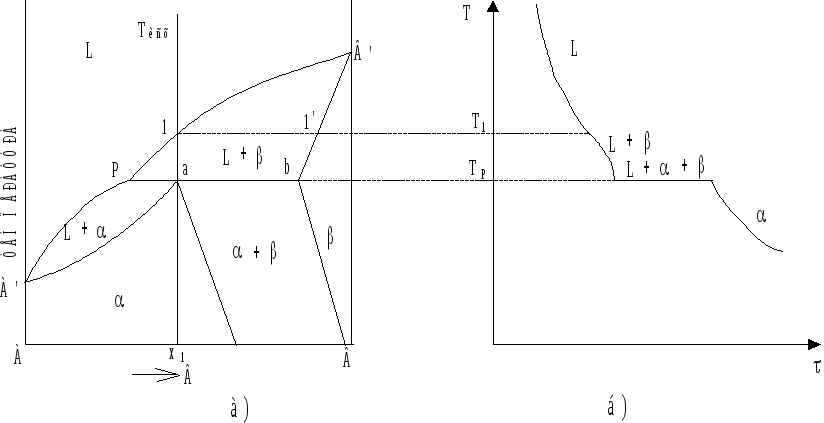
Системы перитектического типа.
“Перитектос” - окружение (греч.). Диаграмма состояния перитектического типа изображена на рис. 6.6.
До температуры
точки 1 охлаждается однородная жидкость
, которая при температуре Т1
насыщается относительно
![]() -
твердого раствора, который начинает
выделяться. Процесс выделения
-
твердого раствора, который начинает
выделяться. Процесс выделения![]() -
твердого раствора продолжается в
интервале температур (Т1
- ТР)
и может быть описан уравнением вида:
-
твердого раствора продолжается в
интервале температур (Т1
- ТР)
и может быть описан уравнением вида:
![]() ,
,
характеризующим процесс первичной кристаллизации.
Рис. 6.6. Диаграмма
состояния системы перитектического
типа (а)
и кривая охлаждения
сплава x1
(б).
![]() .(6.9)
.(6.9)
При температуре
ТР
(температура перитектической горизонтали
Раb) жидкость состава точки Р становится
ненасыщенной по отношению к выпавшим
кристаллам
![]() -
твердого раствора и пересыщенной по
отношению к кристаллам
-
твердого раствора и пересыщенной по
отношению к кристаллам![]() -
твердого раствора состава точки а.
Поэтому
-
твердого раствора состава точки а.
Поэтому![]() -
кристаллы растворяются в жидкости, а
-
кристаллы растворяются в жидкости, а![]() -
кристаллы из нее выделяются.
-
кристаллы из нее выделяются.
Уравнение (6.9) описывает процесс перитектической кристаллизации.
Число степеней свободы для системы при ТР:
с = k - f + 1 = 2 - 3 + 1 = 0.
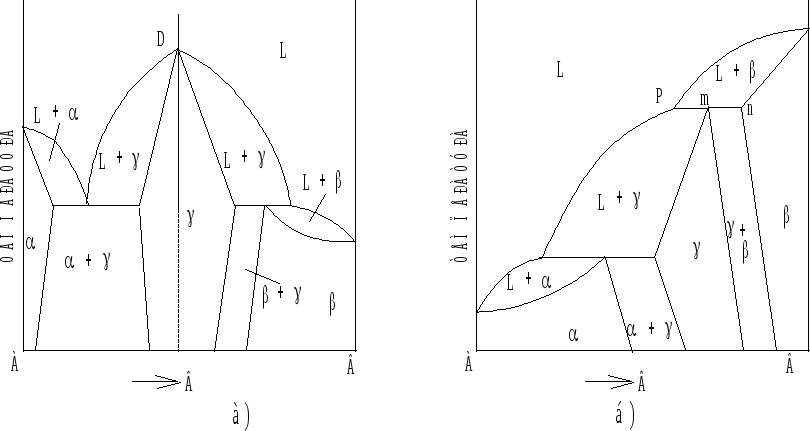
Системы с промежуточными фазами.
Рис. 6.7. Диаграммы
состояния с конгруентно (а) и
инконгруентно
(б) плавящейся промежуточной фазой.
Если составы жидкости и твердой фазы при температуре плавления совпадают (т. D), то такие системы называют системами с конгруентно плавящейся промежуточной фазой (рис.6.7, а), а если составы равновесных фаз при температуре плавления не совпадают (рис. 6.7, б), то это системы с инконгруентно плавящейся промежуточной фазой.
Точка D называется дистектической (трудноплавящейся) точкой.
Системы с ограниченной растворимостью в жидком состоянии.
Диаграммы состояния систем с ограниченной растворимостью в жидком состоянии представлены диаграммами двух типов: с монотектическим и синтектическим превращениями (рис. 6.8 а,б).
Линия nkm - купол расслоения - линия ограниченной растворимости в жидком состоянии.
При охлаждении сплава x1 (рис. 6.8, а) и достижении им температуры точки 1 жидкость состава точки 1 насыщается по отношению к другой жидкости состава точки 1’. В интервале (Т1 - Т2) идет процесс расслоения, сопровождающийся изменением состава жидкостей:
![]() .
(6.10)
.
(6.10)
Системы синтектического типа в реальных металлургических системах встречаются редко. Смысл синтектического превращения может быть представлен схемой вида:
![]() ,(6.11)
,(6.11)
для которого
с = k - f + 1 = 2 - 3 + 1 = 0.
Рис. 6.8. Диаграммы
состояния систем с расслоением.

