
- •Министерство сельского хозяйства рф
- •Раздел 1
- •1.2. Теплотехнические требования к условиям обитаемости
- •Глава 2 Источники энергии
- •2.1. Невозобновляемые источники энергии
- •2.2. Возобновляемые источники энергии
- •2. 4. Блок – схема ветроэнергетической установки:
- •2.5. Ветроэлектрическая установка
- •Глава 3 Основы воспламенения и горения химических топлив
- •3.1. Кинетика процессов горения
- •3.2. Воспламенение топлив
- •3.3. Горение гомогенных топлив
- •3.4. Горение гетерогенных топлив
- •3.5. Понятие о детонационном горении
- •Глава 4 Преобразователи энергии химических топлив
- •4.1. Виды преобразователей энергии и их характеристики
- •4. 2. Котельные установки
- •4.3. Паровые и водогрейные котлы
- •4.4. Воздухонагреватели
- •Раздел II Теплоснабжение сельскохозяйственных сооружений
- •Глава 5 Тепловые сети и тепловые пункты
- •5.1. Тепловые сети
- •5.2. Тепловые пункты
- •Глава 6 Отопление и горячее водоснабжение
- •6.1. Системы отопления
- •Циркуляцией теплоносителя:
- •6.2 Общие сведения о горячем водоснабжении
- •Разводкой системы горячего водоснабжения:
- •Раздел III
- •7.2. Вентиляторы и их характеристики
- •7.3. Расчет систем вентиляции
- •7.4. Подбор вентиляторов
- •Глава 8 Системы кондиционирования
- •8.1. Назначение и виды систем кондиционирования
- •8.2. Процессы обработки воздуха в кондиционерах
- •8. 3. Кондиционеры
- •А.Т. Манташов теплотехника
- •Часть II
- •Теплотехническое обеспечение обитаемости
2. 4. Блок – схема ветроэнергетической установки:
1 – ветроагрегат; 2 – рабочая машина; 3 – аккумулирующее устройство;
4 – дублирующий двигатель; 5 – блок автоматического управления
Ветроагрегат 1 в комплексе с одной или несколькими рабочими машинами 2 передает энергию либо сразу потребителю, либо в аккумулирующее устройство 3. В случае недостаточной энергии ветра включается в работу неветровой дублирующий двигатель 4. Система 5 выполняет функции автоматического управления и регулировки режимов работы. На рис. 2.5 представлена одна из современных ветроэлектрических установок.
К достоинствам ветровой энергии, прежде всего, следует отнести доступность, повсеместное распространение и возобновляемость. Источник энергии не нужно добывать и транспортировать к месту потребления: ветер сам движется к установленному на его пути ветродвигателю. Эти особенности ветровой энергии дают предпочтение в ее использовании для относительно мелких (мощностью до 1000кВт) ее потребителей, удаленных от централизованных систем энергоснабжения и рассосредоточенных по территориям районов. Основные проблемы в использовании ветра, как энергетического источника – это непостоянство его скорости и направления, что усложняет системы автоматического регулирования режимов работы.
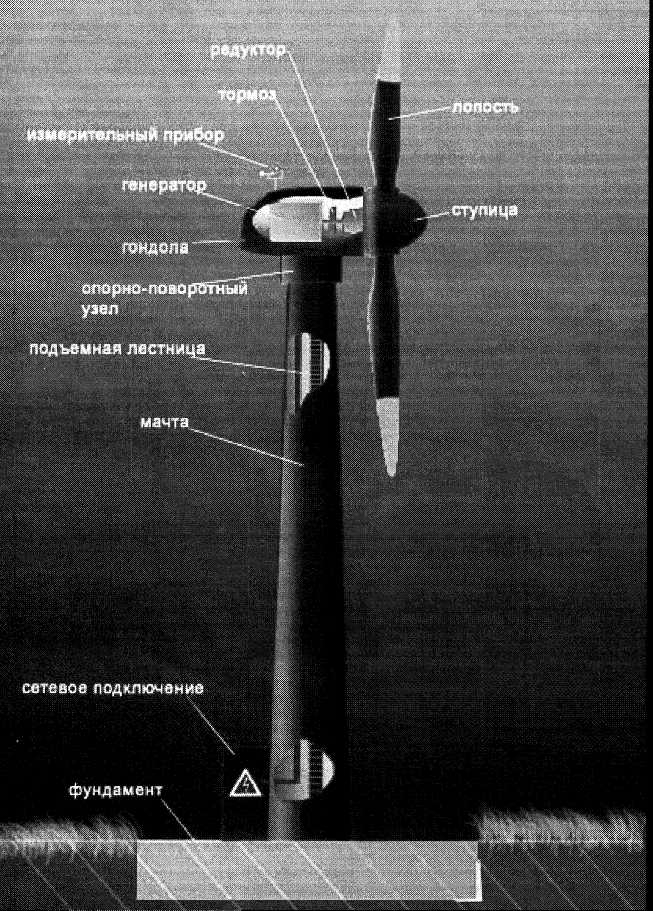
2.5. Ветроэлектрическая установка
2.2.3 Энергия движения вод в реках и морях
Энергия, которой располагает водный поток, определяется двумя величинами: количеством протекающей воды и высотой ее створа от поверхности условного отсчета. Перепад высот при использовании энергии воды может быть природным (горные реки, приливы), либо создается искусственно в виде гидротехнических сооружений.
На 2011 г. гидроэнергетика обеспечивает 19% всей мировой электроэнергии, а установленная гидротехническая мощность составляет 715 ГВт. Суммарная мощность гидроэлектростанций России составляет 38,7 ГВт (пятое место после Китая, Канады, Бразилии, США). В выработке электроэнергии доля ГЭС составляет 15%. Степень освоения экономических гидроресурсов в России составляет всего 21% (в Германии – 95%).
На
рис. 2.6 показан схематичный разрез
устройства одной из гидроэлектростанций.
Здесь указана высота створа, она равна
6 м.
Доступный потенциал энергии приливов составляет около 200 ГВт. Так
высота приливов на востоке России в районе Охотского моря достигает 13 м, у берегов Кольского полуострова в Баренцевом море она составляет 7 м. Достигнуты существенные сдвиги в использовании энергии морских приливов, в России построены и проходят испытания приливные электроагрегаты.
Глава 3 Основы воспламенения и горения химических топлив
3.1. Кинетика процессов горения
Кинетика горения – это учение о скорости и механизме химических реакций при сгорании топлив.
Под горением понимают быстропротекающее химическое превращение, сопровождающееся выделением значительного количества тепла и обычно ярким свечением (пламенем).
В общем случае при горении происходит образование новых молекул или перераспределение химических связей между молекулами, участвующими в реакции. Такой процесс возможен, если топливо имеет состав, несущественно отличающийся от стехиометрического и реагирующие элементы находятся в непосредственном соприкосновении. Следовательно, необходимым условием осуществления окислительно-восстановительной реакции является столкновение реагирующих молекул. Согласно молекулярно-кинетической теории газов, каждая молекула за счет хаотического теплового движения испытывает 109столкновений в секунду. Если бы при каждом соударении молекулы реагировали между собой, то любая реакция протекала бы мгновенно. Этого мы не наблюдаем на практике.
Для того, чтобы произошла реакция, т.е.
образовались новые молекулы, необходимо
сначала разорвать или ослабить связи
между атомами в молекулах исходных
веществ. На это надо затратить определенную
энергию. Если сталкивающиеся молекулы
не обладают такой энергией, столкновение
будет неэффективным. В качестве примера
на рис.3.1 схематично показано изменение
энергии по времени при догорании угарного
газа в среде кислорода 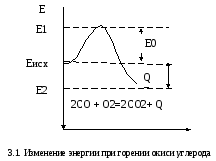
В исходном состоянии средняя энергия всех частиц, находящаяся в реагирующей системе, – Eисх. При подведении энергии в каком-либо объеме системы и доведение ее до уровня Е1начнется химическая реакция, которая затем пойдет самопроизвольно с выделением теплоты, при этом энергетический уровень продуктов реакции понизится до Е2. Здесь количество выделенной теплотыQ = Eисх – Е2. Превышение энергииЕ1надЕисх обозначаютЕ0, измеряют в Дж/кг и называют э н е р г и е й а к т и –
в а ц и и.
Для
моля энергия активации обозначается
 и измеряется
в Дж/моль
и измеряется
в Дж/моль
Энергия активации, этоизбыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к началу химической реакции.
Величина энергии активации зависит от структуры молекул, температуры реагирующих компонентов. Определяют ее экспериментально. Молекулы, обладающие энергией Е1 = Еисх + Е0, называют активными молекулами или активными комплексами. Активный комплекс – это неустойчивое промежуточное состояние химических элементов (связи разорваны) с большим запасом энергии. Чем больше активных молекул в реагирующей смеси, тем более интенсивно, с большей скоростью будут протекать химические реакции.
Под скоростью химической реакции понимают количество молей вещества, прореагировавшее в единице объема в единицу времени.
Весьма сильное влияние на скорость реакции оказывает температура смеси. С ростом температуры увеличивается интенсивность взаимных соударений реагирующих молекул, что способствует росту скорости реакции. Например, для некоторых реакций увеличение температуры всего на 10приводит к возрастанию скорости в 2…4 раза.
В связи с этим скорость химической реакции будет определяться концентрацией молекул, их температурой и энергией активации.
Согласно теории Вант - Гоффа и Аррениуса, формула скорости химической реакции имеет вид:
W= к0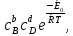 (3.1)
(3.1)
где W– скорость химической реакции;
к0– характерная для исследуемой реакции константа;
cB,cD– концентрации исходных продуктов реакции;
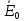 – энергия активации;
– энергия активации;
 –
универсальная газовая постоянная;
–
универсальная газовая постоянная;
Т– температура.
Выражение (3.1) показывает, что зависимость скорости химической реакции от температуры носит экспоненциональный характер.
Химическая реакция горения в большинстве случаев является сложной, т.е. состоит из большего числа элементарных химических процессов. Кроме того, химические превращения при горении связаны с рядом физических процессов (переносом тепла и масс) и характеризуются соответствующими гидро и газодинамическими закономерностями. В силу комплексной природы горения суммарная скорость горения практически никогда не тождественная скорости чисто химического взаимодействия.
Характерная черта горения – способность к пространственному распространению. Это объясняется либо диффузией активных частиц в топливной смеси, либо образованием новых активных центров вследствие подвода энергии в форме теплоты из зон химических реакций. В первом случае говорят о диффузионном, а во втором – о тепловом механизме распространения пламени.
Для любого вида горения характерны две типичные стадии – воспламенение и последующее сгорание (догорание) топлива. Время, затраченное на обе стадии, составляет общее время горения. Обеспечение минимального суммарного времени горения при максимальном тепловыделении является основной задачей техники сжигания.
Различают гомогенное и гетерогенное горение. При гомогенном горении горючее и окислитель подаются в одинаковых агрегатных состояниях, при гетерогенном – в разных.
