
- •1.1. Предмет аналитической химии
- •1.2. Принцип, метод и методика анализа
- •1.3. Виды анализа
- •2.1. Аналитические реакции
- •2.2. Систематический и дробный анализ
- •3.1. Общая характеристика химического равновесия. Константа химического равновесия
- •3.2. Активность и коэффициент активности
- •3.3. Отклонения от идеальности в растворах сильных электролитов
- •3.5. Общие принципы расчёта состава равновесных систем
- •4.1. Важнейшие теории кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.5. Применение органических реагентов в аналитической химии
- •6.1. Произведение растворимости малорастворимого электролита
- •6.2. Растворимость
- •6.3. Влияние различных факторов на растворимость
- •7.1. Общая характеристика окислительно-восста- новительных реакций
- •7.2. Количественная оценка окислительно-восстано- вительной способности веществ
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций
- •8.1. Отбор пробы
- •8.2. Разложение пробы
- •9.1. Общая характеристика и классификация
- •9.2. Жидкость - жидкостная экстракция
- •10.1. Приближённые вычисления и значащие цифры
- •10.2. Понятие об аналитическом сигнале
- •10.4. Неопределённость и погрешности измерений
- •10.6. Пример статистической обработки результатов измерений. Исключение промахов
- •10.7. Основные характеристики методики анализа
- •11.1. Общая характеристика
- •11.2. Виды гравиметрических определений
- •11.3. Понятие о механизме образования осадка
- •11.4. Коллоидная стадия образования осадка
- •11.6. Основные этапы методики гравиметрического определения методом осаждения
- •12.1. Основные понятия титриметрии
- •12.2. Классификация титриметрических методов анализа и способов титрования
- •ГЛАВА 13 Кислотно-основное титрование
- •13.1. Титранты и стандартные вещества
- •13.2. Обнаружение конечной точки титрования. Ки- слотно-основные индикаторы
- •13.3. Кривые титрования
- •13.5. Погрешности титрования
- •13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
- •14.1. Ограничения возможностей кислотно-основного основного титрования в водных растворах
- •14.3. Применение в фармацевтическом анализе
- •ГЛАВА 15 Комплексометрическое титрование
- •15.1. Общая характеристика
- •15.2. Меркуриметрическое титрование
- •15.3. Комплексонометрическое титрование
- •15.3.1. Понятие о комплексонах
- •15.3.2. Свойства этилендиаминтетрауксусной кислоты и её взаимодействие с катионами металлов
- •15.3.3. Кривые титрования
- •15.3.4. Способы обнаружения конечной точки титрования. Металлоиндикаторы
- •15.3.5. Индикаторные погрешности
- •15.3.6. Титранты и стандартные вещества
- •15.3.7. Способы комплексонометрического титрования и его применение
- •ГЛАВА 16 Осадительное титрование
- •16.1. Общая характеристика
- •16.2. Аргентометрическое титрование
- •16.2.1. Кривые титрования
- •16.2.2. Способы обнаружения конечной точки титрования
- •16.2.3. Титранты и стандартные вещества
- •16.2.4. Применение в фармацевтическом анализе
- •16.3. Меркурометрическое титрование
- •17.1. Общая характеристика и классификация
- •17.2. Кривые титрования
- •18.1. Иодометрическое титрование
- •18.2. Хлориодометрическое титрование
- •18.3. Иодатометрическое титрование
- •18.4. Броматометрическое титрование
- •18.5. Нитритометрическое титрование
- •18.6. Перманганатометрическое титрование
- •18.7. Дихроматометрическое титрование
- •18.8. Цериметрическое титрование
- •20.3. Атомно-абсорбционная спектроскопия
- •20.3.1. Процессы, приводящие к появлению аналитического сигнала
- •20.3.2. Измерение аналитического сигнала
- •20.3.3. Практическое применение
- •20.4.2. Измерение аналитического сигнала
- •20.5. ИК-спектроскопия
- •20.5.1. Процессы, приводящие к появлению аналитического сигнала
- •20.5.2. Общая характеристика ИК-спектров
- •20.5.3. Измерение аналитического сигнала
- •20.5.4. Практическое применение
- •21.1. Атомно-эмиссионная спектроскопия
- •21.1.1. Процессы, приводящие к появлению аналитического сигнала
- •21.1.2. Измерение аналитического сигнала
- •21.1.3. Практическое применение
- •21.2. Люминесцентная спектроскопия
- •20.2.1 Классификация видов люминесценции
- •21.2.4. Влияние различных факторов на интенсивность флуоресценции растворов
- •21.2.5. Измерение аналитического сигнала
- •22.1. Общая характеристика
- •22.2. Классификация хроматографических методов
- •22.3. Хроматографические параметры
- •22.4. Теории хроматографического разделения
- •ГЛАВА 23 Газовая хроматография
- •23.1. Общая характеристика
- •23.2. Устройство газового хроматографа
- •23.3. Особенности газотвёрдофазной хроматографии
- •23.4. Особенности газожидкостной хроматографии
- •23.5. Индексы удерживания Ковача
- •23.6. Практическое применение
- •ГЛАВА 24 Жидкостная хроматография
- •24.1. Общая характеристика
- •24.2. Плоскостная хроматография
- •24.2.1. Методика получения плоскостной хроматограммы
- •24.2.2. Анализ плоскостной хроматограммы
- •24.2.3. Практическое применение
- •24.3. Колоночная жидкостная хроматография
- •24.3.1. Устройство жидкостного хроматографа
- •24.3.2. Практическое применение
- •24.4. Характеристика отдельных видов жидкостной хроматографии
- •24.4.1. Ионообменная хроматография
- •24.4.2. Эксклюзионная хроматография
- •25.2. Классификация электрохимических методов анализа
- •25.3. Кондуктометрия
- •25.3.1. Теоретические основы и классификация
- •25.3.2. Измерение аналитического сигнала
- •25.3.4. Практическое применение
- •25.3.5. Понятие о высокочастотной кондуктометрии
- •26.1. Потенциометрический метод анализа
- •26.1.1. Общая характеристика и классификация
- •26.1.2. Условия измерения аналитического сигнала
- •26.1.3. Индикаторные электроды
- •26.1.4. Прямая потенциометрия
- •26.1.5. Потенциометрическое титрование
- •26.2. Кулонометрический метод анализа
- •26.2.1. Общая характеристика и классификация
- •26.2.2. Прямая кулонометрия
- •26.2.3. Кулонометрическое титрование
- •27.1. Принцип измерения аналитического сигнала.
- •27.2. Вольтамперограмма
- •27.4. Практическое применение вольтамперометрии. Амперометрическое титрование
- •ЛИТЕРАТУРА
- •Общая
- •Справочная
- •Дополнительная литература к отдельным темам
- •Химические методы обнаружения неорганических веществ
- •Хемометрика
- •Химические методы анализа
- •Инструментальные методы анализа (общая литература)
- •Спектроскопические методы анализа
- •Хроматографические методы анализа
- •Электрохимические методы анализа
Раздел 3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В качестве примера |
|||
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
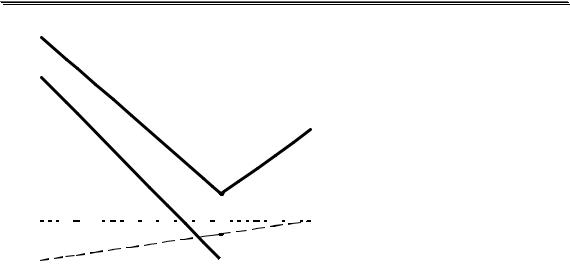
на рис. 25.5 показана |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кривая |
титрования |
рас- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
твора |
HCl |
раствором |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NaOH. До точки эквива- |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
лентности |
величина |
|||||||||||
|
|
|
|
|
H+ |
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
удельной электропровод- |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ности раствора уменьша- |
|||
|
|
|
Cl- |
|
|
|
OH- |
ется вследствие того, что |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
ионы H3O+ заменяются |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гораздо |
менее |
подвиж- |
|
|
|
|
Na+ |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ными ионами Na+. После |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
0 |
0,5 |
|
|
|
|
|
|
|
1 |
|
|
|
1,5 f |
точки эквивалентности в |
|||||||||||
|
|
|
|
|
|
|
|
|
|
растворе появляется |
из- |
||||||||||||||
Рис. 25.5. Кривая титрования HCl раствором |
быток |
подвижных |
OH- |
||||||||||||||||||||||
NaOH с указанием вкладов отдельных ионов (без |
ионов, что вновь приво- |
||||||||||||||||||||||||
учёта разбавления раствора) |
|
|
|
|
|
|
|
|
дит к значительному уве- |
||||||||||||||||
личению электропроводности. Конечной точке титрования соответствует точка пересечения нисходящей и восходящей ветвей кривой титрования.
Кондуктометрическое титрование может быть использовано в тех случаях, когда трудно провести визуальное обнаружение конечной точки титрования - при анализе мутных и окрашенных растворов, а также в случае определения веществ в сильно разбавленных растворах (10-4 М и меньше).
25.3.5. Понятие о высокочастотной кондуктометрии
В высокочастотной кондуктометрии (осциллометрии), применяемой, главным образом, в виде высокочастотного титрования, используется электрический ток высокой частоты (мегагерцы). Электроды в ячейках для высокочастотного титрования не соприкасаются с анализируемым раствором. Существует два типа таких ячеек: емкостная и индуктивная. При использовании емкостных ячеек измеряют изменение частоты генератора в процессе титрования. Индуктивная ячейка помещается внутрь электромагнитной катушки. При титровании происходит изменение величины индуктивности.
К преимуществам высокочастотной кондуктометрии относится возможность анализа растворов как с очень малой, так и с очень большой электропроводностью. Электроды находятся вне раствора, поэтому не происходит их поляризации. Метод высокочастотного титрования может быть использован для анализа агрессивных сред, растворов, находящихся в замкнутых сосудах и т.д. Основной недостаток - более высокая стоимость оборудования.
326
