
- •1.1. Предмет аналитической химии
- •1.2. Принцип, метод и методика анализа
- •1.3. Виды анализа
- •2.1. Аналитические реакции
- •2.2. Систематический и дробный анализ
- •3.1. Общая характеристика химического равновесия. Константа химического равновесия
- •3.2. Активность и коэффициент активности
- •3.3. Отклонения от идеальности в растворах сильных электролитов
- •3.5. Общие принципы расчёта состава равновесных систем
- •4.1. Важнейшие теории кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.5. Применение органических реагентов в аналитической химии
- •6.1. Произведение растворимости малорастворимого электролита
- •6.2. Растворимость
- •6.3. Влияние различных факторов на растворимость
- •7.1. Общая характеристика окислительно-восста- новительных реакций
- •7.2. Количественная оценка окислительно-восстано- вительной способности веществ
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций
- •8.1. Отбор пробы
- •8.2. Разложение пробы
- •9.1. Общая характеристика и классификация
- •9.2. Жидкость - жидкостная экстракция
- •10.1. Приближённые вычисления и значащие цифры
- •10.2. Понятие об аналитическом сигнале
- •10.4. Неопределённость и погрешности измерений
- •10.6. Пример статистической обработки результатов измерений. Исключение промахов
- •10.7. Основные характеристики методики анализа
- •11.1. Общая характеристика
- •11.2. Виды гравиметрических определений
- •11.3. Понятие о механизме образования осадка
- •11.4. Коллоидная стадия образования осадка
- •11.6. Основные этапы методики гравиметрического определения методом осаждения
- •12.1. Основные понятия титриметрии
- •12.2. Классификация титриметрических методов анализа и способов титрования
- •ГЛАВА 13 Кислотно-основное титрование
- •13.1. Титранты и стандартные вещества
- •13.2. Обнаружение конечной точки титрования. Ки- слотно-основные индикаторы
- •13.3. Кривые титрования
- •13.5. Погрешности титрования
- •13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
- •14.1. Ограничения возможностей кислотно-основного основного титрования в водных растворах
- •14.3. Применение в фармацевтическом анализе
- •ГЛАВА 15 Комплексометрическое титрование
- •15.1. Общая характеристика
- •15.2. Меркуриметрическое титрование
- •15.3. Комплексонометрическое титрование
- •15.3.1. Понятие о комплексонах
- •15.3.2. Свойства этилендиаминтетрауксусной кислоты и её взаимодействие с катионами металлов
- •15.3.3. Кривые титрования
- •15.3.4. Способы обнаружения конечной точки титрования. Металлоиндикаторы
- •15.3.5. Индикаторные погрешности
- •15.3.6. Титранты и стандартные вещества
- •15.3.7. Способы комплексонометрического титрования и его применение
- •ГЛАВА 16 Осадительное титрование
- •16.1. Общая характеристика
- •16.2. Аргентометрическое титрование
- •16.2.1. Кривые титрования
- •16.2.2. Способы обнаружения конечной точки титрования
- •16.2.3. Титранты и стандартные вещества
- •16.2.4. Применение в фармацевтическом анализе
- •16.3. Меркурометрическое титрование
- •17.1. Общая характеристика и классификация
- •17.2. Кривые титрования
- •18.1. Иодометрическое титрование
- •18.2. Хлориодометрическое титрование
- •18.3. Иодатометрическое титрование
- •18.4. Броматометрическое титрование
- •18.5. Нитритометрическое титрование
- •18.6. Перманганатометрическое титрование
- •18.7. Дихроматометрическое титрование
- •18.8. Цериметрическое титрование
- •20.3. Атомно-абсорбционная спектроскопия
- •20.3.1. Процессы, приводящие к появлению аналитического сигнала
- •20.3.2. Измерение аналитического сигнала
- •20.3.3. Практическое применение
- •20.4.2. Измерение аналитического сигнала
- •20.5. ИК-спектроскопия
- •20.5.1. Процессы, приводящие к появлению аналитического сигнала
- •20.5.2. Общая характеристика ИК-спектров
- •20.5.3. Измерение аналитического сигнала
- •20.5.4. Практическое применение
- •21.1. Атомно-эмиссионная спектроскопия
- •21.1.1. Процессы, приводящие к появлению аналитического сигнала
- •21.1.2. Измерение аналитического сигнала
- •21.1.3. Практическое применение
- •21.2. Люминесцентная спектроскопия
- •20.2.1 Классификация видов люминесценции
- •21.2.4. Влияние различных факторов на интенсивность флуоресценции растворов
- •21.2.5. Измерение аналитического сигнала
- •22.1. Общая характеристика
- •22.2. Классификация хроматографических методов
- •22.3. Хроматографические параметры
- •22.4. Теории хроматографического разделения
- •ГЛАВА 23 Газовая хроматография
- •23.1. Общая характеристика
- •23.2. Устройство газового хроматографа
- •23.3. Особенности газотвёрдофазной хроматографии
- •23.4. Особенности газожидкостной хроматографии
- •23.5. Индексы удерживания Ковача
- •23.6. Практическое применение
- •ГЛАВА 24 Жидкостная хроматография
- •24.1. Общая характеристика
- •24.2. Плоскостная хроматография
- •24.2.1. Методика получения плоскостной хроматограммы
- •24.2.2. Анализ плоскостной хроматограммы
- •24.2.3. Практическое применение
- •24.3. Колоночная жидкостная хроматография
- •24.3.1. Устройство жидкостного хроматографа
- •24.3.2. Практическое применение
- •24.4. Характеристика отдельных видов жидкостной хроматографии
- •24.4.1. Ионообменная хроматография
- •24.4.2. Эксклюзионная хроматография
- •25.2. Классификация электрохимических методов анализа
- •25.3. Кондуктометрия
- •25.3.1. Теоретические основы и классификация
- •25.3.2. Измерение аналитического сигнала
- •25.3.4. Практическое применение
- •25.3.5. Понятие о высокочастотной кондуктометрии
- •26.1. Потенциометрический метод анализа
- •26.1.1. Общая характеристика и классификация
- •26.1.2. Условия измерения аналитического сигнала
- •26.1.3. Индикаторные электроды
- •26.1.4. Прямая потенциометрия
- •26.1.5. Потенциометрическое титрование
- •26.2. Кулонометрический метод анализа
- •26.2.1. Общая характеристика и классификация
- •26.2.2. Прямая кулонометрия
- •26.2.3. Кулонометрическое титрование
- •27.1. Принцип измерения аналитического сигнала.
- •27.2. Вольтамперограмма
- •27.4. Практическое применение вольтамперометрии. Амперометрическое титрование
- •ЛИТЕРАТУРА
- •Общая
- •Справочная
- •Дополнительная литература к отдельным темам
- •Химические методы обнаружения неорганических веществ
- •Хемометрика
- •Химические методы анализа
- •Инструментальные методы анализа (общая литература)
- •Спектроскопические методы анализа
- •Хроматографические методы анализа
- •Электрохимические методы анализа
Общие вопросы аналитической химии
|
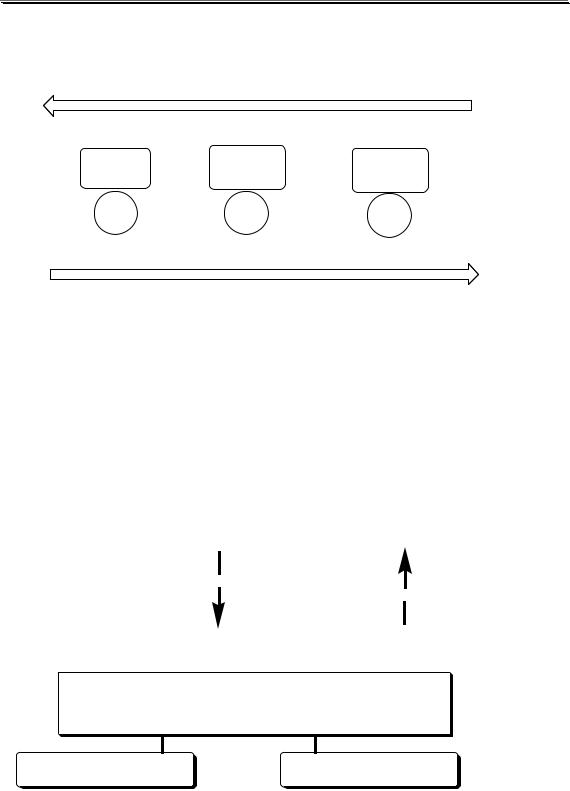
увеличение силы сопряжённой кислоты |
||
C6H5NH3+ |
NH4+ |
[(NH2)3C]+ |
|
KBH+ |
2,6 10-5 |
5,75 10-10 |
3,55 10-14 |
pKBH+ |
4,58 |
9,24 |
13,5 |
C6H5NH2 |
NH |
(NH ) C=NH |
|
|
|
3 |
2 2 |
увеличение силы основания
4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
Кислотно-основные свойства растворителя
Сила кислоты зависит от природы взаимодействующего с ней основания, а сила основания - от взаимодействующей с ним кислоты. Например, первичный амин в воде является более слабым основанием, чем в уксусной кислоте.
RNH2 + H2O î RNH3+ + OH-
более сильный донор протона более сильный акцептор протона
RNH2 + CH3COOH î RNH3+ + CH3COO-
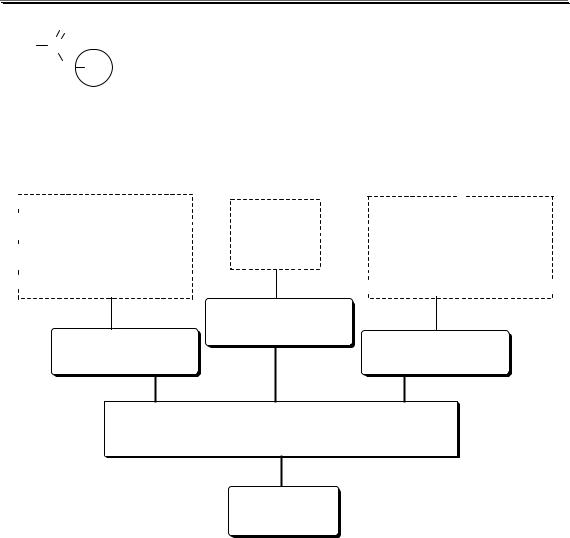
НАЛИЧИЕ ПРОТОНИЗИРОВАННЫХ АТОМОВ ВОДОРОДА
протонные |
апротонные |
||||
H2O |
|
|
|
|
|
|
|
|
|
|
|
полярные (ε > 15) |
|
неполярные (ε < 15) |
|||
NH3 |
|
|
|
|
|
CH3CN |
|
|
C6H6 |
||
CH3COOH |
|
|
|||
|
HCON(CH3)2 |
|
|
C6H14 |
|
|
CH3COCH3 |
|
|
CCl4 |
|
33
Раздел 1
O
H3C C
O H
Протонизированным называют атом водорода, связанный с атомом сильно электроотрицательного элемента и способный легко отщепляться от молекулы в виде протона (поэтому иногда его называют «подвижным»).
В зависимости от кислотно-основных свойств растворители бы-
вают:
CH3COOH
 Вещества, у которых
Вещества, у которых
 преобладают кислотные
преобладают кислотные
 свойства. По сравнению
свойства. По сравнению
 с водой повышают силу
с водой повышают силу
 растворённых оснований
растворённых оснований  и понижают силу кислот.
и понижают силу кислот.
C2H5OH |
NH3 |
Кислотные и |
Вещества, у которых |
основные |
преобладают основные |
свойства |
свойства. По сравнению |
соизмеримы |
с водой повышают силу |
|
растворённых кислот |
 и понижают силу оснований
и понижают силу оснований
амфотерные кислотные (амфипротные) основные
(протогенные) (протофильные)
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА
инертные Практически не принимают участия в кислотно-основном
C6H6 взаимодействии
Протонные растворители могут относиться как к кислотным (уксусная кислота), так и к основным (аммиак) или амфотерным растворителям (вода). Одни из представителей полярных апротонных растворителей, например, диметилформамид, обладают основными свойствами, другие (кетоны, ацетонитрил, диметилсульфоксид), а также неполярные апротонные растворители вообще не склонны к реакциям кислотно-основного взаимодействия.
Автопротолиз растворителя. Константа автопротолиза
Автопротолизом называют процесс кислотно-основного взаимодействия между двумя молекулами вещества, при котором одна молекула ведёт себя как кислота, а вторая - как основание.
H2O + H2O î H3O+ + OH-
СH3COOH + СH3COOH î СH3COO- + СH3COOH2+
C2H5OH + C2H5OH î C2H5O- + C2H5OH2+
NH3 + NH3 î NH2- + NH4+
34
Общие вопросы аналитической химии
Автопротолизу в той или иной степени подвергается большинство растворителей. Однако у одних веществ он идёт более интенсивно, у других - менее интенсивно.
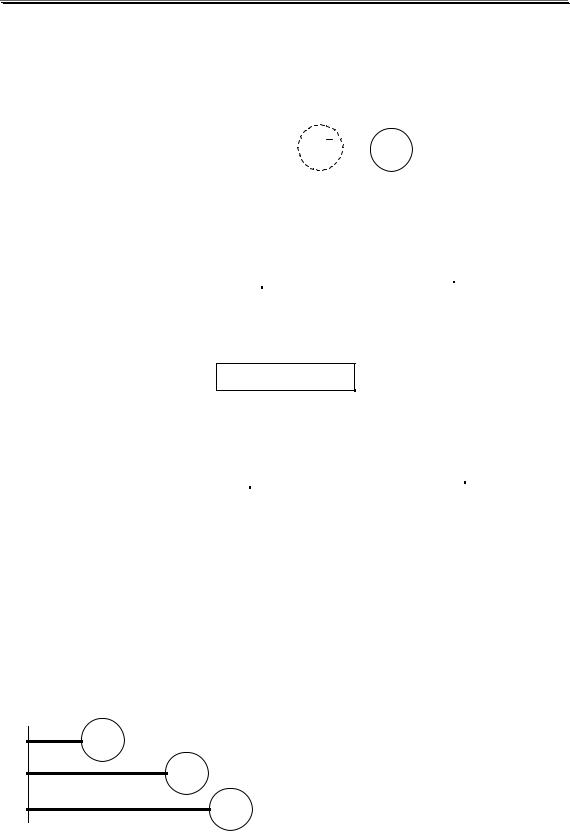
Рассмотрим реакцию кислотно-основного взаимодействия между двумя молекулами растворителя
SH + SH î S + SH2+
ион ион лиата лиония
Для чистого растворителя aSH =1, поэтому
K SH0 = aSH2+ aS − |
|
K SH =[SH 2+ ][S − ] |
|
|
Полученная константа называется константой автопротолиза
(KSH).
−lg KSH = pKSH
Вслучае воды выражения для константы автопротолиза (обычно обозначается как KW) выглядит следующим образом:
KW0 = aH O aOH − |
|
K W =[H3O+ ][OH− ] |
3 |
|
|
|
|
При 25 °С K 0W = 1,0 10-14, pKW = 14,0. При увеличении темпера-
туры константа автопротолиза воды увеличивается, а её показатель, соответственно, уменьшается.
Показатель константы автопротолиза является мерой протяжённости шкалы кислотности (от aSH2+ =1 до aS− =1) для данного рас-
творителя. Величина, равная половине pKSH, соответствует нейтральной среде для данного растворителя. В нейтральной среде
aSH2+ = aS− .
0
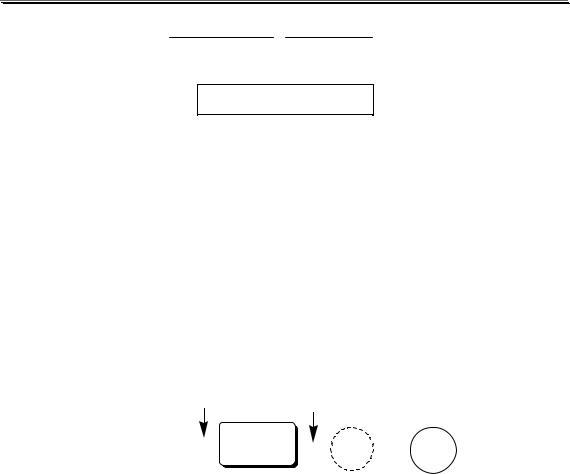
3,05  6,1 муравьиная кислота
6,1 муравьиная кислота
7,0  14,0 вода
14,0 вода
9,55  19,1 этанол
19,1 этанол
Константа автопротолиза растворителя связывает между собой константы кислотности и основности частиц, образующих сопряжённую кислотно-основную пару. Например, для водных растворов:
35
Раздел 1
Kb K BH+ = [BH+ ][OH− ] [B][H3+O+ ] =[OH− ][H3O+ ]
[B][BH ]
pK b + pK BH+ = pK W
Диэлектрическая проницаемость
Диэлектрической проницаемостью среды (ε) называют без-
размерную величину, которая показывает, во сколько раз взаимодействие между двумя точечными электрическими зарядами в данной среде слабее, чем в вакууме.
Чем выше диэлектрическая проницаемость растворителя, тем лучше происходит диссоциация растворённого в нём электролита. Растворители, у которых ε > 15, называются полярными, а те, у которых ε < 15 - неполярными.
Диэлектрическая проницаемость влияет на величину константы автопротолиза.
ионизация диссоциация
SH + SH î S- SH2+ î S- |
+ SH+ |
|
2 |
ионная
пара
Если растворитель имеет малую диэлектрическую проницаемость, то константа диссоциации ионной пары будет также мала, следовательно, и значение константы автопротолиза будет небольшим.
растворитель |
ε |
pKSH |
HCOOH |
57,0 |
6,1 |
CH3COOH |
6,2 |
14,4 |
Диэлектрическая проницаемость растворителя оказывает влияние на константу кислотности (или основности) растворённого вещества. При уменьшении ε величины данных констант уменьшаются. Причём у заряженных частиц они изменяются менее сильно, чем у незаряженных.
кислота |
H2O |
CH3OH |
∆pKa |
C6H5COOH |
4,2 |
9,5 |
5,3 |
C6H5NH3+ |
4,6 |
6,1 |
1,5 |
36
